一种含有4-咪唑基的谷氨酰胺酰基环化酶抑制剂的制备方法及应用与流程
本发明涉及药物化学领域,尤其涉及一种含有4-咪唑基的谷氨酰胺酰基环化酶抑制剂的制备方法及应用。
背景技术:
谷氨酰胺酰基环化酶(glutaminylcyclase,qc,ec2.3.2.5)是一种催化多肽、蛋白等n端谷氨酰胺分子内环化反应生成焦谷氨酸(pglu)的酶。1963年,qc首次在热带植物番木瓜(caricapapaya)乳胶中发现,后研究证实,qc在植物、动物、微生物中均有分布。在植物中,qc的生理功能并不十分明确,可能在植物防御病原微生物过程中有一定的作用。动物体内的qc具有改变蛋白等n端化学结构、调节活性、增强稳定性等重要生物学功能。
最近研究证实,qc特异性高表达在多种重大疾病发病初期发挥关键调控作用。阿尔茨海默病(alzheimer’sdisease,ad)主要症状包括进行性记忆和认知功能障碍等,具有不可逆转、高死亡率等特征,是一种常见的神经退行性疾病,老年痴呆的主要形式(ad患者超过老年痴呆患者总数的65%以上),目前确切病理机制尚不明了,临床亦无特效治疗药物,已成为仅次于心脑血管疾病和肿瘤的第三大世界性健康问题。临床研究表明,ad病理学特征主要是脑部神经元外部的aβ沉淀和神经元内部的过度磷酸化tau蛋白缠结等。但多项体内和临床研究发现,与正常老年人脑部aβ老年斑沉淀不同的是,ad患者脑部老年斑沉淀的主要成分并非aβ,而是变异的aβ,即n端谷氨酰胺残基分子内环合而成的pglu-aβ,尤其是pglu-aβ42/pglu-aβ40等,含量超过50%。pglu-aβ具有更强神经毒性、更快聚集沉淀速度、一旦产生无法被降解清除等特性,比aβ出现更早、更特异。相关研究的进一步深入显示,pglu-aβ是qc酶催化作用的产物,且早在产生pglu-aβ、aβ之前,外周血液中即可检测到qcrna的特征性上调,而选择性抑制qc活性可显著抑制pglu-aβ的产生和老年斑沉淀的形成,并明显改善认知、记忆功能损伤等ad症状。可见,qc高表达是ad发病、发展的关键促进因素,qc为ad病理及病因性抗ad药物研究开启了新的战略性突破口。
同时,炎症是qc活性增强诱发系统性疾病的另一个重要“切入点”。ccl2(mcp1)是主要炎症趋化因子之一,通过与ccr2结合而激活ccl2/ccr2通路,继而诱发炎症反应。研究发现,炎症初期体内局部存在大量n端修饰的ccl2,即pglu-ccl2,该类修饰后的因子难以被氨肽酶等降解,半衰期显著延长,且与ccr2结合活性大大提高,能够持续激活下游炎症反应。研究进一步证实,qc在风湿性关节炎、非酒精性肝炎、皮肤黑色素瘤、红斑狼疮综合症等多种与机体固有免疫功能失调相关复杂疾病的发病早期均有特异性高表达,抑制qc活性可显著改善上述疾病症状。故,qc抑制剂有望成为创新抗炎症药物开发的重要新方向。
然而,qc抑制剂相关研究相对较少。ep1713780b1、ep2091948b1、us7304086b2、us7371871b2、us7741354b2、us7892771b2、us8129160b2、us8188094b2、us8202897b2、us8227498b2、us20080214620a1、us200880286231a1、us20090269301a1、zl201510703417.9等专利公开了一类qc抑制剂分子。虽然该类qc抑制剂分子具有一定的qc抑制活性,但该类分子在结构与活性方面尚存在一定的不足之处,如关键药效团结构单一、活性仍有较大提升空间等。
进一步地,本申请人在2015年申请了一种化学结构式为
因此,现有技术还有待于提高和改进。
技术实现要素:
鉴于上述现有技术的不足,本发明的目的在于提供一种含有4-咪唑基的谷氨酰胺酰基环化酶抑制剂的制备方法及应用,旨在解决现有谷氨酰胺酰基环化酶抑制剂合成步骤繁琐、关键药效团结构单一、分子活性有限等问题。
本发明的技术方案如下:
一种含有4-咪唑基的谷氨酰胺酰基环化酶抑制剂,其结构通式为:
其中,a单元是含有4-咪唑基的官能团;b单元和c单元独立选自苯环、六元杂芳环、五元杂芳环、七元芳环、萘、蒽、萘醌或多芳环体系中的一种,r1和r2独立选自氢、直链状烷基、支链状烷基、烷氧基、卤素、羧基、硝基、磺酸基、胺基、磷酸基及其取代物中的一种;
其中,所述含有4-咪唑基的谷氨酰胺酰基环化酶抑制剂的制备方法包括步骤:
以带有溴取代基和r1的b单元原料和带有硼酸基和r2的c单元原料起始,经suzuki偶联反应,制备b单元和c单元偶联的联苯中间体;
以b单元和c单元偶联的联苯中间体和2-(1h-咪唑-4-基)乙胺为原料,经sn2反应制备得到含有4-咪唑基的谷氨酰胺酰基环化酶抑制剂;
所述a单元和c单元在b单元的链接位置是邻位。
一种含有4-咪唑基的谷氨酰胺酰基环化酶抑制剂的应用,其中,将所述含有4-咪唑基的谷氨酰胺酰基环化酶抑制剂应用于qc靶向抗ad先导药物中。
一种含有4-咪唑基的谷氨酰胺酰基环化酶抑制剂的应用,其中,将所述含有4-咪唑基的谷氨酰胺酰基环化酶抑制剂应用于治疗qc特异性高表达疾病的药物中。
一种含有4-咪唑基的谷氨酰胺酰基环化酶抑制剂的应用,其中,将所述含有4-咪唑基的谷氨酰胺酰基环化酶抑制剂应用于qc诊断试剂盒中。
有益效果:本发明所提供的制备方法,其仅需suzuki偶联、sn2反应两步即可完成,相比现有技术,本发明的工艺路线简单可行,收率高,更适合大规模制备;且本发明制备的基于4-咪唑基的谷氨酰胺酰基环化酶抑制剂具有更高活性,可广泛应用于高效qc抑制剂类新药的开发、ad等qc特异性高表达相关疾病的药物、创新药物及诊断试剂盒的开发等。
附图说明
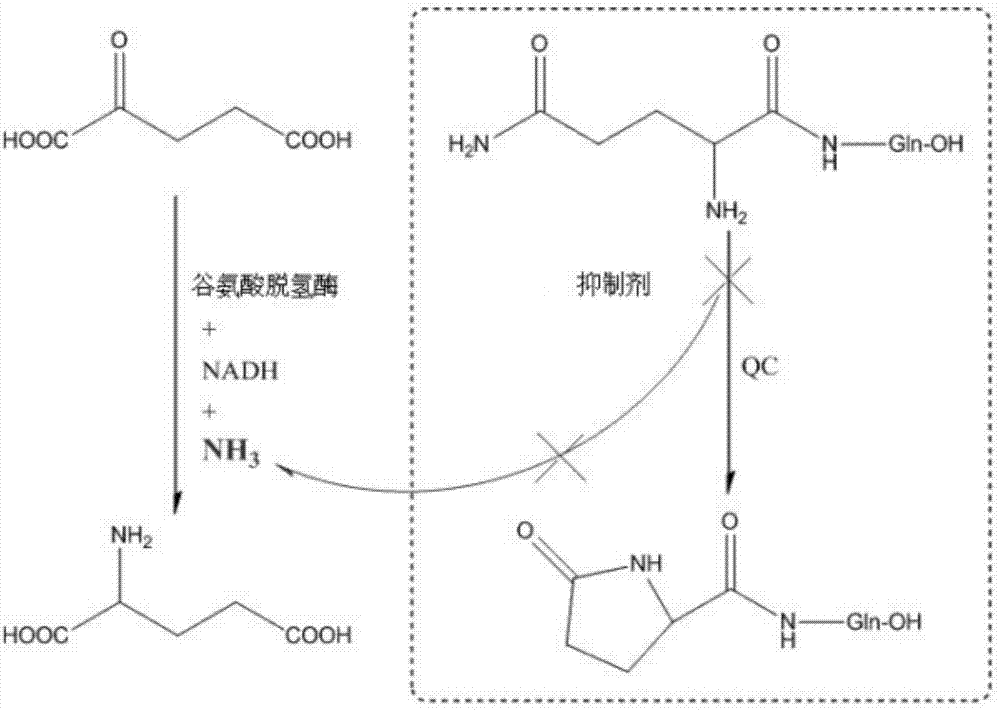
图1为本发明中qc酶抑制活性测试原理示意图。
具体实施方式
本发明提供了一种含有4-咪唑基的谷氨酰胺酰基环化酶抑制剂的制备方法及应用,为使本发明的目的、技术方案及效果更加清楚、明确,以下对本发明进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
本发明提供一种含有4-咪唑基的谷氨酰胺酰基环化酶抑制剂,其结构通式为:
其中,a单元是含有4-咪唑基的官能团;b单元和c单元独立选自苯环、六元杂芳环、五元杂芳环、七元芳环、萘、蒽、萘醌或多芳环体系中的一种,r1和r2独立选自氢、直链状烷基、支链状烷基、烷氧基、卤素、羧基、硝基、磺酸基、胺基、磷酸基及其取代物中的一种;
其中,所述含有4-咪唑基的谷氨酰胺酰基环化酶抑制剂的制备方法包括步骤:
以带有溴取代基和r1的b单元原料和带有硼酸基和r2的c单元原料起始,经suzuki偶联反应,制备b单元和c单元偶联的联苯中间体;
以b单元和c单元偶联的联苯中间体和2-(1h-咪唑-4-基)乙胺为原料,经sn2反应制备得到含有4-咪唑基的谷氨酰胺酰基环化酶抑制剂;
所述a单元和c单元在b单元的链接位置是邻位。
具体来讲,由于现有化学结构式为
进一步地,现有技术在制备化学结构式为
而本发明在制备化学结构式为
进一步地,本发明制备的含有4-咪唑基的谷氨酰胺酰基环化酶抑制剂中,所述a单元和c单元在b单元的链接位置是邻位。所述b单元上邻位结构可以显著增强分子刚性,更好的保持a单元和c单元药效团的空间指向,从而使分子整体可以与谷氨酰胺酰基环化酶活性中心更好的结合,化合物抑制活性更强。
优选地,在同一个化合物内,b单元和c单元的母核结构相同或不相同,r1和r2的结构相同或不相同。
优选地,所述r1是单取代或不同位置的多取代。
优选地,所述r2是单取代或不同位置的多取代。
作为举例,本发明中的含有4-咪唑基的谷氨酰胺酰基环化酶抑制剂可以为
本发明中的谷氨酰胺酰基环化酶抑制剂在药学上可接受的盐,包括锂盐、钠盐、钾盐、镁盐、钙盐、铁盐、铜盐、有机铵盐、盐酸盐、磷酸盐、乙酸盐、丙酸盐、乙二酸盐、柠檬酸盐等。
本发明提供一种含有4-咪唑基的谷氨酰胺酰基环化酶抑制剂的应用,其中:将所述含有4-咪唑基的谷氨酰胺酰基环化酶抑制剂应用于qc靶向抗ad先导药物中。
发明还提供一种含有4-咪唑基的谷氨酰胺酰基环化酶抑制剂的另一应用,其中:将所述含有4-咪唑基的谷氨酰胺酰基环化酶抑制剂应用于治疗qc特异性高表达疾病(包括风湿性关节炎、非酒精性肝炎、皮肤黑色素瘤、红斑狼疮综合症等)的药物中。
发明还提供一种含有4-咪唑基的谷氨酰胺酰基环化酶抑制剂的另一应用,其中:将所述含有4-咪唑基的谷氨酰胺酰基环化酶抑制剂应用于qc诊断试剂盒中。
下面通过具体实施例对本发明一种含有4-咪唑基的谷氨酰胺酰基环化酶抑制剂的制备方法以及qc抑制剂对qc酶抑制活性的测试做进一步的解释说明:
实施例1
n-([1,1'-联苯]-2-甲基)-2-(1h-咪唑-4-基)乙基-1-胺的合成,其合成路线如下所示:
1)、2-(溴甲基)-1,1'-联苯的制备:
将2-溴甲基溴苯(7.53mmol,1当量),苯硼酸(9.04mmol,1.2当量)和[1,1’-双(二苯基膦)二茂铁]二氯化钯(ii)二氯甲烷络合物(0.45mmol,0.06当量)置于50ml圆底烧瓶中,分别加入10ml的二氧六环和10ml的2mol/lk2co3溶液,100℃,回流3h。加入饱和nacl溶液淬灭反应,冷却至室温,乙酸乙酯萃取三次,合并后饱和nacl溶液洗一次,无水na2so4干燥,硅胶柱层析收集产物,收率为79%。
2)、n-([1,1'-联苯]-2-甲基)-2-(1h-咪唑-4-基)乙基-1-胺的制备:
将2-(溴甲基)-1,1'-联苯(1.35mmol,1当量)、2-(1h-咪唑-4-基)乙胺(9.45mmol,7当量)溶于6ml无水乙腈,加入无水k2co3(2.71mmol,2当量)固体,搅拌回流过夜,蒸除溶剂,乙酸乙酯和水萃取三次,合并有机相并用饱和nacl溶液洗一次,无水na2so4干燥,硅胶柱层析收集产物,收率为68%。
实施例2
n-(3’,4,4’,5’-四甲氧基-[1,1'-联苯]-2-甲基)-2-(1h-咪唑-4-基)乙基-1-胺的合成,其合成路线如下:
1)、2-(溴甲基)-3’,4,4’,5’-四甲氧基-1,1'-联苯的制备:
将2-溴甲基-4-甲氧基溴苯(6.49mmol,1当量),3,4,5-三甲氧基苯硼酸(7.78mmol,1.2当量)和[1,1’-双(二苯基膦)二茂铁]二氯化钯(ii)二氯甲烷络合物(0.39mmol,0.06当量)置于50ml圆底烧瓶中,分别加入10ml的二氧六环和10ml的2mol/lk2co3溶液,100℃,回流3h。加入饱和nacl溶液淬灭反应,冷却至室温,乙酸乙酯萃取三次,合并后饱和nacl溶液洗一次,无水na2so4干燥,硅胶柱层析收集产物,收率为63%。
2)、n-(3’,4,4’,5’-四甲氧基-[1,1'-联苯]-2-甲基)-2-(1h-咪唑-4-基)乙基-1-胺的制备:
将2-(溴甲基)-3’,4,4’,5’-四甲氧基-1,1'-联苯(934.15μmol,1当量)、2-(1h-咪唑-4-基)乙胺(6.54mmol,7当量)溶于6ml无水乙腈,加入无水k2co3(1.87mmol,2当量)固体,搅拌回流过夜,蒸除溶剂,乙酸乙酯和水萃取三次,合并有机相并用饱和nacl溶液洗一次,无水na2so4干燥,硅胶柱层析收集产物,收率为58%。
实施例3
n-((4’-环丙基-4-氟-[1,1'-联苯]-2-甲基)-2-(1h-咪唑-4-基)乙基-1-胺(9)的合成,其合成路线如下:
1)、2-(溴甲基)-4’-环丙基-4-氟-1,1'-联苯的制备:
将2-溴甲基-4-氟溴苯(6.41mmol,1当量),对环丙基苯硼酸(7.69mmol,1.2当量)和[1,1’-双(二苯基膦)二茂铁]二氯化钯(ii)二氯甲烷络合物(0.38mmol,0.06当量)置于50ml圆底烧瓶中,分别加入10ml的二氧六环和10ml的2mol/lk2co3溶液,100℃,回流3h。加入饱和nacl溶液淬灭反应,冷却至室温,乙酸乙酯萃取三次,合并后饱和nacl溶液洗一次,无水na2so4干燥,硅胶柱层析收集产物,收率为75%。
2)、n-(4’-环丙基-4-氟-[1,1'-联苯]-2-甲基)-2-(1h-咪唑-4-基)乙基-1-胺的制备:
将2-(溴甲基)-4’-环丙基-4-氟-1,1'-联苯(2.03mmol,1当量)、2-(1h-咪唑-4-基)乙胺(14.21mmol,7当量)溶于6ml无水乙腈,加入无水k2co3(4.07mmol,2当量)固体,搅拌回流过夜,蒸除溶剂,乙酸乙酯和水萃取三次,合并有机相并用饱和nacl溶液洗一次,无水na2so4干燥,硅胶柱层析收集产物,收率为63%。
实施例4
n-((1-(3,4-二氟苯)萘-2-基)甲基)-2-(1h-咪唑-4-基)乙基-1-胺(19)的合成,其合成路线如下:
1)、2-(溴甲基)-1-(3,4-二氟苯)萘的制备:
将1-溴-2-溴甲基萘(8.81mmol,1当量),3,4-二氟苯硼酸(10.57mmol,1.2当量)和[1,1’-双(二苯基膦)二茂铁]二氯化钯(ii)二氯甲烷络合物(0.53mmol,0.06当量)置于50ml圆底烧瓶中,分别加入10ml的二氧六环和10ml的2mol/lk2co3溶液,100℃,回流3h。加入饱和nacl溶液淬灭反应,冷却至室温,乙酸乙酯萃取三次,合并后饱和nacl溶液洗一次,无水na2so4干燥,硅胶柱层析收集产物,收率为47%。
2)、n-((1-(3,4-二氟苯)萘-2-基)甲基)-2-(1h-咪唑-4-基)乙基-1-胺的制备:
2-(溴甲基)-1-(3,4-二氟苯)萘(1.06mmol,1当量)、2-(1h-咪唑-4-基)乙胺(7.42mmol,7当量)溶于6ml无水乙腈,加入无水k2co3(2.12mmol,2当量)固体,搅拌回流过夜,蒸除溶剂,乙酸乙酯和水萃取三次,合并有机相并用饱和nacl溶液洗一次,无水na2so4干燥,硅胶柱层析收集产物,收率为51%。
实施例5
qc抑制剂对qc酶抑制活性测试:
qc酶抑制活性测试原理示意图如图1所示,酶活测试在96孔酶标板中进行,采用200μlph8.0tris缓冲体系:0.3mmnadh,2.0mm新鲜制备gln-gln,14mmα-酮戊二酸,30u/ml谷氨酸脱氢酶,50mmtris,ph8.0缓冲液,最后加入0.28μm重组人qc蛋白与不同浓度抑制剂的混合液,振荡30秒后以酶标仪动态检测25℃时nadh在340nm波长处15min内吸收值变化,每隔30s进行一次数据采集,根据测试结果,计算抑制剂对qc酶活抑制作用的ic50值,对于不同qc抑制剂的测试结果如表1中所示,其中,ic50值越小说明化合物的活性越高。
表1qc抑制剂的测试结果
实施例6
基于4-咪唑基药效团的qc抑制剂抗ad作用研究
以双转基因ad小鼠(b6c3-tg(appswe,psen1de9)85dbo/mmjnju)为模型动物,选择雌性12月龄ad小鼠,设用药组和对照组,各6只,以表1中1-22号化合物为实验用药,剂量8.0mg/kg,腹腔注射,隔两天给药1次,对照组给等量缓冲溶液,连续用药6周后开展行为学实验。nestconstruction行为学实验,在各笼中随机放入等量的试纸团,并均匀分布,在间隔24小时后,观察记录小鼠对试纸团的挪移、粉碎及用试纸团筑巢的情况,结果表明,用药组小鼠再筑行为明显改善,认知、记忆功能显著增强。ad相关病理学实验,处死小鼠,取脑组织,蔗糖梯度脱水,oct包埋后进行冠装冰冻切片,然后进行westernblot和ths染色分析,结果表明,用药后小鼠脑部的老年斑沉淀明显减少。综合上述实验,表1中1-22号化合物在小鼠体内显示出显著的抗ad作用。
综上所述,本发明制备方法,其仅需suzuki偶联、sn2反应两步即可完成,相比现有技术,本发明的工艺路线简单可行,收率高,更适合大规模制备;且本发明制备的基于4-咪唑基的谷氨酰胺酰基环化酶抑制剂具有更高活性,与阳性对照化合物相比,活性提高了两个数量级,作为先导化合物值得进一步的优化设计、合成,具备开发成为新型、高效qc抑制剂的极大潜力。本发明提供制备方法所得qc抑制剂可用于ad、肿瘤、风湿性关节炎等多种与qc特异性高表达相关疾病病因性治疗药物的开发、发病机理及分子机制研究、早期诊断及诊断试剂盒的开发等。
应当理解的是,本发明的应用不限于上述的举例,对本领域普通技术人员来说,可以根据上述说明加以改进或变换,所有这些改进和变换都应属于本发明所附权利要求的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!