一种基于芴基-噁二唑的双极性磷光铱配合物及其制备方法和应用与流程
本发明涉及一种基于芴基-噁二唑的双极性磷光铱配合物及其制备方法和应用,属于有机磷光材料技术领域。
背景技术:
磷光铱配合物由于其自身的优势受到科研工作者和商业的广泛关注,随着科技的发展,新型主体材料的研发也越来越重要。在发光过程中同时需要空穴传输材料和电子传输材料,空穴传输材料一般要求配体具有很好空穴传输能力的基团,我们经常用的有咔唑基团、吲哚基团、芴基等;电子传输材料通常具有很好的电子传输能力,也就是具有吸电子基团,常用基团有二苯氧膦、噁二唑、吡啶等,这两种材料一直是历年来研究的重点,但是这两种材料存在难以控制其发射层平衡性的问题,因此具备优良性能的双极性主体材料进入大家的视野,所谓双极性主体材料也就是一种材料中同时具有优良的电子传输能力和空穴传输能力的材料,以实现发射层中的电子和空穴平衡。这种具有高的三线态能量的双极性主体材料已被用作磷光oled的主体材料。目前相关文献报道中将噁二唑作为电致发光材料中具有强电子亲和力的电子受体和电子传递单元,但是具有双极性磷光oled的噁二唑很少有报道。
基于上述问题我们选用芴基为空穴传输材料,噁二唑为电子传输材料,采用芴基-噁二唑基团为主体用二苯胺基团对噁二唑衍生物进行修饰,在此基础上设计出目标配合物,并与重原子铱结合成配合物。
技术实现要素:
本发明所要解决的技术问题是克服现有技术的缺陷,提供一种基于芴基-噁二唑的双极性磷光铱配合物及其制备方法和应用,分子中包含给电子和吸电子基团,有利于平衡电子和空穴的注入及在发光层中的传输,显著提升器件的效率。
为解决上述技术问题,本发明提供一种基于芴基-噁二唑的双极性磷光铱配合物,在基于芴基-噁二唑的双极性主体的基础上,在芴基上引入基团a,在噁二唑上引入基团r2,所述的基于芴基-噁二唑的双极性磷光铱配合物由b型和fb型两种化合物组成,其结构式如下:
其中,基团a为二苯胺基团,基团r1为烷基链,基团r2为吸电子基团。
优选地,所述吸电子基团为h。
优选地,所述吸电子基团为f。
优选地,所述烷基链为己基链。
本发明还提供了上述的基于芴基-噁二唑的双极性磷光铱配合物的制备方法,其特征在于包括如下步骤:
(1)在氮气的保护下,2-溴-7-碘芴和卤代烷烃溶解于dmso中,在碱性条件下,合成2-溴-7-碘-9,9-二己基芴;
(2)2-溴-7-碘-9,9-二己基芴在甲苯溶液中与二苯胺在碘化亚铜、叔丁醇钾的催化下进行suzuki偶联反应,得到2-n,n-二苯基-7-溴-9,9-二己基-芴;
(3)以dmf为溶剂,2-n,n-二苯基-7-溴-9,9-二己基-芴和cucn反应得到2-氰基-7-(二苯基氨基)-9,9-二己基-芴;
(4)以dmf为溶剂,在盐酸三乙胺的催化下,2-氰基-7-(二苯基氨基)-9,9-二己基-芴与nan3发生环化反应,得到化合物2-四氮唑-7-(二苯基氨基)-9,9-二己基-芴。
(5)以吡啶作为反应溶剂,2-四氮唑-7-(二苯基氨基)-9,9-二己基-芴与苯甲酰氯反应,得到所需的主配体2-苯基噁二唑-7-(二苯基氨基)-9,9-二己基-芴;
(6)将所制备的主配体与水合三氯化铱在乙二醇乙醚的水溶液中反应得到二聚物的中间体,之后与吡啶甲酸反应,得到芴基-噁二唑的双极性磷光铱配合物
本发明还提供了上述的基于芴基-噁二唑的双极性磷光铱配合物的制备方法,其特征在于包括如下步骤:
(1)在氮气的保护下,2-溴-7-碘芴和卤代烷烃溶解于dmso中,在碱性条件下,合成2-溴-7-碘-9,9-二己基芴;
(2)2-溴-7-碘-9,9-二己基芴在甲苯溶液中与二苯胺在碘化亚铜、叔丁醇钾的催化下进行suzuki偶联反应,得到2-n,n-二苯基-7-溴-9,9-二己基-芴;
(3)以dmf为溶剂,2-n,n-二苯基-7-溴-9,9-二己基-芴和cucn反应得到2-氰基-7-(二苯基氨基)-9,9-二己基-芴;
(4)以dmf为溶剂,在盐酸三乙胺的催化下,2-氰基-7-(二苯基氨基)-9,9-二己基-芴与nan3发生环化反应,得到化合物2-四氮唑-7-(二苯基氨基)-9,9-二己基-芴。
(5)以吡啶作为反应溶剂,得到化合物2-四氮唑-7-(二苯基氨基)-9,9-二己基-芴。与对氟苯甲酰氯反应,得到所需的主配体对2-对氟苯基噁二唑-7-(二苯基氨基)-9,9-二己基-芴;
(6)将所制备的主配体与水合三氯化铱在乙二醇乙醚的水溶液中反应得到二聚物的中间体,之后与吡啶甲酸反应,得到芴基-噁二唑的双极性磷光铱配合物。
同时,本发明还提供了一种基于芴基-噁二唑的双极性磷光铱配合物在制备有机电致发光材料中的应用。
本发明所达到的有益效果:
(1)本发明制备得到的基于芴基-噁二唑的双极性磷光铱配合物中包含给电子和吸电子基团,有利于平衡电子和空穴的注入及在发光层中的传输,显著提升器件的效率;芴基作为空穴传输基团为电子给体,具有较强亲电子能力的噁二唑基团作为电子受体,能够提高发光效率;采用二苯胺基团对噁二唑衍生物进行修饰,改变电子云的分布从而调节有机电致发光的位置和发光效率。
(2)本发明提供了一种简易制备有机电致发光材料的方法,该方法工艺简单,制造成本低本发明合成的铱配合物制作的器件具有相对较高的效率。
附图说明
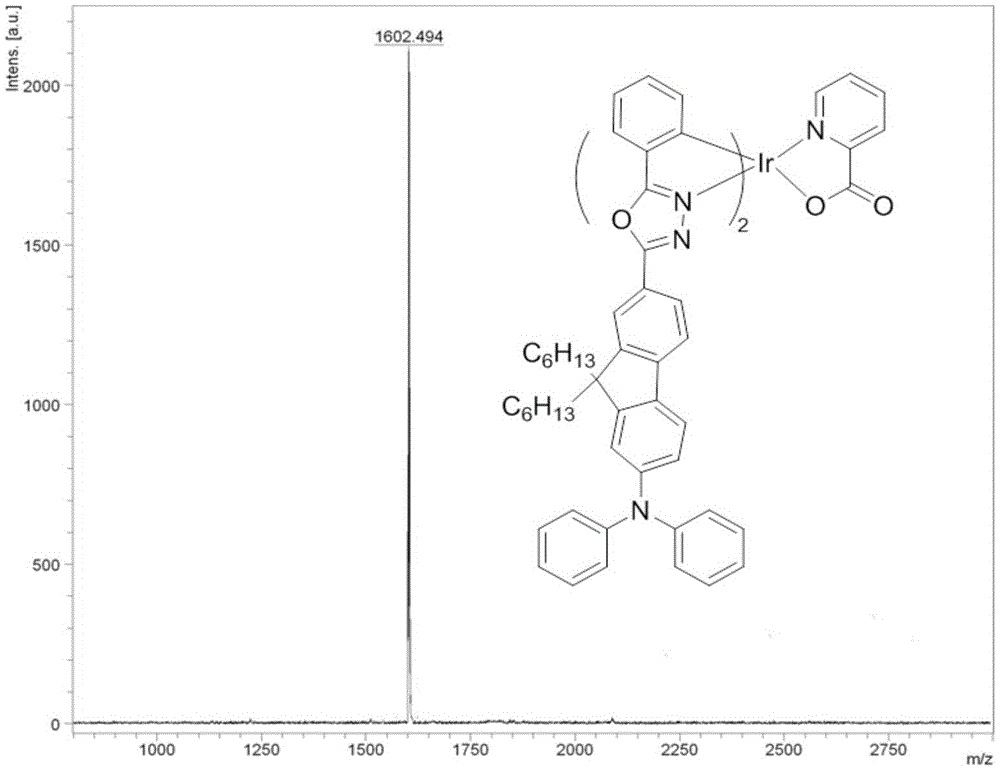
图1是配合物ir(b-dfob)2(pic)的质谱图;
图2是配合物ir(f-dfob)(b-dfob)(pic)的质谱图;
图3是配合物ir(b-dfof)2(pic)的质谱图;
图4是配合物ir(f-dfof)(b-dfof)(pic)的质谱图;
图5是配合物ir(b-dfob)2(pic)的1hnmr图;
图6是配合物ir(f-dfob)(b-dfob)(pic)的1hnmr图;
图7是配合物ir(b-dfof)2(pic)的1hnmr图;
图8是配合物ir(f-dfof)(b-dfof)(pic)的1hnmr图;
图9是有机电致发光磷光器件的结构图;
图10是配合物ir(b-dfob)2(pic)和ir(b-dfof)2(pic)的器件效率图,其中(a)为工作电压为8v时的电致发光光谱,(b)为亮度—电压曲线,(c)为电流密度一电压曲线,(d)为电流效率—电压曲线;
图11是配合物ir(f-dfob)(b-dfob)(pic)和ir(f-dfob)(b-dfob)(pic)的器件效率图,其中(a)为工作电压为10v时的电致发光光谱,(b)为亮度—电压曲线,(c)为电流密度一电压曲线,(d)为电流效率—电压曲线;
图12是ir(b-dfob)2(pic)和ir(b-dfof)2(pic)的吸收和发射光谱;
图13是ir(f-dfob)(b-dfob)(pic)和ir(f-dfof)(b-dfof)(pic)的吸收和发射光谱。
具体实施方式
下面结合附图对本发明作进一步描述。以下实施例仅用于更加清楚地说明本发明的技术方案,而不能以此来限制本发明的保护范围。
如图1~13所示,本发明设计合成了基于芴基-噁二唑的双极性磷光铱配合物,采用质谱、核磁共振氢谱、核磁共振碳谱来表征该系列化合物的分子结构,采用吸收光谱、发射光谱来研究化合物的光物理性质,采用电致发光光谱、亮度—电压曲线、电流密度一电压曲线、电流效率—电压曲线来研究有机电致发光材料的器件效率。
实施例1
(1)2-溴-7-碘-9,9-二己基芴的合成与表征。
称取2-溴-7-碘-芴(25.641g,68.01mmol),溴代正己烷(33.664g,204.02mmol)和氢氧化钠(11.002g,275.1mmol)的混合物溶解于dmso中,在55℃恒温条件下反应10个小时后,用水和乙酸乙酯多次萃取除去dmso溶剂,有机相用无水na2so4干燥,用石油醚作为洗脱剂柱层析提纯,得到白色产物;干燥、称量、计算得到产物产率为90%。
(2)2-n,n-二苯基-7-溴-9,9-二己基-芴的合成与表征。
分别称取2-溴-7-碘-9,9-二己基芴(7.64g,14.12mmol),二苯胺(2.213g,12.82mmol),cui(0.139g,0.715)和叔丁醇钾(t-buok)(4.853g,42.38mmol)投入三口瓶中,抽换氮气三次后,在这些混合物中加入15ml甲苯作为反应溶剂,110℃反应8小时后。对反应物用二氯甲烷萃取并用无水na2so4干燥。旋蒸出溶剂,采用干法上样过柱,得2-n,n-二苯基-7-溴-9,9-二己基-芴,然后真空干燥称量,产率86%。1hnmr(400mhz,cdcl3)δ7.54(d,j=8.2hz,1h),7.50–7.46(m,1h),7.46–7.42(m,2h),7.27(dd,j=10.7,4.9hz,4h),7.14(dd,j=8.1,4.9hz,5h),7.04(dd,j=10.6,4.3hz,3h),1.92–1.79(m,4h),1.24–1.01(m,12h),0.84(t,j=7.2hz,6h),0.73–0.61(m,4h).13cnmr(101mhz,cdcl3)δ152.93,151.80,147.76,140.01,135.13,129.95,129.58,128.86,126.01,123.94,123.53,122.68,120.49,120.20,119.15,55.38,40.20,31.55,29.62,23.76,22.61,14.11.
(3)2-氰基-7-(二苯基氨基)-9,9-二己基-芴的合成与表征。
依次称取干燥的(2)2-n,n-二苯基-7-溴-9,9-二己基-芴(5.952g,10.27mmol)和cucn(1.881g,21mmol)投入到三口瓶中,抽放氮气三次后加入干燥的dmf作为反应溶剂,在155℃搅拌24小时。待反应冷却至室温,逐滴加入氨水30ml搅拌30分钟后,未反应的氰化亚铜与氨水生成络合物溶于液相中,然后抽滤得到的反应固体在二氯甲烷溶剂中超声一个小时,抽滤保留有机溶剂相萃取,然后萃取得到的有机相干燥,采用柱层析提纯。得到目标产物干燥提纯,产率85%。1hnmr(400mhz,cdcl3)δ7.67(d,j=7.8hz,1h),7.61(d,j=8.9hz,3h),7.31(t,j=7.8hz,4h),7.18(d,j=8.2hz,5h),7.09(t,j=6.7hz,3h),1.92(pd,j=13.5,5.2hz,4h),1.18(dd,j=12.7,6.5hz,4h),1.11(s,8h),0.90–0.78(m,6h),0.77–0.58(m,4h).13cnmr(101mhz,cdcl3)δ152.96,151.27,149.06,147.68),145.68,133.65,131.49,129.42,126.24,124.52,123.31,122.89,121.67,120.12,119.48,118.10,108.83,55.45,40.04,31.55,29.58,23.80,22.61,14.14.
(4)2-四氮唑-7-(二苯基氨基)-9,9-二己基-芴的合成与表征。
称取干燥的2-氰基-7-(二苯基氨基)-9,9-二己基-芴(2.141g,4.08mmol),nan3(0.843g,12.97mmol)和net3·hcl(1.68g,12.28mmol)投入到干燥的三口瓶中,加入干燥的dmf作为反应溶剂,在氮气保护的环境下加热至125℃反应72h。反应结束后冷却至室温,然后滴加1mo·ml-1naoh溶液以调节ph=10左右,然后超声使固体溶解并抽滤,在滤液中逐滴加入盐酸至没有固体产生(在ph=3左右),然后用1mol·ml-1的naoh调节ph=5左右,抽滤得到的固体溶解于二氯甲烷中萃取,过柱得到白色的固体,产率83%。1hnmr(400mhz,cdcl3)δ8.32(s,1h),8.31–8.26(m,1h),7.78(d,j=7.9hz,1h),7.59(d,j=8.2hz,1h),7.27(s,1h),7.26(d,j=2.3hz,2h),7.23(s,1h),7.13(d,j=7.5hz,5h),7.03(t,j=7.1hz,3h),2.03–1.95(m,2h),1.86(dt,j=13.1,7.3hz,2h),1.12–0.93(m,13h),0.72(t,j=7.1hz,7h),0.62(t,j=17.9hz,4h).
(5)主配体2-苯基噁二唑-7-(二苯基氨基)-9,9-二己基-芴(dfob)的合成与表征。
称取干燥的2-四氮唑-7-(二苯基氨基)-9,9-二己基-芴(2.768g,4.87mmol)投入两口反应瓶中,然后把两口瓶放入冰浴皿中,在冰浴皿中放入冰块和水的混合物,然后常温下快速称取苯甲酰氯(1.027g,7.233mmol)投入两口瓶中,随后加入干燥的吡啶作为反应溶剂,然后升温至110℃反应24h,待反应结束后加入稀盐酸搅拌2小时除去吡啶,粗产物萃取、柱层析、干燥得到目标产物记为dfob,产率78%。1hnmr(400mhz,cdcl3)δ8.19(dd,j=6.5,3.0hz,1h),8.11–8.04(m,1h),7.73(d,j=7.9hz,1h),7.62(d,j=8.2hz,1h),7.59–7.53(m,2h),7.27(dd,j=10.2,5.5hz,2h),7.14(d,j=7.8hz,3h),7.05(t,j=7.4hz,2h),2.04–1.83(m,2h),1.19–1.00(m,7h),0.83–0.74(m,3h),0.66(s,2h).13cnmr(101mhz,cdcl3)δ165.41,164.35,152.93,151.47,148.38,147.79,144.73,134.62,131.62,129.18,126.96,126.16,124.21,123.15,122.94,121.34,121.02,119.48,118.62,55.42,40.18,31.54,29.58,23.80,22.56,14.05.
(6)中间体二氯桥(b-dfob)2ir(μ-cl)2和(f-dfob)(b-dfob)ir(μ-cl)2的合成。
称取dfob(0.449g,0.69mmol)和ircl3·3h2o(0.118g,0.37mmol)加入反应瓶中,抽换氮气三次后,以3:1的比例投入乙二醇乙醚和水,110℃反应24小时,反应得到的固体加入水抽滤,过滤后的固体混合物真空干燥箱中干燥。
(7)铱配合物ir(b-dfob)2(pic)和ir(f-dfob)(b-dfob)(pic)的合成与表征。
称取(b-dfob)2ir(μ-cl)2和(f-dfob)(b-dfob)ir(μ-cl)2的混合物(0.166g,0.109mmol),吡啶甲酸(0.01g,0.081mmol)和na2co3(0.299g,0.282mmol)加入反应管中,抽换氮气三次后,加入二氯甲烷作为反应溶剂,在38℃条件下匀速搅拌24小时。ir(b-dfob)2(pic)的产率:25%。1hnmr(400mhz,cdcl3)δ8.35(d,j=7.6hz,1h),8.19–8.09(m,2h),7.97(d,j=8.0hz,1h),7.90(t,j=6.9hz,2h),7.85(s,1h),7.76–7.66(m,4h),7.65–7.60(m,2h),7.41–7.33(m,1h),7.29(d,j=7.6hz,6h),7.15(d,j=7.8hz,11h),7.06(d,j=6.4hz,8h),6.97(d,j=6.8hz,4h),6.81(d,j=6.8hz,1h),2.09–1.75(m,10h),1.23–0.96(m,27h),0.80(dd,j=15.1,7.6hz,14h),0.65(s,9h).13cnmr(101mhz,cdcl3)δ176.57,175.73,173.78,164.40,153.19,152.75,151.80,151.53,149.76,148.58,147.74,147.23,146.32,145.28,137.63,134.42,131.82,129.32,127.59,126.65,126.46,125.94,125.06,124.31,123.05,122.23,121.67,121.40,120.80,120.41,119.53,118.50,55.52,40.10,31.57,29.51,23.80,22.60,14.11.ms(maldi-tof,m/z)calcdforc96h96irn7o4,1603.72;found:1602.494.
ir(f-dfob)(b-dfob)(pic):产率19%。1hnmr(400mhz,cdcl3)δ8.33(d,j=7.1hz,1h),8.23(d,j=7.5hz,2h),8.05(d,j=7.3hz,1h),7.98(d,j=8.0hz,1h),7.93–7.82(m,3h),7.69(d,j=7.1hz,1h),7.63–7.49(m,6h),7.35(d,j=8.2hz,1h),7.26(dd,j=13.1,8.2hz,5h),7.21(s,5h),7.12(dd,j=14.9,8.1hz,5h),7.09(s,9h),6.99(s,3h),6.85(dd,j=15.9,8.3hz,2h),1.86(s,10h),1.07(d,j=17.2hz,26h),0.87–0.74(m,11h),0.69(dd,j=13.7,6.3hz,9h).13cnmr(101mhz,cdcl3)δ176.32,175.84,173.60,166.40,166.16,166.03,165.83,164.36,163.77,163.37,162.46,153.46,152.97,152.78,151.57,151.50,151.33,149.70,148.55,148.42,147.71,145.44,145.25,144.89,144.58,144.44,137.74,134.41,129.30,127.59,126.99,126.82,126.22,124.81,124.18,123.22,122.68,121.36,120.68,120.28,119.55,118.46,116.68,109.79,55.44,54.51,40.29,31.52,29.58,24.45,23.34,22.53,14.07.ms(maldi-tof,m/z)calcdforc96h96irn7o4,1603.72;found:1602.196.
实施例2
(1)2-溴-7-碘-9,9-二己基芴的合成。
称取2-溴-7-碘-芴(25.641g,68.01mmol),溴代正己烷(33.664g,204.02mmol)和氢氧化钠(11.002g,275.1mmol)的混合物溶解于dmso中,在55℃恒温条件下反应10个小时后,用水和乙酸乙酯多次萃取除去dmso溶剂,有机相用无水na2so4干燥,用石油醚作为洗脱剂柱层析提纯,得到白色产物;干燥、称量、计算得到产物产率为90%。
(2)2-n,n-二苯基-7-溴-9,9-二己基-芴的合成。
分别称取2-溴-7-碘-9,9-二己基芴(7.64g,14.12mmol),二苯胺(2.213g,12.82mmol),cui(0.139g,0.715)和t-buok(4.853g,42.38mmol)投入三口瓶中,抽换氮气三次后,在这些混合物中加入15ml甲苯作为反应溶剂,110℃反应8小时后。对反应物用二氯甲烷萃取并用无水na2so4干燥。旋蒸出溶剂,采用干法上样过柱,得2-n,n-二苯基-7-溴-9,9-二己基-芴,然后真空干燥称量,产率86%。
(3)2-氰基-7-(二苯基氨基)-9,9-二己基-芴的合成。
依次称取干燥的(2)2-n,n-二苯基-7-溴-9,9-二己基-芴(5.952g,10.27mmol)和cucn(1.881g,21mmol)投入到三口瓶中,抽放氮气三次后加入干燥的dmf作为反应溶剂,在155℃搅拌24小时。待反应冷却至室温,逐滴加入氨水30ml搅拌30分钟后,未反应的氰化亚铜与氨水生成络合物溶于液相中,然后抽滤得到的反应固体在二氯甲烷溶剂中超声一个小时,抽滤保留有机溶剂相萃取,然后萃取得到的有机相干燥,采用柱层析提纯。得到目标产物干燥提纯,产率85%
(4)中间体2-四氮唑-7-(二苯基氨基)-9,9-二己基-芴的合成。
称取干燥的2-氰基-7-(二苯基氨基)-9,9-二己基-芴(2.141g,4.08mmol),nan3(0.843g,12.97mmol)和net3·hcl(1.68g,12.28mmol)投入到干燥的三口瓶中,在氮气保护的环境下加热至125℃反应72h。反应结束后冷却至室温,然后滴加1mo·ml-1naoh溶液以调节ph=10左右,然后超声使固体溶解并抽滤,在滤液中逐滴加入盐酸至没有固体产生(在ph=3左右),然后用1mol·ml-1的naoh调节ph=5左右,抽滤得到的固体溶解于二氯甲烷中萃取,过柱得到白色的固体,产率83%
(5)主配体对2-对氟苯基噁二唑-7-(二苯基氨基)-9,9-二己基-芴(dfof)的合成。
称取干燥的2-四氮唑-7-(二苯基氨基)-9,9-二己基-芴(2.768g,4.87mmol)投入两口反应瓶中,然后把两口瓶放入冰浴皿中,在冰浴皿中放入冰块和水的混合物,然后常温下快速称取对氟苯甲酰氯(1.146g,7.233mmol)投入两口瓶中,随后加入干燥的吡啶作为反应溶剂,然后升温至110℃反应24h,待反应结束后加入稀盐酸搅拌2小时除去吡啶,粗产物萃取、柱层析、干燥得到目标产物记为dfof,产率78%。
(6)二聚物中间体的合成。
称取dfof(0.449g,0.69mmol)和ircl3·3h2o(0.118g,0.37mmol)加入反应瓶中,抽换氮气三次后,以3:1的比例投入乙二醇乙醚和水,110℃反应24小时,反应得到的固体加入水抽滤,过滤后的固体混合物真空干燥箱中干燥。
(7)铱配合物ir(b-dfof)2(pic)和ir(f-dfof)(b-dfof)(pic)的合成与表征。
称取(b-dfof)2ir(μ-cl)2和(f-dfof)(b-dfof)ir(μ-cl)2的混合物(0.166g,0.109mmol),吡啶甲酸(0.01g,0.081mmol)和na2co3(0.296g,0.282mmol)加入反应管中,抽换氮气三次后,加入二氯甲烷作为反应溶剂,在38℃条件下匀速搅拌24小时。ir(b-dfob)2(pic)的产率:23%。铱配合物ir(b-dfof)2(pic):1hnmr(400mhz,cdcl3)δ8.35(d,j=7.6hz,1h),8.17–8.07(m,2h),7.94(dd,j=11.7,7.5hz,3h),7.84(s,1h),7.79–7.67(m,4h),7.62(dd,j=7.9,5.6hz,2h),7.46–7.38(m,1h),7.28(t,j=6.7hz,6h),7.15(d,j=7.9hz,9h),7.07(d,j=7.0hz,6h),6.83(t,j=7.7hz,1h),6.75(t,j=7.6hz,1h),6.61(d,j=9.5hz,1h),6.46(d,j=9.3hz,1h),2.08–1.80(m,9h),1.23–1.00(m,24h),0.80(dd,j=14.8,7.4hz,12h),0.65(s,8h).13cnmr(101mhz,cdcl3)δ175.72,174.93,173.65,165.95,164.51,163.45,153.08,152.60,151.82,151.56,150.43,149.75,149.47),148.64,147.73,145.46,137.99,134.34,129.32,127.74,127.06,126.26,124.33,123.25,122.77,122.49,121.41,120.97,120.13,119.57,118.46,110.22,109.23,55.53,40.16,31.56,29.58,23.83(s,8h),22.60,14.09.ms(maldi-tof,m/z)calcdforc96h94f2irn7o4,1639.70;found:1638.141.
ir(f-dfof)(b-dfob)(pic):1hnmr(400mhz,cdcl3)δ8.35–8.30(m,1h),8.23(dd,j=8.8,5.1hz,2h),7.97–7.92(m,1h),7.92(s,2h),7.82(s,1h),7.70(t,j=7.8hz,2h),7.59(d,j=10.1hz,2h),7.38–7.31(m,2h),7.30–7.23(m,7h),7.24(s,6h),7.14(d,j=7.6hz,5h),7.11(d,j=1.8hz,1h),7.06(d,j=7.6hz,7h),7.03(d,j=1.4hz,1h),6.99(t,j=7.3hz,2h),6.87(dd,j=8.2,1.8hz,1h),6.72(td,j=8.8,2.2hz,1h),6.46(dd,j=9.5,2.3hz,1h),1.87(ddd,j=34.1,21.2,6.8hz,10h),1.23–0.96(m,27h),0.82(t,j=7.0hz,4h),0.79–0.72(m,8h),0.64(s,7h).13cnmr(101mhz,cdcl3)δ176.32,175.84,173.60,166.34,166.22,165.97,165.73,164.36,163.77,163.37,162.46,153.46,152.87,151.57,151.51,151.32,149.70,148.49,147.71,145.35,144.89,144.55,137.74,134.41,129.30,127.59,126.97,126.76,126.22,124.81,124.18,123.21,122.69,121.25,120.81,120.28,119.55,118.46,116.68,109.79,55.44,54.51,40.29,31.52,29.58,24.30,23.27,22.53,14.07.ms(maldi-tof,m/z)calcdforc96h94f2irn7o4,1639.70;found:1638.044.
图1~图8给出的质谱图和核磁氢谱图验证了化合物结构。
为了更进一步对本章中合成材料的电致发光性质进一步的研究,以配合物作为客体发光材料进行设计结构为ito/pedot:pss/eml/tmpypb(60nm)/lif(0.8nm)/al的器件,器件以ito作为阳极,pedot作为空穴传输传输层,tmpypb为电子传输层,lif最为缓冲层利于电子注入,al作为器件的阴极。其中发光层中我们采用6%的配合物掺杂,主体材料采用tcta:26-dczppy(3:7)。
图9给出了有机电致发光磷光器件的结构图。
如图10所示,ir(b-dfob)2(pic)和ir(b-dfof)2(pic)的最大发射峰在556nm左右,这两种铱配合物都显示橙黄光发射,从图10(b)可以看出,器件的亮度随着电压的增加而增加,同样的电压条件下ir(b-dfof)2(pic)的亮度低于ir(b-dfob)2(pic)的亮度,ir(b-dfof)2(pic)的启亮电压要高于ir(b-dfob)2(pic),分别为5.8v和5.1v,这说明f原子的引入会降低器件的亮度,增大器件的启亮电压,这与二苯胺基团的引入有很大关系。结合9(c)和9(d)在同样的电压条件下配合物ir(b-dfob)2(pic)有更大的电流密度,说明ir(b-dfob)2(pic)有更好的载流子产生能力,并且ir(b-dfob)2(pic)的最大电流效率为11.5cd/a(7.0v)要高于ir(b-dfof)2(pic)的最大电流效率9.2cd/a(7.5v)。综上,在二苯胺修饰的这些配合物中,引入f原子会降低器件的整体性能。
图11可以看出,配合物ir(f-dfob)(b-dfob)(pic)和ir(f-dfob)(b-dfob)(pic)的发光波长都在橙黄光波长范围内配合物中,单个f原子的引入同样会产生器件的亮度、电流密度和电流效率降低的现象。
图12和图13给出了配合物的光物理性质的数据,由此可以得知如下数据。
对ir(b-dfob)2(pic)和ir(b-dfof)2(pic)的光谱进行对比可以看出,苯环对位f原子的引入使得配合物的发射峰有蓝移现象。
本发明制备得到的芴基-噁二唑的双极性磷光铱配合物中包含给电子和吸电子基团,有利于平衡电子和空穴的注入及在发光层中的传输,显著提升器件的效率;芴基作为空穴传输基团为电子给体,具有较强亲电子能力的噁二唑基团作为电子受体,能够提高发光效率;采用二苯胺基团对噁二唑衍生物进行修饰,改变电子云的分布从而调节有机电致发光的位置和发光效率。本发明还提供了一种简易制备有机电致发光材料的方法,该方法工艺简单,制造成本低本发明合成的铱配合物制作的器件具有相对较高的效率。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变形,这些改进和变形也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!