一种多芳基取代富瓦烯化合物及其合成方法与流程
本发明属于精细化工技术领域,具体涉及一种多芳基取代富瓦烯化合物及其合成方法。
背景技术:
富瓦烯及其衍生物在有机合成化学、有机电致发光器件、场效应晶体管、激光器和光伏电池等领域展现了广阔应用前景。传统合成方法一般是将环戊烯酮或者环戊二烯衍生物与锂试剂在溶液中作用,然后加入碘醚或者通入氧气进行反应获得富瓦烯化合物;也有文献报道在950℃下真空闪蒸热解二茂镍制备9,10-二氢富瓦烯。这些合成方法大多反应条件苛刻、步骤繁琐、产品产率低,且很难分离纯化。最近也有文献(synlett,2016,27,2085-2090)报道可以在碱性条件下合成并四苯基芴基富瓦烯衍生物。随着光电新材料产业的快速发展,设计合成新型富瓦烯化合物吸引了人们极大关注。
联环戊二烯是典型的富瓦烯化合物,该类分子具有大π共轭结构,可以作为电子受体材料和电子传输材料,在有机光伏器件和有机发光二极管等方面具有的应用潜力;但受限结构稳定性差、合成步骤多、操作复杂等原因,该类化合物的合成报道并不多见。邱昌隆和刘继峰(兰州大学学报(自然科学版),1984,20,276-277)报道了在冰浴条件下,使用四氯化钛、三乙胺与三苯基环戊二烯反应制备联环戊二烯化合物;okuda等人(chem.ber.1991,124,1575-1577)报道在-95℃下使用氯化铁和1,2,4-三(三甲基硅烷)环戊二烯基锂反应制备二氢富瓦烯衍生物。迄今为止尚缺少高产率的多芳基取代联环戊二烯类富瓦烯化合物的合成方法,对其结构和性质的研究更是鲜有报道。
技术实现要素:
本发明的目的是提供一种多芳基取代富瓦烯化合物及其合成方法。
本发明的技术方案:
一种多芳基取代富瓦烯化合物,其结构式如(i)所示:
式中,r为4-溴苯基、4-甲氧基苯基、4-甲基苯基、4-噻吩-2-苯基、3,5-二甲氧基苯基、3,4,5-三甲氧基苯基、2-甲氧基-1萘基、4-甲氧基-1萘基、4-吡啶基-4苯基、苯基或4-联苯基。
一种多芳基取代富瓦烯化合物的合成方法,步骤如下:
将不同取代基环戊二烯溶于有机溶剂,再加入催化助剂,在60~150℃温度条件下搅拌反应2h~10h;反应结束后,加入去离子水,利用二氯甲烷萃取;萃取液中加入无水mgso4干燥,抽滤得到滤液,将滤液浓缩、蒸发后获得粗产品;使用石油醚和二氯甲烷的混合溶剂作为洗脱剂,粗产品通过硅胶柱层析法纯化、并真空干燥后获得产品。
所述的不同取代基环戊二烯为1,2-二苯基-4-(4-溴苯基)-1,3-环戊二烯、1,2-二苯基-4-(4-甲氧基)苯基-1,3-环戊二烯、1,2-二苯基-4-(4-甲基)苯基-1,3-环戊二烯、1,2-二苯基-4-(4-噻吩-2-苯基)-1,3-环戊二烯、1,2-二苯基-4-(3,5-二甲氧基苯基)-1,3-环戊二烯、1,2-二苯基-4-(3,4,5-三甲氧基苯基)-1,3-环戊二烯、1,2-二苯基-4-(2-甲氧基-1萘基)-1,3-环戊二烯、1,2-二苯基-4-(4-甲氧基-1-萘基)-1,3-环戊二烯、1,2-二苯基-4-(4-吡啶基-4-苯基)-1,3-环戊二烯、1,2,4-三苯基-1,3-环戊二烯、1,2-二苯基-4-(4-联苯基)-1,3-环戊二烯中的一种。
所述的有机溶剂为乙腈、苯、甲苯、n,n’-二甲基甲酰胺、二甲基亚砜、四氢呋喃中的一种。
所述的催化助剂为氯化镍、氯化铝、氯化钛、氯化铜、氯化锡、氯化锰、三苯基膦、二苯基膦、苯基膦、四(三苯基膦)钯、双(三苯基膦)氯化钯中的一种或两种以上混合。
所述的不同取代基环戊二烯和催化助剂的摩尔比为1:0.005~0.35。
本发明的优点和效果是利用催化助剂可以简便合成多苯基取代富瓦烯化合物,具有反应条件温和、绿色、简便、产率高的特点,在原料成本、工艺流程、环境友好等方面具有显著优势。所发明的化合物结构稳定,在医药、有机合成中间体、光电材料等领域都有着良好的应用前景。
附图说明
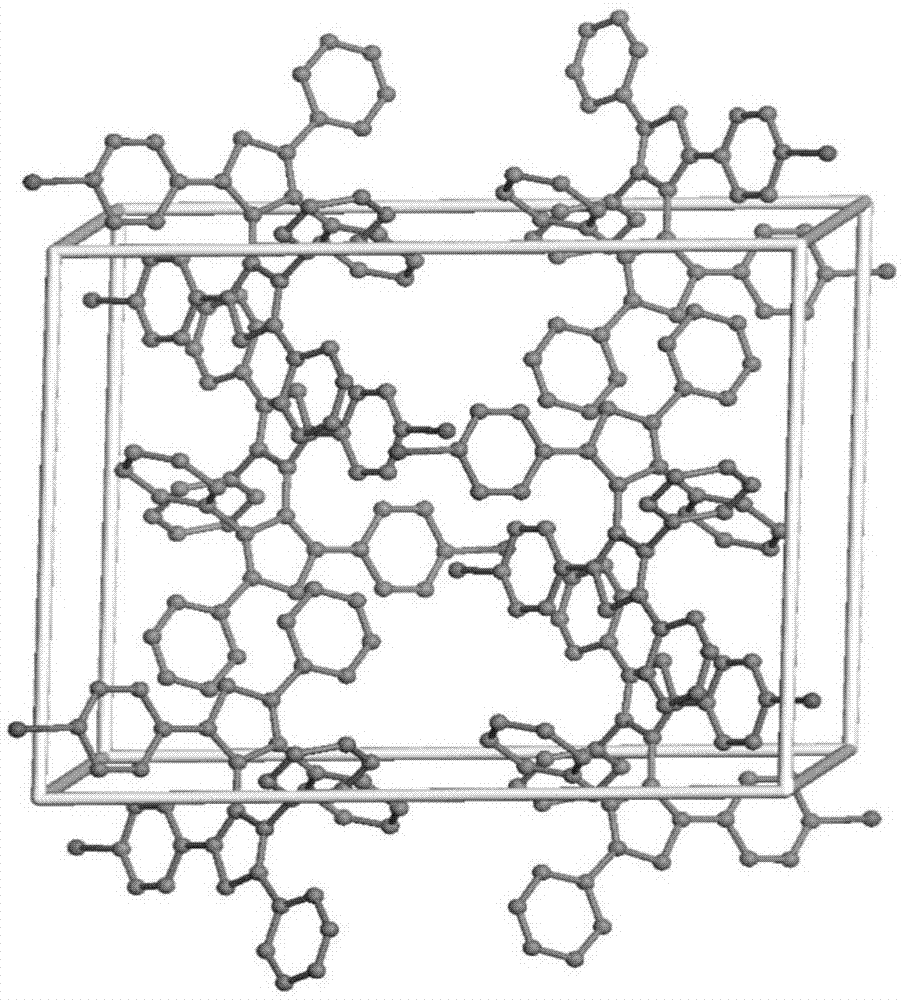
图1为3,7-二氢-1,2,5,6-四苯基-4,8-二(对溴苯基)富瓦烯的晶体结构。
具体实施方式
以下结合附图和技术方案叙述本发明的具体实施方式,但不限定本发明的范围。
实施例1
在100ml的圆底烧瓶中加入1.0mmol1,2-二苯基-4-(4-溴苯基)-1,3环戊二烯、0.13mmolnicl2,然后加入5mldmf,在90℃条件下持续搅拌反应5h,冷却至室温,得到橙红色溶液。将溶液加入到分液漏斗中,加入40ml去离子水,摇匀,再加入50ml二氯甲烷,摇匀,分层,分出下层有机相,加入无水mgso4干燥,抽滤得到滤液;利用旋转蒸发仪将二氯甲烷滤液浓缩、蒸发后得到橙黄色粗产品。利用二氯甲烷/石油醚(1:100)作为洗脱剂、硅胶柱层析法对其提纯、真空干燥后获得产品。产率:74.2%。表征数据:ms(api-es):742.8;1hnmr(400mhz,cdcl3)δ(ppm):7.19–6.96(m,24h),6.69(d,4h),3.83(s,4h).13cnmr(500mhz,cdcl3)δ(ppm):144.06,140.38,140.29,140.12,135.98,135.82,135.47,131.37,129.29,128.11,128.01,127.60,126.60,126.57,120.39,44.52;产物为3,7-二氢-1,2,5,6-四苯基-4,8-二(对溴苯基)富瓦烯。采用溶剂扩散法获得了单晶,并利用x-射线单晶衍射分析证明了其结构(图1)。
结构式为:
将化合物溶于二氯甲烷中配制成5×10-5mol/l溶液,从紫外吸收和荧光发射光谱中可以看出该分子最大吸收波长为360nm,荧光发射峰为453nm。
实施例2
在100ml的圆底烧瓶中加入1.0mmol1,2-二苯基-4-(4-溴苯基)-1,3环戊二烯、0.15mmolpph3,然后加入5mldmf,在90℃条件下持续搅拌反应6h,冷却至室温,得到红色溶液。将溶液加入到分液漏斗中,加入40ml去离子水,摇匀,再加入50ml二氯甲烷,摇匀,分层,分出下层有机相,加入无水mgso4干燥,抽滤得到滤液;利用旋转蒸发仪将二氯甲烷滤液浓缩、蒸发后得到红色粗产品。利用二氯甲烷/石油醚(1:100)作为洗脱剂、硅胶柱层析法对其提纯、真空干燥后获得产品。产率:87.2%。表征数据:ms(api-es):742.8;1hnmr(400mhz,cdcl3)δ(ppm):7.19–6.96(m,24h),6.69(d,4h),3.83(s,4h).13cnmr(500mhz,cdcl3)δ(ppm):144.06,140.38,140.29,140.12,135.98,135.82,135.47,131.37,129.29,128.11,128.01,127.60,126.60,126.57,120.39,44.52;产物为3,7-二氢-1,2,5,6-四苯基-4,8-二(对溴苯基)富瓦烯。
结构式为:
将化合物的二氯甲烷溶液(5×10-5mol/l)最大吸收波长为360nm,荧光发射峰为453nm。
实施例3
在100ml的圆底烧瓶中加入1.0mmol1,2-二苯基-4-(4-溴苯基)-1,3环戊二烯、0.1mmolnicl2和0.10mmolpph3,然后加入5mldmf,在90℃条件下持续搅拌反应6h,冷却至室温,得到深红色油状物。将产物加入到分液漏斗中,加入40ml去离子水,摇匀,再加入50ml二氯甲烷,摇匀,分层,分出下层有机相,加入无水mgso4干燥,抽滤得到滤液;利用旋转蒸发仪将二氯甲烷滤液浓缩、蒸发后得到深红色粗产品。利用二氯甲烷/石油醚(1:100)作为洗脱剂、硅胶柱层析法对其提纯,并真空干燥后获得产品。产率:95%。表征数据:ms(api-es):742.8;1hnmr(400mhz,cdcl3)δ(ppm):7.19–6.96(m,24h),6.69(d,4h),3.83(s,4h).13cnmr(500mhz,cdcl3)δ(ppm):144.06,140.38,140.29,140.12,135.98,135.82,135.47,131.37,129.29,128.11,128.01,127.60,126.60,126.57,120.39,44.52;产物为3,7-二氢-1,2,5,6-四苯基-4,8-二(对溴苯基)富瓦烯。结构式为:
将化合物的二氯甲烷溶液(5×10-5mol/l)最大吸收波长为360nm,荧光发射峰为453nm。
实施例4
在100ml的圆底烧瓶中加入1.0mmol1,2-二苯基-4-(4-甲氧基苯基)-1,3环戊二烯、0.10mmolnicl2和0.1mmolpph3,然后加入5mldmso,在90℃条件下持续搅拌反应5h,冷却至室温,得到红色溶液。将溶液加入到分液漏斗中,加入40ml去离子水,摇匀,再加入50ml二氯甲烷,摇匀,分层,分出下层有机相,加入无水mgso4干燥,抽滤得到滤液;利用旋转蒸发仪将二氯甲烷滤液浓缩、蒸发后得到深红色粗产品。利用二氯甲烷/石油醚(2:5)作为洗脱剂、硅胶柱层析法对其提纯、真空干燥后获得产品。产率:85%。表征数据:ms(api-es):646.29;1hnmr(400mhz,cdcl3)δ(ppm):7.41–7.37(m,4h),7.14–6.94(m,16h),6.77–6.67(m,8h),3.89–3.79(m,4h),3.77(s,6h).13cnmr(500mhz,cdcl3)δ(ppm):158.37,144.77,140.93,139.72,139.30,136.48,129.86,129.41,128.01,127.77,127.39,126.43,126.04,113.83,55.23,44.50;产物为3,7-二氢-1,2,5,6-四苯基-4,8-二(4-甲氧基苯基)富瓦烯。
结构式为:
将化合物溶于二氯甲烷中配制成5×10-5mol/l溶液,从紫外吸收光谱和荧光发射光谱中可以看出该分子吸收峰位置为351nm,荧光发射波长为463nm。
实施例5
在100ml的圆底烧瓶中加入1.0mmol1,2-二苯基-4-(4-甲氧基苯基)-1,3环戊二烯、0.10mmolcucl2、0.2mmol二苯基膦,然后加入5mldmf,在90℃条件下持续搅拌反应5h,冷却至室温,得到红色溶液。将溶液加入到分液漏斗中,加入40ml去离子水,摇匀,再加入50ml二氯甲烷,摇匀,分层,分出下层有机相,加入无水mgso4干燥,抽滤得到滤液;利用旋转蒸发仪将二氯甲烷滤液浓缩、蒸发后得到红色粗产品。利用二氯甲烷/石油醚(2:5)作为洗脱剂、硅胶柱层析法对其提纯,并真空干燥后获得产品。产率:80%。表征数据:ms(api-es):646.29;1hnmr(400mhz,cdcl3)δ(ppm):7.41–7.37(m,4h),7.14–6.94(m,16h),6.77–6.67(m,8h),3.89–3.79(m,4h),3.77(s,6h).13cnmr(500mhz,cdcl3)δ(ppm):158.37,144.77,140.93,139.72,139.30,136.48,129.86,129.41,128.01,127.77,127.39,126.43,126.04,113.83,55.23,44.50;产物为3,7-二氢-1,2,5,6-四苯基-4,8-二(4-甲氧基苯基)富瓦烯。
结构式为:
将化合物溶于二氯甲烷中配制成5×10-5mol/l溶液,从紫外吸收光谱和荧光发射光谱中可以看出该分子最大吸收波长为351nm,荧光发射峰为463nm。
实施例6
在100ml的圆底烧瓶中加入1.0mmol1,2-二苯基-4-(4-甲氧基苯基)-1,3环戊二烯、0.10mmolnicl2和0.1mmolpph3,然后加入3ml乙腈,在90℃条件下持续搅拌反应5h,冷却至室温,得到红色溶液。将溶液加入到分液漏斗中,加入40ml去离子水,摇匀,再加入50ml二氯甲烷,摇匀,分层,分出下层有机相,加入无水mgso4干燥,抽滤得到滤液;利用旋转蒸发仪将二氯甲烷滤液浓缩、蒸发后得到红色粗产品。利用二氯甲烷/石油醚(2:5)作为洗脱剂、硅胶柱层析法对其提纯,并真空干燥后获得产品。产率:79%。表征数据:ms(api-es):646.29;1hnmr(400mhz,cdcl3)δ(ppm):7.41–7.37(m,4h),7.14–6.94(m,16h),6.77–6.67(m,8h),3.89–3.79(m,4h),3.77(s,6h).13cnmr(500mhz,cdcl3)δ(ppm):158.37,144.77,140.93,139.72,139.30,136.48,129.86,129.41,128.01,127.77,127.39,126.43,126.04,113.83,55.23,44.50;产物为3,7-二氢-1,2,5,6-四苯基-4,8-二(4-甲氧基苯基)富瓦烯。
结构式为:
将化合物溶于二氯甲烷中配制成5×10-5mol/l溶液,从紫外吸收光谱和荧光发射光谱中可以看出该分子最大吸收峰为351nm,荧光最大发射波长为463nm。
实施例7
在100ml的圆底烧瓶中加入1.0mmol1,2-二苯基-4-(4-甲基苯基)-1,3环戊二烯、0.10mmolnicl2、0.10mmolpd(pph3)4,然后加入5mldmso,在90℃条件下持续搅拌反应4h,冷却至室温,得到橙色溶液。将溶液加入到分液漏斗中,加入40ml去离子水,摇匀,再加入50ml二氯甲烷,摇匀,分层,分出下层有机相,加入无水mgso4干燥,抽滤得到滤液;利用旋转蒸发仪将二氯甲烷滤液浓缩、蒸发后得到橙黄色粗产品。利用二氯甲烷/石油醚(1:50)作为洗脱剂、硅胶柱层析法对其提纯,并真空干燥后获得产品。产率:78%。表征数据:ms(api-es):614.30;1hnmr(400mhz,cdcl3)δ(ppm):7.40–7.00(m,24h),6.69(d,4h),3.95–3.77(m,4h),2.28(s,6h).13cnmr(500mhz,cdcl3)δ(ppm):144.73,141.12,139.68,138.79,136.44,136.28,134.09,129.51,129.12,128.04,127.47,126.53,126.13,44.52,21.19;产物为3,7-二氢-1,2,5,6-四苯基-4,8-二(4-甲基苯基)富瓦烯。
结构式为:
将化合物溶于二氯甲烷中配制成5×10-5mol/l溶液,从紫外吸收光谱和荧光发射光谱中可以看出该分子最大吸收波长为352nm,在二氯甲烷中荧光发射峰为455nm。
实施例8
在100ml的圆底烧瓶中加入1.0mmol1,2-二苯基-4-(4-甲基苯基)-1,3环戊二烯、0.10mmolnicl2和0.20mmolpph3,然后加入5mldmf,在90℃条件下持续搅拌反应2h,冷却至室温,得到橙黄色溶液。将溶液加入到分液漏斗中,加入40ml去离子水,摇匀,再加入50ml二氯甲烷,摇匀,分层,分出下层有机相,加入无水mgso4干燥,抽滤得到滤液;利用旋转蒸发仪将二氯甲烷滤液浓缩、蒸发后得到橙黄色粗产品。利用二氯甲烷/石油醚(1:50)作为洗脱剂、硅胶柱层析法对其提纯,并真空干燥后获得产品。产率:75%。表征数据:ms(api-es):614.30;1hnmr(400mhz,cdcl3)δ(ppm):7.40–7.00(m,24h),6.69(d,4h),3.95–3.77(m,4h),2.28(s,6h).13cnmr(500mhz,cdcl3)δ(ppm):144.73,141.12,139.68,138.79,136.44,136.28,134.09,129.51,129.12,128.04,127.47,126.53,126.13,44.52,21.19;产物为3,7-二氢-1,2,5,6-四苯基-4,8-二(4-甲基苯基)富瓦烯。
结构式为:
将化合物溶于二氯甲烷中配制成5×10-5mol/l溶液,从紫外吸收光谱和荧光发射光谱中可以看出该分子吸收峰为352nm,在二氯甲烷中荧光发射峰为455nm。
实施例9
在100ml的圆底烧瓶中加入1.0mmol1,2-二苯基-4-(4-甲基苯基)-1,3环戊二烯、0.10mmolnicl2和0.10mmolpdcl2(pph3)2,然后加入5mldmf,在100℃条件下持续搅拌反应4h,冷却至室温,得到橙红色溶液。将溶液加入到分液漏斗中,加入40ml去离子水,摇匀,再加入50ml二氯甲烷,摇匀,分层,分出下层有机相,加入无水mgso4干燥,抽滤得到滤液;利用旋转蒸发仪将二氯甲烷滤液浓缩、蒸发后得到红色粗产品。利用二氯甲烷/石油醚(1:50)作为洗脱剂、硅胶柱层析法对其提纯,并真空干燥后获得产品。产率:75%。表征数据:ms(api-es):614.30;1hnmr(400mhz,cdcl3)δ(ppm):7.40–7.00(m,24h),6.69(d,4h),3.95–3.77(m,4h),2.28(s,6h).13cnmr(500mhz,cdcl3)δ(ppm):144.73,141.12,139.68,138.79,136.44,136.28,134.09,129.51,129.12,128.04,127.47,126.53,126.13,44.52,21.19;产物为3,7-二氢-1,2,5,6-四苯基-4,8-二(4-甲基苯基)富瓦烯。
结构式为:
将化合物溶于二氯甲烷中配制成5×10-5mol/l溶液,从紫外吸收光谱和荧光发射光谱中可以看出该分子最大吸收波长为352nm,在二氯甲烷中荧光发射峰为455nm。
实施例10
在100ml的圆底烧瓶中加入1.0mmol1,2-二苯基-4-(4-噻吩-2-苯基)-1,3环戊二烯、0.10mmolnicl2和0.15mmolpph3,然后加入5mldmf,在90℃条件下持续搅拌反应6h,冷却至室温,得到橙黄色溶液。将溶液加入到分液漏斗中,加入40ml去离子水,摇匀,再加入50ml二氯甲烷,摇匀,分层,分出下层有机相,加入无水mgso4干燥,抽滤得到滤液;利用旋转蒸发仪将二氯甲烷滤液浓缩、蒸发后得到黄色粗产品。利用二氯甲烷/石油醚(1:30)作为洗脱剂、硅胶柱层析法对其提纯,并真空干燥后获得产品。产率:90%。表征数据:ms(api-es):749.40;1hnmr(400mhz,cdcl3)δ(ppm):7.45(s,8h),7.18-6.96(m,22h),6.73(d,4h),3.91(s,4h).13cnmr(500mhz,cdcl3)δ(ppm):144.38,140.78,140.55,139.67,136.14,135.88,132.42,129.43,128.08,127.55,126.95,126.38,125.79,124.56,122.73,44.45;产物为3,7-二氢-1,2,5,6-四苯基-4,8-二(4-噻吩-2-苯基)富瓦烯。
结构式为:
将化合物溶于二氯甲烷中配制成5×10-5mol/l溶液,从紫外吸收光谱和荧光发射光谱中可以看出该分子最大吸收波长为358nm,在二氯甲烷中荧光发射峰为473nm。
实施例11
在100ml的圆底烧瓶中加入1.0mmol1,2-二苯基-4-(4-噻吩-2-苯基)-1,3环戊二烯、0.10mmolalcl3和0.20mmolpph3,然后加入5mldmf,在70℃条件下持续搅拌反应5h,冷却至室温,得到黄色溶液。将溶液加入到分液漏斗中,加入40ml去离子水,摇匀,再加入50ml二氯甲烷,摇匀,分层,分出下层有机相,加入无水mgso4干燥,抽滤得到滤液;利用旋转蒸发仪将二氯甲烷滤液浓缩、蒸发后得到黄色粗产品。利用二氯甲烷/石油醚(1:30)作为洗脱剂、硅胶柱层析法对其提纯、真空干燥后获得产品。产率:72%。表征数据:ms(api-es):749.40;1hnmr(400mhz,cdcl3)δ(ppm):7.45(s,8h),7.18-6.96(m,22h),6.73(d,4h),3.91(s,4h).13cnmr(500mhz,cdcl3)δ(ppm):144.38,140.78,140.55,139.67,136.14,135.88,132.42,129.43,128.08,127.55,126.95,126.38,125.79,124.56,122.73,44.45;产物为3,7-二氢-1,2,5,6-四苯基-4,8-二(4-噻吩-2-苯基)富瓦烯。
结构式为:
将化合物溶于二氯甲烷中配制成5×10-5mol/l溶液,从紫外吸收光谱和荧光发射光谱中可以看出该分子吸收峰位置为358nm,在二氯甲烷中荧光最大发射波长为473nm。
实施例12
在100ml的圆底烧瓶中加入1.0mmol1,2-二苯基-4-(4-噻吩-2-苯基)-1,3环戊二烯、0.10mmolnicl2、0.20mmolpph3,然后加入5mldmf,在90℃条件下持续搅拌反应4h,冷却至室温,得到橙黄色溶液。将溶液加入到分液漏斗中,加入40ml去离子水,摇匀,再加入50ml二氯甲烷,摇匀,分层,分出下层有机相,加入无水mgso4干燥,抽滤得到滤液;利用旋转蒸发仪将二氯甲烷滤液浓缩、蒸发后得到黄色粗产品。利用二氯甲烷/石油醚(1:30)作为洗脱剂、硅胶柱层析法对其提纯、真空干燥后获得产品。产率:82%。表征数据:ms(api-es):749.40;1hnmr(400mhz,cdcl3)δ(ppm):7.45(s,8h),7.18-6.96(m,22h),6.73(d,4h),3.91(s,4h).13cnmr(500mhz,cdcl3)δ(ppm):144.38,140.78,140.55,139.67,136.14,135.88,132.42,129.43,128.08,127.55,126.95,126.38,125.79,124.56,122.73,44.45;产物为3,7-二氢-1,2,5,6-四苯基-4,8-二(4-噻吩-2-苯基)富瓦烯。
结构式为:
将化合物溶于二氯甲烷中配制成5×10-5mol/l溶液,从紫外吸收光谱和荧光发射光谱中可以看出该分子最大吸收波长为358nm,在二氯甲烷中最大荧光发射波长为473nm。
- 还没有人留言评论。精彩留言会获得点赞!