一种Cu-Ag双金属水凝胶的制备方法与一种晶体的制备方法与流程
本发明涉及水凝胶技术领域,尤其涉及一种cu-ag双金属水凝胶的制备方法与一种晶体的制备方法。
背景技术:
超分子水凝胶是低分子量凝胶因子之间通过π-π堆积、疏水等非共价键的协同作用自组装形成的纤维网络结构,从而束缚住水分子的软材料。超分子水凝胶具有良好的生物相容性与生物降解能力,经常用于生物传感器、生物材料以及组织工程的支架等。超分子水凝胶因子中引入金属离子,可以改变体系的相态及性能从而形成超分子金属水凝胶。超分子金属水凝胶具备超分子水凝胶所具备的多重刺激响应性(如温度、热、ph、化学物质等)。
到目前为止,有少数含有两种金属离子的凝胶属于超分子金属有机凝胶,并且是在凝胶因子本身形成凝胶的体系中混入金属离子形成的。超分子金属水凝胶中一般只包含一种金属离子,由于金属离子的引入,使得超分子水凝胶具备了各种新的特殊性质,比如磁响应性、催化、传感、氧化还原、光电作用等。而双金属中心可以提高体系的光学选择性和活性等。金属作为催化剂的活性中心,链接配体的方向对其催化性能有至关重要的影响;通过构建具有多金属中心的超分子水凝胶对体系的立体选择性、催化活性等方面具有极大的改善作用。
基于苯丙氨酸的氨基酸或短肽的水凝胶具备生物兼容性好、生物易降解、化学可修饰及廉价易制备等诸多优良性质,已被广泛应用于组织工程、药物缓释、细胞培养等领域。苯丙氨酸是天然氨基酸中的一种,并且结构中含有苯环,因此基于苯丙氨酸的衍生物比其它氨基酸类更容易形成凝胶。
如果只以苯丙氨酸为基础设计超分子金属水凝胶,其配位能力不够强,有可能达不到想要的效果;如果只以单独的吡啶为配体设计超分子金属水凝胶,由于其亲水性太强、不利于形成凝胶;并且要制备双金属水凝胶,凝胶因子必须同时具备多个配位点。因此,利用苯丙氨酸与吡啶形成的超分子金属水凝胶是研究的重要方向。
技术实现要素:
本发明解决的技术问题在于提供一种cu-ag双金属水凝胶的制备方法。
有鉴于此,本申请提供了一种cu-ag双金属水凝胶的制备方法,包括:
将如式(ⅰ1)或式(ⅰ2)所示的配体的水溶液、铜盐的水溶液和银盐的水溶液混合,调整得到的混合液的ph,得到cu-ag双金属水凝胶;
优选的,所述配体的水溶液的浓度为0.08~0.20mol/l。
优选的,所述配体的水溶液的浓度为0.08~0.10mol/l。
优选的,所述配体的水溶液中的配体与金属离子的摩尔当量为2:1;所述金属离子为铜盐的水溶液中铜离子与银盐的水溶液中银离子的总量。
优选的,所述调整得到的混合液的ph至8~10。
优选的,所述铜盐为醋酸铜,所述银盐为硝酸银。
优选的,所述配体的水溶液中还包括助溶剂。
优选的,所述助溶剂为氢氧化钠。
本身其还提供了一种晶体的制备方法,包括:
将如式(ⅰ1)或式(ⅰ2)所示的配体的水溶液与铜盐的水溶液混合,调整混合液的ph,放置后得到晶体;
优选的,所述放置的时间为3周以上。
本申请提供了一种cu-ag双金属水凝胶的制备方法,其是将如式(ⅰ1)或式(ⅰ2)所示的配体(pf)的水溶液、铜盐的水溶液和银盐的水溶液混合,调整得到的混合液的ph,得到cu-ag双金属水凝胶;在制备cu-ag双金属水凝胶的过程中,配体pf具体为苯丙氨酸与吡啶形成的化合物,其中苯丙氨酸具有芳香性,在自组装过程中可提供π-π堆积,氨基氮原子、羧基氧原子和吡啶氮原子都可以作为金属离子配位点,由此,该配体具有极强的选择性响应能力,在其中加入铜盐和银盐,可以制备出罕见的pf-cu-ag双金属水凝胶。该金属水凝胶具有良好的多重刺激响应性。
附图说明
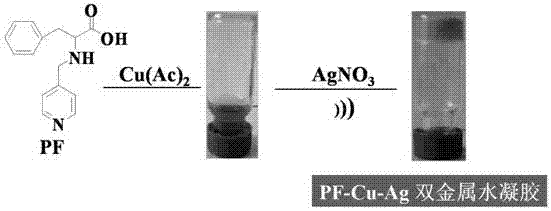
图1为pf-cu-ag双金属水凝胶的形成过程实物图;
图2为2-pf、3-pf、bf分别与cu2+和ag+混合后的成胶情况实物图;
图3为pfcu单晶的形成过程实物图;
图4为pfcu单晶的结构示意图;
图5为pf-cu-ag双金属水凝胶的刺激响应性图;
图6为pf-cu-ag双金属水凝胶的频率扫描曲线图;
图7为pf-cu-ag双金属水凝胶的sem图;
图8为pf、pf-cu和pf-cu-ag双金属水凝胶的红外光谱图;
图9为pf-cu-ag双金属水凝胶的质谱图。
具体实施方式
为了进一步理解本发明,下面结合实施例对本发明优选实施方案进行描述,但是应当理解,这些描述只是为进一步说明本发明的特征和优点,而不是对本发明权利要求的限制。
本发明提供的cu-ag双金属水凝胶是以小分子pf作为配体,与含有cu离子和ag离子的水溶液进行混合、超声,通过多种非共价键相互作用自组装而成。
本申请提供的cu-ag双金属水凝胶与现有技术中的凝胶存在如下区别:文献报道的双金属凝胶中绝大多数都是金属有机凝胶,本发明中涉及的双金属凝胶是金属水凝胶;文献报道中的金属凝胶绝大部分都是凝胶因子本身可以形成凝胶然后在其中掺杂金属离子形成的,本发明中涉及的凝胶因子本身不能形成凝胶,是在双金属离子的作用下引发形成的;文献中报道的双金属凝胶绝大部分是凝胶因子可以和单独的每种金属离子形成凝胶,再制备成双金属凝胶,该发明中涉及的双金属凝胶是凝胶因子与其中两种单独的金属离子都不能形成凝胶,而是在两种凝胶因子的协同作用下才可以形成凝胶;文献报道中的双金属绝大部分不在同一族,该发明中涉及的cu2+和ag+是同一族的元素;文献中报道的双金属凝胶涉及的凝胶因子和凝胶制备过程复杂,而该发明涉及的凝胶因子和凝胶的制备过程简单。由此,本申请提供的cu-ag双金属水凝胶具有重要的意义。具体的,本发明实施例公开了一种cu-ag双金属水凝胶的制备方法,包括:
将如式(ⅰ1)或式(ⅰ2)所示的配体的水溶液、铜盐的水溶液和银盐的水溶液混合,调整得到的混合液的ph,得到cu-ag双金属水凝胶;
在制备cu-ag双金属水凝胶的过程中,本申请采用的配体是基于苯丙氨酸和4-吡啶甲醛形成的配体(pf),其具体如式(ⅰ1)或式(ⅰ2)所示,其本身不能形成凝胶。所述配体pf按照现有方法制备即可,对此本申请没有特别的限制。在配制配体的水溶液中,在其中优选加入助溶剂,所述助溶剂在具体实施例中选自氢氧化钠。所述配体的水溶液的浓度为0.08~0.20mol/l,在具体实施例中,所述配体的水溶液的浓度为0.08~0.1mol/l。
按照本发明,在配体配制完成后则将铜盐的水溶液与银盐的水溶液与配体的水溶液混合,即得到混合溶液;在此过程中,所述铜盐为本领域技术人员熟知的,对此本申请没有特别的限制,在实施例中,所述铜盐具体为醋酸铜,所述银盐为本领域技术人员熟知的,对此本申请没有特别的限制,在实施例中,所述银盐具体为硝酸银。在具体实施例中,所述配体的水溶液中的配体与金属离子的摩尔当量为2:1;所述金属离子为铜盐的水溶液中铜离子与银盐的水溶液中银离子的总量。
按照本发明,调节上述混合溶液的ph超声后即得到cu-ag双金属水凝胶。所述上述混合溶液的ph具体为8~10。
本申请同时提供了一种晶体的制备方法,包括:
将如式(ⅰ1)或式(ⅰ2)所示的配体的水溶液、铜盐的水溶液混合,调整得到的混合液的ph,放置后得到晶体;
本申请上述晶体的制备过程中,与cu-ag双金属水凝胶的制备方法的区别仅在于没有加入银盐的水溶液,其他条件一致,此处不进行赘述。在此过程中,混合物调整ph之后再放置即可形成pfcu晶体。在上述过程中,所述放置的时间为3周以上。
本发明提供了一种cu-ag双金属水凝胶的制备方法。本发明中的凝胶因子(pf)制备方法简单、符合绿色环保理念,该凝胶因子与cu(ac)2混合放置几周后可以组装形成单晶;凝胶因子与所研究的单独一种金属离子混合都不能形成水凝胶,而当凝胶因子与银盐和铜盐混合后可以形成双金属水凝胶(pf-cu-ag)。该金属水凝胶具有良好的多重刺激响应性。
为了进一步理解本发明,下面结合实施例对本发明提供的金属水凝胶的制备方法进行详细说明,本发明的保护范围不受以下实施例的限制。
以下原料均为市售产品或按照现有方法制备。
实施例1
秤取一定量pf样品(如式(ⅰ1)或式(ⅰ2)所示的配体均可),加少量氢氧化钠助溶,配制0.1m的pf水溶液,溶液无色透明;分别称取一定量的下列各种盐mg(ac)2、ca(ac)2、mn(ac)2、fe(ac)2、co(ac)2、ni(ac)2、zn(ac)2、cu(ac)2以及agno3,并分别配制0.1m的上述各种金属盐的水溶液。
实施例2
分别移取0.1m的pf水溶液100μl与上述各离子溶液按照配体与金属2:1摩尔当量在玻璃瓶中混合,调整得到的混合溶液ph至8~10,震摇或超声,观察是否有金属水凝胶形成。
结果发现上述混合物或形成沉淀、或形成粘稠液体、或是澄清液,都不能形成金属水凝胶。
实施例3
分别移取0.1m的pf水溶液100μl与上述两种二价离子的混合溶液(具体组合为:cu2++mg2+,cu2++ca2+,cu2++mn2+,cu2++fe2+,cu2++co2+,cu2++ni2+,cu2++zn2+)按照配体与金属2:1摩尔当量在玻璃瓶中混合,调整得到的混合溶液ph至8~10,震摇或超声,观察是否有金属水凝胶形成。结果发现上述混合物,都不能形成双金属水凝胶。
实施例4
分别移取0.1m的pf水溶液100μl与上述各二价离子(铜离子除外)与银离子的混合溶液(具体组合为:ag++mg2+,ag++ca2+,ag++mn2+,ag++fe2+,ag++co2+,ag++ni2+,ag++zn2+)按照配体与金属2:1摩尔当量在玻璃瓶中混合,调整得到的混合溶液ph至8~10,震摇或超声,观察是否有金属水凝胶形成。结果发现上述混合物,都不能形成双金属水凝胶。
实施例5
分别移取0.1m的pf水溶液100μl与上述铜离子与银离子的混合溶液按照配体与金属2:1摩尔当量在玻璃瓶中混合,调整得到的混合溶液ph至8~10,超声,观察是否有金属水凝胶形成。结果发现上述混合物能够形成蓝色不透明的双金属水凝胶,如图1。
实施例6
配制一系列不同浓度(0.02m,0.04m,0.06m,0.08m,0.1m)的pf水溶液,分别与上述铜离子与银离子的混合溶液按照配体与金属2:1摩尔当量在玻璃瓶中混合,调整得到的混合溶液ph至8~10,超声,观察是否有金属水凝胶形成。结果发现当pf水溶液浓度为0.08m和0.1m时能够形成蓝色不透明的双金属水凝胶,说明最小成胶浓度为0.08m。
实施例7
分别配制0.1m的2-pf,3-pf,bf水溶液,各取100μl与上述铜离子与银离子的混合溶液按照配体与金属2:1摩尔当量在玻璃瓶中混合,调整得到的混合溶液ph至8~10,超声,观察是否有金属水凝胶形成。结果表明这些混合物都没有凝胶生成,如图2。
实施例8
分别移取0.1m的pf水溶液100μl与上述铜离子溶液按照配体与金属2:1摩尔当量在玻璃瓶中混合,调整得到的混合溶液ph至8~10,超声,放置。结果发现上述混合物,在3周后形成蓝色单晶,如图3。
实施例9
对形成的pfcu单晶进行单晶衍射实验测试,单晶结构结果如图4。
实施例10
对在最小成胶浓度下形成的pf-cu-ag金属水凝胶进行各种表征,结果如图5~9。
图5为pf-cu-ag双金属水凝胶的刺激响应性图;由图5可知,pf-cu-ag金属水凝胶对热、机械剪切力和化学物质等具有良好的刺激响应性。
图6为pf-cu-ag双金属水凝胶的频率扫描曲线图;由图6可知,在测试范围内,pf-cu-ag金属水凝胶的储能模量(g’)和损耗模(g”)都不受频率影响。
图7为pf-cu-ag双金属水凝胶的sem图;由图7可知,pf-cu-ag金属水凝胶的微观形貌呈纤维网络结构。
图8为pf、pf-cu和pf-cu-ag双金属水凝胶的红外光谱图;图9为pf-cu-ag双金属水凝胶的质谱图;图8和图9共同说明凝胶因子与金属离子的配位情况。
以上实施例的说明只是用于帮助理解本发明的方法及其核心思想。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护范围内。
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
- 还没有人留言评论。精彩留言会获得点赞!