一种快速评价葡萄糖氧化酶产酸能力的方法与流程
本发明涉及一种快速评价葡萄糖氧化酶产酸能力的方法。
背景技术:
葡萄糖氧化酶(glucoseoxidase,简称god)能够在有氧气的条件下专一性催化β-d-葡萄糖生成葡萄糖酸和过氧化氢。葡萄糖酸可以降低动物肠道ph值,再加上氧气被消耗,可以抑制动物肠道内有害菌生长繁殖、促进有益菌的生长繁殖。葡萄糖氧化酶广泛地分布于动物、植物和微生物体内,但由于微生物具有生长繁殖速度快,来源广等特点,使之成为葡萄糖氧化酶的主要来源,微生物中的主要生产菌株为黑曲霉和青霉。葡萄糖氧化酶广泛应用于食品、饲料、医药等行业中,起到了去除葡萄糖、脱氧、杀菌等作用。
葡萄糖氧化酶在饲料领域作为一种新型酶制剂,有着出色的产酸能力,能在底物存在的条件下快速降低溶液的ph,而低ph具有改善动物肠道健康的作用。
当前要解决葡萄糖氧化酶产酸能力的评价问题,迫切需要一种体外评判方法,来真实快速地反映葡萄糖氧化酶在实际生产中的产酸能力。
技术实现要素:
针对现有技术中存在的缺陷,本发明的目的在于提供一种快速评价葡萄糖氧化酶产酸能力的方法,具有检测时间短,方法简单,快速,重现性好的优点。
为达到以上目的,本发明采取的技术方案是:
一种快速评价葡萄糖氧化酶产酸能力的方法,所述方法包括如下步骤:
(1)配置一定浓度的葡萄糖溶液,静置一段时间后得到ph稳定的葡萄糖溶液,测定ph稳定的葡萄糖溶液的ph,得第一ph值;
(2)向步骤(1)ph稳定的葡萄糖溶液中加入一定量的待测葡萄糖氧化酶,反应一段时间后,测定溶液的ph,得第二ph值;
(3)比较第一ph值和第二ph值,即可以反映待测葡萄糖氧化酶的产酸能力。
在上述方法中,所述步骤(1)中葡萄糖溶液的浓度为1%—30%,优选5%—10%,更优选6%;所述步骤(1)中静置一段时间为0.5—25min。
在上述方法中,所述步骤(2)中加入的待测葡萄糖氧化酶的终浓度为0.1—10u/ml,优选0.3—1u/ml;所述步骤(2)反应一段时间为1—10h,优选,2-8h,更优选2h。
在上述方法中,所述步骤(1)中在配置葡萄糖溶液时加入一定浓度的强酸强碱盐;
优选的,所述强酸强碱盐选自kcl、nacl、k2so4、na2so4、kno3、或nano3,优选kcl或nacl,更优选kcl。
在上述方法中,当所述强酸强碱盐为kcl时,所述强酸强碱盐的终浓度为8.4×10-4mol/l—2.7×10-2mol/l(即实施例5表5中10%kcl溶液加入量为0.03125—1ml),优选6.7×10-3mol/l—1.3×10-2mol/l(即实施例5表5中10%kcl溶液加入量为0.25—0.5ml);
当所述强酸强碱盐为nacl时,所述强酸强碱盐的终浓度为1.1×10-3mol/l—3.4×10-2mol/l(即实施例5表5中10%nacl溶液加入量为0.03125—1ml),优选3.4×10-2mol/l(即实施例5表5中10%nacl溶液加入量为1ml)。
在上述方法中,所述步骤(1)中静置一段时间为0.5—10min,优选,1—5min。
本发明还提供了包含葡萄糖和强酸强碱盐的溶液在评价葡萄糖氧化酶产酸能力中的应用。
在上述应用中,所述强酸强碱盐选自kcl、nacl、k2so4、na2so4、kno3、或nano3,优选kcl或nacl,更优选kcl。
在上述应用中,所述葡萄糖的浓度为1%—30%,优选5%—10%,更优选6%。
在上述应用中,当所述强酸强碱盐为kcl时,所述强酸强碱盐的终浓度为8.4×10-4mol/l—2.7×10-2mol/l,优选6.7×10-3mol/l—1.3×10-2mol/l;
当所述强酸强碱盐为nacl时,所述强酸强碱盐的终浓度为1.1×10-3mol/l—3.4×10-2mol/l,优选3.4×10-2mol/l。
本发明的有益效果如下:
本发明提供的葡萄糖氧化酶产酸能力评价方法简单快速;加入强酸强碱盐,可将葡萄糖溶液的ph值稳定时间从几十分钟降低至两分钟左右;葡萄糖含量为6%时可大大节省底物用量且起始ph值接近水的固有ph且葡萄糖氧化酶损耗较低;本发明可在使用葡萄糖氧化酶前进行简单快速地评估不同厂家产品的差异,以找到效果最好的葡萄糖氧化酶用于实际生产。
综上所述,本发明提供的快速评价葡萄糖氧化酶产酸能力的方法,具有检测时间短,方法简单,快速,重现性好的优点。
附图说明
此处所说明的附图用来提供对本申请的进一步理解,构成本申请的一部分,本申请的示意性实施例及其说明用于解释本申请,并不构成对本申请的不当限定。在附图中:
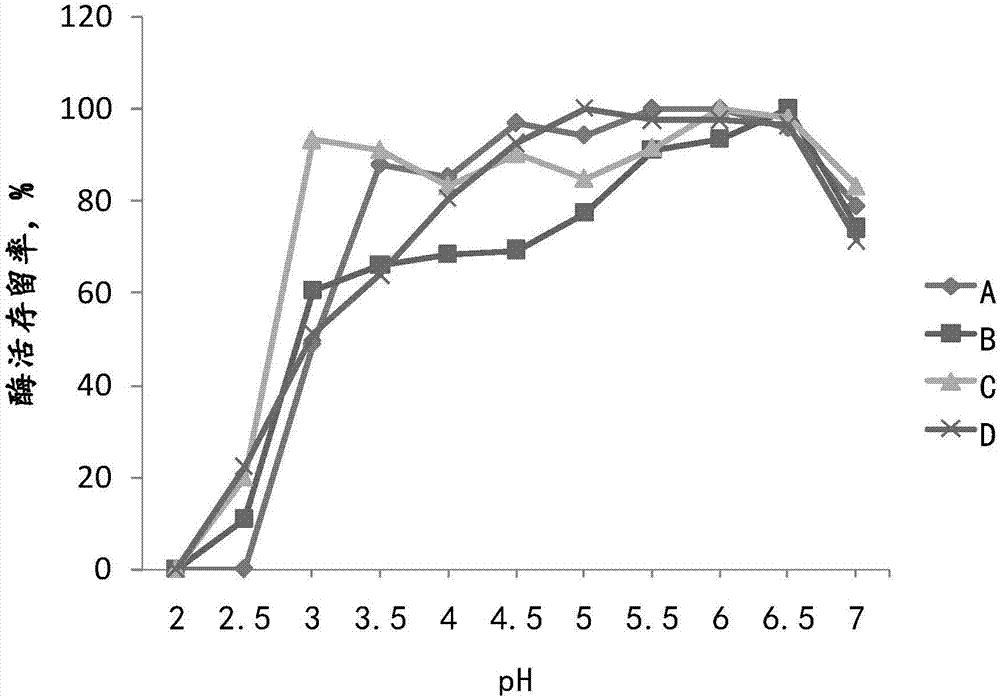
图1为不同厂家葡萄糖氧化酶的ph耐受性(酶活存留率,%)。
图2为不同葡萄糖氧化酶酶活对ph的影响。
图3为不同厂家葡萄糖氧化酶ph降低速率。
具体实施方式
为了更清楚的阐释本申请的整体构思,下面结合说明书附图以示例的方式进行详细说明。
后文中使用的水如无特别说明,均为:除去co2的纯净水,优选煮沸冷却去co2的纯净水。
下述实施例中使用的试剂及其配置方法如下:
葡萄糖氧化酶:带有载体的葡萄糖氧化酶要在纯净水中充分搅拌溶解30min再定容,定容后将配制好的葡萄糖氧化酶溶液4000rpm离心5min。
葡萄糖溶液:称取葡萄糖,加入水80ml充分搅拌(30min),用水定容至100ml,浓度单位“%”的含义为“g/100ml”。
10%kcl溶液配制:称取1gkcl,加入水8ml充分搅拌(5min),用水定容至10ml,其中“%”的含义为“g/100ml”。
10%nacl溶液配制:称取1gnacl,加入水8ml充分搅拌(5min),用水定容至10ml,其中“%”的含义为“g/100ml”。
下述实施例中ph测定使用ph计为上海雷磁仪器有限公司的phs-3c型ph计。
下述实施例中的葡萄糖氧化酶酶活检测方法及酶活定义方法如下:
酶活定义方法:在37℃、ph值为5.5的条件下,每分钟能把1.0μmol的β-d-葡萄糖氧化成d-葡萄糖酸和h2o2的酶量为1u。
酶活检测原理:葡萄糖和氧反应,在葡萄糖氧化酶的作用下,生成水和红色的氧化型邻联茴香胺。
酶活检测方法:
缓冲溶液a(0.25mol/l乙酸-乙酸钠缓冲溶液,ph5.50)配制:称取34.02g三水合乙酸钠于1000ml烧杯中,加入900ml经煮沸冷却(去除co2)的水,搅拌溶解,用冰乙酸调节ph至5.5±0.01,用煮沸冷却的水定容至1000ml。
缓冲溶液b配制:称取0.1000g邻联茴香胺,加入10ml甲醇,混匀器振荡溶解。临用时现配,取0.1ml加入到12ml缓冲溶液a中混匀,避光保存。
葡萄糖溶液配制:18.00g无水葡萄糖加适量蒸馏水溶解,并定容至100ml。配置完后室温须放置2h以上或4℃过夜,待变旋平衡后方可使用。4℃保存,有效期为3天。
辣根过氧化物酶溶液配制:称取辣根过氧化物酶(hrp,美国ameresco公司,250u/mg)10mg,溶于30ml蒸馏水。
(1)待测酶样品的处理
称取固体样品精确至0.0001g,置于100ml容量瓶中,加入缓冲溶液b摇匀并定容至刻度。放入一个磁力棒,在磁力搅拌器上搅拌30min。6000r/min离心5min,取上清用缓冲溶液a做适当稀释后进行试验,使得测定△a值在0.25-0.4。
液体样品直接用缓冲溶液a做适当稀释后进行试验,使得测定△a值在0.25-0.4。
(2)酶活测定
取2支干净试管,按顺序分别加入以下试剂,酶样品置于试管中37℃预热5min。取10ml稀释好的酶液置37℃恒温水浴锅中,恒温5min。取两支洁净试管,分别加入缓冲溶液b2.5ml,葡萄糖溶液0.3ml,辣根过氧化物酶溶液0.1ml,置37℃恒温水浴锅中,恒温5min后,向其中一管加入0.1ml蒸馏水,以空白管调零,随后向样品管中加入0.1ml恒温后的样品溶液摇匀,立即在460nm波长处用1cm杯比色。读取初始吸光度值为a0并计时,反应3min时读取吸光度值为a1,得出△a=a1-a0。
(3)结果表示与计算
公式ⅰ:x=(δa×n×3)/(11.3×t×0.1)
公式ⅰ中,x为酶活(用整数表示);n为稀释倍数;3为反应液体积(ml);11.3为消光系数;t为测定时间(min);0.1为样品体积(ml)。
实施例1、不同浓度葡萄糖溶液的ph
先称取葡萄糖,然后加入水50ml稀释葡萄糖,置于搅拌器上搅拌,获得不同浓度的葡萄糖溶液50ml,分别立即用ph计测定溶液的ph,同时按下秒表记录其ph稳定所需时间。每个浓度的样本做三次平行。结果用平均值±标准差表示,如表1所示。
表1、不同浓度的葡萄糖溶液对终点ph的影响
表1结果表明:葡萄糖浓度越高ph稳定下来所需要的时间越少,并且其ph值也越低,只有6%的葡萄糖溶液比较接近水的固有ph值7.0。
实施例2、葡萄糖氧化酶对不同浓度葡萄糖溶液终点ph的影响
先称取葡萄糖,然后加入水50ml稀释葡萄糖,置于搅拌器上搅拌,分别获得不同浓度的葡萄糖溶液,加入葡萄糖氧化酶至溶液中葡萄糖氧化酶终浓度为2u/ml的溶液,立即用ph计测定溶液的ph,9小时后再测定溶液ph。每个样做三次平行。结果用平均值±标准差表示,如表2所示。
表2、葡萄糖氧化酶对不同浓度葡萄糖溶液终ph的影响
表2的结果显示:葡萄糖溶液的浓度在6%-20%对终点ph没有影响,而葡萄糖溶液的浓度低于6%时会影响终点的ph,因此选择6%的葡萄糖溶液进行葡萄糖氧化酶产酸评价,不仅对终点ph没有影响,而且葡萄糖用量相对较低。
实施例3、不同酶活对终点ph的影响
准备6%的葡萄糖溶液,分装于100ml烧杯中各50ml的葡萄糖溶液,置于搅拌器上搅拌,并加入葡萄糖氧化酶至溶液中葡萄糖氧化酶终浓度为1-10u/ml,立即用ph计测定溶液的ph,9小时后再次测定溶液ph。每个样做三次平行。结果用平均值±标准差表示,如表3所示。
表3、不同酶活对终点ph的影响
表3的结果表明:不同酶活对终点ph有一定的影响,酶活添加量越高,终点ph越高。
实施例4、市场主要葡萄糖氧化酶产品的ph曲线测定
磷酸氢二钠柠檬酸缓冲溶液配置:
溶液a:称取5.25g的柠檬酸溶于水中,定容至500ml。
溶液b:称取35.82g磷酸氢二钠(na2hpo4·12h2o)溶于水中,定容至500ml。
将溶液a和b按不同比例混合,分别获得ph为2、2.5、3.0、3.5、4、4.5、5、5.5、6、6.5、或7的磷酸氢二钠柠檬酸缓冲溶液。
将市场主要葡萄糖氧化酶产品的样品用水溶解稀释至葡萄糖氧化酶活性为250u/ml的酶液,取1ml酶液用不同ph的磷酸氢二钠柠檬酸缓冲溶液稀释定容至25ml,40℃放置4h后,按照酶活检测方法检测其酶活为u耐酸。
对照组吸取1ml稀释后的酶液用ph5.50的乙酸-乙酸钠缓冲溶液稀释定容至25ml,按照酶活检测方法检测其酶活为u0。计算不同ph耐酸性条件下酶活存留率。结果如表4和图1所示。
酶活存留率(%)=(u耐酸/u0)×100
表4.不同厂家葡萄糖氧化酶的ph耐受性(酶活存留率,%)
表4和图1的结果表明:在ph6.5-7及以上时对酶活影响较大,而ph起点低于6.5时对酶活的影响较小。
实施例5、缩短ph稳定的时间,利用强酸强碱盐稳定溶液ph
选择两种实验室最常见的强酸强碱盐nacl和kcl来稳定溶液的ph。配置10%的nacl、kcl溶液,在50ml6%的葡萄糖溶液中加入不同体积的盐溶液,测定加入后稳定ph值所需的时间,每个样做三次平行。结果用平均值±标准差表示,如表5所示。
表5、不同盐溶液对葡萄糖溶液ph的影响
表5的结果表明:加入的盐溶液的量越大,ph稳定的时间越短,但其影响实际溶液最终ph越大,其中,kcl用较小的量就能稳定葡萄糖溶液的ph,在添加量为0.25ml的时候比较接近酶活损失最小ph6.5,且添加的离子浓度较小。
实施例6、不同酶活对ph降低速率的影响
准备100ml烧杯若干,每个烧杯中均加入6%葡萄糖溶液和0.25ml的10%kcl溶液,再分别添加不同葡萄糖氧化酶酶活,每一小时测一次ph,每个样做三次平行。结果用平均值±标准差表示,如表6和图2所示。
表6、不同葡萄糖氧化酶酶活对降ph速率的影响
表6和图2的结果表明:酶活添加量大于1u/ml的组对最终的ph有一定影响,酶活越高,终点ph越高,但小于1u/ml的组对8小时即可到达ph3.0左右,选择0.3-1u/ml的葡萄糖氧化酶进行测量较为合适。
实施例7、不同厂家葡萄糖氧化酶的降酸能力对比
一、条件组合1
准备100ml烧杯若干,每个烧杯中均加入50ml的6%葡萄糖溶液和0.25ml的10%kcl溶液,混合均匀后,静置2min后,测定溶液ph值(即表7中0h的结果),再分别添加不同厂家a、b、c、d的葡萄糖氧化酶(酶活均为0.3u/ml),每一小时测一次ph,每个样做三次平行。结果用平均值±标准差表示,如表7和图3所示。
表7、不同厂家葡萄糖氧化酶ph降低速率
表7和图3的结果表明:其中各个不同厂家的葡萄糖氧化酶降ph最快的时间段主要集中在2h之内,其余时间降ph速率都较小,可集中检测最初2h内的降ph速率,来区别最初产酸能力的问题,8~9小时的降ph能力用于评判其在较低ph的情况下的产酸能力。产酸能力为:a>b>c>d。
二、条件组合2
准备100ml烧杯若干,每个烧杯中均加入50ml的1%葡萄糖溶液和1ml的10%nacl溶液,混合均匀后,静置1min后,测定溶液ph值(即表8中0h的结果),再分别添加不同厂家a、b、c、d的葡萄糖氧化酶(酶活均为10u/ml),每一小时测一次ph,每个样做三次平行。结果用平均值±标准差表示,如表8所示。
表8、不同厂家葡萄糖氧化酶ph降低速率
表8的结果表明:反应2h后,即可以判断葡萄糖氧化酶的产酸能力,产酸能力为:a>b>c>d。
三、条件组合3
准备100ml烧杯若干,每个烧杯中均加入50ml的30%葡萄糖溶液和1ml的10%kcl溶液,混合均匀后,静置1min后,测定溶液ph值(即表9中0h的结果),再分别添加不同厂家a、b、c、d的葡萄糖氧化酶(酶活均为10u/ml),每一小时测一次ph,每个样做三次平行。结果用平均值±标准差表示,如表9所示。
表9、不同厂家葡萄糖氧化酶ph降低速率
表9的结果表明:反应2h后,即可以判断葡萄糖氧化酶的产酸能力,产酸能力为:a>b>c>d。
对比例1、不同厂家葡萄糖氧化酶的抑菌能力对比
取实际动物养殖中的井水和水线水(井水通过管道后,由于管道中有养分沉积,形成生物膜结构,会滋生大量细菌),分别加入少量的葡萄糖和一定量的葡萄糖氧化酶(实施例7中不同厂家的a、b、c、d葡萄糖氧化酶产品)后,4-6小时测定水中菌落数,做为葡萄糖氧化酶组;以不加入葡萄糖和葡萄糖氧化酶为对照组;结果如表10所示。
结果表明,抑菌效果从大到小依次为a>b>c>d,抑菌效果反应产酸能力,产酸能力越好,抑菌效果越好。因此产酸能力从大到小依次为a>b>c>d,与实施例7中的结果一致。
表10.养殖现场菌落数测定cfu·ml-1
本说明书中未作详细描述的内容属于本领域专业技术人员公知的现有技术。以上所述仅为本申请的实施例而已,并不用于限制本申请。对于本领域技术人员来说,本申请可以有各种更改和变化。凡在本申请的精神和原理之内所作的任何修改、等同替换、改进等,均应包含在本申请的权利要求范围之内。
- 还没有人留言评论。精彩留言会获得点赞!