一种条件性诱导表达AsCpf1慢病毒载体及其构建方法和在猪小肠上皮细胞建系中的应用与流程
本发明涉及基因生物工程领域,特别涉及一种crispr-ascpf1系统及其在猪小肠上皮细胞建系中的应用。
背景技术:
crispr/cas系统最早在古细菌中发现,是古细菌用来抵御外源遗传物质的入侵的一种防御系统。它通过特异性的小rna指引识别外源dna序列,并通过表达核酸酶将它们切断,沉默外源基因的表达。正是由于这种精确的基因靶向功能,crispr/cas9系统被开发成一种高效的基因编辑工具。
张锋等(2015)发表在《细胞》杂志上的一项研究中,报道了crispr/cpf1系统。cpf1隶属于ii类typevcrispr系统,其具有与cas9系统不同的优势,可以让基因编辑更简单和精准。crispr/cpf1相比crispr/cas9主要具有如下优势:1)cpf1酶比标准的spcas9要小,更容易操作;2)cpf1剪切时离识别位点很远,位置更灵活;3)cpf1在目标序列的选择上更加灵活,需要更短的rna序列引导,并利用富含t的protospacer相邻基序(pam)序列切割双链dna(dsdna)靶标;4)cas9剪切dna分子的双链,最后形成的是平末端,而cpf1剪切后形成相差5nt的黏性末端。张锋评论说:粘性末端让dna插入更可控。
crispr/cas9系统利用细胞自身dna修复机制,即同源重组与非同源末端连接可以靶向的转入外源dna。虽然同源重组的准确性很高,但由于高等真核细胞内外源dna与靶细胞dna序列自然发生同源重组的机率非常低,约为百万分之一,要把外源基因成功敲入细胞是一件非常困难的工作。另有最新研究显示crispr/cas9系统利用环状dna进行非同源末端连接的机制获得理想的精准靶向外源dna整合结果,但操作繁琐。更简单,高效和精准的外源dna整合技术成为目前医学和动植物育种应用的迫切需要技术之一。
cpf1高敲除低脱靶的切割特性使得其有望成为高效的体外dna靶向整合工具,cpf1主要包括fncpf1、ascpf1和lbcpf1,其中fncpf1识别5’-ytn-3’,而ascpf1和lbcpf1识别5’-tttn-3’pam。以猪小肠上皮细胞为研究模型,可望建立条件性诱导表达crispr/ascpf1系统,为后续猪小肠上皮细胞的科学研究和应用提供可靠的细胞材料。
crispr基因编辑技术是目前应用最广和最主流的基因研究工具,极大的促进了医学和生命科学的研究发展,但目前在人类医学上应用最大的瓶颈是其脱靶效应引起的极其严重的后果,极大的限制了其在人类医学上应用,更精细精准的调控成为目前研究最亟待解决问题之一。tet-on系统因具有极为严密的开/关调控的功能,在制作转基因动物和人类医学研究中得到了广泛的应用。该系统实现了对转入的外源基因时间上的调控表达。人为的控制ascpf1表达,一定程度上减少了crispr系统长期表达进而造成不可预估的脱靶效应,具有潜在应用前景。当在细胞和动物体上研究一些基因时,添加诱导剂,基因得到调控,然后及时停止添加诱导剂,关闭crispr的系统,防止长时间表达引起脱靶。此外对于凋亡调控基因,通过条件性诱导表达可以避免种子细胞枯竭。crispr-ascpf1系统将被广发应用于建立各种动物和细胞模型上,成为功能基因组学和医学研究的有力工具。将crispr-ascpf1系统与tet-on诱导表达系统相结合,有望更好地实现crispr-ascpf1对各种模型动物和细胞模型进行基因的时空敲除、敲入及基因修饰作用,真正按照人们意愿及需求建立各种动物模型及探索研究全基因组基因功能分析提供技术支持。
技术实现要素:
本发明的目的在于通过慢病毒技术与crispr-ascpf1和tet-on-3g相结合的系统,建立条件性诱导ascpf1表达的猪小肠细胞系。ascpf1通过dox.(强力霉素,doxycycline)诱导时,细胞开始大量表达ascpf1,在crrna引导下靶向基因;当停止dox添加时,ascpf1也停止表达,此系统操作简单,使用方便,对于研究一些猪小肠上皮细胞的关键功能基因具有潜在的使用价值,多种证据显示ascpf1具有低脱靶效应,极大地凸显了该细胞系应用前景,证明获得了条件性诱导基因编辑的猪小肠上皮细胞的工具系。
本发明所采取的技术方案是:一种条件性诱导表达ascpf1慢病毒载体的构建方法,其包括步骤:
1)通过nhe1和bamh1双酶切pcw-cas9载体,得到长度为7595bp的线性化tet-on-3g慢病毒载体片段;
2)利用引物1和引物2,以plvx-ascpf1质粒为模板扩增ascpf1基因,得到长度为4026bp的ascpf1基因片段,所述引物1和引物2的序列如seqidno1和2所示;
3)通过连接酶将步骤2)所得ascpf1基因片段与步骤1)中tet-on-3g慢病毒载体片段连接,即构建获得长度为11585bp的tet-on-3g-plvx-ascpf1慢病毒载体。
本发明的另一目的在于提供一种tet-on-3g-plvx-ascpf1慢病毒在猪小肠上皮细胞建系中的应用。
本发明所采取的另一个技术方案是:一种条件性诱导ascpf1表达的猪小肠上皮细胞系的构建方法,其包括步骤:
1)通过对tet-on-3g-plvx-ascpf1慢病毒载体进行慢病毒包装,获得tet-on-3g-plvx-ascpf1病毒液;
2)用tet-on-3g-plvx-ascpf1病毒液对猪小肠上皮细胞进行病毒侵染,经嘌呤霉素筛选,获得稳转的条件性诱导表达ascpf1的猪小肠上皮细胞系;
3)对条件性诱导表达ascpf1的猪小肠上皮细胞系进行目标基因crrna载体的转染,经灭稻瘟菌素筛选,获得crrna稳转条件性诱导ascpf1表达的猪小肠上皮细胞系。
本发明的有益效果是:
本发明利用tet-on-3g系统调控ascpf1表达的慢病毒系统筛选出诱导表达的稳转猪小肠上皮细胞系,将构建好条件性诱导ascpf1表达猪小肠上皮细胞系在体外培养过程中,通过rt-pcr检测分析ascpf1表达情况,当添加dox诱导时,24h内细胞就启动了大量ascpf1表达,无dox诱导时无ascpf1表达;当停止添加dox时,ascpf1在12h后显著下降,在停止添加dox24h和48h时ascpf1表达水平极低,72h后观察不到表达。该结果证明ascpf1严格受dox调控。本发明构建所得的系统操作简单,使用方便,对于研究一些肠道细胞的关键功能基因具有潜在的使用价值:一是可以防止细胞敲除以后发生凋亡,而丧失种子细胞;二是可以有效的防治脱靶效应造成影响。本发明建立了良好的条件性诱导敲除猪小肠上皮细胞模型,对于肠道微环境和营养吸收等方面研究提供重要的试验材料,因此,该本发明构建所得的细胞系将在该领域上具有更广泛的应用。
附图说明
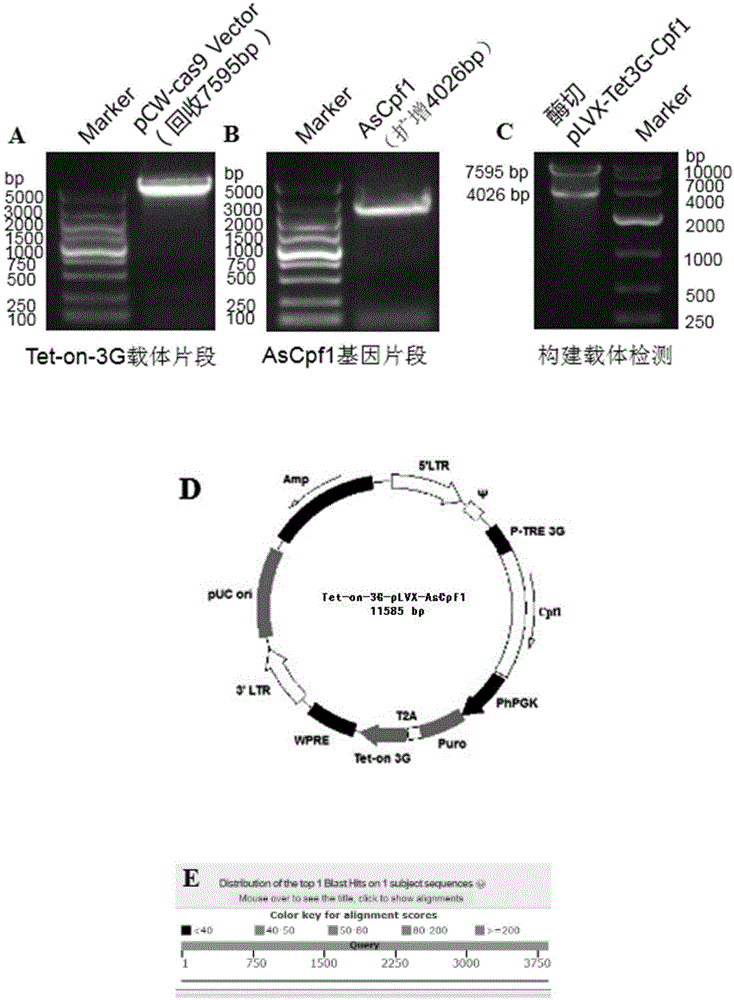
图1为实施例1的tet-on-3g-plvx-ascpf1慢病毒载体构建(a:通过双酶切获得线性化tet-on-3g载体片段;b:通过pcr扩增获取ascpf1基因片段;c;双酶切检测载体构建结果;d:tet-on-3g-plvx-ascpf1慢病毒载体图谱;e:测序比对结果);
图2为实施例2中tet-on-3g-plvx-ascpf1稳转猪小肠上皮细胞筛选(a:通过嘌呤霉素筛选得到的条件性诱导表达ascpf1的猪小肠上皮细胞团;b:通过挑取单个稳筛后的细胞团,获得大量稳转的条件性诱导表达ascpf1的猪小肠上皮细胞);
图3为实施例3中条件性诱导ascpf1表达的检测结果;
图4为实施例4中靶向aqp3基因crrna靶点设计及crrna慢病毒载体构建;
图5为实施例5的crrna慢病毒载体病毒包装(a:包装293ft细胞;b:荧光显微镜观察);
图6为实施例6中crrna稳转条件性表达ascpf1的猪小肠上皮细胞系筛选(a:稳定表达crrna的猪小肠上皮细胞;b:荧光显微镜观察;c:扩大培养后猪小肠上皮细胞侵染crrna;d:荧光显微镜观察);
图7为实施例7中猪小肠上皮细胞目的基因敲除初步分析结果。
具体实施方式
下面结合实施例对本发明进行具体描述,以便于所属技术领域的人员对本发明的理解。有必要在此特别指出的是,实施例只是用于对本发明做进一步说明,不能理解为对本发明保护范围的限制,所属领域技术熟练人员,根据上述发明内容对本发明做出的非本质性的改进和调整,应仍属于本发明的保护范围。同时下述所提及的原料未详细说明的,均为市售产品;未详细提及的工艺步骤或制备方法为均为本领域技术人员所知晓的工艺步骤或制备方法。
实施例1
一种条件性诱导表达ascpf1慢病毒载体的构建方法,其包括步骤:
1)通过nhe1和bamh1双酶切pcw-cas9载体,得到长度为7595bp的线性化tet-on-3g慢病毒载体片段,如图1a所示;
2)利用引物1(序列如seqidno1所示)和引物2(序列如seqidno2所示),以plvx-ascpf1质粒为模板扩增ascpf1基因,得到长度为4026bp的ascpf1基因片段,如图1b所示;
3)通过连接酶将步骤2)所得ascpf1基因片段与步骤1)中tet-on-3g慢病毒载体片段连接,即构建获得长度为11585bp的tet-on-3g-plvx-ascpf1慢病毒载体;
4)用nhe1和bamh1双酶切对步骤3)所得产物进行初步检测,检测结果如图1c所示,该构建好的tet-on-3g-plvx-ascpf1慢病毒载体图谱如图1d所示,将酶切正确的载体送测序公司进行测序,测通后,对比序列,如图1e所示100%正确,证明最终成功获得tet-on-3g-plvx-ascpf1慢病毒载体。
实施例2
一种条件性诱导ascpf1表达的猪小肠上皮细胞系的构建方法,其包括步骤:
1)通过对tet-on-3g-plvx-ascpf1慢病毒载体进行慢病毒包装,获得tet-on-3g-plvx-ascpf1病毒液,具体所述慢病毒包装方案如下:
a、293ft细胞铺板:提前一天在10cm2培养皿中培养293ft细胞,10%293ft细胞培养基培养,当细胞接触达到70~80%时进行侵染;
b、侵染时,取干净的1.5ml离心管,加入300μl的dmem以及慢病毒包装质粒pspax2、pmd2.g和穿梭质粒(plvx-tet-on-3g-ascpf1),各质粒使用量分别为3.5μg、10.4μg和10μg,加入60μlqiagen转染试剂,用移液枪混合均匀,15~25℃静置10~15min;
c、用pbs清洗细胞两次并加入6ml10%293ft细胞培养基,滴加混合液;
d、放置37℃细胞培养箱培养,6h后弃去培养液,继续用10%fbs293ft细胞培养基培养,以维持细胞活性,37℃、5%co2培养箱内培养;
e、48和72h分别收集病毒液,用慢速离心机以2000rpm离心3min取上清液用0.45μm滤器过滤并标注好放进冰箱4℃保存;
2)用tet-on-3g-plvx-ascpf1病毒液对猪小肠上皮细胞进行病毒侵染,获得稳转的条件性诱导表达ascpf1的猪小肠上皮细胞系,具体所述慢病毒侵染方案如下:
a、复苏液氮保存的猪小肠上皮细胞,接种至卡式瓶内,用猪小肠上皮细胞培养液进行细胞培养,置于37℃、5%co2的培养箱中培养,待猪小肠上皮细胞生长至70~80%时用pbs清洗2次;
b、添加5ml完全培养基,根据慢病毒操作手册,计算病毒量,添加6μg/ml的聚凝胺辅助tet-on-3g-plvx-ascpf1病毒液进行病毒侵染,6~12h换液,在病毒侵染48h后添加1μg/ml嘌呤霉素进行筛选,2周后获得猪小肠上皮细胞克隆,如图2a所示;
c、进行传代稳定增殖,稳转的条件性诱导表达ascpf1的猪小肠上皮细胞,如图2b所示,冻存保存,备用;
3)对条件性诱导表达ascpf1的猪小肠上皮细胞系进行目标基因crrna载体的转染,经灭稻瘟菌素筛选,获得crrna稳转条件性诱导ascpf1表达的猪小肠上皮细胞系。
实施例3:条件性诱导表达ascpf1的检测
将上述实施例2中构建好的条件性诱导ascpf1表达的猪小肠上皮细胞,在添加dox24h和停止添加dox12h,24h,48h和72h,分别提取rna,合成cdna,通过rt-pcr分析ascpf1表达情况。
1、猪小肠上皮细胞总rna的提取方法(qiagen微量抽提试剂盒)
1)微量样品,加入新配好的裂解液80μl(裂解液:1ml的缓冲液rlt中含10μl巯基乙醇,使用前配制);
2)加入80μl70%的乙醇,用枪头混匀,不要离心;
3)将样品转移至试剂盒中提供的核酸纯化柱中,装配2ml收集管,轻轻盖上盖子,8000g离心15s,弃去穿透液,放回收集管;
4)加入350μl缓冲液rw1,轻轻盖上盖子,8000g离心15s,弃穿透液,放回收集管;
5)将80μldnaseⅰ直接滴到硅质膜上,室温静置15min,务必直接全部滴上,否则dna会消化不完全;
6)加入350μl缓冲液rw1,8000g离心15s,弃穿透液及收集管;
7)更换新的2ml收集管,加入500μl缓冲液rpe(已按要求加入了无水乙醇),轻轻盖上盖子,8000g离心15s,弃穿透液;
8)加入500μl缓冲液rpe,轻轻盖上盖子,8000g离心2min,彻底去除乙醇,弃穿透液及收集管,取下核酸纯化柱时避免接触到穿透液,乙醇会影响回收;
9)将核酸纯化柱移至新的2ml收集管,并开盖做高速离心2min,弃穿透液和收集管,更换新的1.5ml收集管,直接滴加20~40μl高纯度纯水在膜中心,最高转速离心2min,重复洗脱一次可增加回收量,-80℃保存或立即合成cdna。
2、总rna浓度测定
2%琼脂糖凝胶电泳跑rna样品检测rna是否降解,nanodrop2000检测rna的浓度及纯度,纯度控制在od260/od280为1.8~2.0之间,根据rna浓度计算出样本rna调至1μg的体积。
3、rt-pcr步骤
逆转录检测1ststrandcdnasynthesis采用二步法。第一步:反应体系:样本rna1μg,random6mersprimer1μl,dntp1μl,蒸馏水配平至10μl,反应条件为为65℃5min,冰上急冷;第二步:反应体系:第一步变性、退火后反应液10μl,5×primescripttmbuffer4μl,rnaseinhibitor(40u/μl)0.5μl,primescripttmrnase(200u/μl)1μl,蒸馏水4.5μl,总体系20μl,反应条件:30℃10min,42℃60min,70℃15min,4℃1h。
rt-pcr检测采用20μl体系,体系为:premixtaq10μl;混合引物(使用浓度10pm)0.8μl;dna模板2μl;无菌水7.2μl。反应条件为:第一步预变性;第二步95℃3min,95℃30s、60℃30s和72℃30s(30个循环);第三步总延伸72℃7min。其中β-actin为内参照,对ascpf1表达水平进行分析。
结果显示dox诱导24h后猪小肠上皮细胞大量表达ascpf1基因,在dox诱导前不表达ascpf1;随后停止添加dox,12h后ascpf1表达水平明显减少,到24h和48h表达量极低,72h后检测不到ascpf1表达。检测结果如图3所示,结果证明ascpf1严格受dox调控,实施例2成功构建了条件性诱导ascpf1表达的猪小肠上皮细胞系,其中内参β-action引物对信息和ascpf1引物对信息如下表1所示,β-action上游引物序列如seqidno3所示,β-action下游引物序列如seqidno4所示;ascpf1上游引物序列如seqidno5所示,ascpf1下游引物序列如seqidno6所示。
表1β-action和ascpfl引物对信息
实施例4:靶向aqp3基因crrna靶点设计及crrna慢病毒载体构建
1、根据crrna靶向序列特点和aqp3基因结构(如图4a所示),利用网页工具设计aqp3基因(enssscg00000010991)crrna靶向序列(gctgtggctccgtggcacaggtc),所述crrna靶向序列如seqidno7所示。
2、通过载体定点突变方案,将靶序列构建到plvx-mcherry慢病毒载体中u6启动子下游,根据测序结果成功构建plvx-crrna-mcherry慢病毒载体,所述plvx-crrna-mcherry慢病毒载体图谱如图4b所示。
实施例5:crrna慢病毒载体包装
将上述实施例4构建好的crrna慢病毒载体和包装质粒pspax2和pmd2.g一起转染293ft细胞(如图5a所示),在48h后观察红色荧光蛋白mcherry的表达情况,结果显示mcherry大量表达(如图5b所示),证明crrna慢病毒载体成功转入,可以进一步收集病毒液和纯化。
实施例6:crrna稳转条件性诱导ascpf1表达的猪小肠上皮细胞系筛选
将实施例5包装好的crrna慢病毒对条件性诱导ascpf1表达的猪小肠上皮细胞进行侵染,在添加3μg/ml灭稻瘟菌素筛选2周后,猪小肠上皮细胞全部表达红色荧光,相应检测结果如图6a和6b所示。通过传代扩大培养,红色荧光mcherry稳定表达,相应检测结果如图6c和6d所示,证明本发明构建所得的条件性诱导ascpf1表达的猪小肠上皮细胞系稳定表达crrna。
实施例7:猪小肠上皮细胞目的基因敲除初步分析
将实施例6所得的条件性诱导ascpf1表达的猪小肠上皮细胞在dox诱导24h后进行提取基因组(dox诱导组),同时将不进行dox诱导的猪小肠上皮细胞(对照组)进行提取基因组,分别通过基因组引物进行特异性扩增,其中目的基因为aqp3基因,采用的引物对信息如下表2所示,其中上游引物序列如seqidno8所示;下游引物序列如seqidno9所示。然后送到测序公司进行测序分析,分析结果如图7所示,结果显示dox诱导组出现一些套峰,但高度不高,预估计靶点活性不高,或者dox诱导时间过短引起的,但证明ascpf1具有切割活性。
表2aqp3引物对信息
上述实施例为本发明的优选实施例,凡与本发明类似的工艺及所作的等效变化,均应属于本发明的保护范畴。
sequencelisting
<110>佛山科学技术学院
<120>一种条件性诱导表达ascpf1慢病毒载体及其构建方法和在猪小肠上皮细胞建
系中的应用
<130>2018.11.2
<160>9
<170>patentinversion3.5
<210>1
<211>48
<212>dna
<213>人工合成
<400>1
gatcgcctggagaattggctagcgccaccatgacacagttcgagggct48
<210>2
<211>51
<212>dna
<213>人工合成
<400>2
ggcgcaaccccaaccccggatccttactttttcttttttgcctggccggcc51
<210>3
<211>18
<212>dna
<213>人工合成
<400>3
cctctacgccaacacggt18
<210>4
<211>19
<212>dna
<213>人工合成
<400>4
tgcaactaacagtccgcct19
<210>5
<211>20
<212>dna
<213>人工合成
<400>5
atgccaccaagaagccctac20
<210>6
<211>20
<212>dna
<213>人工合成
<400>6
aacaggccggtccaatacag20
<210>7
<211>23
<212>dna
<213>人工合成
<400>7
gctgtggctccgtggcacaggtc23
<210>8
<211>21
<212>dna
<213>人工合成
<400>8
gcttctcatcctcctgtctcc21
<210>9
<211>26
<212>dna
<213>人工合成
<400>9
cgcctaaggttctaagtatcaaattc26
- 还没有人留言评论。精彩留言会获得点赞!