弓形虫SAG2基因和MIC3基因重组腺病毒构建的方法及重组腺病毒和应用与流程
本发明属于基因生物工程领域,涉及构建重组腺病毒的方法,具体说,是一种利用toxoplasmagondiisag2基因和mic3基因重组腺病毒构建的方法及重组腺病毒和应用。
背景技术:
刚地弓形虫(toxoplasmagondii)是专性细胞内有核寄生的顶覆门原虫,是危害严重的食源性人兽共患寄生虫,能感染畜禽和人在内的200余种动物。人类感染率约为25%~50%,全球约有5~10亿人感染弓形虫病;弓形虫致死性爆发可造成畜禽大量死亡,猪爆发弓形虫病时,死亡率达60%。弓形虫不仅直接危害畜牧业的发展和产品质量安全,而且可因肉食品安全而引发公共卫生和生物恐慌事件,影响社会稳定。
目前,弓形虫的常规疫苗种类包括灭活疫苗、减毒活疫苗、虫体特异组分疫苗和重组蛋白疫苗。但还没有可用于人的弓形虫疫苗,部分国家使用的兽用弓形虫疫苗也仅有一种:s48弱毒株疫苗。因此,研发新型疫苗是控制弓形虫感染和传播的迫切需求。基因工程苗同时具备弱毒疫苗和灭活疫苗的优点,尤其多价基因工程疫苗对控制疫病的传播更具优势。
技术实现要素:
本发明所要解决的技术问题是,提供一种sag2基因和mic3基因重组腺病毒构建的方法及重组腺病毒和应用,将t.gondii的入侵相关蛋白的基因sag2和mic3与腺病毒载体系统高效稳定表达外源基因的特性结合起来,构建出能够表达上述蛋白质的重组腺病毒,分别检测免疫鼠后机体内产生的抗t.gondii抗体的水平、淋巴细胞比例和细胞因子变化等指标,并通过免疫攻虫保护试验检测其免疫保护效果,评价研制的预防弓形虫病的二价基因工程活载体疫苗。
为了解决上述技术问题,本发明采用的技术方案是:一种sag2基因和mic3基因构建重组腺病毒的方法,包括以下步骤:
1)从t.gondiirh株中分别扩增出sag2基因序列gi:m33572.1和mic3基因序列gi:aj132530.1;
所述的sag2基因和mic3基因的扩增包括:以sag2-fseqidno.1和sag2-rseqidno.2为引物,以rh株的rna为模板,rt-pcr扩增获得sag2基因;以mic3-fseqidno.3和mic3-rseqidno.4为引物,以rh株的rna为模板,rt-pcr扩增获得mic3基因;
2)将目的基因重组至腺病毒穿梭质粒,获得的重组质粒phbad-sag2-mic3-egfp与腺病毒大骨架质粒pbhgloxe1,3cre共转染hek293a细胞,重组并包装获得重组腺病毒ad-sag2-mic3-egfp。
所述的t.gondiisag2基因和mic3基因重组腺病毒的构建方法制备的重组腺病毒。
所述的t.gondiisag2基因和mic3基因重组腺病毒的构建方法制备的重组腺病毒在预防弓形虫中的应用。
本发明的有益效果是:分别将t.gondii的入侵相关的基因sag2和mic3与腺病毒载体系统高效稳定表达外源基因的特性结合起来,构建出能够表达上述基因的重组腺病毒ad-sag2-mic3-egfp,籍此研制了预防弓形虫病的二价基因工程活载体疫苗。通过对免疫balb/c小鼠的抗弓形虫抗体水平、淋巴细胞比例和细胞因子变化等指标检测并进行免疫攻虫试验,评价了重组腺病毒的免疫效果。研究结果表明,免疫重组腺病毒ad-sag2-mic3-egfp的balb/c小鼠,免疫28天后小鼠体内抗体可达到有效抗体水平,激活小鼠细胞免疫,且可产生有效的免疫保护作用。本发明研制出一种预防弓形虫病的二价基因工程活载体疫苗。
附图说明
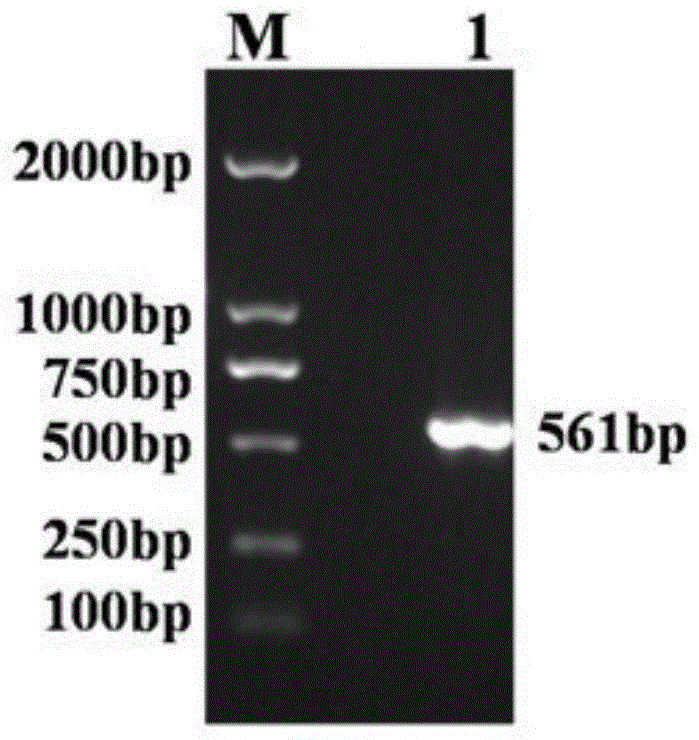
图1是sag2基因rt-pcr扩增结果(m:trans2kdna分子质量标准;1:sag2基因rt-pcr产物);
图2是mic3基因rt-pcr扩增结果(m:trans2kdna分子质量标准;1:mic3基因rt-pcr产物);
图3是重组腺病毒感染hek293a细胞图;
图4是westernblot检测在重组腺病毒感染hek293a细胞后sag2蛋白质和mic3蛋白质的表达情况;
图5是重组腺病毒ad-sag2-mic3-egfp的sag2基因的pcr扩增结果(m:trans2kdna分子质量标准;1:sag2基因pcr产物);
图6是重组腺病毒ad-sag2-mic3-egfp的mic3基因的pcr扩增结果(m:trans2kdna分子质量标准;1:mic3基因pcr产物);
图7是elisa检测免疫重组腺病毒后小鼠抗t.gondii的抗体水平;
图8是流式检测免疫重组腺病毒后小鼠脾脏t淋巴细胞和非t淋巴细胞比例;
图9是流式检测免疫重组腺病毒后小鼠脾脏b淋巴细胞和活化的b淋巴细胞比例;
图10是流式检测免疫重组腺病毒后小鼠脾脏杀伤性t淋巴细胞和活化的杀伤性t淋巴细胞比例;
图11是流式检测免疫重组腺病毒后小鼠脾脏th淋巴细胞和活化的th淋巴细胞比例;
图12是免疫重组腺病毒小鼠血清中th1细胞因子变化;
图13是免疫重组腺病毒小鼠血清中其它细胞因子变化;
图14是免疫重组腺病毒的小鼠攻虫100个t.gondii速殖子的存活率和存活时间;
图15是免疫重组腺病毒小鼠攻虫1000个t.gondii速殖子的存活率和存活时间。
具体实施方式
下面结合附图和具体实施方式对本发明作进一步详细说明:
腺病毒载体相比其他载体具有明显的优势,国内外均有很多以腺病毒为载体制备疫苗的报道,目前腺病毒载体系统已经相当成熟。对t.gondii的研究也已相当清晰,有报道利用其它载体研制sag2或mic3的基因工程疫苗,且免疫攻虫试验证实对小鼠有一定的保护作用,因此,本发明利用t.gondiisag2和mic3基因构建重组腺病毒ad-sag2-mic3-egfp,籍此研制预防弓形虫病的二价基因工程活载体疫苗。
本发明t.gondiisag2基因和mic3基因构建重组腺病毒ad-sag2-mic3-egfp的方法,包括以下步骤:
1)t.gondiisag2基因和mic3基因片段的扩增;
2)在hek293a细胞中重组和包装病毒ad-sag2-mic3-egfp。
具体包括步骤如下:
1)从t.gondiirh株中分别扩增出sag2基因序列gi:m33572.1和mic3基因序列gi:aj132530.1;
所述的sag2基因和mic3基因的扩增包括:以sag2-fseqidno.1和sag2-rseqidno.2为引物,以rh株的rna为模板,rt-pcr扩增获得sag2基因;以mic3-fseqidno.3和mic3-rseqidno.4为引物,以rh株的rna为模板,rt-pcr扩增获得mic3基因;
2)将目的基因重组至腺病毒穿梭质粒,获得的重组质粒phbad-sag2-mic3-egfp与腺病毒大骨架质粒pbhgloxe1,3cre共转染hek293a细胞,重组并包装获得重组腺病毒ad-sag2-mic3-egfp。
所述的t.gondiisag2基因和mic3基因重组腺病毒的构建方法制备的重组腺病毒。
所述的t.gondiisag2基因和mic3基因重组腺病毒的构建方法制备的重组腺病毒在预防弓形虫中的应用。
也就是说:从t.gondiirh株中扩增出目的基因(sag2和mic3);将目的基因经t-a克隆至pmd19-t载体上;经酶切及测序鉴定后与穿梭载体phbad-ef1a-mcs-3flag-cmv-egfp连接;利用脂质体转染法将重组腺病毒穿梭质粒phbad-sag2-mic3-egfp与腺病毒大骨架pbhglox(delta)e1,3cre共转染hek293a细胞,获得重组腺病毒ad-rop9-mic3-egfp,并通过pcr、westernblot鉴定重组腺病毒;重组腺病毒纯化后,经tcid50方法测定重组腺病毒的滴度;将重组腺病毒疫苗免疫balb/c小鼠,elisa检测免疫小鼠抗体;检测免疫小鼠淋巴细胞比例和细胞因子变化等指标;免疫攻虫检测免疫小鼠的发病率和死亡率,评价研制二价疫苗免疫小鼠的效果。
下面结合具体实例对本发明作进一步详细说明:
1材料与方法
1.1sag2基因和mic3基因的扩增
腹腔接种t.gondiirh株于balb/c小鼠,收集的小鼠腹腔液,纯化速殖子,利用trizol法提取虫体rna。根据genbank中t.gondiirh株的sag2基因(m33572.1)和mic3基因序列(aj132530.1)设计引物,进行rt-pcr扩增目的基因片段。sag2基因和mic3基因引物见表1(划线部分为酶切位点,加粗部分为kozak序列),sag2基因和mic3基因的pcr反应体系见表2。
表1扩增sag2和mic3基因片段的引物序列
表2sag2基因和mic3基因的rt-pcr反应体系
注:反应程序为:95℃,预变性5min;{95℃,变性30s;62℃,退火45s;72℃,延伸60s}共30个循环,72℃延伸10min。
1.2重组穿梭腺病毒载体的构建
将获得的sag2基因和mic3基因先后与穿梭载体phbad-ef1a-mcs-3flag-cmv-egfp用相应的酶进行双酶切(酶切反应体系见表3和表4),再将其用t4连接酶16℃连接12h(反应体系见表5)。经菌液pcr、酶切及测序鉴定,筛选出正确的重组穿梭质粒phbad-sag2-mic3-egfp。
表3酶切反应体系
表4酶切反应体系
表5t4连接酶连接体系
1.3腺病毒的重组与包装
取脂质体15.0μl,并将其与3μg腺病毒穿梭质粒phbad-sag2-mic3-egfp和6μg腺病毒大骨架质粒pbhglox(delta)e1,3cre混匀,共转染hek293a细胞,使其在hek293a细胞中重组与包装14d左右,收集cpe细胞,反复冻融并收集病毒,冻存-80℃。
将收集的重组腺病毒接种到正常的hek293a细胞,观察细胞病变情况及荧光显微镜观察细胞荧光情况。通过提取病毒基因组试剂盒提取重组腺病毒的dna,并进行pcr检测目的基因;收集重组腺病毒感染48h后的hek293a细胞,然后通过westernblot检测sag2蛋白和mic3蛋白的表达情况。
1.4重组腺病毒滴度的测定
利用腺病毒纯化试剂盒,将重组腺病毒纯化,再根据tcid50法检测重组腺病毒的滴度。
1.5elisa检测免疫balb/c的抗体水平
选取20~22gspf级balb/c小鼠50只,随机分组5组,10只/组;分别设置ad-sag2-mic3-egfp组、ad-sag2-egfp组、ad-mic3-egfp组、ad-egfp(对照)组和pbs(空白)组。两次免疫,间隔14天,肌肉注射接种109cpu重组腺病毒颗粒。期间,每7天进行一次尾静脉采集血并分离血清,利用elisa试剂盒检测免疫小鼠不同时间的抗体水平。首次免疫28天后,眼球采血并分离血清检测细胞因子变化;用流式细胞术检测脾脏淋巴细胞变化。
1.6免疫保护试验
选取20~22gspf级balb/c小鼠100只,随机分组10组,10只/组;分别设置ad-sag2-mic3-egfp组(a)、ad-sag2-egfp(a)组、ad-mic3-egfp(a)组、ad-egfp(a;对照)组、pbs(a;空白)组、ad-sag2-mic3-egfp组(b)、ad-sag2-egfp(b)组、ad-mic3-egfp(b)组、ad-egfp(b;对照)组、pbs(b;空白)组,分别进行免疫接种。首次免疫28天后,a组接种1×102t.gondiirh株速殖子;b组接种1×103t.gondiirh株速殖子;每日观察小鼠的状态,并统计小鼠的发病率与死亡率。
2结果与分析
2.1sag2基因和mic3基因的rt-pcr扩增结果
利用根据genbank中sag2基因序列设计的sag2基因引物对提取t.gondiirh的rna进行rt-pcr扩增,经测序,获得大小为561bp左右的预期片段;t-a克隆获得pmd-sag2质粒,同样利用设计的sag2基因引物进行pcr扩增,经测序,获得大小为561bp左右的预期目的片段(图1)。
利用根据genbank中mic3基因序列设计的mic3基因引物对提取t.gondiirh的rna进行rt-pcr扩增,经测序,获得大小为1080bp左右的预期片段;t-a克隆获得pmd-mic3质粒,同样利用设计的mic3基因引物进行pcr扩增,经测序,获得大小为1080bp左右的预期目的片段(图2)。
2.2扩增的sag2基因与mic3基因测序结果分析
将测序后的sag2基因与mic3基因的核苷酸序列分别与genbank中sag2基因核苷酸序列(m33572.1)和mic3基因核苷酸序列(aj132530.1)进行blast对比分析,sag2基因序列的同源性达100%,mic3基因序列的同源性达100%,且均无碱基缺失和插入。
2.3获得重组腺病毒
利用t4连接酶将目的片段sag2和mic3分别连接至腺病毒穿梭质粒,获得重组质粒pbhad-sag2-egfp、pbhad-mic3-egfp和pbhad-sag2-mic3-egfp。利用脂质体将腺病毒大骨架分别与重组穿梭质粒共转染hek293a细胞,经过14d左右培养后,收获原代重组腺病毒ad-sag2-egfp、ad-mic3-egfp和ad-sag2-mic3-egfp。通过噬斑筛选出单克隆病毒,重组腺病毒分别感染正常hek293a细胞,在荧光显微镜下通过蓝紫光激发,可看到细胞呈现绿色荧光;未感染细胞状态正常,且在荧光显微镜下观察不到绿色荧光(图3)。
2.4westernblot检测sag2蛋白和mic3蛋白表达的结果
westernblot结果显示:重组腺病毒ad-sag2-mic3-egfp和ad-sag2-egfp在约22kda处出现特异性条带,与预期sag2蛋白分子质量大小相当;ad-sag2-mic3-egfp和ad-mic3-egfp在约38kda处出现特异性条带,与预期mic3蛋白分子质量大小相当;ad-sag2-mic3-egfp、ad-sag2-egfp、ad-mic3-egfp和ad-egfp在约42kda处均出现特异性条带,与预期内参β-actin蛋白分子质量大小相当(图4)。
2.5重组病毒的目的基因检测
对包装好的重组腺病毒提取dna,分别利用设计的sag2基因和mic3基因引物进行pcr扩增,并对目的基因序列进行测序分析,结果显示:分别在561bp左右和1080bp左右处出现与预期片段大小一致的目的条带(图5和图6)。
2.6重组病毒的滴度测定结果
对纯化浓缩后的重组腺病毒作倍比稀释后感染hek293a细胞,感染7d后,根据kaber法进行计算阳性孔比率,测定ad-sag2-mic3-egfp、ad-sag2-egfp、ad-mic3-egfp和ad-egfp滴度为1.58×1011cpu、1.58×1011cpu、1.58×1011cpu和1.58×1011cpu。
2.7elisa检测结果
根据elisa试剂盒说明书,利用分离的血清检测其抗体od405。
从免疫后第14天和第28天,免疫ad-sag2-mic3-egfp的小鼠抗体水平与注射ad-egfp和pbs的小鼠抗体水平差异极显著(p<0.001);注射ad-egfp组与pbs组之间的小鼠抗体水平无显著性差异(p>0.05;图7)。
2.8淋巴细胞变化
首次免疫小鼠后第28天,摘取小鼠脾脏,检测脾脏中淋巴细胞比例。免疫ad-sag2-mic3-egfp组的小鼠非t淋巴细胞极著低于pbs组的小鼠(p<0.001;图8),t淋巴细胞极显著高于pbs组(p<0.001)的小鼠(图8);ad-sag2-mic3-egfp组小鼠的活化的淋巴b细胞极显著高于pbs组(p<0.001)小鼠(图9);ad-sag2-mic3-egfp组小鼠的活化的ctl极显著高于pbs组(p<0.001)小鼠,显著高于ad-egfp组小鼠(p<0.05;图10);ad-sag2-mic3-egfp组小鼠的th淋巴细胞极显著高于pbs组小鼠(p<0.001;图10),ad-sag2-mic3-egfp组小鼠的活化的th淋巴细胞极显著高于pbs(p<0.001)组,显著高于ad-egfp(p<0.05)小鼠(图11)。
2.9细胞因子变化
首次免疫小鼠后第28天,眼球采血并分离血清,通过流式细胞术检测不同组间的血清细胞因子水平。免疫ad-sag2-mic3-egfp组的小鼠血清中il-6、tn-α、il-10、il-22和il-17a等细胞因子均极显著高于ad-egfp和pbs组的小鼠(p<0.001或p<0.01;图12和图13),if-γ和il-17a显著高于pbs组(p<0.05;图12和图13);注射ad-egfp组与pbs组之间的小鼠的细胞因子均无显著性差异(p>0.05;图12和图13)。
2.10免疫保护结果
免疫后攻虫试验结果显示:攻虫剂量为1×102t.gondiirh速殖子时,ad-sag2-mic3-egfp免疫小鼠的保护率为60%,ad-sag2-egfp免疫小鼠的保护率为20%,ad-mic3-egfp免疫小鼠的保护率为50%,注射ad-egfp和pbs小鼠在攻虫后第11天全部死亡,均未产生保护作用(图14)。
攻虫剂量为1×103t.gondiirh速殖子时,ad-sag2-mic3-egfp免疫小鼠的保护率为30%;ad-sag2-egfp免疫组小鼠第13天全部死亡,ad-mic3-egfp免疫组小鼠第17天全部死亡,一定程度上延长了小鼠的存活时间;注射ad-egfp和pbs小鼠在攻虫后第8天全部死亡,均未产生保护作用(图15)。
3结论
3.1从t.gondiirh株中分别扩增出sag2基因和mic3基因;
3.2成功包装重组腺病毒ad-sag2-mic3-egfp;且重组腺病毒能够很好的表达sag2蛋白和mic3蛋白;
3.3收获的重组腺病毒ad-sag2-mic3-egfp滴度为:1.58×1011pfu,符合后续动物试验的所需的滴度要求;
3.4构建的重组腺病毒免疫小鼠产生较高的抗体水平,淋巴细胞被活化,细胞因子被激活;
3.5重组腺病毒对小鼠产生一定的免疫保护效果。
本发明的创新之处在于,将t.gondii的入侵相关蛋白的基因sag2和mic3与腺病毒载体系统高效稳定表达外源基因的特性结合起来,构建出能够表达上述蛋白质的重组腺病毒,分别检测免疫鼠后机体内产生的抗t.gondii抗体的水平、淋巴细胞比例和细胞因子变化等指标,并通过免疫攻毒保护试验检测其免疫保护效果,成功研制了预防弓形虫病的二价基因工程活载体疫苗。
以上所述的实施例仅用于说明本发明的技术思想及特点,其目的在于使本领域内的技术人员能够理解本发明的内容并据以实施,不能仅以本实施例来限定本发明的专利范围,即凡本发明所揭示的精神所作的同等变化或修饰,仍落在本发明的专利范围内。
sequencelisting
<110>沈阳农业大学
<120>弓形虫sag2基因和mic3基因重组腺病毒构建的方法及重组腺病毒和应用
<130>1
<160>4
<170>patentinversion3.5
<210>1
<211>38
<212>dna
<213>人工序列<artificialsequence>
<220>
<221>primer_bind
<222>(14)..(38)
<400>1
gggatccgccaccatgagtttctcaaagaccacgagcc38
<210>2
<211>34
<212>dna
<213>人工序列<artificialsequence>
<220>
<221>primer_bind
<222>(10)..(34)
<400>2
tcccccgggttacacaaacgtgatcaacaaacct34
<210>3
<211>30
<212>dna
<213>人工序列<artificialsequence>
<220>
<221>primer_bind
<222>(15)..(30)
<400>3
ggggtaccgccaccatgcgaggcgggacgt30
<210>4
<211>36
<212>dna
<213>人工序列<artificialsequence>
<220>
<221>primer_bind
<222>(17)..(36)
<400>4
ataagaatgcggccgcctgcttaattttctcacacg36
- 还没有人留言评论。精彩留言会获得点赞!
- 基因重组技术制备pgrp的制作方法
- 基因重组Exendin-4的表达和制备新方法
- 一种表达重组nisin-rbLF-N融合基因的大肠杆菌工程菌的制作方法
- 人类新基因famlf在人基因重组、恶性肿瘤基因检测、特异性单克隆抗体的研制与应用的制作方法
- 在毕赤酵母细胞器中表达的重组酪氨酸激酶及其基因、衍生融合蛋白和制备方法
- 一种p53基因、p53蛋白和基因重组药物的应用的制作方法
- Muc1和gm-csf双基因共表达重组载体及其制备方法和应用的制作方法
- Muc1和il-2双基因共表达重组载体及其制备方法和应用的制作方法
- Afp和gm-csf双基因共表达重组载体及其制备方法和应用的制作方法
- 重组病毒载体基因a3g的制备及其应用的制作方法