一种与绵羊单胎多羔性状相关的SNP分子标记及其检测试剂盒和应用的制作方法
本发明涉及分子标记检测技术,具体地说,涉及一种与绵羊单胎多羔性状相关的snp分子标记及其检测试剂盒和应用。
背景技术:
产羔性状是绵羊的重要经济性状之一。对于绵羊而言,提高每胎的产羔数是提升生产经济效益的重要措施。应用基因组学方法的研究能在整个基因组的水平去筛选出与绵羊繁殖性状相关的候选基因和分子标记,使学者们能够更深入的理解绵羊多羔性状的遗传机理,可对我国绵羊业的可持续发展将带来巨大的经济效益。
bmp4基因位于绵羊7号染色体上,包含6个外显子,编码区总长1229bp,编码蛋白含409个氨基酸,该基因在山羊、牦牛和小鼠之间具有非常高的同源性。bmp4基因发挥功能主要依赖于经典的bmp/smad信号通路。在bmp/smad通路中,在细胞内合成的bmp4成熟蛋白,以旁分泌/自分泌形式胞吐,再形成同源/异源二聚体,陆续激活bmprⅱ型、ⅰa型受体。活化的ⅰa型受体将细胞质内的r-smad(smadreceptor)磷酸化,与co-smad(commonmediatorsmads,co-smads)即smad4结合形成smad蛋白异聚体复合物,进入细胞核与靶基因结合,发挥转录调控作用。哺乳动物的生殖活动主要受下丘脑、垂体、性腺轴的激素调节,张弛等发现bmp4可以通过调控繁殖激素的变化,最终促进哺乳动物卵泡中颗粒细胞分化,卵泡成熟,排卵数增加(张驰,周建设,秦楠,等.骨形态发生蛋白4与哺乳动物卵泡发育的研究进展[j].中国畜牧兽医,2010.37(3):141-144.)。shimasaki等发现bmp4可诱导增加颗粒细胞对fsh(follicle-stimulatinghormone)敏感性,调控fsh依赖的雌激素和孕酮合成(shimasakis,zachowrj,lid,etal.afunctionalbonemorphogeneticproteinsystemintheovary[j].proceedingsofthenationalacademyofsciencesoftheunitedstatesofamerica,1999.96(13):7282-7287.)。tan等在小鼠中发现,在体内或体外添加bmp4都可以促进原始卵泡转化为次级卵泡。da在牦牛中发现,bmp4基因可促进卵巢原始卵泡以及次级卵泡直径的增加,并调控牦牛卵母细胞成熟(tans,fengb,yinm,etal.stromalsenp1promotesmouseearlyfolliculogenesisbyregulatingbmp4expression[j].cell&bioscience,2017.7(1):36.)。储明星等研究发现,小尾寒羊bmp4基因外显子3第305位碱基发生c/a突变。该突变的bb型小尾寒羊平均产羔数比ab型和aa型多0.61只,与小尾寒羊多羔性状呈加性效应(储明星,周文然,孙少华,等.小尾寒羊bmp4基因多态性及其与高繁殖力关系[j].农业生物技术学报,2008.16(2):237-241.)。
通过对10个绵羊品种99个绵羊个体进行全基因组重测序并将其分为单羔组和多羔组,并通过fst值计算获得了大量的有效snp位点并筛选获得一些基因,其中包括bmp4基因。因此,对其进行研究有助于挖掘出更多与绵羊产羔数相关的分析标记。
技术实现要素:
本发明的目的在于提供一种与绵羊单胎多羔性状相关的snp分子标记及其检测试剂盒和应用。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了一种与绵羊单胎多羔性状相关的snp分子标记,所述snp分子标记位于绵羊第7号染色体上第63454744bp位点nc_019464.1(63452568..63681991);所述位点上存在t/g碱基突变,与绵羊单胎多羔具有显著的相关性;所述snp分子标记基于绵羊基因组序列信息版本号oar_v3.1,2012年9月。
本发明提供了一种利用sequenom
本发明提供了一种利用sequenom
优选的,所述试剂盒还包括dntps、taqdna聚合酶、mg2+、pcr反应缓冲液和sap酶。
优选的,所述试剂盒还包括标准阳性模板。
利用sequenom
1)提取待测绵羊的基因组dna;
2)以待测绵羊的基因组dna为模板,利用上述方案所述引物组中的扩增引物f和r,进行pcr扩增反应,获得pcr扩增产物;
3)用sap酶对步骤2)所述pcr扩增产物进行消化,得到消化产物;
4)以步骤3)所述消化产物为模板,利用上述方案所述引物组中的延伸引物进行延伸反应,得到延伸产物;
5)利用基质辅助激光解析电离飞行时间质谱技术分析延伸产物,确定所述snp位点的基因型。
优选的,步骤2)中所述pcr扩增反应使用的反应体系以5μl计包括:10ng/μl基因组dna1μl,10×pcr反应缓冲液0.5μl,25mmol/lmgcl20.4μl,25μmol/ldntps0.1μl,0.5μmol/lpcrprimermix1μl,5u/μltaqdna聚合酶0.2μl,去离子水1.8μl;
所述pcr扩增反应的程序为:预变性95℃2min;变性95℃30s,退火56℃30s,延伸72℃60s;所述变性、退火和延伸步骤进行45个循环后;72℃保持5min。
优选的,步骤3)中所述消化体系以2μl计包括:10×sapbuffer0.17μl,1.7u/μlsapenzyme0.3μl,去离子水1.53μl;所述消化的程序为:37℃,40min;85℃,5min。
优选的,步骤4)中所述延伸反应体系以2μl计包括:10×iplexbufferplus0.2μl,iplexterminator0.2μl,0.6-1.3μmol/lprimermix0.94μl,iplexenzyme0.041μl,去离子水0.619μl;
所述延伸反应的程序为:94℃30s;[94℃5s,(52℃5s,80℃5s)];其中所述(52℃5s,80℃5s)进行5个循环,所述[94℃5s,(52℃5s,80℃5s)]进行40个循环;72℃3min。
本发明提供了上述方案中所述的snp位点在绵羊辅助育种中的应用。
本发明的有益效果:本发明提供的与绵羊多羔性状相关的snp分子标记,所述snp分子标记位于绵羊第7号染色体上第63454744bp位点nc_019464.1(63452568..63681991);所述位点上存在t/g碱基突变,与绵羊多羔具有显著的相关性。通过对所述snp位点进行分型即可确定待测绵羊产羔性能。
本发明提供的利用sequenom
附图说明
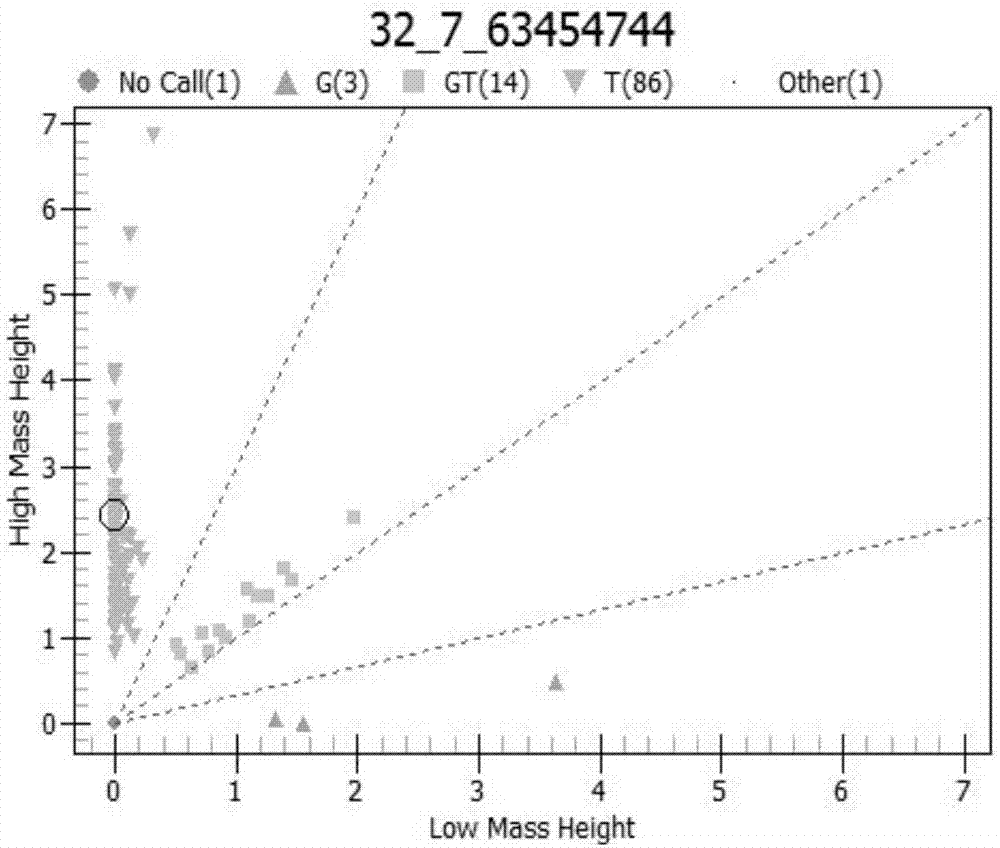
图1表示实施例1中延伸产物的质谱检测结果。
具体实施方式
本发明提供了一种与绵羊单胎多羔性状相关的snp分子标记,其特征在于,所述snp分子标记位于绵羊第7号染色体上第63454744bp位点nc_019464.1(63452568..63681991);所述位点上存在t/g碱基突变,与绵羊多羔具有显著的相关性,该基因存在tt、gt和gg三种基因型,gg基因型的个体产羔数显著高于gt基因型以及tt基因型。所述snp分子标记基于绵羊基因组序列信息版本号oar_v3.1,2012年9月。
本发明还提供了利用sequenom
本发明所述的sequenom
本发明还提供了利用sequenom
本发明中,所述引物组中上游引物f和下游引物r的使用浓度优选的独立为0.45~0.55μmol/l,更优选的独立为0.50μmol/l;所述引物组中的延伸引物的浓度优选为0.6~1.3μmol/l。在本发明中,所述dntps的使用浓度优选为20~30μmol/l,更优选为25μmol/l;所述taqdna聚合酶的使用浓度优选为4~6u/μl,更优选为5u/μl;所述mgcl2的使用浓度优选为20~30mmol/l,更优选为25mmol/l;所述pcr反应缓冲液优选为10×pcr反应缓冲液;所述sap酶的酶活优选为1.7u/μl。本发明中所述试剂盒优选的还包括10×sapbuffer。在本发明中,所述试剂盒优选的还包括基因型为gg的标准阳性模板dna;所述标准阳性模板dna作为阳性对照,增加所述snp位点检测的准确性。
本发明还提供了利用sequenom
在本发明中,首先提取待测绵羊的基因组dna。本发明对所述待测绵羊的种类没有特殊要求,任何种类的绵羊均可,在本发明实施例中采用的是小尾寒羊绵羊;本发明对所述待测绵羊基因组的提取方法没有特殊限定,采用本领域常规的动物细胞基因组提取方法即可。
在本发明具体实施过程中,所述基因组提取方法包括以下步骤:
a)取绵羊血与红细胞裂解液混合,得到dna粗提物;
b)将所述步骤a)中的dna粗提物与蛋白沉淀液混合,经异丙醇沉淀,沉淀复溶,得到dna提取液。
本申请中,取绵羊血与红细胞裂解液混合,得到dna粗提物;所述绵羊血优选的取自颈静脉;所述绵羊血优选的采用edta进行抗凝处理;所述抗凝处理中,绵羊血与edta的体积质量比优选为1:1.5;所述红细胞裂解液购自于geneode,型号1×红细胞裂解液;所述红细胞裂解液与绵羊血的体积比优选为3:1;所述混合的时间优选为5~10min;所述混合的温度优选为15~30℃。本发明中,所述红细胞裂解液的作用是去除不含dna的红细胞,同时裂解细胞释放出基因组dna。
本申请在获得dna粗提物后,将dna粗提物与乙酸钠混合使其终浓度为0.3mol/l,加入上述混合液的0.6-0.7倍体积丙醇沉淀,再加入适量te(ph=8.0)重新溶解dna沉淀,得到dna提取液。
本发明在获得所述待测绵羊基因组dna后,以待测绵羊的基因组dna为模板,利用所述引物组中的上游扩增引物f和下游扩增引物r进行pcr扩增反应获得pcr扩增产物。本发明中所述pcr扩增反应使用的反应体系以5μl计包括:10ng/μl基因组dna1μl,10×pcr反应缓冲液0.5μl,25mmol/lmgcl20.4μl,25μmol/ldntps0.1μl,0.5μmol/lpcrprimermix1μl,5u/μltaqdna聚合酶0.2μl,去离子水1.8μl;
所述pcr扩增反应的程序为:预变性95℃2min;变性95℃30s,退火56℃30s,延伸72℃60s;所述变性、退火和延伸步骤进行45个循环后;72℃保持5min。本发明在所述pcr扩增完成后,优选的将pcr扩增产物保存于4℃。本发明所述pcr扩增反应结束后,所述pcr扩增产物中含有目标snps位点所在的dna片段。
本发明在获得所述pcr扩增产物后,用sap酶对获得的pcr扩增产物进行消化获得消化后的产物。在本发明中所述消化体系以2μl计包括:10×sapbuffer0.17μl,1.7u/μlsapenzyme0.3μl,去离子水1.53μl;在本发明中,所述消化的程序为:37℃,40min;85℃,5min。本发明中所述消化后的产物优选的保存于4℃。本发明中所述消化的作用为消化掉pcr扩增反应体系中的引物序列和剩余的dntps。
本发明在获得所述消化产物后,以消化产物为模板,利用所述引物组中的延伸引物进行延伸反应获得延伸产物。本发明中,所述延伸反应体系以2μl计包括:10×iplexbufferplus0.2μl,iplexterminator0.2μl,0.6-1.3μmol/lprimermix0.94μl,iplexenzyme0.041μl,去离子水0.619μl;所述延伸反应的程序为:94℃30s;[94℃5s,(52℃5s,80℃5s)];其中所述(52℃5s,80℃5s)进行5个循环,所述[94℃5s,(52℃5s,80℃5s)]进行40个循环;72℃3min。
本发明中,所述延伸体系中的10×iplexbufferplus、iplexterminator、0.6-1.3μmol/lprimermix和iplex酶来源于
本发明在获得所述延伸产物后,利用基质辅助激光解析电离飞行时间质谱技术分析延伸产物,确定所述snp位点的基因型。本发明将所述延伸产物点样至靶片上,并使用质谱仪对不同延伸产物的分子量差异进行检测,通过数据分析,就可得到各突变位点的具体基因型。本发明中,所述质谱点样有关的使用massarraynanodispenserrs1000进行;所述质谱分析优选的使用massarraycompactsystem进行;本发明在所述质谱分析后,优选的利用typer4.0软件检测质谱峰,并根据质谱峰图判读各样本目标位点基因型。
本发明中所述sequenom
本发明还提供了所述的snp位点在绵羊辅助育种中的应用。在绵羊育种过程中,筛选所述snp位点为g碱基的绵羊进行后续育种。在本发明中所述snp位点的筛选优选的采用上述sequenom
下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例均按照常规实验条件,如sambrook等分子克隆实验手册(sambrookj&russelldw,molecularcloning:alaboratorymanual,2001),或按照制造厂商说明书建议的条件。
实施例1
一种利用sequenom
1、实验材料
选取380只小尾寒羊绵羊为检测对象。
2、试剂及仪器
试剂:completegenotypingreagentkitfor
基因扩增:abi
质谱点样:massarraynanodispenserrs1000;
质谱分析:massarraycompactsystem;
所有试剂和仪器均购自北京康普森生物技术有限公司(beijingcompassbiotechnologyco.,ltd)。
3、基因组dna的提取
绵羊颈静脉采血1ml,用edta抗凝处理。首先红细胞裂解液裂解去除不含dna的红细胞,细胞核裂解液裂解细胞释放出基因组dna,然后蛋白沉淀液选择性沉淀去除蛋白,最后纯净的基因组dna通过异丙醇沉淀并重溶解于dna溶解液。
4、sequenom
针对绵羊第7号染色体上第63454744bp位点(nc_019464.1(63452568..63681991),基于绵羊基因组序列信息版本号oar_v3.1,2012年9月)设计引物组合。
pcr扩增引物的核苷酸序列如下:
2nd-pcrp:acgttggatgcaggatactccagaccgatg;
1st-pcrp:acgttggatgcatgcgggatctttacagac;
延伸引物序列及延伸产物如表1所示。
表1延伸引物序列及延伸产物
上述引物由北京康普森生物技术有限公司合成。
检测流程如下:
1、提取待测绵羊的基因组dna;
2、以待测绵羊的基因组dna为模板,利用上述引物2nd-pcrp和1st-pcrp进行pcr扩增反应;
3、用sap酶对pcr扩增产物进行消化;
4、以消化后的pcr扩增产物为模板,利用所述延伸引物s1进行延伸反应;
5、分析延伸产物,从而对绵羊bmp4基因型进行判定。
其中,pcr扩增反应使用的反应体系以5μl计为:10ng/μl基因组dna1μl,10×pcr反应缓冲液0.5μl,25mmol/lmgcl20.4μl,25μmol/ldntps0.1μl,0.5μmol/lpcrprimermix1μl,5u/μltaqdna聚合酶0.2μl,去离子水1.8μl;
pcr扩增反应的扩增程序为:95℃2min;95℃30s,56℃30s,72℃60s,45个循环;72℃5min;4℃保存。
对pcr扩增产物进行消化,使用的sap酶消化体系以2μl计为:10×sapbuffer0.17μl,1.7u/μlsapenzyme0.3μl,去离子水1.53μl;
反应条件为:37℃40min,85℃5min,4℃保存。
延伸反应体系以2μl计为:10×iplexbufferplus0.2μl,iplexterminator0.2μl,0.6-1.3μmol/lprimermix0.94μl,iplexenzyme0.041μl,去离子水0.619μl;
反应条件为:94℃30s;94℃5s,52℃5s,80℃5s,5个循环,40个循环;72℃3min;4℃保存。
将树脂纯化后的延伸产物移至384孔spectrochip(sequenom)芯片上,进行maldi-tof-ms(基质辅助激光解析电离飞行时间质谱)反应,利用typer4.0软件检测质谱峰,并根据质谱峰图判读各样本目标位点基因型。
经质谱分析得到pcr扩增产物大小为103bp,延伸产物的质谱检测结果如图1所示。
统计结果:
待测绵羊第7号染色体上第63454744bp位点不同基因型分析统计结果见表2。
表2待测绵羊第7号染色体上第63454744bp位点不同基因型分析统计
对380只小尾寒羊血液dna样品采用sequenom
待测绵羊第7号染色体上第63454744bp位点不同基因型与小尾寒羊产羔数关联分析统计结果见表3。
表3待测绵羊第7号染色体上第63454744bp位点不同基因型与小尾寒羊产羔数关联分析
注:上标不同的小写字母代表差异显著。
由表3可知,小尾寒羊第一胎产羔数的统计数据显示,绵羊第7号染色体上第63454744bp位点的tt和gt基因型为2.21±0.08和2.26±0.20均显著低于gg型的4.00±0.44(p<0.05)。第二胎和第三胎的产羔数统计数据也均显示,突变后的gg基因型均显著高于野生型tt和杂合子gt(p<0.05)。综上,说明该位点在一定程度上增加了小尾寒羊产羔能力。
由以上实施例可知,本发明提供了一种与绵羊单胎多羔性状相关的snp分子标记及其检测试剂盒和应用,并具体提供了一种利用sequenom
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
序列表
<110>中国农业科学院北京畜牧兽医研究所
<120>一种与绵羊单胎多羔性状相关的snp分子标记及其检测试剂盒和应用
<160>3
<170>siposequencelisting1.0
<210>1
<211>30
<212>dna
<213>sheet
<400>1
acgttggatgcaggatactccagaccgatg30
<210>2
<211>30
<212>dna
<213>sheet
<400>2
acgttggatgcatgcgggatctttacagac30
<210>3
<211>21
<212>dna
<213>sheet
<400>3
cctacagaccgatgccctgga21
- 还没有人留言评论。精彩留言会获得点赞!