从南山茶中提取山奈酚半乳糖苷类化合物的方法与流程
本发明涉及化合物提取领域,具体而言,涉及一种从南山茶中提取山奈酚半乳糖苷类化合物的方法。
背景技术:
南山茶又名广宁红花油茶(camelliasemiserratachi.),属于山茶科(theaceae)山茶属(camellial.)植物,多年生乔木或灌木。南山茶主要分布在我国的广西东南部以及广东西部。它是油茶的一种重要栽培物种。经研究比较发现,在各类油茶中,广宁红花油茶中的化学成分相对比较丰富。
南山茶及其饼粕尤其富含具有多种生物活性的黄酮类和皂苷等化合物。目前,对油茶饼粕的研究主要集中在以总黄酮或皂苷为指标进行的各种提取工艺的优化,还有一些着重于对得到的粗提物或初步纯化物进行抗氧化以及抑菌等活性方面的研究。但是,对提取物中具体成分的研究不够。
山奈酚及其衍生物是油茶中一类重要的化合物,具有抗癌、治疗糖尿病和骨质疏松以及保护损伤细胞等功能。
分析南山茶中的有效活性物质,将其活性成分从复杂多样的成分中分离提取出来,得到纯度较高的产品,对于南山茶的深度开发具有重要的作用。
有鉴于此,特提出本发明。
技术实现要素:
本发明的目的在于提供一种从南山茶中提取山奈酚半乳糖苷类化合物的方法,所述方法从南山茶中提取出目标化合物,而且快速有效、纯度很高。
为了实现本发明的上述目的,特采用以下技术方案:
一种从南山茶中提取山奈酚半乳糖苷类化合物的方法,所述方法包括以下步骤:
a.将南山茶茶饼经过浸提处理得到样品液;
b.将所述样品液湿法上样至大孔树脂层析柱,依次用体积分数为5%、15%、50%、95%的乙醇水溶液进行梯度洗脱,经色谱检测,收集用所述50%乙醇水溶液洗脱的洗脱液,浓缩冻干得粗组分;
c.将所述粗组分上样至葡聚糖凝胶层析柱,依次用体积分数为50%的甲醇水溶液、纯甲醇进行梯度洗脱,经色谱检测,收集含有目标化合物的洗脱液,浓缩冻干得到粗提取物;
d.将所述粗提取物用第一溶剂溶解后进样,使用lc6000型高效液相色谱仪、c18hce色谱柱进行dac制备,用乙腈水溶液作为流动相进行等度洗脱,收集含有所述目标化合物的流份段,浓缩冻干得到粗分离物;
e.将所述粗分离物用第二溶剂溶解后进样,使用lc3000型高效液相色谱仪、所述c18hce色谱柱、用乙腈-乙酸水溶液作为流动相,进行等度洗脱,收集含有所述目标化合物的流份段,浓缩冻干得到所述目标化合物,所述目标化合物的结构式为:
采用浸提-大孔树脂柱层析-葡聚糖凝胶柱层析-dac(动态轴向压缩)制备-液相半制备的方法,可以快速有效的将目标化合物从南山茶中分离出来。
优选地,所述步骤b中,所述大孔树脂层析柱的制备方法为:先用乙醇浸泡d101大孔树脂,然后装柱,依次用乙醇、水冲洗至无乙醇味。
对大孔树脂使用乙醇浸泡进行预处理,目的在于除去大孔树脂内的杂质,使得大孔树脂的处理能力得到最大程度的释放,以获得最佳的处理效果。
进一步优选地,所述大孔树脂层析柱的柱体积bv1为10l。
更加优选地,所述5%乙醇的用量为6倍bv1、所述15%乙醇的用量为8倍bv1、所述50%乙醇的用量为8倍bv1、所述95%乙醇的用量为4倍bv1。
限定柱体积和洗脱梯度及用量,目的是为了最快、最大程度的将目标化合物从众多的物质中分离出来。
优选地,所述步骤c中,所述葡聚糖凝胶层析柱的柱体积bv2为1l,所述50%甲醇水溶液、所述纯甲醇均洗脱至洗脱液无色为止。
更加优选地,所述梯度洗脱过程中,每50ml为一个收集单位,并顺次编号,收集第22-36号洗脱液。
优选地,所述步骤d中,所述c18hce色谱柱规格为:100a,50mm×250mm,10μm;所述乙腈水溶液的体积分数为24%。
优选地色谱柱规格,有利于分离提取的最有效进行,提高得率和纯度。
进一步优选地,所述第一溶剂为体积比1:1的甲醇和二甲基亚砜。
溶剂的使用是为了保障目标分离物获得较好的分离结果。
优选地,所述步骤e中,所述乙腈-乙酸水溶液中乙腈与乙酸水溶液的体积比为23:77,所述乙酸水溶液的体积分数为0.2%;所述第二溶剂为所述乙腈-乙酸水溶液。
可选地,所述步骤a中,所述浸提处理的方法为:用体积分数为50-60%的乙醇水溶液浸提,料液比为1kg所述南山茶茶饼对应2-4l所述乙醇水溶液,在60-70℃加热回流浸提2-4次,过滤、合并得到提取液;然后减压浓缩,再用正丁醇萃取得到萃取液,加水稀释18-22倍得到所述样品液。
与现有技术相比,本发明的有益效果为:
(1)首次从山茶属植物中分离出了目标化合物;
(2)本申请提供的提取方法简单、有效,适合于推广应用。
(3)目标化合物提取纯度高。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,以下将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
图1为实施例1对粗提取物进行制备的hplc谱图;
图2为实施例1对粗分离物进行制备的hplc谱图;
图3为实施例1制备得到的目标化合物的纯度测定图;
图4为本申请制备得到的目标化合物的质谱图;
图5为本申请制备得到的目标化合物的h谱图;
图6为本申请制备得到的目标化合物的c谱图;
图7为本申请制备得到的目标化合物的h-hcosy谱图;
图8为本申请制备得到的目标化合物的hsqc谱图;
图9为本申请制备得到的目标化合物的hmbc谱图;
图10为本申请制备得到的目标化合物的tocsy谱图。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
实施例1
将南山茶的茶果晾晒,去壳,以物理压榨法脱去油脂后产生的饼晾干,并适当粉碎,即得到南山茶茶饼。以体积分数为50%的乙醇水溶液于60℃条件下超声浸提3次,每次2h,料液比为1:4(m/v),然后进行过滤、合并,得到提取液。然后将提取液浓缩、用等体积的正丁醇萃取得到萃取液,再用水稀释20倍得到样品液。
去壳、脱去油脂,是为了最大程度的保证提取得率,减少分离过程中的干扰。合适的原料处理方法还有利于避免目标化合物的流失。
选取大孔树脂的型号为d101型,先用乙醇浸泡d101大孔树脂,然后装柱(柱体积bv1为10l),依次用乙醇、水冲洗至无乙醇味,可以用酒精计检测,读数小于5即可。将样品液缓慢的加入到大孔树脂层析柱中,然后依次用6倍bv1的体积分数为5%乙醇、8倍bv1的体积分数为15%乙醇、8倍bv1的体积分数为50%乙醇、4倍bv1的体积分数为95%乙醇洗脱,经色谱检测,收集用50%乙醇进行洗脱的洗脱液,浓缩冻干得粗组分。
将粗组分上样至葡聚糖凝胶层析柱(柱体积bv2为1l),每100ml凝胶上样1-1.5g,先用体积分数为50%的甲醇水溶液进行洗脱至洗脱液无色为止,然后用纯甲醇进行洗脱,经色谱检测,每50ml为一个收集单位,并顺次编号,收集第22-36号洗脱液,浓缩冻干得到粗提取物。
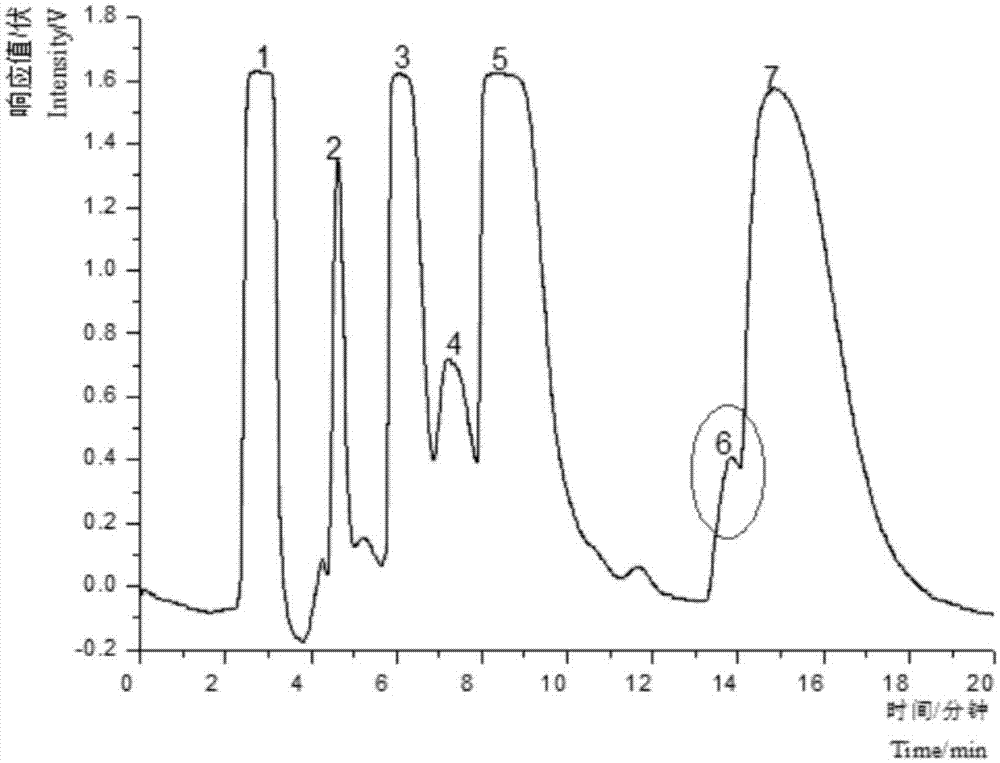
将粗提取物用少量体积比1:1的甲醇和二甲基亚砜溶解后进样,使用lc6000型高效液相色谱仪、c18hce色谱柱(规格为:100a,50mm×250mm,10μm),进样量9ml,控制流速85ml/min进行dac制备,用体积分数为24%的乙腈水溶液作为流动相进行等度洗脱,检测器254nm,收集含有目标化合物的流份段(见图1,7号峰),浓缩冻干得到粗分离物。
将粗分离物用少量乙腈-乙酸水溶液(乙腈与乙酸水溶液的体积比为23:77,乙酸水溶液的体积分数为0.2%)溶解后进样,使用lc3000型高效液相色谱仪、c18hce色谱柱(规格为:100a,50mm×250mm,10μm)、用前述的乙腈-乙酸水溶液作为流动相,进样量2ml,控制流速20ml/min,进行等度洗脱,检测器254nm,收集含有目标化合物的流份段(见图2),浓缩冻干得到目标化合物。
对目标化合物进行纯度测定:以乙腈-乙酸水溶液(乙腈与乙酸水溶液的体积比为23:77,乙酸水溶液的体积分数为0.2%)作为流动相,用lc3000型高效液相色谱仪,xchargec18(4.6mm×250mm,5μm),检测器:uv254nm,控制流速1ml/min。测得纯度为97.4%(见图3),提取得率为64mg/kg。
实施例2
将南山茶的茶果晾晒,去壳,以物理压榨法脱去油脂后产生的饼晾干,并适当粉碎,即得到南山茶茶饼。以体积分数为60%的乙醇水溶液于70℃条件下超声浸提2次,每次2h,料液比为1:2(m/v),然后进行过滤、合并,得到提取液。然后将提取液浓缩、用等体积的正丁醇萃取得到萃取液,再用水稀释22倍得到样品液。
选取大孔树脂的型号为d101型,先用乙醇浸泡d101大孔树脂,然后装柱(柱体积bv1为10l),依次用乙醇、水冲洗至无乙醇味,可以用酒精计检测,读数小于5即可。将样品液缓慢的加入到大孔树脂层析柱中,然后依次用6倍bv1的体积分数为5%乙醇、8倍bv1的体积分数为15%乙醇、8倍bv1的体积分数为50%乙醇、4倍bv1的体积分数为95%乙醇洗脱,经色谱检测,收集用50%乙醇进行洗脱的洗脱液,浓缩冻干得粗组分。
将粗组分上样至葡聚糖凝胶层析柱(柱体积bv2为1l),每100ml凝胶上样1-1.5g,先用体积分数为50%的甲醇水溶液进行洗脱至洗脱液无色为止,然后用纯甲醇进行洗脱,经色谱检测,每50ml为一个收集单位,并顺次编号,收集第22-36号洗脱液,浓缩冻干得到粗提取物。
将粗提取物用少量体积比1:1的甲醇和二甲基亚砜溶解后进样,使用lc6000型高效液相色谱仪、c18hce色谱柱(规格为:100a,50mm×250mm,10μm),进样量9ml,控制流速85ml/min进行dac制备,用体积分数为24%的乙腈水溶液作为流动相进行等度洗脱,检测器254nm,收集含有目标化合物的流份段,浓缩冻干得到粗分离物。
将粗分离物用少量乙腈-乙酸水溶液(乙腈与乙酸水溶液的体积比为23:77,乙酸水溶液的体积分数为0.2%)溶解后进样,使用lc3000型高效液相色谱仪、c18hce色谱柱(规格为:100a,50mm×250mm,10μm)、用前述的乙腈-乙酸水溶液作为流动相,进样量2ml,控制流速20ml/min,进行等度洗脱,检测器254nm,收集含有目标化合物的流份段,浓缩冻干得到目标化合物。
实施例3
将南山茶的茶果晾晒,去壳,以物理压榨法脱去油脂后产生的饼晾干,并适当粉碎,即得到南山茶茶饼。以体积分数为55%的乙醇水溶液于65℃条件下超声浸提4次,每次2h,料液比为1:4(m/v),然后进行过滤、合并,得到提取液。然后将提取液浓缩、用等体积的正丁醇萃取得到萃取液,再用水稀释18倍得到样品液。
选取大孔树脂的型号为d101型,先用乙醇浸泡d101大孔树脂,然后装柱(柱体积bv1为10l),依次用乙醇、水冲洗至无乙醇味,可以用酒精计检测,读数小于5即可。将样品液缓慢的加入到大孔树脂层析柱中,然后依次用6倍bv1的体积分数为5%乙醇、8倍bv1的体积分数为15%乙醇、8倍bv1的体积分数为50%乙醇、4倍bv1的体积分数为95%乙醇洗脱,经色谱检测,收集用50%乙醇进行洗脱的洗脱液,浓缩冻干得粗组分。
将粗组分上样至葡聚糖凝胶层析柱(柱体积bv2为1l),每100ml凝胶上样1-1.5g,先用体积分数为50%的甲醇水溶液进行洗脱至洗脱液无色为止,然后用纯甲醇进行洗脱,经色谱检测,每50ml为一个收集单位,并顺次编号,收集第22-36号洗脱液,浓缩冻干得到粗提取物。
将粗提取物用少量体积比1:1的甲醇和二甲基亚砜溶解后进样,使用lc6000型高效液相色谱仪、c18hce色谱柱(规格为:100a,50mm×250mm,10μm),进样量9ml,控制流速85ml/min进行dac制备,用体积分数为24%的乙腈水溶液作为流动相进行等度洗脱,检测器254nm,收集含有目标化合物的流份段,浓缩冻干得到粗分离物。
将粗分离物用少量乙腈-乙酸水溶液(乙腈与乙酸水溶液的体积比为23:77,乙酸水溶液的体积分数为0.2%)溶解后进样,使用lc3000型高效液相色谱仪、c18hce色谱柱(规格为:100a,50mm×250mm,10μm)、用前述的乙腈-乙酸水溶液作为流动相,进样量2ml,控制流速20ml/min,进行等度洗脱,检测器254nm,收集含有目标化合物的流份段,浓缩冻干得到目标化合物。
对实施例1-3得到的化合物单体均进行lc-ms测定和核磁共振检测。
如图4所示,m/z825.2478[m+h]+,质子碎片m/z679.1892,287.0560。根据离子碎片,结合核磁数据,推测其分子式为c37h44o21,推测为该化合物为山奈酚糖苷。
1h-nmr(见图5)中,δ6.19(h,d,j=1.9hz)与δ6.40(h,d,j=1.9hz),其化学位移、裂分及耦合常数均符合苯环上间位氢的特征,推断其分属于山奈酚a环h-6与h-8。δ7.95(2h,d,j=8.9hz)与δ6.89(2h,d,j=8.9hz),通过积分面积可得该两组信号均包含2个质子,应属于对称结构,其化学位移、裂分及耦合常数符合苯环上邻位氢的特征,该结果与山奈酚b环结构相符合,因此推断其分属于山奈酚b环h-2',6'与h-3',5'。δ4.66(h,t,j=10.0hz)为半乳糖端基质子信号;δ4.55(h,d,j=1.1hz)、4.54(h,d,j=1.1hz)为鼠李糖端基质子信号;δ1.92(h,s)、2.00(h,s)为乙酰基质子信号;δ1.01(3h,d,j=6.2hz)、0.74(3h,d,j=6.2hz)为鼠李糖基甲基质子信号;δ4.0-3.0段多组信号为糖基其它质子信号,该结果与质谱推断相吻合。
13c-nmr(见图6)中,δ102.60,74.16,71.24,69.27,75.29,66.69为一组半乳糖基信号,δ96.82,71.52,76.40,73.83,65.54,17.15以及δ101.03,70.33,70.58,71.01,69.36,18.10为两组组鼠李糖基信号,δ169.98,20.83和δ170.15,20.83则归属于乙酰基鼠李糖基中的乙酰基,其余信号与山奈酚特征信号高度吻合,该结果与上述推断一致。
h-hcosy(见图7)中,δ6.19(h,d,j=1.9hz)与δ6.40(h,d,j=1.9hz),其特征符合苯环上间位氢的特征,推断其分属于山奈酚a环h-6与h-8;δ7.95(2h,d,j=8.9hz)与δ6.89(2h,d,j=8.9hz)相互耦合,形成典型的对位取代苯的aa'bb'自旋耦合体系,符合山奈酚b环结构;δ4.66(h,t,j=10.0hz)与δ3.80(m)相互耦合,根据化学位移值可推断其归属于半乳糖糖基端基,通过其耦合常数可以判断,该半乳糖苷键为β构型。δ1.01(3h,d,j=6.2hz)、0.74(3h,d,j=6.2hz)均与δ3.00-4.00(m)相互耦合,符合鼠李糖基甲基质子信号特征。
hsqc(见图8)中,δ98.85与δ6.19(h,d,j=1.9hz)对应,δ93.71与δ6.40(h,d,j=1.9hz)对应,δ130.74与δ7.95(2h,d,j=8.9hz)对应,δ115.10与6.89(2h,d,j=8.9hz)对应,δ102.60与δ4.66(h,t,j=10.0hz)对应,δ96.82与δ4.55(h,d,j=1.1hz)对应,δ101.03与δ4.54(h,d,j=1.1hz)对应,δ17.15与δ1.01(3h,d,j=6.2hz)对应,δ18.10与δ0.74(3h,d,j=6.2hz)对应,δ20.83与δ1.92(h,s)对应,δ20.8与δ2.00(h,s)对应。
hmbc(见图9)中,δ6.19(h,d,j=1.9hz)与δ159.98、164.55相关,δ6.40(h,d,j=1.9hz)与δ164.55、156.52相关,δ7.95(2h,d,j=8.9hz)与δ120.82、115.10、161.24相关,δ6.89(2h,d,j=8.9hz)与δ130.74、161.24、120.82相关,其特征与山奈酚完全符合。
结合tocsy(见图10)及hsqc,通过hmbc可确定不同片段的连接位点,δ4.66(h,t,j=10.0hz)与δ132.91相关,可知半乳糖基与山奈酚c-3相连;δ4.55(h,d,j=1.1hz)与δ66.69相关,可知鼠李糖基rha(1)与glu-c-6相连;δ4.54(h,d,j=1.1hz)与δ76.40相关,可知鼠李糖基rha(2)与鼠李糖基rha(1)-c-3相连。δ1.92(h,s)、2.00(h,s)分别与δ71.52、73.83相关,可知两个乙酰基与鼠李糖基rha(1)-c-2及rha(1)-c-4相连。
对h谱和c谱的峰进行归属:
1h-nmr:7.95(2h,d,j=8.9hz,h-2’,6’),6.89(2h,d,j=8.9hz,h-3’,5’),6.40(h,d,j=1.9hz,h-8),6.19(h,d,j=1.9hz,h-6),4.89(h,dd,j=3.5,1.5hz,h-2””),4.66(h,t,j=10.0hz,h-1”),4.55(h,d,j=1.1hz,h-1”’),4.54(h,d,j=1.1hz,h-1””),2.00(h,s,aco-c-4”’),1.92(h,s,aco-c-2”’),1.01(h,d,j=6.2hz,h-6”’),0.74(h,d,j=6.2hz,h-6””)。
13c-nmr:156.57(c-2),132.91(c-3),177.36(c-4),159.98(c-5),98.85(c-6),164.55(c-7),93.71(c-8),156.52(c-9),103.80(c-10),120.82(c-1’),130.74(c-2’,6’),115.10(c-3’,5’),161.24(c-4’),102.60(c-1”),74.16(c-2”),71.24(c-3”),69.27(c-4”),75.29(c-5”),66.69(c-6”),96.82(c-1”’),71.52(c-2”’),76.40(c-3”’),73.83(c-4”’),65.54(c-5”’),17.15(c-6”’),101.03(c-1””),70.33(c-2””),70.58(c-3””),71.01(c-4””),69.36(c-5””),18.10(c-6””),170.15,20.8(aco-c-4”’),169.98,20.83(aco-c-2”’)。
综合所有核磁谱图及质谱结果,化合物y-31鉴定为山奈酚-3-o-[α-l-吡喃鼠李糖(1→3)-2"',4"'-二乙酰基-α-l-吡喃鼠李糖(1→6)-β-d-半乳糖苷],结构式为:
本申请提供的从南山茶中提取山奈酚半乳糖苷类化合物的方法,首次从山茶属植物中分离提取出了目标化合物,方法简单实用,适宜于规模化应用,产品纯度高,对于南山茶的深度开发利用有着积极意义。
尽管已用具体实施例来说明和描述了本发明,然而应意识到,在不背离本发明的精神和范围的情况下可以作出许多其它的更改和修改。因此,这意味着在所附权利要求中包括属于本发明范围内的所有这些变化和修改。
- 还没有人留言评论。精彩留言会获得点赞!