引物延伸靶标富集及对其的包括同时富集DNA和RNA的改进的制作方法
本发明涉及核酸测序的领域。更具体地,本发明涉及富集用于测序的稀有核酸靶标的领域。
发明背景
用于高通量测序的样品制备通常涉及富集步骤,其增加样品中的含有靶序列的核酸与非靶标核酸的比率。本领域中已知的基于序列的富集技术包括杂交捕获、pcr扩增、引物延伸靶标富集(pete)。基于引物的靶标富集方法涉及一轮或多轮拷贝链的合成。dna测序的一些临床应用目的在于检测非常稀有的靶标,例如癌症的血液中存在的无细胞肿瘤dna(ctdna)。特征在于突变的肿瘤dna以低至每ml典型血液样品(capp纸)几个拷贝的浓度存在。需要利用尽可能少的来自患者的样品材料可靠地检测此类稀有的靶序列。
发明概述
在一个实施方案中,本发明是从样品富集靶标多核苷酸的方法,所述方法包括:提供包含所述靶标多核苷酸的样品;使第一靶标特异性引物与所述靶标多核苷酸杂交,其中所述引物包含靶标结合区域和与衔接子互补的区域;用dna聚合酶延伸杂交的靶标特异性引物以形成引物延伸产物;使所述样品与包含具有5'-突出端的较长链和较短链的衔接子接触,其中所述5'-突出端包含与所述靶标特异性引物中的区域互补的区域,且所述较短链包含通用引发位点;使所述衔接子与所述引物延伸产物杂交;将所述衔接子的一条链连接至所述引物延伸产物以形成连接产物;使第二靶标特异性引物与所述引物延伸产物杂交,其中所述第二靶标特异性引物包含靶标结合位点和通用引发位点;利用与所述通用引发位点杂交的引物扩增所述连接产物。在一些实施方案中,引物退火和延伸步骤或引物退火和扩增步骤同时进行。在一些实施方案中,所述方法进一步包括除去所述靶标特异性引物或所述衔接子的纯化步骤。所述纯化可以选自酶促消化、基于大小排阻的纯化和基于亲和力的纯化。
在一些实施方案中,用具有热启动能力的dna聚合酶进行扩增。
在一些实施方案中,所述衔接子的较短链的长度短于或等于所述5'-突出端的长度的1.5倍。在一些实施方案中,所述衔接子包含在3'-末端的延伸阻断。所述阻断可以包含3'-或2'-磷酸酯基团。
在一些实施方案中,扩增包括子循环热循环概况。
在一些实施方案中,所述第一和第二靶标特异性引物中的至少一者包含条形码,诸如独特的分子条形码(uid)和样品条形码(sid)。
在一些实施方案中,步骤h)中的扩增包括数字液滴pcr。
更详细地,本发明提供了从样品富集靶标多核苷酸的方法,所述方法包括:
a)提供包含所述靶标多核苷酸的样品;
b)使第一靶标特异性引物与所述靶标多核苷酸杂交,其中所述引物包含靶标结合区域和与衔接子互补的区域;
c)用dna聚合酶延伸杂交的靶标特异性引物以形成引物延伸产物;
d)使所述样品与包含具有5'-突出端的较长链和较短链的衔接子接触,其中所述5'-突出端包含与所述靶标特异性引物中的区域互补的区域,且所述较短链包含通用引发位点;
e)使所述衔接子与所述引物延伸产物杂交;
f)将所述衔接子的一条链连接至所述引物延伸产物以形成连接产物;
g)使第二靶标特异性引物与所述引物延伸产物杂交,其中所述第二靶标特异性引物包含靶标结合位点和通用引发位点;
h)利用与所述通用引发位点杂交的引物扩增所述连接产物。
步骤b)和c)可以同时进行。步骤g)和h)同时进行。所述方法可以进一步包括在步骤c)之后除去所述靶标特异性引物的纯化步骤。在步骤e)之后,也可以使用纯化步骤来除去衔接子。纯化可以选自酶促消化、基于大小排阻的纯化和基于亲和力的纯化。步骤h)中的扩增可以通过具有热启动能力的dna聚合酶来进行。
所述衔接子的较短链的长度可以短于或等于所述5'-突出端的长度的1.5倍。所述衔接子可以在3'-末端包含延伸阻断,其优选为3'-或2'-磷酸酯基团。
扩增步骤h)可以包括子循环热循环概况。所述第一和第二靶标特异性引物中的至少一者可以包含条形码,其可以是独特的分子条形码(uid)和样品条形码(sid)。步骤h)可以作为数字液滴pcr进行。
本发明还提供了从样品富集靶标多核苷酸的方法,所述方法包括:
a)提供包含单链rna和双链dna形式两者的靶标多核苷酸的样品;
b)使第一靶标特异性引物与所述靶标多核苷酸的单链rna形式杂交,其中所述引物包含靶标结合区域和与衔接子互补的区域;
c)用逆转录酶延伸杂交的第一靶标特异性引物,以形成包含rna链和第一引物延伸产物的双链rna-dna杂合体;
d)使所述样品经受双链核酸变性条件;
e)使第二靶标特异性引物与变性的dna杂交,其中所述引物包含靶标结合区域和与所述衔接子互补的区域;
f)用dna聚合酶延伸杂交的第二靶标特异性引物以形成第二引物延伸产物;
g)使所述样品与包含较长链和较短链的衔接子接触,其中所述较长链包含与所述靶标特异性引物中的区域互补的区域,且所述较短链包含通用引发位点;
h)使所述衔接子与所述第一和第二引物延伸产物杂交;
i)将所述衔接子的一条链连接至所述第一和第二引物延伸产物以形成连接产物;
j)使第三靶标特异性引物与所述第一引物延伸产物杂交,和使第四引物与所述第二引物延伸产物杂交,其中所述第三和第四靶标特异性引物包含靶标结合位点和通用引发位点;和
k)利用与所述通用引发位点杂交的引物扩增所述连接产物。
所述第一和第二靶标特异性引物可以包含独特的分子条形码。所述第一靶标特异性引物可以与所述第二靶标特异性引物相同。或者,所述第一靶标特异性引物可以与所述第二靶标特异性引物不同,但靶向相同的基因。所述第三靶标特异性引物可以与所述第四靶标特异性引物相同。在一个具体实施方案中,所述第一靶标特异性引物与所述第二靶标特异性引物相同,但所述第三靶标特异性引物与所述第四靶标特异性引物不同。
所述方法可以进一步包括在步骤c)之后从rna-dna杂合体除去rna的步骤。此外,所述方法可以进一步包括在步骤g)中使样品与衔接子接触之前从样品除去未使用的引物的步骤或在步骤k)中扩增之前从样品除去未使用的引物的步骤。所述方法还可以包括在步骤c)和f)之后除去单链核酸的步骤。步骤f)中的dna聚合酶可以是具有热启动能力的热稳定聚合酶。
本发明还包括从样品测序靶标多核苷酸的方法,所述方法包括以下步骤:
a)提供包含单链rna和双链dna形式两者的靶标多核苷酸的样品;
b)使第一靶标特异性引物与所述靶标多核苷酸的单链rna形式杂交,其中所述引物包含靶标结合区域和与衔接子互补的区域;
c)用逆转录酶延伸杂交的第一靶标特异性引物,以形成包含rna链和第一引物延伸产物的双链rna-dna杂合体;
d)使所述样品经受双链核酸变性条件;
e)使所述第二靶标特异性引物与变性的dna杂交,
f)用dna聚合酶延伸杂交的第二靶标特异性引物以形成第二引物延伸产物,其中所述引物包含靶标结合区域和与衔接子互补的区域;
g)使所述样品与包含较长链和较短链的衔接子接触,其中所述较长链包含与所述第一和第二靶标特异性引物中的区域互补的区域,且所述较短链包含通用引发位点;
h)使所述衔接子与所述第一和第二引物延伸产物杂交;
i)将所述衔接子的一条链连接至所述第一和第二引物延伸产物以形成连接产物;
j)使第三靶标特异性引物与所述第一引物延伸产物杂交,和使所述第四靶标特异性引物与所述第二引物延伸产物杂交,其中所述第三和第四靶标特异性引物包含靶标结合位点和通用引发位点;
k)利用与所述通用引发位点杂交的引物扩增所述连接产物;
l)将来自步骤k)的扩增的连接产物进行测序。
所述通用引物可以用作测序引物。或者,所述第三和第四靶标特异性引物进一步包含测序引物结合位点。又或者,所述衔接子进一步包含测序引物结合位点。所述衔接子还可以包含条形码,其可以是样品标识条形码。
在一个具体实施方案中,如果所述通用引物也用作测序引物,则可以检测样品中的基因融合体。在这种情况下,来自样品的靶标多核苷酸以使得第一和第二靶标特异性引物相同、但第三和第四靶标特异性引物不同的方式进行处理和测序。
本发明还包括从样品富集靶标多核苷酸的方法,所述方法包括:
a)提供包含单链rna和双链dna形式两者的靶标多核苷酸的样品;
b)使第一靶标特异性引物与所述靶标多核苷酸的单链rna形式杂交,其中所述引物包含靶标结合区域;
c)用逆转录酶延伸杂交的第一靶标特异性引物,以形成包含rna链和第一引物延伸产物的双链rna-dna杂合体;
d)使所述样品经受双链核酸变性条件;
e)使第二靶标特异性引物与变性的dna杂交,其中所述引物包含靶标结合区域和与衔接子互补的区域;
f)使第三靶标特异性引物与所述第一引物延伸产物杂交,其中所述引物包含靶标结合区域和与所述衔接子互补的区域;
g)用dna聚合酶延伸杂交的第二和第三靶标特异性引物以形成第二和第三引物延伸产物;
h)使所述样品与包含较长链和较短链的衔接子接触,其中所述较长链包含与所述靶标特异性引物中的区域互补的区域,且所述较短链包含通用引发位点;
i)使所述衔接子与所述第二和第三引物延伸产物杂交;
j)将所述衔接子的一条链连接至所述第二和第三引物延伸产物以形成连接产物;
k)使第四靶标特异性引物与所述第二引物延伸产物杂交,和使第五引物与所述第三引物延伸产物杂交,其中所述第四和第五靶标特异性引物包含靶标结合位点和通用引发位点;和
l)利用与所述通用引发位点杂交的引物扩增所述连接产物。
本发明还提供了用于从样品同时富集dna和rna靶标的试剂盒,其包含:包含靶标结合区域和与衔接子互补的区域的第一靶标特异性引物,逆转录酶,包含靶标结合区域和与所述衔接子互补的区域的第二靶标特异性引物,形成第二引物延伸产物的dna聚合酶;所述衔接子包含较长链和较短链,其中所述较长链包含与所述第一和第二靶标特异性引物中的区域互补的区域,且所述较短链包含通用引发位点;和任选地,用于dna连接和dna扩增的通用引物和试剂。所述试剂盒可以进一步包含用于将富集的dna和rna靶标进行测序的试剂。
本发明还提供了用于从样品同时富集dna和rna靶标的反应混合物,其包含:包含靶标结合区域和与衔接子互补的区域的第一靶标特异性引物,逆转录酶,包含靶标结合区域和与所述衔接子互补的区域的第二靶标特异性引物,形成第二引物延伸产物的dna聚合酶;所述衔接子包含较长链和较短链,其中所述较长链包含与所述第一和第二靶标特异性引物中的区域互补的区域,且所述较短链包含通用引发位点。
附图简述
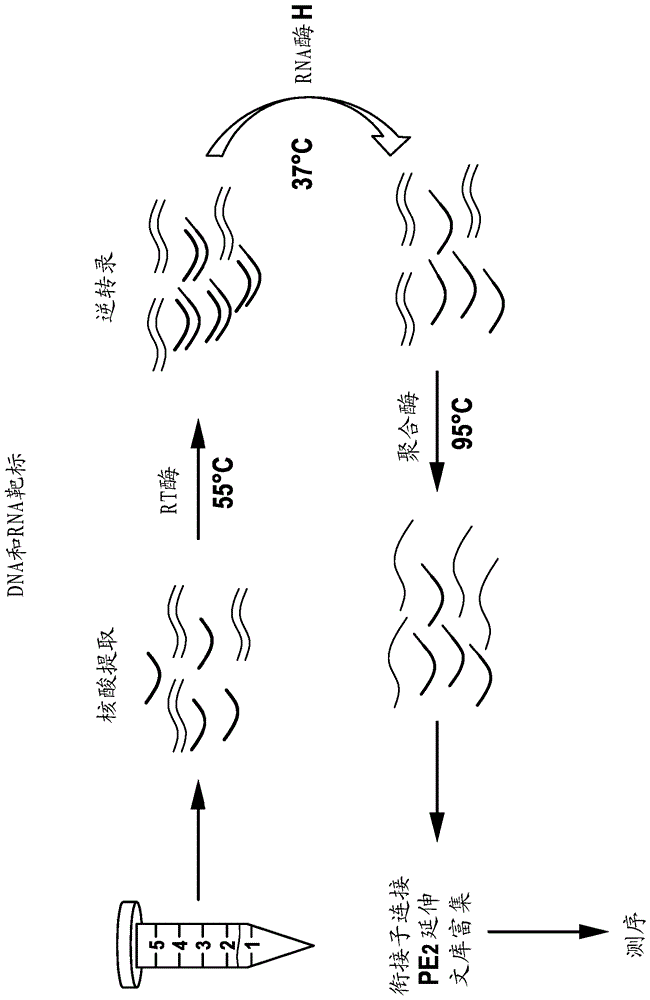
图1是本发明的工作流程的概览图。
图2是本发明的工作流程的图,其包括同时富集dna和rna。
图3举例说明将该方法应用于rna靶标的结果。
图4是举例说明图2的方法的示意流程图。
图5是根据本公开的方法的一个实施方案的示意图,其中第二引物延伸步骤和通用引物扩增步骤组合成单一步骤。
图6是连接至引物延伸产物的衔接子的示意图。
图7是突出显示图6的衔接子的实施方案的单链突出端区域的详细视图。
图8是柱状图,其举例说明当应用于根据本公开的方法的第一引物延伸反应时子循环对中靶百分比的影响。
图9是根据本公开的方法的一个实施方案的示意图,其包括并入有uid和mid两者的引物。
图10是根据本公开的方法的一个实施方案的示意图,其中该方法被修改以用于与数字液滴pcr(ddpcr)一起使用。
发明详述
定义
除非另外定义,否则本文使用的技术和科学术语具有与本领域普通技术人员通常理解的相同的含义。参见,sambrook等人,molecularcloning,alaboratorymanual,第4版.coldspringharborlabpress(2012)。
提供以下定义以便于对本公开的理解。
术语“条形码”是指可以检测和标识的核酸序列。条形码通常可以是2个或更多且最多达约50个核苷酸长。条形码被设计为与群体中的其他条形码具有至少最小数量的差异。条形码可以对于样品中的每个分子是独特的,或者对于样品是独特的,并且由样品中的多个分子共享。
术语“多重标识符”、“mid”或“样品条形码”是指标识样品或样品来源的条形码。因此,来自单一来源或样品的所有或实质上所有mid条形码化的多核苷酸将共享相同序列的mid;而来自不同来源或样品的所有或实质上所有(例如,至少90%或99%)mid条形码化的多核苷酸将具有不同的mid条形码序列。来自具有不同mid的不同来源的多核苷酸可以混合和平行测序,同时维持在mid条形码中编码的样品信息。
术语“独特的分子标识符”或“uid”是指标识与其连接的多核苷酸的条形码。通常,uid条形码化的多核苷酸的混合物中的所有或实质上所有(例如,至少90%或99%)uid条形码是独特的。
术语“核酸”或“多核苷酸”是指单链或双链形式的脱氧核糖核酸(dna)或核糖核酸(rna)及其聚合物。除非特别限定,否则该术语涵盖含有天然核苷酸的已知类似物的核酸,其具有与参考核酸相似的结合特性,并以与天然存在的核苷酸相似的方式代谢。除非另有说明,否则特定核酸序列还隐含地涵盖其保守修饰的变体(例如,简并密码子取代)、等位基因、直向同源物、snp和互补序列以及明确指示的序列。
术语“聚合酶”是指进行多核苷酸的模板指导合成的酶。dna聚合酶包括原核poli、polii、poliii、poliv和polv,真核dna聚合酶,古细菌dna聚合酶,端粒酶和逆转录酶。术语“热稳定聚合酶”是指这样的酶,其对热稳定,耐热并且保留足够的活性以实现随后的多核苷酸延伸反应并且当经受高温持续实现双链核酸的变性所必需的时间时不会变得不可逆变性(失活)。在一些实施方案中,可以使用以下热稳定聚合酶:嗜热热球菌(thermococcuslitoralis)(vent,genbank:aaa72101),激烈热球菌(pyrococcusfuriosus)(pfu,genbank:d12983,baa02362),沃氏热球菌(pyrococcuswoesii),热球菌gb-d(deepvent,genbank:aaa67131),thermococcuskodakaraensiskodi(kod,genbank:bd175553,baa06142;热球菌属种菌株kod(pfx,genbank:aae68738)),thermococcusgorgonarius(tgo,pdb:4699806),sulfolobussolataricus(genbank:nc002754,p26811),敏捷气热菌(aeropyrumpernix)(genbank:baa81109),闪烁古生球菌(archaeglobusfulgidus)(genbank:029753),耐超高温热棒菌(pyrobaculumaerophilum)(genbank:aal63952),隐蔽热网菌(pyrodictiumoccultum)(genbank:baa07579,baa07580),热球菌9度nm(genbank:aaa88769,q56366),thermococcusfumicolans(genbank:caa93738,p74918),thermococcushydrothermalis(genbank:cac18555),热球菌属种ge8(genbank:cac12850),热球菌属种jdf-3(genbank:ax135456;wo0132887),热球菌属种ty(genbank:caa73475),pyrococcusabyssi(genbank:p77916),pyrococcusglycovorans(genbank:cac12849),pyrococcushorikoshii(genbank:np143776),热球菌属种ge23(genbank:caa90887),热球菌属种st700(genbank:cac12847),thermococcuspacificus(genbank:ax411312.1),thermococcuszilligii(genbank:dq3366890),thermococcusaggregans,thermococcusbarossii,thermococcusceler(genbank:dd259850.1),thermococcusprofundus(genbank:e14137),thermococcussiculi(genbank:dd259857.1),thermococcusthioreducens,thermococcusonnurineusna1,嗜酸热硫化叶菌(sulfolobusacidocaldarium),sulfolobustokodaii,pyrobaculumcalidifontis,冰岛热棒菌(pyrobaculumislandicum)(genbank:aaf27815),詹氏甲烷球菌(methanococcusjannaschii)(genbank:q58295),脱硫球菌属种tok,脱硫球菌属,火叶菌属,热网菌属,葡萄热菌属,vulcanisaetta,甲烷球菌(genbank:p52025)和其他古细菌b聚合酶,诸如genbankaac62712、p956901、baaa07579)),嗜热细菌栖热菌属种(例如,黄栖热菌、红色栖热菌、嗜热栖热菌、乳栖热菌、红色栖热菌、水生栖热菌),嗜热脂肪芽孢杆菌(bacillusstearothermophilus),海栖热袍菌(thermotogamaritima),炽热甲烷嗜热菌(methanothermusfervidus),kod聚合酶,tna1聚合酶,热球菌种9度n-7、t4、t7、phi29,激烈热球菌(pyrococcusfuriosus),p.abyssi,t.gorgonarius,t.litoralis,t.zilligii,热球菌属种gt,热球菌属种gb-d,kod,pfu,t.gorgonarius,t.zilligii,t.litoralis和热球菌属种9n-7聚合酶。在一些情况下,所述核酸(例如,dna或rna)聚合酶可以是修饰的天然存在的a型聚合酶。本发明的一个进一步实施方案通常涉及这样的方法,其中修饰的a型聚合酶,例如,在引物延伸、末端修饰(例如,末端转移酶、降解或抛光)或扩增反应中的修饰的a型聚合酶,可以选自亚栖热菌属、热袍菌属或热微菌属的任何种。本发明的另一个实施方案总体涉及这样的方法,其中聚合酶,例如,在引物延伸、末端修饰(例如,末端转移酶、降解或抛光)或扩增反应中的聚合酶,可以分离自水生栖热菌(thermusaquaticus)(taq)、嗜热栖热菌(thermusthermophilus)、thermuscaldophilus或丝状栖热菌(thermusfiliformis)中的任一种。本发明的一个进一步实施方案通常涵盖这样的方法,其中修饰的a型聚合酶,例如,在引物延伸、末端修饰(例如,末端转移酶、降解或抛光)或扩增反应中的修饰的a型聚合酶,可以分离自嗜热脂肪芽孢杆菌(bacillusstearothermophilus)、嗜热球杆菌(sphaerobacterthermophilus)、dictoglomusthermophilum或大肠杆菌。在另一个实施方案中,本发明总体涉及这样的方法,其中修饰的a型聚合酶,例如,在引物延伸、末端修饰(例如,末端转移酶、降解或抛光)或扩增反应中的修饰的a型聚合酶,可以是突变型taq-e507k聚合酶。本发明的另一个实施方案总体涉及这样的方法,其中热稳定聚合酶可用于实现靶核酸的扩增。
术语“引物”是指寡核苷酸,其结合单链模板核酸分子的特定区域且经由聚合酶介导的酶促反应起始核酸合成。通常,引物包含少于约100个核苷酸,且优选包含少于约30个核苷酸。靶标特异性引物在杂交条件下与靶标多核苷酸特异性杂交。此类杂交条件可以包括但不限于在等温扩增缓冲液(20mmtris-hcl,10mm(nh4)2so4),50mmkcl,2mmmgso4,0.1%tween®20,ph8.8,在25℃下)中在约40℃至约70℃的温度下杂交。除了靶标结合区域之外,引物可以具有额外的区域,通常在5'-部分处。额外的区域可以包括通用引物结合位点或条形码。
术语“通用引物”是指可以与通用引物结合位点杂交的引物。通用引物结合位点可以是通常以非靶标特异性方式添加至靶序列的天然或人工序列。
术语“样品”是指包含核酸分子、通常包含dna或rna的任何生物样品。样品可以是组织、细胞或其提取物,或者可以是核酸分子的纯化样品。术语“样品”的使用不一定暗示样品中存在的核酸分子中存在靶序列。
术语“样品”是指含有或假定含有靶核酸的任何组合物。这包括从个体分离的组织或液体样品,例如皮肤、血浆、血清、脊髓液、淋巴液、滑液、尿液、泪液、血细胞、器官和肿瘤,以及由取自个体的细胞建立的体外培养物的样品,包括福尔马林固定的石蜡包埋的组织(ffpet)和从其分离的核酸。样品还可以包括无细胞材料,诸如含有无细胞dna(cfdna)或循环肿瘤dna(ctdna)的无细胞血液级分。
核酸测序正在快速扩展至临床实践中。目前的测序技术采用单分子测序,并且允许检测极端稀有的靶标。核酸测序的临床应用中的是“液体活检”,例如使用血液样品而不是传统的侵入性活检来检测和监测恶性肿瘤。肿瘤dna的特征在于存在突变,包括单核苷酸变异或小序列变异以及基因融合。参见newman,a.,等人,(2014)anultrasensitivemethodforquantitatingcirculatingtumordnawithbroadpatientcoverage,naturemedicinedoi:10.1038/nm.3519和f.mertens,等人(2015)theemergingcomplexityofgenefusionsincancer,nat.rev.cancer15:371。
可以用根据本发明的通过单探针引物延伸的靶标富集的方法克服这些和其他挑战。在一个方面,本公开描述了基于单探针引物延伸的富集的一般方法及其改进。本文描述的改进包括,但不限于,替代的纯化方法,工作流程修改(例如,替代酶,总步骤数量的减少,改进的热循环概况),替代的衔接子设计,和改变以使得能够应用公开的方法同时富集rna和dna两者,以及数字液滴pcr。
在一个实施方案中,本发明是扩增靶序列的方法,其包括以下步骤:使所述靶核酸与引物和聚合酶接触,其中所述引物包含靶结合位点和独特的分子鉴定标签(uid);进行聚合酶延伸反应和终止以产生单链引物延伸产物;将衔接子连接至单链引物延伸产物的每一端以产生连接产物,其中衔接子包含至少一个通用引发位点;利用结合至至少一个通用引发位点的至少一个引物在扩增反应中扩增所述连接产物以产生扩增的靶序列。在一些实施方案中,所述引物和至少一个衔接子包含相互相容的通用连接位点。在一些实施方案中,所述靶标结合位点是预先设计的靶标特异性序列。在一些实施方案中,所述靶标结合位点是随机序列。在一些实施方案中,所述终止通过选自以下的方法实现:温度转换,添加特异性酶抑制剂,添加螯合剂,掺入含尿苷的碱基、随后用尿嘧啶-n-dna糖基化酶处理。在一些实施方案中,至少一个衔接子包含条形码。所述条形码可以是多重样品id(mid)。所述扩增可以是线性扩增或指数扩增。在一些实施方案中,所述方法在引物延伸和连接中的至少一种之后进一步包括纯化步骤。
在其他实施方案中,本发明是用于扩增靶序列的试剂盒,其包含:引物,其包含靶结合位点、独特分子标识标签(uid)和通用连接位点;至少一个衔接子,其包含至少一个通用引发位点、多重样品id(mid)和通用连接位点。在一些实施方案中,所述试剂盒包含具有不同通用引发位点的两个衔接子,但仅包含一个包含通用连接位点和mid的衔接子。在一些实施方案中,所述试剂盒进一步包含以下中的一种或多种:核酸聚合酶、连接酶、热稳定dna聚合酶和通用引物。
检测单独分子通常需要分子条形码,诸如美国专利号7,393,665、8,168,385、8,481,292、8,685,678和8,722,368中所述。独特分子条形码是通常在体外操作的最早步骤期间添加至患者样品中的每个分子的短人工序列。所述条形码标记分子及其后代。所述独特分子条形码(uid)具有多种用途。条形码允许追踪样品中的每个单独的核酸分子,以评价例如患者血液中循环肿瘤dna(ctdna)分子的存在和量,以便在没有活检的情况下检测和监测癌症(newman,a.,等人,(2014)anultrasensitivemethodforquantitatingcirculatingtumordnawithbroadpatientcoverage,naturemedicinedoi:10.1038/nm.3519)。
独特分子条形码也可用于测序错误校正。单一靶分子的整个后代用相同的条形码标记并形成条形码化家族。没有被条形码化家族的所有成员共享的序列的变化作为伪像而非真正的突变被丢弃。条形码也可用于位置去重复(positionaldeduplication)和靶标定量,因为整个家族代表原始样品中的单一分子(newman,a.,等人,(2016)integrateddigitalerrorsuppressionforimproveddetectionofcirculatingtumordna,naturebiotechnology34:547)。
在一些实施方案中,本发明是用于测序的条形码化核酸分子的文库。在一些实施方案中,本发明是经由产生核酸分子的条形码化文库对核酸进行测序的方法。
本发明包括通过核酸测序来检测样品中的靶核酸。可以使用本文所述的方法和组合物检测多种核酸,包括样品中的所有核酸。在一些实施方案中,所述样品来源于主体或患者。在一些实施方案中,所述样品可以包含(例如通过活检)来源于主体或患者的实体组织或实体瘤的片段。所述样品还可以包括体液(例如,尿液、痰液、血清、血浆或淋巴液、唾液、痰液、汗液、泪液、脑脊髓液、羊水、滑液、心包液、腹膜液、胸膜液、囊液、胆汁、胃液、肠液或粪便样品)。所述样品可以包括其中可存在正常或肿瘤细胞的全血或血液级分。在一些实施方案中,所述样品,尤其是液体样品,可以包含无细胞材料,诸如无细胞dna或rna,包括无细胞肿瘤dna或肿瘤rna。在一些实施方案中,所述样品是无细胞样品,例如无细胞血液来源的样品,其中存在无细胞肿瘤dna或肿瘤rna。在其他实施方案中,所述样品是培养的样品,例如含有或怀疑含有源自培养物中的细胞或源自培养物中存在的传染剂的核酸的培养物或培养物上清液。在一些实施方案中,所述传染剂是细菌、原生动物、病毒或支原体。
靶核酸是可以存在于样品中的目标核酸。在一些实施方案中,所述靶核酸是靶标特异性引物与之杂交的基因或基因片段、或转录物或转录物的一部分。在一些实施方案中,多个基因、基因片段、基因间区域和基因转录物构成靶核酸。在一些实施方案中,所述靶核酸含有遗传变体的基因座,例如,多态性,包括单核苷酸多态性或变体(snv的snp),或导致例如基因融合的遗传重排。在一些实施方案中,所述靶核酸包含生物标志物,即其变体与疾病或病况相关的基因。在其他实施方案中,所述靶核酸是特定生物体特征性的并且有助于鉴定生物体或病原生物体的特征,诸如药物敏感性或药物抗性。在还有其他实施方案中,所述靶核酸是人主体的独特特征,例如,定义主体的独特hla或kir基因型的hla或kir序列的组合。
在一些实施方案中,所述靶核酸在自然界中以单链形式(例如,rna,包括mrna、微小rna、病毒rna;或单链病毒dna)存在。在其他实施方案中,所述靶核酸在自然界中以双链形式存在。本领域技术人员将认识到,本发明的方法能够同时富集rna和dna形式两者的靶核酸,并且是有效的,无论样品中存在一种形式还是两种形式。较长的靶核酸可以是片段化的。在一些实施方案中,所述靶核酸是天然片段化的,例如,循环的无细胞dna(cfdna)或化学降解的dna,诸如在保存的样品中发现的核酸。
本发明包括使用待连接至引物延伸产物的末端的一个衔接分子。在一些实施方案中,部分单链衔接子与单链引物延伸产物杂交以产生在一条链中具有切口的部分双链分子。具有切口的链的连接是本领域中众所周知的(参见greenm.,和sambrook,j.,molecularcloning,2012cshlpress)。
在一些实施方案中,所述衔接子分子是体外合成的人工序列。在其他实施方案中,所述衔接子分子是体外合成的天然存在的序列。在还有其他实施方案中,所述衔接子分子是分离的天然存在的分子或分离的非天然存在的分子。
在一些实施方案中,所述衔接子包含一个或多个条形码。条形码可以是用于在样品被混合(多重化)的情况下标识样本来源的多重样品id(mid)。所述条形码还可以充当用于标识每个原始分子及其后代的独特分子id(uid)。所述条形码也可以是uid和mid的组合。在一些实施方案中,单个条形码用作uid和mid两者。在一些实施方案中,每个条形码包含预定义序列。在其他实施方案中,所述条形码包含随机序列。
在一些实施方案中,通过本发明的方法生成的扩增的分子包含至少一个条形码,并且在一些实施方案中,包含至少两个条形码。至少一个条形码是uid,并且至少两个条形码包含uid和mid。在本发明的一些实施方案中,所述条形码为约4-20个碱基长,使得96至384个不同的衔接子(每个衔接子具有不同对的相同条形码)被添加至人基因组样品。普通技术人员将认识到条形码的数目取决于样品的复杂性(即,独特靶分子的预期数目),并且能够为每个实验产生合适数目的条形码。
在一些实施方案中,本发明利用靶标特异性引物。靶标特异性引物至少包含与靶标互补的部分。如果存在额外的序列,则它们通常在引物的5'-部分中。在一些实施方案中,相同的引物或一对靶标特异性引物可用于靶标的rna和dna版本。在其他实施方案中,仅共有一个靶标特异性引物,并且第二靶标特异性引物是不同的。在还有其他实施方案中,所述靶标特异性引物对于不同基因是特异性的,例如,所述第二靶标特异性引物对于基因融合配偶体是特异性的。在还有其他实施方案中,用于dna的引物靶向与用于rna靶标的引物的不同的基因或基因座。
所述衔接子进一步包含用于至少一种通用引物的引物结合位点。本领域技术人员将认识到双链衔接子序列将在一条链上具有引物结合位点,并且在另一条链上具有与所述引物相同的序列。普通技术人员还将认识到单链引物(例如,靶标特异性引物)将具有与所述引物相同的5'-序列,其将被复制至互补链中的引物结合位点。
在一些实施方案中,本发明包括扩增步骤。该步骤可以涉及线性或指数扩增,例如pcr。扩增可以是等温的或涉及热循环。在一些实施方案中,所述扩增是指数的并涉及pcr。使用通用引物,即,单对引物与样品中的所有靶序列上存在的衔接子中的结合位点杂交。可以用相同的引物组扩增文库中的具有相同衔接子的所有分子。因为用通用引物的pcr具有降低的序列偏差,所以不需要限制扩增循环的数目。其中使用通用引物的扩增循环的数目可以是低的,但也可以是10个、20个或高达约30个或更多个循环,这取决于后续步骤所需的产物量。
从靶核酸生成的扩增子可以进行核酸测序。可以通过本领域已知的任何方法进行测序。特别有利的是高通量单分子测序。此类技术的实例包括illuminahiseq平台(illumina,sandiego,cal.)、iontorrent平台(lifetechnologies,grandisland,ny)、利用smrt的pacificbiosciences平台(pacificbiosciences,menlopark,cal.)或利用纳米孔技术的平台诸如由oxfordnanoporetechnologies(oxford,uk)或rochesequencingsolutions(santaclara,cal.)制造的那些和任何其他目前存在或未来的涉及或不涉及边合成边测序的dna测序技术。测序步骤可以利用平台特异性测序引物。可以在扩增步骤中使用的扩增引物的5'-部分中引入这些引物的结合位点。如果条形码化分子的文库中不存在引物位点,则可以进行引入此类结合位点的额外的短扩增步骤。
在一些实施方案中,所述测序步骤涉及序列分析。在一些实施方案中,所述分析包括序列比对的步骤。在一些实施方案中,使用比对来确定来自多个序列(例如具有相同的条形码(uid)的多个序列)的共有序列。在一些实施方案中,使用条形码(uid)来确定来自都具有相同的条形码(uid)的多个序列的共有序列。在其他实施方案中,使用条形码(uid)来消除伪像,即,在一些但不是所有具有相同条形码(uid)的序列中存在的变异。可以消除由pcr错误或测序错误导致的此类伪像。
在一些实施方案中,可以通过定量样品中的具有每种条形码(uid)的序列的相对数目来定量样品中的每种序列的数目。每个uid代表原始样品中的单一分子,并且计数与每种序列变体相关的不同uid可以确定原始样品中每种序列的分数。本领域技术人员将能够确定测定共有序列所必需的序列读取值的数目。在一些实施方案中,相关数目是精确定量结果所必需的每个uid的读取值(“序列深度”)。在一些实施方案中,期望深度是每个uid5-50个读取值。
同时分析来自相同样品的rna和dna材料在临床上具有实质性效用。对于许多类型的样品,核酸的量和质量是有限的,使得难以检测特定靶标。dna和rna两者的使用使可用靶标的量最大化,同时还利用每种类型的核酸的独特特性。例如,dna保存关于突变(包括单核苷酸变体(snv)和拷贝数变异(cnv))的信息。另外,源自dna的信息可以是定量的,即不仅反映突变的类型而且反映肿瘤样品中的突变负荷。相比之下,rna提供关于突变的定性信息,因为不同的表达水平掩盖基因组中的突变负荷。同时,基因转录放大来自稀有突变事件的信号,使其更容易检测。rna的分析对于检测来自两个融合配偶体的野生型dna序列的背景中的基因融合体特别有用。
在一些实施方案中,本发明包括专门应用于rna的引物延伸靶标富集(pete)的方法。通常描述地,所述方法包括rna分子的逆转录,随后为引物延伸靶标富集。引物延伸靶标富集的实例先前已经由本发明人描述于2016年6月1日提交的美国临时申请系列号62/344,330,2016年7月12日提交的美国临时申请系列号62/361,426和2016年8月4日提交的美国申请系列号15/228,806。
在一些实施方案中,本发明包括应用于未分离的rna和dna的混合物的引物延伸靶标富集的方法。在一些实施方案中,所述混合物包含总rna和基因组dna,即,在最少处理的情况下从样品分离的核酸。通常描述地,所述方法包括rna分子的逆转录,同时dna分子被动地存在,随后为应用于基因组dna分子和cdna分子两者的引物延伸靶标富集。
在一些实施方案中,本发明包括中间纯化步骤。在一些实施方案中,用外切核酸酶除去未使用的单一dna和rna链。在一些实施方案中,除去未使用的引物和衔接子,例如通过选自凝胶电泳、亲和色谱和大小排阻色谱的大小选择方法。在一些实施方案中,可以使用来自beckmancoulter(brea,cal.)的固相可逆固定化(spri)技术进行大小选择。
在一些实施方案中,dna聚合酶是热稳定聚合酶。在一些实施方案中,进行引物延伸步骤的相同聚合酶可用于pcr扩增中。在一些实施方案中,所述dna聚合酶具有热启动能力。所述热启动能力包括经由选自抗体相互作用、化学修饰或适体相互作用的机制在环境温度下抑制聚合酶。
在图1-2中更详细地呈现本发明。图1描绘本发明的示例性工作流程。从样品分离总核酸。在第一步骤中,rna经历逆转录,而dna保持双链。用rna酶h除去rna后,仅剩下cdna链。变性后,引物延伸可以在dna靶标上发生。接下来,将dna衍生的和rna衍生的引物延伸产物经受引物延伸靶标富集(pete)程序和测序。
图2描绘本发明的示例性工作流程,其中详细显示pete步骤。首先,逆转录步骤从rna链生成cdna。接下来,具有uid的靶标特异性引物与cdna链和变性的基因组dna链两者退火。部分单链衔接子具有mid、通用引物位点和可以与样品中存在的靶标特异性引物的5'-部分退火的序列。所得复合物的一条链含有可用连接酶密封的切口。第二种靶标特异性引物用于引入第二通用引物位点。可以用通用引物扩增引物延伸产物。
现在转到图4,用于通过单探针引物延伸的靶标富集的方法100包括引物杂交的步骤102,其中第一引物与样品中存在的核酸杂交。在一个方面,所述第一引物是靶标特异性引物。靶标特异性引物的一个实例是基因特异性引物,其经设计为与目标基因(例如,cdna、基因组dna)杂交或在其附近(例如,其上游或5'侧)杂交。所述样品中的核酸可以是rna、dna或其组合。所述引物可以是由核糖核酸、脱氧核糖核酸、修饰的核酸(例如,生物素化的,锁核酸,肌苷,seela碱基等)或本领域中已知的其他核酸类似物构成的寡核苷酸引物。
继续参考图4,步骤102随后为通过聚合酶的引物延伸的步骤104。在一个方面,在第一引物与核酸模板杂交后,第一引物被聚合酶延伸,由此生成包括3'区域的第一引物延伸产物,所述3'区域包含核酸模板的反向互补物。如本文所述,步骤102和步骤104任选地同时实施,而在其他实施方案中,步骤102和步骤104分开(例如,依次)进行。因此,在所公开方法的一些实施方案中,将步骤102和步骤104组合成单个步骤102'。
方法100进一步包括延伸终止的步骤106,以控制在步骤104(或步骤102')中合成的第一引物延伸产物的长度。值得注意的是,所述第一引物延伸产物的长度可以通过技术诸如使步骤104中添加的聚合酶失活的技术主动地控制,或者通过使得反应能够完成诸如通过消耗限制性反应物或通过在进行方法100的步骤之前使核酸模板片段化来被动地控制。
在一个方面,方法100可以进一步包括一个或多个纯化步骤。在举例说明的实施方案中,方法100包括在第一引物延伸步骤104和延伸终止步骤106后的第一纯化步骤108(即,纯化1)。步骤108可以包括用于从反应组分诸如未使用的引物分子、用于产生引物延伸产物的模板核酸分子等纯化第一引物延伸产物的任何合适方法。在一些实施方案中,步骤108包括酶促消化、基于大小排阻的纯化、基于亲和力的纯化等或其组合。
方法100进一步包括衔接子连接的步骤110。衔接子可以具有任何合适的组成,包括但不限于,均聚物尾部、通用引发位点、样品标识符或分子标识符(mid)、独特标识符(uid)或条形码等及其组合。如本文所述,连接衔接子的确切模式是不重要的,只要所述衔接子变得与引物延伸产物缔合并且能够实现下面描述的后续步骤。在一个方面,具有通用引发位点的衔接子可以通过本领域可用的任何单链连接方法添加至所述第一引物延伸产物的一个或两个末端。
方法100可以进一步包括任选的第二引物延伸步骤112。例如,具有游离3'-末端的连接的衔接子可以通过聚合酶朝向所述第一引物延伸产物的5'末端延伸以产生双链核酸产物。也可以使用相对于所述第一靶标特异性引物在相反方向上的第二靶标特异性引物(图5)。其后,方法100可以包括在衔接子连接步骤110和任选第二引物延伸步骤112后的第二纯化步骤114(即,纯化2)。所述第二纯化步骤114可用于除去反应组分,诸如未使用的衔接子分子等。因此,通过任何合适的纯化方法将步骤110的未连接的衔接子和副产物与衔接子连接的第一(或第二)延伸产物分离。
方法100进一步包括扩增的步骤116。步骤116可以涉及线性或指数扩增(例如,pcr)。通常,步骤116包括第一(或第二)衔接子连接的引物延伸产物的扩增。在一些实施方案中,所述引物是通用引物,其可以支持其中已经引入通用引物结合位点的一条或两条链(即,对应于扩增反应的模板的双链核酸的顶部和底部链两者)的合成。
在扩增的步骤116之后,方法100可以包括测序的步骤118。步骤116可以包括用于测定方法100的一种或多种产物的核酸序列的任何方法。步骤116可以进一步包括序列比对,序列变异的鉴定,独特引物延伸产物的计数等,或其组合。在一些实施方案中,在测序118前进行额外的纯化步骤。
实施例
实施例1.已知的融合靶标的检测
在本实施例中,使用已知表达5种临床相关融合基因的3种细胞系评价测定的灵敏度。设计了靶向包含24种alk、11种ret和15种ros1的rna融合体组的一组引物(探针)(表1)。
表1.组中的融合体
该组覆盖总共61种靶标(49种融合体、10种野生型基因和2种持家基因),其使用10种探针用于逆转录和42种探针用于第二延伸步骤。使用rnapete工作流程(图1和2)创建的文库在illuminamiseq仪器上测序。检测据报道存在于原始细胞系中的所有5种融合体。每种融合癌基因的重复深度(dedupeddepth)(基于独特的分子id计数计算)与它们在细胞系中的表达水平相关。
在该实验的逆转录步骤中,将样品核酸与引物混合并在40℃孵育。根据制造商的说明书,该反应进一步包括dntp、dtt、rna酶抑制剂和superscript®iii逆转录酶(thermofisherscientific,waltham,mass.)。使用ampure珠粒(beckmancoulter,brea,cal.)纯化样品中的引物延伸产物。使用t7连接酶在25℃下连接衔接子5分钟。使用ampure珠粒纯化样品中的连接产物。根据制造商的说明书,在硫酸铵存在的情况下使用phusion®dna聚合酶(thermofisherscientific)进行dna引物延伸。延伸在热循环仪中进行15个循环。使用ampure珠粒纯化样品中的引物延伸产物。
使用phusion®dna聚合酶用通用引物经由28个循环的pcr扩增最终的pete产物。使用ampure珠粒纯化扩增产物。成功的rnapete的结果显示在图3上。
实施例2:外切核酸酶i取代spri珠粒清洁
外切核酸酶i是催化以3'至5'方向从单链dna除去核苷酸的酶。在本公开的上下文中,在用于下游工作流程的制备中可以包括外切核酸酶i处理步骤作为纯化步骤以降解过量的单链引物寡核苷酸。在一个方面,除了替代纯化步骤(例如,图4的步骤108)之外或代替替代纯化步骤(例如,图4的步骤108),使用外切核酸酶i处理。替代纯化方法的实例可以包括基于固相可逆固定化(spri)珠粒的纯化方法,基于柱的清洁方法,乙醇沉淀方法等。在第一引物延伸步骤(例如,图4的步骤104)后和在衔接子连接步骤(例如,图4的步骤110)前使用外切核酸酶i用于除去过量引物寡核苷酸已被证明表现出与用于除去过量引物寡核苷酸的spri珠粒纯化相比类似的结果。此外,通过与依赖于spri珠粒纯化步骤的工作流程相比减少手动操作时间的总量,外切核酸酶i的使用可以简化本公开的方法。
实施例3:在单个反应步骤中pe2和通用引物扩增的组合
在一些实施方案中,根据本公开的方法包括第二靶标特异性引物延伸步骤,随后依次为通用引物扩增步骤。如图4和5中所举例说明,在衔接子连接步骤110和相关的反应纯化步骤后,方法可以包括用靶标特异性引物的第二引物延伸步骤112和用通用引物的扩增步骤116。第二引物延伸步骤112和扩增步骤116可以组合成单个步骤112'(例如,两个步骤可以在单个反应容器中进行,而不需要中间清洁步骤、独特的反应条件等或其组合)。在实施组合的方法步骤112'的情况下,可以省略第二纯化步骤114作为方法100的步骤112和步骤114之间的中间步骤。图5进一步示意性地举例说明图3的方法100的一个实施方案的步骤,包括组合的步骤112'。使用图4和5中举例说明的组合方法,证明反向靶标特异性引物可以与通用引物组合,其结果与包括依次的引物延伸和扩增步骤的方法相当。除了由于总步骤数量减少而简化的工作流程之外,引物延伸和通用扩增的组合步骤的一个优点是整个工作流程时间的减少。引物延伸和通用扩增的组合步骤的热循环概况的一个实例显示于表2中。
表2.用于组合的扩增和引物延伸的热循环概况
实施例4:使用具有“热启动”能力的热稳定聚合酶
根据本公开,热不稳定聚合酶(例如,bst聚合酶)用于第一引物延伸步骤(例如,图4的步骤104)中。当使用热不稳定聚合酶时,在变性后的引物杂交步骤(例如,图4的步骤102)期间将聚合酶添加至反应混合物中可能是有用的。在其他实施方案中,使用热稳定聚合酶代替热不稳定聚合酶。已经证明使用热稳定聚合酶使得能够在给定靶核酸双链体变性前将聚合酶添加至扩增或延伸反应混合物中。
实施例5:衔接子修饰
如本文所述,衔接子可以包括双链区域和与连接位点互补的单链突出端,如图2中且更详细地图6和图7中所示。所述组合物包括引物延伸产物200,其具有5'靶标特异性引物区域202和3'延伸的区域204。所述组合物进一步包括具有双链区域208和单链3'-突出端210的第一衔接子206,和具有双链区域214和单链5'-突出端216的第二衔接子212。第二衔接子212的单链5'-突出端216与靶标特异性引物区域202的5'末端的退火导致第二衔接子212的双链区域214和引物区域202的5'末端之间的间隙218。当间隙218是切口(即,引物区域202的5'末端和双链区域214的相邻3'末端之间存在零核苷酸间距)时,可以通过dna连接酶或另一种酶或可以催化引物区域202的3'-oh和第二衔接子212的5'-磷酸酯之间的反应的非酶试剂在间隙218处连接两条链。第一衔接子206可以类似地退火并连接(例如,通过切口修复)至延伸区域204的3'末端。
根据本公开,已经发现减少衔接子的双链部分的核苷酸的总长度可以减少下游扩增反应中不需要的副产物(例如引物二聚体)的形成。如图7中进一步举例说明,通用衔接子212a包括双链区域214a和被设计为与引物区域202的5'-末端退火的单链5'-突出端216a。双链区域214a具有[n]i的核苷酸的总长度,其中n是衔接子核苷酸,且i是代表双链区域214a中核苷酸数目的整数。对于具有单链区域210和双链区域208的衔接子206使用类似的设计。
继续参考图7,具有双链区域214b和单链5'-突出端216b的衔接子212b举例说明衔接子212a的一个实施方案,其中n=10。具有双链区域214c和单链5'-突出端216c的衔接子212c举例说明衔接子206a的一个实施方案,其中n=15。根据本公开,通常优选地在衔接子212c上选择衔接子212b以用于本文所述的方法中。在一个方面,用于连接至引物延伸产物的衔接子具有小于10、小于9、小于8、小于7、小于6、小于5、小于4、小于3、小于2或小于1个核苷酸的双链区域。对于具有单链区域210和双链区域208的衔接子206使用类似的考量。
在另一个方面,已经发现用磷酸酯基团(或另一种类似的阻断基团)将衔接子的3'-末端阻断可以减少下游扩增反应中不需要的副产物(例如引物二聚体)的形成。此外,证明在衔接子的单链突出端的设计中包括3'磷酸酯阻断的情况下,外切核酸酶i纯化步骤和连接反应步骤可以组合于单个反应步骤中。例如,图4中的方法100的步骤108(包括外切核酸酶i处理)和步骤110可以组合成单个步骤108'。在又另一个方面,证明如果在衔接子连接前进行外切核酸酶处理,则不需要外切核酸酶i的热失活。例如,在图4中的方法100的情况下,在纯化步骤108和衔接子连接步骤110之间省略外切核酸酶i的热失活可能是有用的。
实施例6:子循环
子循环是用于pcr的热循环的改进方法,其涉及具有不同退火温度的一系列循环的组合。在一个方面,在多重pcr方法期间,子循环可用于限制相对于另一个靶序列偏向于一个靶序列的扩增(例如,参见guidon.等人,2016.plosone11(6):e0156478;liuq.等人,1998.biotechniques25(6):1022-8)。当在根据本公开的第一引物延伸反应中实施时,已经显示子循环改进中靶率(图8)和均一性。中靶率被定义为与包括第一引物、插入序列和反向靶标特异性引物(其中测序读取长度覆盖它们)的预期靶标匹配的质量过滤读取值的百分比。用于第一引发事件和第二引发事件的实例子循环热循环程序分别显示于表3和4中。通过鉴定落在平均值的0.5x和2.0x之间的靶标的百分比来确定数据的均一性。在181种不同的靶标中,所述靶标中的130种(71.8%)具有在平均值的0.5x和2.0x之间的归一化深度。当作为扩增子gc含量的函数测量时,在181种不同的靶标中,所述靶标中的146种(80.7%)具有在平均值的0.5x和2.0x之间的归一化深度。
表4子循环热概况2。
在表3中,子循环包括在步骤4和5中,而在表4中,子循环包括在步骤5和6中。值得注意的是,表4表示热循环概况,其中步骤5和6的重复嵌套在步骤2-7的重复内。例如,步骤2-7的单个循环将包括以下步骤序列,顺序为:2,3,4,5,6,5,6,5,6,5,6,7。
实施例7:具有完全通用衔接子的基因特异性引物
在一个方面,用通用衔接子、索引(mid)序列或其组合生成基因特异性引物(基因sp.1、uid、mid、通用引物a)可能是有用的。参考图9,使用具有uid和mid中的一种或两种的引物使得能够在根据本公开的方法的第一引物延伸步骤期间对第一引物延伸产物进行索引,由此降低下游交叉污染(其可能导致假阳性结果)的可能性。
实施例8(预言性):引物延伸靶标富集应用于液滴数字pcr(ddpcr)。
液滴数字pcr(ddpcr)是一种基于水-油乳液液滴技术进行数字pcr的方法。将样品分级分离成数千个液滴,并且在每个单独的液滴中发生模板分子的pcr扩增。参考图10,根据本公开的方法可以针对应用于ddpcr进行调整。在一个方面,可用于ddpcr的引物(例如,反向引物和通用引物)可以与第一引物延伸产物和外切核酸酶i组合。值得注意的是,根据本公开的通过引物延伸的靶标富集具有高度多重扩增子生成用于下一代测序的能力。此外,所述方法可以应用以使得能够当在ddpcr中与靶标特异性taqman探针一起使用时计数靶标核酸。
尽管已经关于具体实施例详细描述了本发明,但对本领域技术人员显而易见的是,可以在本发明的范围内进行各种修改。因此,本发明的范围不应由本文所述的实施例、但应由下面呈现的权利要求来限定。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种荧光定量PCR技术检测意大利蜜蜂王浆主蛋白MRJP 2基因表达的方法与流程
- 一种用于对不同银杏进行基因分型的SNP引物及检测方法与流程
- 用于基因甲基化检测的引物和探针、采样方法、试剂盒与流程
- 一种基于荧光PCR检测ESR1基因突变的引物及探针的制造方法与工艺
- 转基因甜菜GTSB77品系特异性实时荧光PCR检测引物、探针、方法和试剂盒与流程
- 一种基于单核苷酸多态性的葡萄球菌种水平鉴定和菌株分型一体化方法与流程
- 一套毛花猕猴桃和中华猕猴桃物种间杂交子代的鉴定引物的制造方法与工艺
- 检测黄杉大小蠹的引物、试剂盒及检测方法与流程
- 环介导等温扩增技术检测铜绿假单胞菌的引物和试剂盒的制造方法与工艺
- 一种用于鉴定浙贝母的引物对及其应用的制造方法与工艺