靶向干细胞因子及半乳糖凝集素-1的双重靶向抗体及其用途的制作方法
本发明涉及靶向干细胞因子(scf,stemcellfactor)及半乳糖凝集素-1(galectin-1)的双重靶向抗体及包含其的用于预防或治疗血管生成相关疾病的组合物。
背景技术:
已知,干细胞因子是深入参与血细胞、精子、黑色素细胞的分化的因子。已知,其主要在成纤维细胞(fibroblast)和内皮细胞(endothelialcell)中产生,通过在低氧(hypoxia)状态下增加表达及分泌来促进血管生成。并且,已知,半乳糖凝集素-1作为通过在低氧状态下分泌来与调节血管生成的代表性蛋白质-血管内皮生长因子(vegf,vascularendothelialgrowthfactor)的受体结合以诱导血管生成的因子,即使抑制血管内皮生长因子,也通过作为新的配体的半乳糖凝集素-1来诱导血管。
血管生成(angiogenesis)是指通过体内的血管生成因子从已经存在的现有血管生成新的微血管。当细胞生长到一定程度时,会分泌刺激血管生成的物质,相反地,当分泌过多时,会分泌抑制其的物质。利用反馈来维持血管生成的平衡。
成人的大部分血管几乎不分裂,正常的血管生成极为罕见。异常的血管生成会导致因血管变化而增加透过性从而导致出血的疾病。例如,产生老年性黄斑变性(age-relatedmaculardegeneration)、糖尿病性视网膜病症(diabeticretinopathy)、脉络膜血管生成(choroidalneovascularization)、青光眼性视网膜色素变性(glaucomaretinitispigmentosa)、早产儿视网膜病变(retinopathyofprematurity)、青光眼(glaucoma)、角膜营养不良症(cornealdystrophy)、视网膜劈裂症(retinoschises)、类风湿性关节炎(rheumatoidarthritis)、银屑病(psoriasis)、肿瘤转移(metastasis)、伤口治愈延迟(delayedwoundhealing)等疾病。
尤其,在上述疾病中,在角膜中的新生血管的生成抑制眼球的透明性从而带来视力损害,视网膜中的新生血管的生成由于异常血管的生成产生血液渗出并通过视网膜细胞的变形来导致失明。因此,眼内的血管生成并非好现象,优选被最大限度地抑制,像这样,由异常的血管生成引起的疾病只有抑制新生血管才能够提高该疾病的治疗效果。
由于这些原因,正在进行关于利用血管生成抑制剂来治疗血管生成相关疾病的研究,并发现了参与血管内皮细胞的生长、移动、分化、毛细血管形成等的血管形成过程的许多血管生成促进因子和血管生成抑制因子。血管生成抑制因子被激活以抵抗血管生成时所需的血管生成促进因子的活性。天然存在于体内的血管生成抑制剂毒性小,可用于抑制病理性血管生成,因此正在开发与此相关的许多药物。
本发明人为了寻找血管生成相关疾病的治疗物质而付出诸多努力的结果,确认了干细胞因子及半乳糖凝集素-1促进血管生成,相反地,在抑制干细胞因子及半乳糖凝集素-1的表达的情况下,新生血管的表达被抑制,并通过制备能够同时中和干细胞因子及半乳糖凝集素-1的双重靶向抗体来完成了本发明。
技术实现要素:
技术问题
本发明的目的在于,提供与干细胞因子及半乳糖凝集素-1特异性结合的双重靶向抗体。
本发明的另一目的在于,提供编码与干细胞因子及半乳糖凝集素-1特异性结合的双重靶向抗体的dna。
本发明的再一目的在于,提供用于预防或治疗血管生成相关疾病的药学组合物,上述药学组合物包含与上述干细胞因子及半乳糖凝集素-1特异性结合的双重靶向抗体。
本发明的又一目的在于,提供血管生成相关疾病的预防或治疗方法,上述方法包括向需要其的个体给药与上述干细胞因子及半乳糖凝集素-1特异性结合的双重靶向抗体的步骤。
本发明的又一目的在于,提供包含与干细胞因子及半乳糖凝集素-1特异性结合的双重靶向抗体的用于同时检测干细胞因子及半乳糖凝集素-1的组合物。
解决问题的手段
为了实现上述目的,本发明提供与干细胞因子及半乳糖凝集素-1特异性结合的双重靶向抗体,上述双重靶向抗体的特征在于,包含:轻链可变区域,包含由序列1的氨基酸序列表示的轻链cdr1、由序列2的氨基酸序列表示的轻链cdr2、及由序列3的氨基酸序列表示的轻链cdr3;以及重链可变区域,包含由序列4的氨基酸序列表示的重链cdr1、由序列5的氨基酸序列表示的重链cdr2、及由序列6的氨基酸序列表示的重链cdr3。
并且,本发明提供编码双重靶向抗体的dna,上述双重靶向抗体与干细胞因子及半乳糖凝集素-1特异性结合,上述编码双重靶向抗体的dna的特征在于,包含:编码轻链可变区域的dna,上述轻链可变区域包含分别编码由序列1表示的轻链cdr1、由序列2表示的轻链cdr2、及由序列3表示的轻链cdr3的序列10、序列11及序列12的碱基序列;以及编码重链可变区域的dna,上述重链可变区域包含分别编码由序列4表示的重链cdr1、由序列5表示的重链cdr2、及由序列6表示的重链cdr3的序列13、序列14及序列15的碱基序列。
并且,本发明提供包含上述dna的载体及由上述载体转化而得的细胞。
并且,本发明提供包含上述与干细胞因子及半乳糖凝集素-1特异性结合的双重靶向抗体的用于预防或治疗血管生成相关疾病的药学组合物。
并且,本发明提供血管生成相关疾病的预防或治疗方法,上述血管生成相关疾病的预防或治疗方法包括向需要其的个体给药与干细胞因子及半乳糖凝集素-1特异性结合的双重靶向抗体的步骤。
并且,本发明提供包含与干细胞因子及半乳糖凝集素-1特异性结合的双重靶向抗体的用于同时检测干细胞因子及半乳糖凝集素-1的组合物。
发明的效果
本发明提供源自人单克隆抗体的双重靶向抗体及包含上述抗体的用于预防或治疗血管生成相关疾病的药学组合物,上述双重靶向抗体同时中和参与新生血管的形成的干细胞因子及半乳糖凝集素-1从而能够有效抑制新生血管的生成。根据本发明的双重靶向抗体同时中和参与新生血管形成的两种靶标,从而可以有效预防或治疗血管生成相关疾病,上述血管生成相关疾病因异常血管生成而使血管变化并增加透过性,从而导致出血。
附图说明
图1为示出通过酶免疫检测法选择的共9种单克隆抗体3c6、3a2、3c3、3a4、3e7、3c8、3c4、3f7以及3f3的图。
图2为示出本发明的通过在血管内皮细胞(huvec)处理共9种单克隆抗体来确认各抗体的血管内皮细胞的管形成的抑制能力的图。
图3为示出在1%的琼脂糖凝胶中电泳通过聚合酶链式反应(pcr)扩增的3c4抗体的可变区中的轻链结构域的dna的结果的图。
图4为示出在1%的琼脂糖凝胶中电泳通过聚合酶链式反应扩增的3c4抗体的可变区中的重链结构域的dna的结果的图。
图5为示出3c4抗体轻链区的碱基序列、氨基酸序列及其互补决定区(cdr)的图。
图6为示出3c4抗体重链区的碱基序列、氨基酸序列及其互补决定区的图。
图7为示出在对动物细胞株中表达的人3c4抗体进行分离纯化后,进行聚丙烯酰胺凝胶电泳(sds-page)分析的结果的图。
图8为示出为了确认本发明的人3c4抗体的干细胞因子结合能力而实施表面等离子共振(spr)的结果的图。
图9为示出对本发明的人3c4抗体的血管内皮细胞的管形成抑制能力进行确认的图。
图10为示出本发明的人3c4抗体的c-kit(干细胞因子受体)磷酸化抑制效能分析结果的图。
图11为示出本发明的对利用人3c4抗体的蛋白质微列阵分析结果的图。
图12为示出在大肠杆菌中过表达人半乳糖凝集素-1基因后的分离纯化结果的图。
图13为示出本发明的为了确认人3c4抗体的半乳糖凝集素-1结合能力而实施表面等离子共振(spr)的结果的图。
图14为示出本发明的对人3c4抗体的血管内皮细胞的管形成抑制能力进行确认的图。
图15为示出本发明的对人3c4抗体的基于半乳糖凝集素-1(a)及干细胞因子(b)的细胞增殖抑制能力进行确认的图。
图16为示出本发明的确认各抗体的血管内皮细胞的管形成抑制能力以比较人3c4抗体和市售中的干细胞因子抗体的中和能力的图。
具体实施方式
发明的最佳实施方式
以下,对本发明进行详细说明。
在本发明中,没有另外定义的术语具有在本发明所属领域中通常使用的含义。
本发明人率先制备了在血管生成相关疾病中抑制新生血管的生成以有效预防或治疗上述疾病的双重靶向抗体。
上述双重靶向抗体能够同时抑制或扩增两个信号,因此与抑制/扩增一个信号的情况相比更有效,与用各个信号抑制剂处理各个信号的情况相比,具有可以低剂量给药并可以在同一时间及空间中抑制/扩增两个信号的优点。
在本发明中,双重靶向抗体可为“多克隆”或“单克隆”抗体,但更优选为单克隆抗体。单克隆抗体指实际上从匀质的抗体群体中获得的抗体,即,构成这样的群体的各个抗体是相同的,除了能够少量存在的天然突变外。单克隆抗体对单一抗原性部位具有高度特异性。尤其,与包含对不同抗原表位的不同抗体的多克隆抗体相反,各个单克隆抗体被抗原上的单个抗原表位诱导。单克隆不应被解释为必须通过任意特定方法来生成抗体。例如,用于本发明的单克隆抗体可以通过文献[kohleretal.,nature,256:495(1975)]中记载的方法来制备,也可以通过重组dna的方法(参照美国专利第4,816,567号)来制备。并且,单克隆抗体也可以使用如文献[clacksonetal.,nature,352:624-628(1991);marksetal.,j.mol.biol.,222:581-597(1991)]中记载的技术从噬菌体抗体文库中分离出来。
作为一实施方式,本发明提供与干细胞因子及半乳糖凝集素-1特异性结合的双重靶向抗体,上述双重靶向抗体的特征在于,包含:轻链可变区域,包含由序列1的氨基酸序列表示的轻链cdr1、由序列2的氨基酸序列表示的轻链cdr2、及由序列3的氨基酸序列表示的轻链cdr3;以及重链可变区域,包含由序列4的氨基酸序列表示的重链cdr1、由序列5的氨基酸序列表示的重链cdr2、及由序列6的氨基酸序列表示的重链cdr3。
在本发明中,术语“抗体(antibody)”不仅包含完整的抗体形式,还包括抗体分子的抗原结合片段。
完整的抗体为具有两个全长的轻链及两个全长的重链的结构,各个轻链通过二硫键结合与重链连接。重链的恒定区域具有γ、μ、α、δ以及ε型,作为子类具有γ1、γ2、γ3、γ4、α1以及α2。轻链的恒定区域具有κ以及λ型(cellularandmolecularimmunology,wonsiewicz,m.j.,ed.,chapter45,pp.41-50,w.b.saundersco.philadelphia,pa(1991);nisonoff,a.,introductiontomolecularimmunology,2nded.,chapter4,pp.45-65,sinauerassociates,inc.,sunderland,ma(1984))。
在本说明书中,术语“抗原结合片段”指保留抗原结合功能的片段,其包括fab、f(ab')、f(ab')2以及fv等。在抗体片段中,fab具有一个抗原结合部位,以作为具有轻链及重链的可变区域和轻链的恒定区域以及重链的第一个恒定区域(ch1)的结构。fab'与fab的不同之处在于,fab'在在重链ch1结构域的c-末端具有包含一个以上的半胱氨酸残基的铰链区域(hingeregion)。f(ab')2抗体通过fab'的铰链区域的半胱氨酸残基形成二硫键结合来生成。fv为仅具有重链可变区及轻链可变区的最小抗体片段,在双链fv(two-chainfv)中,重链可变区和轻链可变区非共价键连接,在单链fv(single-chainfv)中,重链的可变区和单链的可变区通过肽键共价键连接或者直接在c-末端连接,形成双链fv等的二聚物等结构。这样的抗体片段可使用蛋白质水解酶来获得(例如,若用木瓜蛋白酶限制性切断整个抗体,则可以获得fab,而用胃蛋白酶切割,则可以获得f(ab')2片段),或者可以通过基因重组技术来制备。
在本发明中,抗体为fab形式或完整的抗体形式。并且,重链恒定区域可选自γ、μ、α、δ以及ε中的任一同型中。轻链恒定区域可为κ或λ型,根据本发明的一实例,为κ型。
在本说明书中,术语“重链”指所有包含具有用于足以赋予抗原特异性的可变区域序列的氨基酸序列的可变区结构域vh以及包含3个恒定区结构域ch1、ch2及ch3的全长重链及其片段。并且,在本说明书中,术语“轻链”指所有包含具有用于足以赋予抗原特异性的可变区域序列的氨基酸序列的可变区结构域vl以及包含恒定区结构域cl的全长的轻链及其片段。
在本说明书中,术语“cdr(complementaritydeterminingregion)”指免疫球蛋白重链及轻链的超变区(hypervariableregion)的氨基酸序列(kabatetal.,sequencesofproteinsofimmunologicalinterest,4thed.,u.s.departmentofhealthandhumanservices,nationalinstitutesofhealth(1987))。重链及轻链分别包含3个cdr(重链包含cdrh1、cdrh2以及cdrh3以及轻链包含cdrl1、cdrl2以及cdrl3)。cdr作为参与识别抗原的环形状的部位,并且作为重要部位,为抗体提供了主要的接触残基使其与抗原或表位结合,从而根据该部位序列的改变来确定抗体对抗原的特异性。
在本发明中,术语“构架区(fr,frameworkregion)”作为构成抗体的可变区域的组分,指位于上述cdr之间以支撑cdr的环结构的部位。
在本发明中,“与干细胞因子(scf)及半乳糖凝集素-1(galectin-1)特异性结合的双重靶向抗体”可以与“抗-干细胞因子抗体”或“双重靶向抗体”互换使用。
在本发明中,上述抗体可包含由序列7的氨基酸序列表示的轻链可变区域或由序列8的氨基酸序列表示的重链可变区域。
并且,在本发明中,上述抗体的特征在于可由序列9的氨基酸序列表示。
本发明的双重靶向抗体或其抗原结合片段可以包含在能够特异性识别干细胞因子及半乳糖凝集素-1的范围内的所附序列表中记载的氨基酸序列的变异体。例如,可以改变抗体的氨基酸序列以改善抗体的结合亲和力和/或生物学特性。这些变形包括例如抗体氨基酸序列残基的缺失、插入和/或取代。
这样的氨基酸变异基于氨基酸侧链取代体的疏水性、亲水性、电荷、大小等的相似性来实现。通过分析氨基酸侧链取代体的大小、形状及种类可知:精氨酸、赖氨酸及组氨酸为带有正电荷的残基;丙氨酸、甘氨酸及丝氨酸大小相似;以及苯丙氨酸、色氨酸及酪氨酸具有相似的形状。因此,基于这种考虑,精氨酸、赖氨酸及组氨酸;丙氨酸、甘氨酸及丝氨酸;苯丙氨酸、色氨酸及酪氨酸在生物学上可以是功能等同物。
在引入变异方面,可以考虑氨基酸的亲水指数(hydropathicindex)。根据亲水性和电荷,下列各个氨基酸被赋予亲水指数:异白氨酸(+4.5)、缬氨酸(+4.2)、亮氨酸(+3.8)、苯丙氨酸(+2.8)、半胱氨酸(cystaine)(+2.5)、甲硫氨酸(+1.9)、丙氨酸(+1.8)、甘氨酸(-0.4)、苏氨酸(-0.7)、丝氨酸(-0.8)、色氨酸(-0.9)、酪氨酸(-1.3)、脯氨酸(-1.6)、组氨酸(-3.2)、谷氨酸盐(-3.5)、谷氨酰胺(-3.5)、天冬氨酸(-3.5)、天冬酰胺(-3.5)、赖氨酸(-3.9)以及精氨酸(-4.5)。
氨基酸的亲水指数对于赋予蛋白质的相互性生物功能(interactivebiologicalfunction)非常重要。众所周知,只有用具有相似亲水指数的氨基酸取代,才可以保留相似的生物活性。在参照亲水指数引如变异的情况下,优选地,在表现出±2以内的差的氨基酸之间进行取代,更优选地,在表现出±1以内的差的氨基酸之间进行取代,更进一步优选地,在表现出±0.5以内的差的氨基酸之间进行取代。
另外,众所周知,具有相似亲水值(hydrophilicityvalue)的氨基酸之间的取代可导致具有同等生物活性的蛋白质,下列各氨基酸残基被赋予如下的亲水值:精氨酸(+3.0)、赖氨酸(+3.0)、天冬氨酸(+3.0±1)、谷氨酸盐(+3.0±1)、丝氨酸(+0.3)、天冬酰胺(+0.2)、谷氨酰胺(+0.2)、甘氨酸(0)、苏氨酸(-0.4)、脯氨酸(-0.5±1)、丙氨酸(-0.5)、组氨酸(-0.5)、半胱氨酸(-1.0)、甲硫氨酸(-1.3)、缬氨酸(-1.5)、亮氨酸(-1.8)、异白氨酸(-1.8)、酪氨酸(-2.3)、苯丙氨酸(-2.5)、色氨酸(-3.4)。
在参照亲水值引入变异的情况下,优选地,在表现出±2以内的差的氨基酸之间取代,更优选地,在表现出±1以内的差的氨基酸之间取代,更进一步优选地,在表现出±0.5以内的差的氨基酸之间进行取代。
并且,不改变分子的整体活性的蛋白质中的氨基酸交换已为本领域所公知(h.neurath,r.l.hill,theproteins,academicpress,newyork,1979)。最常见的交换为氨基酸残基ala/ser、val/ile、asp/glu、thr/ser、ala/gly、ala/thr、ser/asn、ala/val、ser/gly、thy/phe、ala/pro、lys/arg、asp/asn、leu/ile、leu/val、ala/glu、asp/gly之间的交换。
并且,在本发明中,本发明的与干细胞因子及半乳糖凝集素-1特异性结合的双重靶向抗体的特征在于,可以包含来源于人igg1的恒定区域。根据本发明的一实例,本发明提供作为双重靶向抗体的3c4抗体,上述3c4抗体除了上述轻链可变区及重链可变区之外还包含来源于人igg1的恒定区域。
本发明的双重靶向抗体优选为“人源化抗体”。人源化抗体是指通过改变具有非人互补决定区(cdr)的抗体序列来由其一部分或整体由从人抗体种系(germline)诱导的氨基酸序列组成的抗体。更优选地,本发明的抗体可为“人抗体”。在本发明中,术语“人抗体(humanantibody)”在广义上指包含来源于人免疫球蛋白的可变区域(cdr及fr)的抗体,在狭义上指包含来源于人免疫球蛋白的可变区域及恒定区域(constantregion)的抗体。上述人抗体不仅包含整体抗体(whole)的形态,还可包含抗体分子的功能性片段。人抗体可使用本领域公知的各种技术制备。
与现有的人源化抗体或鼠抗体相比,由于上述人抗体的所有组分均来源于人,因此发生免疫化反应的概率低,当向人给药时,具有不出现意外免疫反应的优点,从而可非常有用地用作以人为对象的治疗用抗体。
根据本发明的目的,上述人抗体可以被认为是与本发明的与干细胞因子及半乳糖凝集素-1特异性结合的双重靶向抗体,上述人抗体也可以被认为进行如下功能:通过与干细胞因子及半乳糖凝集素-1特异性结合来显著阻碍因干细胞因子及半乳糖凝集素-1诱导的新生血管的表达,但不特别限于此。
同时,上述人抗体不特别限于此,但可以被糖基化(glycosylation)和/或聚乙二醇化(pegylation)以增加在给药的活体内滞留时间。
本发明的术语“糖基化(glycosylation)”是指将糖基转移至蛋白质的加工方法。上述糖基化是通过糖基转移酶使糖基与靶蛋白的丝氨酸、苏氨酸、天冬酰胺或羟赖氨酸残基结合而进行,上述糖基化蛋白不仅可以用作活体组织的成分,还可以在细胞表面的细胞识别中起到重要作用。因此,在本发明中,可以通过人抗体的糖基化或改变上述糖基化的模式来提高人抗体的效果。
本发明的术语“聚乙二醇化(peglation)”是指通过将聚乙二醇引入上述人抗体来提高在上述人抗体的血中的滞留时间的加工方法(annam.wu,etal.,naturebiotechnology,23(9):1137-1146,2005;davidschrama,etal.,drugdiscovery,5:147-159,2006;alainbeck,etal.,immunology,10:345-352,2010)。具体地,通过用聚乙二醇将高分子纳米粒子聚乙二醇化,来增加纳米粒子的表面亲水性,并可通过所谓隐身效果(stealtheffect)来防止体内的快速分解,上述隐身效果是指防止被包含用于捕食和消化病原体、废物及外来物质的人体中的巨噬细胞(macrophage)等的免疫功能识别。因此,可通过上述聚乙二醇化来提高人抗体在血中的滞留时间。在本发明中使用的聚乙二醇化可通过将透明质酸的羧基与聚乙二醇的氨基的结合来形成酰胺的方法形成。但不限于此,还可以通过各种方法来进行聚乙二醇化。此时,所使用的聚乙二醇不特别限于此,优选地,使用分子量为100~1000且具有线型或分支型结构的聚乙二醇。
上述糖基化和/或聚乙二醇化可通过维持本发明的抗体功能的一种本领域公知的方法来使各种糖基化和/或聚乙二醇化模式变形,本发明的人抗体包含所有各种糖基化和/或聚乙二醇化模式变形的变异人抗体。
并且,本发明提供与干细胞因子及半乳糖凝集素-1特异性结合的双重靶向抗体,上述双重靶向抗体的特征在于,包含:轻链可变区域,包含由序列1的氨基酸序列表示的轻链cdr1、由序列2的氨基酸序列表示的轻链cdr2、及由序列3的氨基酸序列表示的轻链cdr3;以及重链可变区域,包含由序列4的氨基酸序列表示的重链cdr1、由序列5的氨基酸序列表示的重链cdr2、及由序列6的氨基酸序列表示的重链cdr3。
本发明的特征在于,编码上述轻链可变区域的dna可由序列16表示。
并且,本发明的特征在于,编码上述重链可变区域的dna可由序列17表示。
并且,本发明的特征在于,上述编码双重靶向抗体的dna可由序列18表示。
考虑到具有上述生物学同等活性的变异,本发明的抗体或对其进行编码的核酸分子解释为还包括与序列表中所记载的序列显示出实质同一性(substantialidentity)的序列。上述的实质同一性指如下的序列:在尽可能使上述本发明的序列和任意其他序列相对应地排列(align)并利用本领域常用算法分析排列的序列的情况下,显示出最少61%的相同性,更优选地,显示出70%的相同性,更进一步优选地,显示出80%的相同性,最优选地,显示出90%的相同性的序列。用于序列比较的排列(alignment)方法是本领域公知的。
在本说明书中,术语“核酸分子”是指涵盖性地包含dna(gdna以及cdna)以及rna分子的意思,并且作为核酸分子的基本组成单元的核苷酸不仅包含天然核苷酸,还包含糖或碱基部位变形的类似物(analogue)。本发明的上述编码重链可变区域及轻链可变区域的核酸分子序列可以变形。上述变形包括核苷酸的添加、缺失或非保守性取代或保守性取代。
编码本发明的双重靶向抗体的本发明的核酸分子应解释为还包括与上述核苷酸序列显示出实质同一性的核苷酸序列。上述实质同一性指如下的核苷酸序列:在尽可能使上述本发明的核苷酸序列和任意其他序列相对应地排列并利用本领域常用算法分析排列的序列的情况下,显示出80%、90%或95%的相同性的核苷酸序列。
并且,本发明提供包含上述dna的载体及由上述载体转化而得的细胞。
在本说明书中,术语“载体”作为在宿主细胞中表达目的基因的手段,包含质粒载体;粘粒载体;以及噬菌体载体、腺病毒载体、逆转录病毒载体及腺相关病毒载体等的病毒载体等。
在本发明的载体中,编码双重靶向抗体的dna可以与启动子可操作地连接(operativelylinked)。
在本说明书中,术语“操作地连接”指核酸表达调节序列(例如,启动子、或转录调节因子结合位点的阵列)与其他核酸序列之间的功能性结合,由此,上述调节序列调节上述其他核酸序列的转录和/或翻译。
本发明的重组载体系统可通过本领域公知的各种方法来构建,可作为典型的用于克隆的载体或用于表达的载体来构建。并且,本发明的载体可将原核细胞或真核细胞作为宿主来构建。
另外,本发明的表达载体作为选择标识,可包含本领域常用抗生素抗性基因,上述抗生素抗性基因可以是选自氨苄青霉素、庆大霉素、羧苄青霉素、氯霉素、链霉素、卡那霉素、遗传霉素、新霉素以及四环素中的一种以上。
并且,在本发明中,上述细胞可以是细菌或动物细胞。
转化为上述载体的细胞作为可稳定且连续克隆及表达本发明的载体的宿主细胞,可利用本领域公知的任意宿主细胞。例如,上述载体合适的真核细胞宿主细胞可以是猴肾细胞7(cos7:monkeykidneycells)、nso细胞、sp2/0、中国仓鼠卵巢(cho:chinesehamsterovary)细胞、w138、幼仓鼠肾(bhk:babyhamsterkidney)细胞、狗肾传代细胞(mdck)、骨髓瘤细胞株、hut78细胞及hek-293细胞,优选地,可以是中国仓鼠卵巢细胞,但不限于此。
并且,本发明提供包含本发明的与干细胞因子及半乳糖凝集素-1特异性结合的双重靶向抗体的用于预防或治疗血管生成相关疾病的药学组合物。
由于本发明的药学组合物使用上述本发明的双重靶向抗体或其抗原结合片段作为有效成分,将省略说明这二者之间相同的内容,以避免重复说明导致本发明过度复杂。
在本发明中,上述血管生成相关疾病指由血管生成引起的疾病。本发明的血管生成相关疾病包括眼血管相关疾病、类风湿性关节炎(rheumatoidarthritis)、银屑病(psoriasis)、肿瘤(cancer)、肿瘤转移(metastasis)、伤口治愈延迟(delayedwoundhealing)、慢性炎症(chronicinflammation)、动脉硬化症(atherosclerosis)、狭窄症(stenosis)、血管畸形(vascularmalformation)、与血液透析相关的血管通路狭窄(vascularaccessdysfunctioninpatientswithhemodialysis)、移植动脉血管病(transplantarteriopathy)、血管炎(vasculitis)、迪乔治综合征(digeorgesyndrome)、遗传性出血性毛细管扩张症(hereditaryhemorrhagictelangiectasia)、海绵状血管瘤(cavernousmalformation)、瘢痕疙瘩(keloidscar)、化脓性肉芽肿(pyogenicgranuloma)、水疱疾病(blister)、卡波济氏肉瘤(kaposi'ssarcoma)、增生性玻璃体视网膜病变(proliferativevitreoretinopathy)、原发性肺动脉高压(primarypulmonaryhypertension)、哮喘(asthma)、鼻息肉(nasalpolyps)、炎症性肠病(inflammatoryboweldisease)、牙周病(periodontaldisease)、腹水(ascites)、腹膜黏连(peritonealadhesion)、子宫内膜异位症(endometriosis)、子宫出血(uterinebleeding)、卵巢囊肿(ovariancyst)、卵巢过度刺激综合征(ovarianhyperstimulationsyndrome)、滑膜炎(synovitis)、骨髓炎(osteomyelitis)、骨质增生(osteophyma)、败血症(sepsis)、传染病(infectiousdisease)及自身免疫性疾病(autoimmunedisease),优选为与眼血管相关疾病,但不一定限于此。
并且,在本发明中,上述眼血管相关疾病可以是黄斑变性(maculardegeneration)、老年性黄斑变性(age-relatedmaculardegeneration)、糖尿病性视网膜病变(diabeticretinopathy)、脉络膜新生血管性疾病(choroidalneovascularization)、青光眼性视网膜色素变性(glaucomaretinitispigmentosa)、早产儿视网膜病变(retinopathyofprematurity)、青光眼(glaucoma)、角膜营养不良症(cornealdystrophy)、视网膜劈裂症(retinoschises),优选为老年性黄斑变性或糖尿病性视网膜病变。
如以下实施例中所示,本发明的双重靶向抗体可抑制血管内皮细胞的新生血管的形成,因此有效预防或治疗血管生成相关疾病。
本发明的药学组合物中包含的药学上可接受的载体为制剂时通常使用的载体,包含乳糖、葡萄糖、蔗糖、山梨糖醇、甘露醇、淀粉、阿拉伯胶、磷酸钙、藻酸盐、明胶、硅酸钙、微晶纤维素、聚乙烯吡咯烷酮、纤维素、水、糖浆、甲基纤维素、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石、硬脂酸镁以及矿物油等,但不限于此。除了上述成分以外,本发明的药学组合物还可以包含润滑剂、湿润剂、甜味剂、香味剂、乳化剂、悬浮剂、保鲜剂等。合适的药学上可接受的载体及制剂详细记载于remington'spharmaceuticalsciences(19thed.,1995)中。
本发明的药学组合物可肠胃外给药,例如,可通过静脉内注入、皮下注入、肌肉注入、腹腔注入、局部给药、鼻内给药、肺内给药以及直肠给药等来给药。
本发明的药学组合物的合适剂量根据制剂化方法、给药方式、患者的年龄、体重、性别、疾病状态、饮食、给药时间、给药途径、排泄速度以及反应灵敏性等的因素而多样化,通常,熟练的医生可轻松决定并开出所需治疗或预防的有效剂量。例如,本发明的药学组合物的一日剂量可为0.00001~100mg/kg。本说明书中的术语“药学有效量”是指足以预防或治疗血管生成相关疾病的量。
本发明的药学组合物可根据本发明所属领域的普通技术人员容易实施的方法利用药学上可接受的载体和/或赋形剂来制剂化,从而能够以单位用量的形态制备或通过装入多容量容器内来制备。此时,剂型可以是油或水性介质中的溶液、悬浊液或乳化液形态,也可以是提取剂、散剂、栓剂、粉剂、颗粒剂、片剂或胶囊剂形态,还可以包含分散剂或稳定剂。
并且,本发明的药学组合物可以与靶向血管内皮生长因子的其他治疗剂组合或混合使用,由此可存在异常的新生血管的形成的更为有效的抑制等的协同作用。优选地,上述靶向血管内皮生长因子的治疗剂可以为阿柏西普(eylea,aafibercept)或诺适得(lucentis,ranibizumab),但不限于此。
并且,本发明提供包括向需要其的个体给药本发明的与干细胞因子及半乳糖凝集素-1特异性结合的双重靶向抗体的步骤的血管生成相关疾病的预防或治疗方法。
优选地,上述个体(subject)为包括人的哺乳动物,作为需要治疗血管生成相关疾病的患者包括所有正在治疗血管生成相关疾病的患者、接受过血管生成相关疾病治疗的患者、需要治疗血管生成相关疾病的患者,还可以包括接受过外科手术的患者以治疗血管生成相关疾病。可通过向个体给药本发明的药学组合物来缓解或治疗血管生成相关疾病。
在本说明书中,术语“缓解”是指通过给药根据本发明的药学组合物来改善或有利于使血管生成相关疾病的所有行为。上述本发明的药学组合物以药学上有效的量来给药。
在本说明书中,术语“给药”是指以适当的方法来将本发明的药学组合物导入对象,给药途径可以通过能够到达靶组织的口服或非口服等各种途径来给药。
并且,本发明的包含与干细胞因子及半乳糖凝集素-1特异性结合的双重靶向抗体的用于预防或治疗血管生成相关疾病的药学组合物可以与除此之外的现有的用于治疗血管生成相关疾病的药物或治疗方法并用以同时/依次处理。这样的给药可以是单一或多次给药。考虑到上述因素,重要的是给药无副作用且以最少的量获得最大效果的量,本领域技术人员可以容易地确定。
并且,本发明提供向需要其的个体给药本发明的与干细胞因子及半乳糖凝集素-1特异性结合的双重靶向抗体的步骤的抑制新生血管生成的方法。
具体地,上述方法涉及通过同时对干细胞因子及半乳糖凝集素-1进行中和,来阻碍由干细胞因子及半乳糖凝集素-1引起的新生血管形成的方法。上述方法可以是如下的方法:通过抑制基于干细胞因子的c-kit磷酸化且抑制作为下游(down-stream)信号传导途径的蛋白激酶b(akt)及细胞外信号调节激酶(erk)的磷酸化来有效抑制由干细胞因子及半乳糖凝集素-1诱导的血管内皮细胞的管形成。
并且,本发明提供包含根据本发明的与干细胞因子及半乳糖凝集素-1特异性结合的双重靶向抗体的用于同时检测干细胞因子及半乳糖凝集素-1的组合物以及包含上述组合物的试剂盒。
本发明的检测用组合物及试剂盒包含上述本发明的双重靶向抗体或其抗原片段,与干细胞因子及半乳糖凝集素-1特异性结合且可以同时检测。
由于本发明的检测用组合物及试剂盒包含抗体,基本上能够以各种免疫分析(immunoassay)或免疫染色(immunostaining)的方式适当制备。上述免疫分析或免疫染色包括放射免疫分析、放射免疫沉淀、免疫沉淀、酶联免疫吸附测定(elisa,enzyme-linkedimmunosorbentassay)、捕捉酶联免疫吸附测定、抑制或竞争分析、夹心分析、流式细胞术(flowcytometry)、免疫荧光染色以及免疫亲和性纯化,但不限于此。
可适用于本发明的检测用组合物及试剂盒的试样包括细胞、组织或源自组织的提取物、溶解产物(lysate)或纯化产物、血液、血浆、血清、淋巴或腹水,但不限于此。
发明的具体实施方式。
以下,通过优选实施例进行具体说明以助于理解本发明。然而,以下实施例仅用于例示本发明,而不是限制本发明。
实施例1.靶向干细胞因子及半乳糖凝集素-1的双重靶向抗体生成细胞株的制备
1-1.小鼠免疫
将50μg的购自r&dsystems的重组干细胞因子(scf,stemcellfactor)蛋白(cat#7466-sc)与等体积全弗氏完全佐剂(freund'sadjuvant)(sigma公司,美国)混合以制备乳剂(以一只小鼠为基准)。将乳剂注入4只7周龄的由人cd34+细胞注射制成的雌性人化nsg小鼠的腹腔内。之后,将50μg的抗原以总容积500μl注入各个小鼠中来诱导抗体的生成。经过1周及2周后,将各弗氏完全佐剂(sigma公司,美国)和抗原进行混合的乳剂追加注入小鼠的腹腔内。
1-2.抗体生成细胞的确认及筛选
从通过上述方法被免疫的小鼠的眼球中采集血液,将上述1.5ml的血液放入微量离心管中并以13000rpm离心10分钟。将其保管在-20℃的温度下直至实施分离出血清并确认抗体生成的实验。通过实施使用抗原蛋白质的酶免疫测定法来确认抗体生成与否后,在细胞融合3天前将混合弗氏不完全佐剂(sigma公司,美国)与抗原的乳剂再次注射到小鼠的腹腔内。
1-3.杂交瘤的制备
确认抗体生成后,处死小鼠并分离出脾脏细胞,将其与骨髓瘤细胞p3x63ag8.653(atcccrl-1580)融合以制备杂交瘤。
首先,在使用补充了10%胎牛血清的rpmi1640培养基的培养皿中培养小鼠的p3x63ag8.653细胞。为了实施细胞融合,将p3x63ag8.653细胞用无血清的rpmi1640培养基(hyclone公司,美国)洗涤2次,并调节至1×107的浓度。通过颈椎脱臼的方式处死小鼠并采取脾脏后,放入网状容器(sigma公司,美国)以分离细胞。制备脾脏细胞的悬浮液后,利用离心洗涤悬浮液。将脾脏细胞溶液暴露于氨基丁三醇-nh4cl(20.6g/l的氨基丁三醇,8.3g/l的nh4cl)来溶解红细胞。将完全分离的抗体生成细胞以400xg离心5分钟后,在无血清培养基中洗涤2次,并重悬于10ml的培养基中。使用血球计数仪对淋巴细胞进行计数,在无血清培养基中混合淋巴球1×108与p3x63ag8.653细胞1×10(10:1)。离心是以400xg进行5分钟。之后缓慢添加1ml的在37℃下加热的50%(m/v)聚乙二醇1500(sigma公司,美国)溶液并混合。
使用无血清rpmi1640稀释上述制备的融合混合溶液,以400xg离心3分钟。将细胞悬浮于补充了20%胎牛血清及hat(100μm的次黄嘌呤、0.4μm的氨基蝶呤、16μm的胸苷)的35ml的rpmi1640选择培养基中。将100ul的悬浊液装入一天前涂敷了饲养细胞(使用rpmi1640从腹腔中分离的巨噬细胞)的96孔板,在37℃的温度、5%co2下培养。5天后,每2~3天更换一次hat培养基,并将细胞培养14天。14天后,更换补充了20%胎牛血清及ht(从hat去除0.4μm氨基蝶呤的培养基)的rpmi1640培养基并进第二次培养。将这样从免疫注射干细胞因子的淋巴结中分离的淋巴球与骨髓瘤细胞融合而获得的杂交瘤菌落的上层液用于之后的实验中。
1-4.抗体生成融合细胞的选择及分离
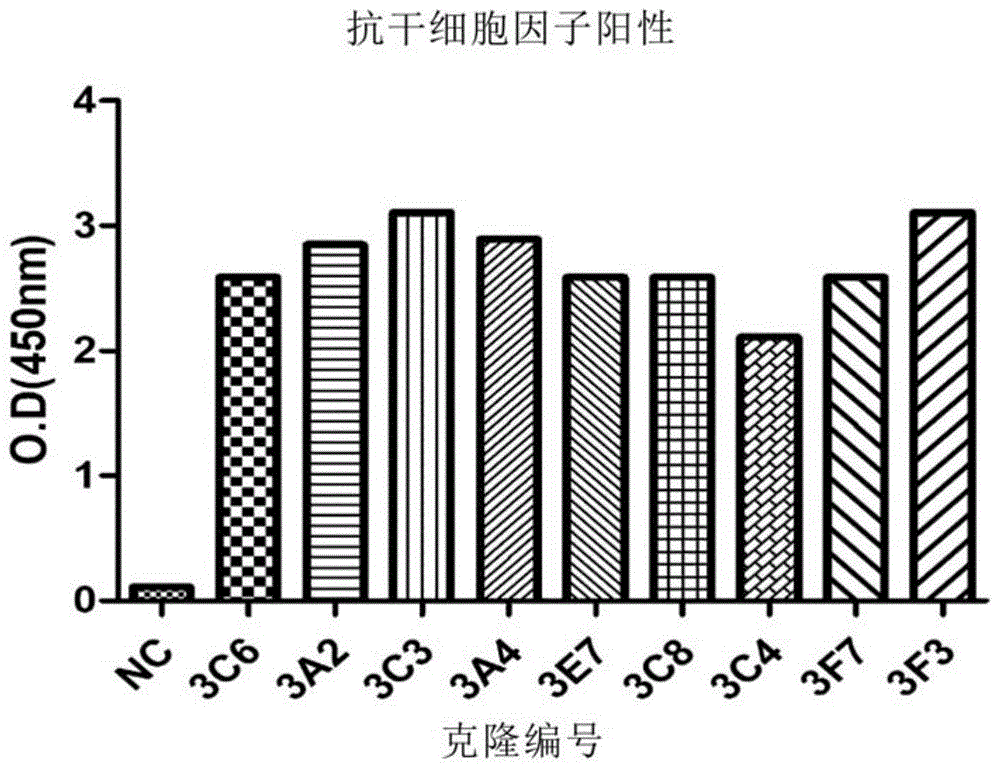
收集在实施例1-3中制备的杂交瘤菌落的上层液并进行酶免疫测定,以确定对上述制备的抗原的特异性抗体的制备。选择显示出阴性对照组的4倍以上滴定浓度的融合细胞的培养液,将其转移至24孔培养板中进行培养。进一步稀释(limitingdilution)以在96孔板中每孔浸入1个细胞并进行培养后回收培养液。之后,在96孔板以每孔0.1μg涂敷用作抗原的干细胞因子蛋白后,进行酶免疫测定。结果,在450nm波长下测定吸光度(opticaldensity,odvalue),最终选择产生9个单克隆抗体(3c6、3a2、3c3、3a4、3e7、3c8、3c4、3f7以及3f3)的融合细胞。将其示于图1。
实施例2.双重靶向抗体的干细胞因子中和能力的确定
将300μl的基质胶(matrigel)(corning公司,美国)分注到12孔板后,将人脐静脉内皮细胞(huvec,humanumbilicalveinendothelialcells)与干细胞因子(50ng/ml)或干细胞因子(50ng/ml)+抗干细胞因子抗体(10μg/ml)混合后分注到基质胶,并在体外(invitro)观察人脐静脉内皮细胞的管的形成(n=10)。将其结果示于图2。
如图2所示,可以确认9个单克隆抗体中3c3以及3c4抗体有效抑制了由干细胞因子诱导的人脐静脉内皮细胞的管的形成。通过上述结果可以确认本发明的3c3以及3c4抗体可通过抑制新生血管生成来用于预防或治疗血管生成相关疾病。
实施例3.igg可变区域(variableregion)的碱基序列分析3-1.从融合细胞合成cdna
从实施例1及实施例2中获得的5×105个的融合细胞3c4克隆分离所有rna,利用随机引物(randomprimer)(bioneer公司,韩国)和逆转录酶进行逆转录反应。
3-2.小鼠igg可变结构域的聚合酶链式反应扩增
使用可变区域特异性引物对通过逆转录反应获得的cdna扩增抗体的轻链及重链的相应部位。所用的引物示于下列表1中。
表1
首先,利用由序列1和序列2表示的引物从cdna扩增κ轻链结构域。通过琼脂糖凝胶电泳确认扩增的dna,将其结果示于图3。并且,利用由序列3和序列4表示的引物从cdna扩增igg1的重链结构域。相同地,通过琼脂糖凝胶电泳确认扩增的dna,将其结果示于图4。
如图3及图4所示,在κ轻链结构域(414bp)和重链结构域(483bp)之间发现带,以确认生成预期大小的聚合酶链式反应产物。在利用阴性对照组的其他聚合酶链式反应中未出现聚合酶链式反应产物。
此后,将上述聚合酶链式反应产物在琼脂糖凝胶中展开并切断带,在60℃的温度下溶解琼脂糖凝胶后,使用吸附柱(qiagen公司)纯化dna。将纯化的dna克隆岛topo-ta载体(invitrogen公司)并转化(transformation)到大肠杆菌dh5a中以获得克隆体后,培养菌落并提取质粒后,再次进行聚合酶链式反应以获得4个质粒后,分析了3c4抗体的碱基序列。将通过碱基序列分析的鉴定结果示于表2。另外,序列分析结果确认3c3克隆具有与3c4克隆相同的碱基序列。3c4的碱基序列、氨基酸序列及其cdr区域示于图5及图6。
如图5所示,3c4轻链按照蓝色字的顺序依次包含轻链的cdr1(序列1)、cdr2(序列2)以及cdr3(序列3)。如图6所示,3c4重链按照蓝色字的顺序依次包含重链的cdr1(序列4)、cdr2(序列5)以及cdr3(序列6)。
并且,3c4轻链氨基酸序列示于序列7,重链氨基酸序列示于序列8,3c4的整体氨基酸序列示于序列9。将3c4的轻链(序列16)以及重链(序列17)的碱基序列示于表2,将3c4的整体碱基序列示于序列18。
表2
实施例4.人抗体克隆
将从实施例3中获得的抗干细胞因子抗体3c4(以下,3c4)的可变结构域移植(grafting)到人fc氨基酸序列,并克隆到磷酸胆碱载体(pchovector)(lifetechnology公司)。
将轻链可变结构域融合在对于人κ恒定区域的框架内,将重链可变结构域融合在对于人igg1恒定区域的框架内。将用于全长igg1抗体的培养基内分泌的前导肽序列添加到两个基因并合成基因后,通过序列分析再次验证。选择3个克隆以在细胞内进行表达试验。制备对于3个克隆的丙三醇储备液,并制备了不含毒素的质粒dna以在cho细胞内进行表达试验。
实施例5.转染至cho细胞后抗体的分离及纯化
将在实施例4中获得的质粒dna转染至cho-s细胞内。在转染一周前,将cho-s(invitrogen公司,10743-029)转移至细胞培养基(dmem)补充血清内单层培养物内。转染一天前分注细胞后,对转染试样准备了dna-脂质体复合物。将细胞在5%co2、37℃的温度下的培养箱中培养过夜,每2~3日添加一次培养基,培养一周后,回收培养液,并与proteina/g琼脂糖(公司)结合后用磷酸缓冲溶液(pbs)洗涤。之后,用0.1m的甘氨酸(ph2.8)洗脱后,用1m的tris-hcl(ph8.0)中和。再用磷酸缓冲溶液透析后,在-70℃的温度下保管。将其结果示于图7。
如图7所示,聚丙烯酰胺凝胶电泳(sds-page)的结果观察到50kda左右的重链和25kda左右的轻链带,据此确认了准确的合成并生成了抗体。
实施例6.3c4抗体的亲和力的验证
进行了表面离子共振(surfaceplasmonresonance,spr)以通过定量来准确确认对本发明的3c4抗体结合干细胞因子的能力。使用sr7500dc(reichert公司,美国)将用于抗体制备的20μg的人抗原干细胞因子蛋白质固定在聚乙二醇(peg)(reichert公司,美国)芯片后,将本发明的抗干细胞因子抗体按照浓度(0nm、7.8125nm、15.625nm、31.25nm、62.5nm、125nm、250nm、500nm、1um以及2um)流过。使用scrubber2程序分析作为对干细胞因子的亲和力的kd值并将其结果示于图8。kd值是通过将kd值除以ka值获得的值,其值越低对相应物质的结合能力越大。
如图8所示,kd值约为18.8±2×10-9m,可以确认本发明的3c4抗体对干细胞因子显示出强亲和力。
实施例7.基于3c4抗体的干细胞因子的血管形成诱导抑制能力的再次验证
将300μl的基质胶(corning公司,美国)分注到12孔板后,将人脐静脉内皮细胞与干细胞因子(50ng/ml)或干细胞因子(50ng/ml)+3c4抗体(10μg/ml)混合后分注到基质胶。之后,观察人脐静脉内皮细胞的管形成进行观察(n=10),并将其结果示于图9。
如图9所示,可以确认本发明的3c4抗体可有效抑制由干细胞因子诱导的人脐静脉内皮细胞的管的形成。通过上述结果可以确认本发明的3c4抗体可通过抑制新生血管的生成来用于预防或治疗血管生成相关疾病。
实施例8.基于3c4抗体的干细胞因子的c-kit磷酸化的抑制效能的分析
将6×104个细胞培养12小时后,将血清枯竭4小时,预处理本发明的3c4抗体15分钟,并处理干细胞因子后获取细胞。通过基于蛋白印迹法的c-kit表达来分析3c4抗体是否有效抑制基于干细胞因子的信号传导。将其结果示于图10。
如图10所示,可以确认本发明的3c4抗体有效中和干细胞因子,从而不仅抑制基于干细胞因子的c-kit磷酸化,还通过影响下游(down-stream)信号传导途径来抑制蛋白激酶b以及细胞外信号调节激酶的磷酸化。
实施例9.通过蛋白质微阵列分析确认对于干细胞因子及半乳糖凝集素-1的结合能力
利用huprottmv3.1人蛋白质微阵列(humanproteomemicroarray)(cdilaboratories公司)蛋白质条来进行蛋白质微阵列分析。首先在常温下用包含2%的牛血清蛋白(bsa)、0.1%tween20的磷酸吐温缓冲液(pbst)(ph7.4)阻断蛋白质芯片2小时。将2μg的生物素化(biotinylation)的3c4抗体溶解在包含2%的牛血清蛋白、0.1%tween20的磷酸吐温缓冲液(ph7.4),在4℃的温度下诱导结合8小时后,使用磷酸吐温缓冲液洗涤3次。将1μg的链霉亲-素荧光(streptavidin-fluorescence)(alexa-fluor公司,532nm)(18.9pmol)洒在蛋白芯片上,在4℃的温度下诱导结合1小时后,再用磷酸吐温缓冲液洗涤3次。完全去除剩余的缓冲液后,在-20℃的温度下冷冻蛋白芯片,并用genepix4100a微阵列激光扫描仪(microarraylaserscanner)(moleculardevices公司)进行扫描。并将其结果示于图11。
如图11所示,可以确认本发明的3c4抗体除对干细胞因子外还显示出对半乳糖凝集素-1(lgals1)的高结合力。
实施例10.3c4抗体对半乳糖凝集素-1的亲和力的验证
进行了表面离子共振(surfaceplasmonresonance,spr)以通过定量来准确确认本发明的3c4抗体结合干细胞因子的能力。首先,将人半乳糖凝集素-1(np_002296.1)基因克隆到pet-3a的ndei/bamhi并在大肠杆菌中过表达后,通过离子交换色谱法分离纯化,之后用磷酸缓冲溶液透析(dialysis)并在-70℃的温度下保管。用纯化的样品通过聚丙烯酰胺凝胶电泳来确认蛋白是否是半乳糖凝集素-1。并将其结果示于图12。
接下来,使用sr7500dc(reichert公司,美国)将20μg的人抗原半乳糖凝集素-1蛋白固定在聚乙二醇(reichert公司,美国)芯片后,将本发明的3c4抗体按照浓度(0nm、23.4375nm、46.875nm、93.75nm、187.5nm、375nm、750nm、1.5um、3um以及6um)流过。使用scrubber2程序分析作为对半乳糖凝集素-1的亲和力的kd值并将其结果示于图13。
如图13所示,kd值约为46.9±9×10-9m,可以确认本发明的3c4抗体不仅对干细胞因子显示出强亲和力,还对半乳糖凝集素-1显示出强亲和力。
实施例11.基于半乳糖凝集素-1的血管形成诱导抑制能力的验证
将300μl的基质胶(corning公司,美国)分注到12孔板后,将人脐静脉内皮细胞与半乳糖凝集素-1(50ng/ml)或半乳糖凝集素-1(50ng/ml)+3c4抗体(5μg/ml或10μg/ml)混合后分注到基质胶。之后,观察人脐静脉内皮细胞的管形成进行观察(n=10),并将其结果示于图14。
如图14所示,可以确认本发明的3c4抗体可有效抑制由半乳糖凝集素-1诱导的人脐静脉内皮细胞的管的形成。通过上述结果可以确认本发明的3c4抗体作为双重靶向抗体,不仅抑制由干细胞因子诱导的新生血管的生成,还抑制由半乳糖凝集素-1诱导的新生血管的生成,从而可用于预防或治疗血管生成相关疾病。
实施例12.基于干细胞因子及半乳糖凝集素-1的细胞增殖抑制能力的验证
将5×103个人脐静脉内皮细胞分注到96孔板,使用egm2培养基培养12小时。之后,处理本发明的3c4抗体并用celigo成像细胞仪(celigoimagingcytometer)(nexcelombioscience公司)扫描基于干细胞因子及半乳糖凝集素-1的细胞增殖抑制效果,通过hoechst染色确认了细胞数。将其结果示于图15。
如图15所示,可以确认当处理3c4抗体时,由干细胞因子及半乳糖凝集素-1诱导的人脐静脉内皮细胞增殖以浓度依赖的方式被抑制。通过上述结果,再次确认了本发明的3c4抗体不仅有效抑制由干细胞因子诱导的新生血管的生成,还有效抑制由半乳糖凝集素-1诱导的新生血管的生成。
比较例1.本发明的3c4抗体和r&dsystems的多克隆(polyclonal)抗体的中和能力的比较
进行了用于比较市售中的干细胞因子抗体和本发明的3c4抗体的中和能力的实验。将300μl的基质胶(corning公司,美国)分注到12孔板后,放置5分钟使其固化。将人脐静脉内皮细胞与干细胞因子(50ng/ml)、干细胞因子(50ng/ml)+3c4抗体或r&dsystems的抗干细胞因子多克隆抗体(cat#,af-255-na)按照浓度混合后,分注到基质胶。之后,观察人脐静脉内皮细胞的管形成(n=7),并将其结果示于图16(*p<0.05)。
如图16所示,可以确认本发明的3c4抗体在所有浓度中的由干细胞因子诱导的人脐静脉内皮细胞的管形成抑制能力均高于r&dsystems的抗干细胞因子多克隆抗体。通过上述比较例可以再次确认,与市售中的干细胞因子抗体相比,在使用本发明的3c4抗体的情况下,新生血管表达被显著抑制,从而更有效治疗血管生成相关疾病。
在眼血管疾病的情况下,主要治疗剂是靶向血管内皮生长因子的药物,但约20%的患者是血管内皮生长因子的无反应组,因此需要开发新的治疗剂。如上述实施例和比较例中所确认的,本发明的双重靶向抗体能够与干细胞因子(scf,stemcellfactor)及半乳糖凝集素-1(galectin-1)特异性结合,不仅抑制分别由干细胞因子及半乳糖凝集素-1诱导的血管形成,还能够有效治疗现有治疗剂无反应组患者,还有望可通过与靶向血管内皮生长因子的现有药物组合给药来有效抑制异常新生血管形成。
虽然通过上述提及的优选实施例说明了本发明,但可以在不脱离发明的要旨和范围的情况下进行各种修改或变形。并且,所附发明要求保护范围包括落入本发明要旨的修改或变形。
序列表
<110>康沃斯制药公司
<120>靶向干细胞因子及半乳糖凝集素-1的双重靶向抗体及其用途
<130>comeworth1-1p
<150>10-2017-0143816
<151>2017-10-31
<150>10-2018-0127615
<151>2018-10-24
<160>22
<170>patentin3.2版
<210>1
<211>11
<212>prt
<213>人工的
<220>
<223>3c4的轻链可变区的cdr1
<400>1
glnserleuvaltyrseraspglyasnthrtyr
1510
<210>2
<211>3
<212>prt
<213>人工的
<220>
<223>3c4的轻链可变区的cdr2
<400>2
lysvalser
1
<210>3
<211>8
<212>prt
<213>人工的
<220>
<223>3c4的轻链可变区的cdr3
<400>3
metglnglythrhistrpproleu
15
<210>4
<211>8
<212>prt
<213>人工的
<220>
<223>3c4的重链可变区的cdr1
<400>4
glyphethrphesersertyrgly
15
<210>5
<211>8
<212>prt
<213>人工的
<220>
<223>3c4的重链可变区的cdr2
<400>5
iletrptyraspglyserasnasn
15
<210>6
<211>16
<212>prt
<213>人工的
<220>
<223>3c4的重链可变区的cdr3
<400>6
alaargglyglnasntyrtyrglyleuglysertyrphepheasptyr
151015
<210>7
<211>111
<212>prt
<213>人工的
<220>
<223>3c4的轻链可变区
<400>7
aspvalvalmetthrglnserproleuserleuprovalthrleugly
151015
glnproalaserilesercysargserserglnserleuvaltyrser
202530
aspglyasnthrtyrleuasntrppheglnglnargproglyglnser
354045
proargargleuiletyrlysvalserasnargaspserglyvalpro
505560
aspargpheserglyserglyserglythraspphethrleulysile
65707580
serargvalglualagluaspvalglyvaltyrtyrcysmetglngly
859095
thrhistrpproleuseralagluglyproargtrpargserasn
100105110
<210>8
<211>120
<212>prt
<213>人工的
<220>
<223>3c4的重链可变区
<400>8
glnvalglnleuvalgluserglyglyglyvalvalglnproglyarg
151015
serleuargleusercysvalalaserglyphethrphesersertyr
202530
glymethistrpvalargglnalaproglylysglyleuasptrpval
354045
alavaliletrptyraspglyserasnasnasptyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaargglyglnasntyrtyrglyleuglysertyrphepheasptyr
100105110
trpglyglnglythrleuvalthr
115120
<210>9
<211>671
<212>prt
<213>人工的
<220>
<223>3c4的氨基酸序列
<400>9
aspvalvalmetthrglnserproleuserleuprovalthrleugly
151015
glnproalaserilesercysargserserglnserleuvaltyrser
202530
aspglyasnthrtyrleuasntrppheglnglnargproglyglnser
354045
proargargleuiletyrlysvalserasnargaspserglyvalpro
505560
aspargpheserglyserglyserglythraspphethrleulysile
65707580
serargvalglualagluaspvalglyvaltyrtyrcysmetglngly
859095
thrhistrpproleuseralagluglyproargtrpargserasnarg
100105110
thrvalalaalaproservalpheilepheproproseraspglugln
115120125
leulysserglythralaservalvalcysleuleuasnasnphetyr
130135140
proargglualalysvalglntrplysvalaspasnalaleuglnser
145150155160
glyasnserglngluservalthrgluglnaspserlysaspserthr
165170175
tyrserleuserserthrleuthrleuserlysalaasptyrglulys
180185190
hislysvaltyralacysgluvalthrhisglnglyleuserserpro
195200205
valthrlysserpheasnargglyglucysglnvalglnleuvalglu
210215220
serglyglyglyvalvalglnproglyargserleuargleusercys
225230235240
valalaserglyphethrphesersertyrglymethistrpvalarg
245250255
glnalaproglylysglyleuasptrpvalalavaliletrptyrasp
260265270
glyserasnasnasptyralaaspservallysglyargphethrile
275280285
serargaspasnserlysasnthrleutyrleuglnmetasnserleu
290295300
argalagluaspthralavaltyrtyrcysalaargglyglnasntyr
305310315320
tyrglyleuglysertyrphepheasptyrtrpglyglnglythrleu
325330335
valthrvalserseralaserthrlysglyproservalpheproleu
340345350
alaproserserlysserthrserglyglythralaalaleuglycys
355360365
leuvallysasptyrpheprogluprovalthrvalsertrpasnser
370375380
glyalaleuthrserglyvalhisthrpheproalavalleuglnser
385390395400
serglyleutyrserleuserservalvalthrvalproserserser
405410415
leuglythrglnthrtyrilecysasnvalasnhislysproserasn
420425430
thrlysvalasplyslysvalgluprolyssercysasplysthrhis
435440445
thrcysproprocysproalaprogluleuleuglyglyproserval
450455460
pheleupheproprolysprolysaspthrleumetileserargthr
465470475480
progluvalthrcysvalvalvalaspvalserhisgluaspproglu
485490495
vallyspheasntrptyrvalaspglyvalgluvalhisasnalalys
500505510
thrlysproargglugluglntyrasnserthrtyrargvalvalser
515520525
valleuthrvalleuhisglnasptrpleuasnglylysglutyrlys
530535540
cyslysvalserasnlysalaleuproalaproileglulysthrile
545550555560
serlysalalysglyglnproarggluproglnvaltyrthrleupro
565570575
proserargaspgluleuthrlysasnglnvalserleuthrcysleu
580585590
vallysglyphetyrproseraspilealavalglutrpgluserasn
595600605
glyglnprogluasnasntyrlysthrthrproprovalleuaspser
610615620
aspglyserphepheleutyrserlysleuthrvalasplysserarg
625630635640
trpglnglnglyasnvalphesercysservalmethisglualaleu
645650655
hisasnhistyrthrglnlysserleuserleuserproglylys
660665670
<210>10
<211>33
<212>dna
<213>人工的
<220>
<223>编码3c4的轻链可变区的cdr1的dna序列
<400>10
caaagcctcgtatacagtgatggaaacacctac33
<210>11
<211>9
<212>dna
<213>人工的
<220>
<223>编码3c4的轻链可变区的cdr2的dna序列
<400>11
aaggtttct9
<210>12
<211>24
<212>dna
<213>人工的
<220>
<223>编码3c4的轻链可变区的cdr3的dna序列
<400>12
atgcaaggtacacactggcctctt24
<210>13
<211>24
<212>dna
<213>人工的
<220>
<223>编码3c4的重链可变区的cdr1的dna序列
<400>13
ggattcaccttcagtagctatggc24
<210>14
<211>24
<212>dna
<213>人工的
<220>
<223>编码3c4的重链可变区的cdr2的dna序列
<400>14
atatggtatgatggaagtaataac24
<210>15
<211>48
<212>dna
<213>人工的
<220>
<223>编码3c4的重链可变区的cdr3的dna序列
<400>15
gcgagagggcaaaattactatggtttggggagttatttctttgactac48
<210>16
<211>333
<212>dna
<213>人工的
<220>
<223>编码3c4的轻链可变区的dna序列
<400>16
gatgttgtgatgactcagtctccactctccctgcccgtcacccttggacagccggcctcc60
atctcctgcaggtctagtcaaagcctcgtatacagtgatggaaacacctacttgaattgg120
tttcagcagaggccaggccaatctccaaggcgcctaatttataaggtttctaaccgggac180
tctggggtcccagacagattcagcggcagtgggtcaggcactgatttcacactgaaaatc240
agcagggtggaggctgaggatgttggggtttattactgcatgcaaggtacacactggcct300
ctttcggcggagggaccaaggtggagatcaaac333
<210>17
<211>360
<212>dna
<213>人工的
<220>
<223>编码3c4的重链可变区的dna序列
<400>17
caggtgcagctggtggagtctgggggaggcgtggtccagcctgggaggtccctgagactc60
tcctgtgtagcgtctggattcaccttcagtagctatggcatgcactgggtccgccaggct120
ccaggcaaggggctggactgggtggcagttatatggtatgatggaagtaataacgactat180
gcagactccgtgaagggccgattcaccatctccagagacaattccaagaacacactgtat240
ctacaaatgaacagcctgagagccgaggacacggctgtatattactgtgcgagagggcaa300
aattactatggtttggggagttatttctttgactactggggccagggaaccctggtcacc360
<210>18
<211>2019
<212>dna
<213>人工的
<220>
<223>编码3c4的dna序列
<400>18
gatgttgtgatgactcagtctccactctccctgcccgtcacccttggacagccggcctcc60
atctcctgcaggtctagtcaaagcctcgtatacagtgatggaaacacctacttgaattgg120
tttcagcagaggccaggccaatctccaaggcgcctaatttataaggtttctaaccgggac180
tctggggtcccagacagattcagcggcagtgggtcaggcactgatttcacactgaaaatc240
agcagggtggaggctgaggatgttggggtttattactgcatgcaaggtacacactggcct300
ctttcggcggagggaccaaggtggagatcaaaccgtacggtggctgcaccatctgtcttc360
atcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctg420
aataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcg480
ggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagc540
agcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtc600
acccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgttgacag660
gtgcagctggtggagtctgggggaggcgtggtccagcctgggaggtccctgagactctcc720
tgtgtagcgtctggattcaccttcagtagctatggcatgcactgggtccgccaggctcca780
ggcaaggggctggactgggtggcagttatatggtatgatggaagtaataacgactatgca840
gactccgtgaagggccgattcaccatctccagagacaattccaagaacacactgtatcta900
caaatgaacagcctgagagccgaggacacggctgtatattactgtgcgagagggcaaaat960
tactatggtttggggagttatttctttgactactggggccagggaaccctggtcaccgtc1020
tcctcagcctccaccaagggcccatcggtcttccccctggcaccctcctccaagagcacc1080
tctgggggcacagcggccctgggctgcctggtcaaggactacttccccgaaccggtgacg1140
gtgtcgtggaactcaggcgccctgaccagcggcgtgcacaccttcccggctgtcctacag1200
tcctcaggactctactccctcagcagcgtggtgaccgtgccctccagcagcttgggcacc1260
cagacctacatctgcaacgtgaatcacaagcccagcaacaccaaggtggacaagaaagtt1320
gagcccaaatcttgtgacaaaactcacacatgcccaccgtgcccagcacctgaactcctg1380
gggggaccgtcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccgg1440
acccctgaggtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttc1500
aactggtacgtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcag1560
tacaacagcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaat1620
ggcaaggagtacaagtgcaaggtcagcaacaaagccctcccagcccccatcgagaaaacc1680
atctccaaagccaaagggcagccccgagaaccacaggtgtacaccctgcccccatcccgg1740
gatgagctgaccaagaaccaggtcagcctgacctgcctggtcaaaggcttctatcccagc1800
gacatcgccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcct1860
cccgtgctggactccgacggctccttcttcctctacagcaagctcaccgtggacaagagc1920
aggtggcagcaggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccac1980
tacacgcagaagagcctctccctgtctccgggtaaatga2019
<210>19
<211>27
<212>dna
<213>人工的
<220>
<223>轻链正向引物
<400>19
cagctcctggggctgctaatgctctgg27
<210>20
<211>24
<212>dna
<213>人工的
<220>
<223>轻链反向引物
<400>20
cagttgctaactgttccgtggatg24
<210>21
<211>26
<212>dna
<213>人工的
<220>
<223>重链正向引物
<400>21
atggarttggggctgwgctgggtttt26
<210>22
<211>24
<212>dna
<213>人工的
<220>
<223>重链反向引物
<400>22
acttttgagagcagttccaggagc24
- 还没有人留言评论。精彩留言会获得点赞!