用于扩增靶核酸的方法及用于扩张靶核酸的组合物与流程
本发明涉及一种扩增靶核酸的方法,其可以最小化对靶核酸的核苷酸序列的依赖性,以及一种扩增靶核酸的方法,其可以最小化在增加靶核酸的检测灵敏度的过程中靶核酸扩增效率的变化。更具体地,本发明涉及一种通过在存在靶核酸时诱导靶核酸与任何替代靶之间产生融合扩增子并且扩增该融合扩增子从而以高效率和高灵敏度执行靶核酸扩增的方法,一种通过在产生靶核酸与任何替代靶之间的融合扩增子的过程中仅控制替代靶的添加量来有效调节靶核酸的检测灵敏度的方法,以及一种用于执行此类方法的聚合酶链式反应(pcr)组合物。
背景技术:
:地球上所有活生物体拥有的遗传信息是每个个体特征的来源,并记录在序列中,其中腺嘌呤(a)、鸟嘌呤(g)、胞嘧啶(c)、胸腺嘧啶(t)和尿嘧啶(u)碱基排列在核酸(dna或rna)中。因此,确定或鉴定这些碱基的序列(核苷酸序列)可以鉴定活生物体的特征并理解潜在的代谢机制的过程。近年来,分子诊断已通过检测或鉴定生物体中特定核苷酸序列的方法广泛用于确定生物体的存在或特征。医学上有用的分子诊断方法的典型示例包括检测与人类癌症相关的基因突变或检测导致可能在人体内发生的传染病的病原体,而检测食品中有害微生物的其他检测方法也是分子诊断方法的一部分。许多用于特异性鉴定特定核苷酸序列的分子诊断技术都是使用具有dna聚合酶的聚合酶链式反应(pcr)进行的。聚合酶链式反应可以使用包括能够特异性杂交包含特定核苷酸序列区域的靶核酸的一对引物的组合物、以及能够以靶核酸作为模板且以引物作为起点而进行聚合酶链式反应的热稳定dna聚合酶、以及能够以逐步和重复的方式向组合物施加预定温度的热循环仪而进行。此外,使用聚合酶链式反应的分子诊断利用核酸结合染料或探针可实时检测大量已形成(已扩增)的靶核酸中的特定核苷酸序列,这称为实时pcr(higuchi,r.等,biotechnology1992.10:413-417,higuchi,r.等,biotechnology1993.11:1026-1030)。迄今为止,大多数分子诊断方法已经使用了直接扩增靶核酸的方法,同时通过聚合酶链式反应鉴定靶核酸的存在或特征。一对或多对引物用于扩增靶核酸,并且由于引物必须与靶核酸互补,因此没有太多机会任意调节核苷酸序列。因此,靶核酸的核苷酸序列特征直接影响分子诊断的性能。如果靶核酸的鸟嘌呤(g)/胞嘧啶(c)含量高,则会出现二级结构形成和过高的熔解温度,这大大降低了聚合酶链式反应期间的扩增效率。已经有人指出这是开发诊断产品的主要障碍(mcdowell,d.g.等,nucleicacidsres.1998.26:3340-3347)。此外,迄今为止,许多分子诊断方法都使用了能够生成荧光信号同时通过实时聚合酶链式反应鉴定靶核酸的存在或特征的探针。探针还需要具有与靶核酸互补的核苷酸序列,其类似于扩增靶核酸的引物,因此,当靶核酸被改变时,探针也必须被改变,这是低效率的。如果使用核酸结合染料而不是靶特异性探针来检测聚合酶链式反应产物,则不必根据靶核酸的变化来改变核酸结合染料,但核酸结合染料不能区分靶核酸的核苷酸序列,因此在靶特异性检测中存在局限性的问题。此外,可以通过在实时聚合酶链式反应中获得的扩增曲线的斜率来评估靶核酸的扩增效率,并且可以将靶核酸的检测灵敏度表示为根据扩增曲线计算的循环阈(ct)值。然而,迄今为止,在大多数分子诊断方法中,大部分需要在优化靶核酸的扩增效率或检测灵敏度时调节引物的核苷酸序列或添加量,因此难以独立地调节扩增效率和检测灵敏度。因此,这些诊断方法的缺点在于优化扩增效率和检测灵敏度需要花费大量时间和成本。即,当核苷酸序列或引物添加量改变时,扩增效率和检测灵敏度也改变,基于该原因,在增加检测灵敏度的过程中难以控制扩增效率,因此,需要反复试验和错误。因此,本发明人进行了广泛的努力,以开发一种不受靶核酸特性限制的扩增靶核酸的方法,以及一种在对核酸扩增效率影响最小化的同时有效地提高靶核酸扩增的灵敏度的方法。结果,本发明人发现,当通过使用与靶核酸杂交的靶特异性引物、包括与靶核酸和任意序列结合的序列的替代靶、以及能够扩增所述替代靶的扩增引物来进行pcr时,可以最小化对靶核酸的依赖性,并且可以以高灵敏度和高效率扩增靶核酸,并且当调节替代靶的量时,能够独立地且容易地调节仅靶核酸扩增的灵敏度,从而完成本发明。以上在该
背景技术:
部分公开的信息仅用于增强对本发明
背景技术:
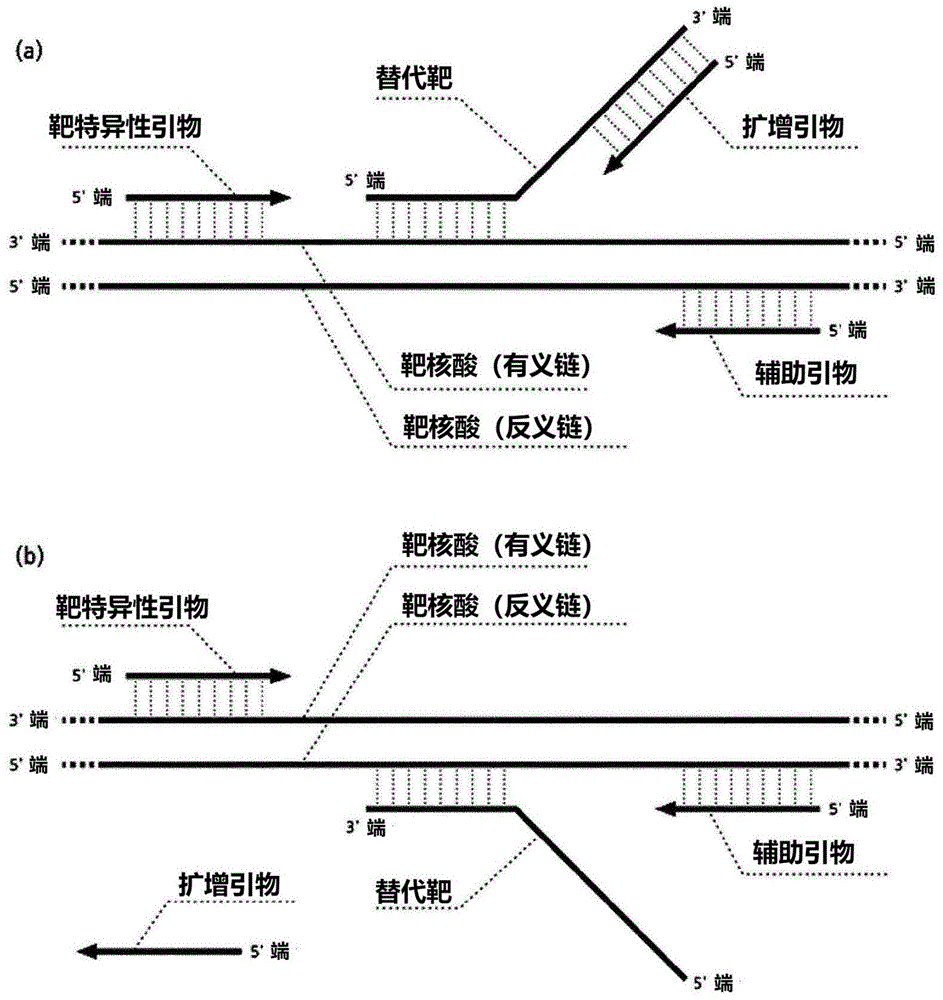
的理解。因此,其可能不包含构成本发明所属领域中已知的常规技术信息。技术实现要素:本发明的一个目的是提供一种扩增靶核酸的方法,其可以最小化对靶核酸的依赖,以及一种扩增靶核酸的方法,其可以有效地调节靶核酸扩增的灵敏度,同时最小化对核酸扩增效率的影响。本发明的另一个目的是提供一种用于扩增靶核酸的聚合酶链式反应(pcr)组合物,其可以最小化对靶核酸的依赖性并有效地调节靶核酸扩增的灵敏度。为了实现上述目的,本发明提供了一种扩增靶核酸的方法,该方法包括以下步骤:(a)从样品中分离核酸;(b)通过添加以下物质进行聚合酶链式反应(pcr):i)至少一种能够与靶核酸杂交的靶特异性引物,ii)至少一种替代靶,其包含与靶核酸区域结合的序列以及不与靶核酸结合的任意序列,其中所述靶核酸区域与所述靶特异性引物不结合,和iii)至少一种能够扩增所述替代靶的扩增引物;以及(c)确定融合扩增子的存在或不存在。本发明还提供了一种用于扩增靶核酸的聚合酶链式反应组合物,该组合物包含:i)至少一种能够与靶核酸杂交的靶特异性引物;ii)至少一种替代靶,其包含与靶核酸区域结合的序列以及不与靶核酸结合的任意序列,其中所述靶核酸区域与所述靶特异性引物不结合;和iii)至少一种能够扩增所述替代靶的扩增引物。附图说明图1显示了实现本发明所必需的元件以及这些元件之间的杂交关系。具体而言,图1(a)显示了靶特异性引物和替代靶与同一靶核酸链结合的情况,而图1(b)显示了靶特异性引物和替代靶结合至不同的靶核酸链的情况。图2显示了可以在本发明的实施中使用的替代靶的结构。图3显示了在本发明的实施方案中获得的融合扩增子(图3(a))与在常规聚合酶链式反应中获得的扩增子(图3(b))之间的比较。图4显示了在本发明的一个实施方案中用于形成融合扩增子的一种可能的机制。具体而言,图4(a)表示靶核酸、靶特异性引物、替代靶和扩增引物之间的杂交关系。图4(b)显示了通过扩增引物合成替代靶的相反核酸链。图4(c)和4(d)显示了在图4(b)中合成的替代靶的相反核酸链在与靶核酸结合后延伸;图4(e)和4(f)显示靶特异性引物在结合至图4(d)中所合成的延伸的替代靶的相反链后延伸;图4(g)显示了另一靶特异性引物和另一扩增引物结合至图4(d)和图4(f)中合成的延伸的替代靶的相反链和靶特异性引物的延伸链,并且重复进行该合成过程。图5显示了在本发明的一个实施方案中用于形成融合扩增子的一种可能的机制。具体而言,图5(a)表示靶核酸、靶特异性引物、替代靶和扩增引物之间的杂交关系。图5(b)显示了与靶核酸结合的靶特异性引物和与替代靶结合的扩增引物被延伸以合成新的核酸链;图5(c)显示了在图5(b)中合成的靶特异性引物的延伸链和扩增引物的延伸链被分离,然后在它们之间发生杂交并融合扩增子的产生开始;图5(d)显示完全产生的融合扩增子;以及图5(e)显示了另一靶特异性引物和另一扩增引物与图5(d)中产生的融合扩增子结合,并且重复进行该合成过程。图6显示了在本发明的一个实施方案中用于形成融合扩增子的一种可能的机制。具体而言,图6(a)表示靶核酸、靶特异性引物、替代靶和扩增引物之间的杂交关系。图6(b)显示了与靶核酸结合的靶特异性引物和与替代靶结合的扩增引物被延伸以合成新的核酸链。图6(c)和6(d)显示了在图6(b)中合成的扩增引物的延伸链在与另一个靶核酸结合后被另外延伸;图6(e)和6(f)显示靶特异性引物在与扩增引物的延伸链结合后被延伸,在图6(d)中另外延伸;并且图6(g)显示了另一靶特异性引物和另一扩增引物结合至图6(d)和6(f)中合成的扩增引物的延伸链和靶特异性引物的延伸链,并且重复进行合成过程。图7显示了在本发明的一个实施方案中用于形成融合扩增子的一种可能的机制。具体而言,图7(a)表示靶核酸、靶特异性引物、替代靶和扩增引物之间的杂交关系。图7(b)显示与靶核酸结合的靶特异性引物和替代靶被延伸以合成新链;图7(c)和7(d)显示了另一种靶特异性引物被延伸以结合至在图7(b)中合成的替代靶的延伸链;和图7(e)显示了另一靶特异性引物和另一扩增引物结合图7(b)和7(d)中合成的替代靶的延伸链和靶特异性引物的延伸链,并且重复进行合成过程。图8显示了可以在本发明的实施方式中使用的辅助引物的作用。辅助引物可以与靶特异性引物配对以增加靶核酸的靶区域的量,从而在存在痕量靶核酸的条件下促进融合扩增子的产生。图9显示了在本发明的实施例中扩增和检测人基因组中的表皮生长因子受体(egfr)基因的结果。图10显示了在本发明的实施例中使用辅助引物扩增和检测人基因组中的表皮生长因子受体(egfr)基因的结果。图11显示了在本发明的实施例中使用各种类型的替代靶扩增和检测人基因组中的表皮生长因子受体(egfr)基因的结果。图12显示了在本发明的实施例中扩增人基因组中具有相对较高的鸟嘌呤/胞嘧啶含量的hras基因的结果,并且将本发明的靶核酸扩增方法(图12(a))与常规的靶核酸扩增方法(图12(b))进行了比较。图13显示了在本发明的实施例中扩增和检测人基因组中具有相对较高的鸟嘌呤/胞嘧啶含量的hras基因的结果,并且将本发明的靶核酸扩增方法(图13(a))与常规的靶核酸扩增方法(图13(b))进行了比较。图14显示了在本发明的实施例中调节人类基因组中的表皮生长因子受体(egfr)基因的检测灵敏度的结果,并且比较了本发明的灵敏度调节方法(图14(a))和常规的灵敏度调节方法(图14(b))。图15显示了本发明实施例中人基因组中egfr基因和hras基因的多重扩增检测结果的结果,并且比较了在egfr基因靶的添加量大于hras基因靶的添加量的条件下(图15(a))和在hras基因靶的添加量大于hras基因靶的添加量的条件下(图15(b))的本发明的靶核酸扩增方法与常规的靶核酸扩增方法。具体实施方式除非另有定义,否则本说明书中使用的所有技术和科学术语具有与本说明书所属领域的技术人员通常理解的相同含义。通常,本说明书中使用的术语是众所周知的并在本领域中常用。在本发明中,研究了是否可以在对靶核酸的依赖性最小化的状态下扩增靶核酸。即,在本发明的实施例中,对于人egfr基因的外显子20的密码子790附近的区域,通过添加能够结合于靶核酸的有义链的靶特异性引物、包括与靶核酸序列互补的序列(其与靶特异性引物的下游区域)的替代靶、和任意序列,以及能够结合该替代靶的任意序列的扩增引物来进行聚合酶链式反应(pcr)。结果,可以确认在人egfr基因的外显子20的密码子790附近的区域与替代靶之间正常地形成了融合扩增子,因此通过检测探针检测到了该融合扩增子(图9)。另外,还添加了能够与靶核酸的反义链结合的辅助引物,结果证实了人egfr基因的检测灵敏度为每个反应约10个拷贝,说明可以以非常高的灵敏度检测到该基因(图10)。在本发明的另一个实施例中,对于人hras基因的外显子2的密码子12和13附近的区域,由于平均鸟嘌呤/胞嘧啶(g/c)含量高,难以通过常规的聚合酶链式反应进行扩增,通过添加能够与靶核酸的有义链结合的靶特异性引物、包括与靶核酸序列的反义链互补的序列(其对应于该靶特异性引物的下游区域)的替代靶、和任意序列、具有与所述替代靶的任意序列的一部分相同的序列的扩增引物、以及能够与靶核酸的反义链结合的辅助引物来进行聚合酶链式反应。结果,与不添加替代靶和扩增引物的常规方法相比,可以以更高的扩增效率和准确度检测hras基因的外显子2的密码子12和13的区域(图13)。此外,在本发明中,研究了当任意地调节靶核酸的检测灵敏度时是否可以使对靶核酸的扩增效率的影响最小化。即,在本发明的实施例中,对于egfr基因的外显子20的密码子790附近的区域,通过添加能够结合于靶核酸的正义链的靶特异性引物来进行聚合酶链式反应,各种量(0.01fmole、0.1fmole、1fmole和10fmole)的替代靶,其包含与靶标核酸序列互补的对应于靶特异性引物的下游区域的序列,以及任意序列,能够与替代靶的任意序列结合的扩增引物和能够与靶标核酸的反义链结合的辅助引物。结果,可以确认,与通过增加或减少引物的浓度来调节靶核酸的检测灵敏度时该核酸的扩增效率也被改变的传统方法相反,通过控制添加的替代靶的量来调节靶核酸的检测灵敏度时,核酸的扩增效率保持恒定。因此,在一个方面,本发明提供了一种扩增靶核酸的方法,该方法包括以下步骤:(a)从样品中分离核酸;(b)通过添加以下物质进行聚合酶链式反应(pcr):i)至少一种能够与靶核酸杂交的靶特异性引物;ii)至少一种替代靶,其包含与靶核酸区域结合的序列以及不与靶核酸结合的任意序列,其中所述靶核酸区域与所述靶特异性引物不结合;和iii)至少一种能够扩增替代靶的扩增引物;以及(c)确定融合扩增子的存在或不存在。如本文所用,术语“靶核酸”是指要检测的所有类型的核酸,并且包括源自不同物种、亚种或变体的基因序列,或相同物种中的基因突变。该术语可以包括所有类型的dna,包括基因组dna、线粒体dna和病毒dna,或所有类型的rna,包括mrna、核糖体rna、非编码rna、trna和病毒rna,但不限于此。靶核酸在聚合酶链式反应的条件下与靶特异性引物、辅助引物和替代靶杂交,并且探针也可以与部分或全部靶核酸杂交。如本文所用,术语“杂交”是指通过具有互补碱基序列的单链核酸之间的氢键形成双链核酸,并且以类似于退火的意义使用。但是,从广义上讲,杂交不仅包括两条单链的核苷酸序列完全匹配的情况,还包括一些核苷酸序列错配的例外情况。如本文所用,术语“靶特异性引物”是指能够与靶核酸杂交并通过聚合酶链式反应形成并扩增融合扩增子的引物。如本文所用,术语“扩增引物”是指当替代靶和与靶特异性引物杂交的相同的靶核酸链杂交时可与替代靶的任意序列的一部分杂交的引物,并可以形成和扩增融合扩增子。此外,术语“扩增引物”是指当替代靶和与靶特异性引物杂交的靶核酸链相反的链杂交时,与替代靶的任意序列的一部分具有相同序列的引物,并且可以形成和扩增融合扩增子。在本发明中,扩增引物可以用作通用引物。即,如果有几种类型的靶核酸要扩增,则可以用一种扩增引物同时扩增几种类型的靶。即,在常规的多重pcr中,应同时准备和使用与要检测的靶数量相同的数量的正向和反向引物对,而在本发明的方法中,使用与待检测的靶的数量相同的数量的正向引物(靶特异性引物)以同时检测多重靶dna,并且仅使用一种反向引物(扩增引物)作为通用引物,因此,仅使用少量的引物来检测多个靶,从而降低了pcr的复杂性和pcr效率的差异。如本文所用,术语“融合扩增子”是指由靶特异性引物、替代靶和扩增引物所形成和扩增的产物,其由靶核酸的一部分和替代靶的一部分或全部的融合物组成。在一个优选的实施方案中,融合扩增子的形成可以通过聚合酶的5’-3’核酸外切酶活性或侧翼核酸内切酶活性来诱导,但不限于此。在本发明中,与靶特异性引物不结合的靶核酸区域可以存在于靶特异性引物的下游,并且靶特异性引物的下游方向可以为靶特异性引物在结合靶核酸后通过pcr延伸的方向。在本发明中,替代靶优选与靶特异性引物配对,但不限于此。在本发明中,如果需要的话,可以使用任何方法以使替代靶不充当引物。优选地,不与靶核酸结合的任意序列可以位于替代靶的3’端或5’端,或者可以在替代靶的3’端额外包括用于抑制核酸聚合的官能团或寡核苷酸。在本发明中,用于抑制核酸聚合的官能团或寡核苷酸可以选自胺基、磷酸基、烷基、链烷二醇、硫代磷酸酯、生物素、非核苷酸接头、c3-18间隔子、双脱氧核苷三磷酸(ddntp)、反向(inverted)脱氧核苷三磷酸(反向dntp)和反向双脱氧核苷三磷酸(反向ddntp)中的一种或多种,但不限于此。在本发明中,靶特异性引物、替代靶和扩增引物的每一个可以由寡核苷酸、lna(锁核酸)和pna(肽核酸)中的任何一种或者两种或更多种的组合物组成。在本发明中,可以使用替代靶而无需特别限制,只要它是通过靶特异性引物和扩增引物诱导融合扩增子形成并且能够与靶核酸杂交的核酸即可。优选地,替代靶可以是制备成具有10至500个核苷酸的长度的寡核苷酸。更优选地,替代靶可以是制备成具有20至150个核苷酸的长度的单链寡核苷酸。在本发明中,与靶核酸结合的替代靶的一部分与替代靶的任意序列的比率可以为6∶4至2∶8,但不限于此。在本发明中,与靶核酸结合的替代靶的部分可以包含具有40至80℃的熔解温度(tm)的10至50个核苷酸的序列,但不是限于此。在本发明中,替代靶的任意序列可以是10至100个核苷酸的序列,并且可以被任意地确定从而与靶核酸不互补,或者可以从衍生自不同于靶核酸的物种的物种的基因组核苷酸序列中被确定,但不限于此。在本发明中,替代靶可以进一步包含间隔子,其为单链寡核苷酸。间隔子可以是1至100个核苷酸的序列,更优选2至20个核苷酸的序列。在本发明中,间隔子的gc含量可以为30%或更低,更优选5至30%,最优选1至10%。在本发明中,术语“间隔子”是指除了与扩增引物杂交的序列或替代靶中所包含的任意序列中的扩增引物所包含的序列之外的序列。间隔子的作用是阻止与靶核酸和扩增引物杂交或扩增引物中包含的替代靶的序列区彼此之间过于靠近或彼此重叠。间隔子的作用是控制融合扩增子的gc含量。另外,甚至在必要时通过使用能够与间隔子结合的探针,相同的探针也可以检测不同的靶核酸。在本发明的一个实施例中,证实了当使用不具有间隔子的替代靶时,扩增效率降低。在本发明中,替代靶可以与靶核酸的链杂交,该链与靶特异性引物杂交的链相同或相反。在本发明中,融合扩增子的长度可以为50bp至1kbp,并且可以具有35至65%、更优选为40至60%的gc含量。在本发明中,靶特异性引物可以不与替代靶互补,并且可以不与替代靶杂交,或者甚至当其与替代靶部分杂交时,核酸的合成延伸也可能不发生。扩增引物可以不与靶核酸互补,并且可以不与靶核酸杂交,并且甚至当其与靶核酸部分杂交时,也可能不会发生核酸的合成延伸。在本发明中,可以使用能够结合融合扩增子的核酸结合染料或探针来进行确定融合扩增子的存在或不存在的步骤(c)。在本发明中,可以使用核酸结合染料而无特别限制,只要其是嵌入剂或dna小沟结合剂即可。优选地,核酸结合染料选自溴化乙锭、greeni、gold、evagreen、yo-pro-1、syto、bebo和bexto。在本发明中,能够与融合扩增子结合的探针可以选自寡核苷酸、lna、pna及其混合物。pna(肽核酸)是一种dna类似物,包含通过肽主链而不是糖-磷酸盐主链连接的核酸碱基,并且于1991年由nielsen等人首先合成。pna是人工合成的作为基因识别剂的一种,如lna(锁核酸)或mna(吗啉代核酸),并且具有由聚酰胺组成的基本骨架。pna具有出色的亲和力和选择性,对核酸酶高度稳定,因此不会被现有的限制酶降解。另外,其具有的优点在于其具有优异的物理性质并且在热/化学上高度稳定,因此易于长时间保存。pna通过与具有互补核苷酸序列的天然核酸杂交形成双链。当长度相同时,pna/dna双链比dna/dna双链更稳定,而pna/rna双链比dna/rna双链更稳定。另外,pna比天然核酸具有更好的检测snp(单核苷酸多态性)的能力,因为其由于单碱基错配而引起的双链不稳定性更大。也就是说,pna-dna的亲和力远高于dna-dna的亲和力,尽管存在一个核苷酸错配,但pna-dna的熔解温度(tm)差异通常约为15至20℃。利用结合亲和力的这种差异,可以检测核苷酸序列的变化,例如单核苷酸多态性(snp)和插入/缺失(in/del)。在本发明中,能够与融合扩增子结合的探针可以具有与包括任意核苷酸序列和靶核酸序列的融合扩增子中的任何核苷酸序列部分或全部互补的核苷酸序列。优选地,可以将报道分子(reporter)和淬灭剂连接到探针的两端。在本发明中,当探针中的报道分子与淬灭剂之间的距离短时,抑制了来自探针的信号的产生,并且随着报道分子与淬灭剂之间的距离变长,信号强度增加。通常,当探针与互补核苷酸序列杂交时,报道分子和淬灭剂之间的距离变得最长,因此可以通过信号产生的增加或信号强度的增加来检测特定的核苷酸序列。在本发明中,报道分子可以是选自荧光素、荧光素氯三嗪基、若丹明绿、若丹明红、四甲基若丹明、fitc、俄勒冈绿(oregongreen)、alexafluor、fam、joe、rox、hex、德克萨斯红(texasred)、tet、tritc、tamra、花青基染料和噻二碳杂花青染料中的一种或多种荧光物质。在本发明中,淬灭剂可以选自dabcyl、tamra、eclipse、ddq、qsy、blackberry淬灭剂(blackberryquencher)、blackhole淬灭剂(blackholequencher)、qxl、爱荷华黑fq(iowablackfq)、爱荷华黑rq(iowablackrq)和irdyeqc-1中的一种或多种。在本发明的一个优选实施方案中,融合扩增子的检测通过实时pcr进行。具体地,可以通过从通过融合扩增子的扩增获得的扩增曲线中测量ct(循环阈值)值,或者从在聚合酶链式反应之后获得的熔解曲线中测量探针的熔解峰,或者综合考虑从获得的扩增曲线和熔解曲线的两个结果,来检测融合扩增子,但不限于此。由于融合扩增子因样品中存在靶核酸而较早扩增,检测探针产生的信号量较早增加,因此达到阈值的循环数减少并且低的ct值被测量。基于该ct值,可以确定靶核酸的存在或不存在。另外,通常在实时聚合酶链式反应中的核酸扩增后进行熔解曲线分析。具体地,在将样品的温度降低至低温(约25至55℃),然后以每1到10秒0.3至1℃的速率升高至高温(约75至95℃)的同时测量信号图案,或将样品温度升高到高温,然后以每1到10秒0.3到1℃的速率降低到低温。如果融合扩增子已被扩增,则通过熔解曲线分析,信号图谱的变化会出现在与融合扩增子结合的探针的熔解温度(tm)附近,并且可以通过将该变化作为融合峰来鉴定扩增子。在本发明中,步骤(b)可以进一步包括添加辅助引物,该辅助引物和与靶特异性引物杂交的靶核酸链相反的链杂交。即,如果靶特异性引物与靶核酸的有义链杂交,则辅助引物与靶核酸的反义链杂交。在本发明中,辅助引物具有通过与靶特异性引物配对而增加某些靶核酸区的量的作用。辅助引物可以与替代靶不互补并且可以不与替代靶杂交,或者即使当它与替代靶部分杂交时,也可能不会发生核酸的合成延伸。在本发明中,辅助引物的主要作用是在靶核酸量非常小的条件下,通过增加靶核酸的量(拷贝数)来提高融合扩增子的产生率。如果在本发明中使用辅助引物,则聚合酶链式反应(pcr)可以按以下两个步骤进行:1)“靶核酸扩增步骤”,其中靶特异性引物和辅助引物彼此配对以诱导主要的合成反应;和2)“融合扩增子扩增步骤”,其中靶特异性引物、替代靶和扩增引物起作用以诱导主要扩增融合扩增子。在本发明中,该步骤的细分主要通过具体地调节退火步骤的温度来实施,该退火步骤在聚合酶链式反应(pcr)的逐步和重复热循环期间诱导元件之间的杂交。优选地,在靶核酸扩增步骤中,可以将退火步骤的温度设置为高,并且可以将靶特异性引物和辅助引物的熔解温度(tm)设置为高,以使通过靶特异性引物和辅助引物的靶核酸的扩增可以优先发生。在融合扩增子扩增步骤中,可以降低退火步骤的温度,并且可以将扩增引物的熔解温度和替代靶的靶核酸结合位点设置得较低,从而诱导融合扩增子的扩增。此时,如果限制辅助引物的量,则辅助引物在靶核酸扩增步骤中大部分被耗尽,因此,可以完成两步聚合酶链式反应,其中对于参与反应的每个步骤只需要必需的元件。另一方面,本发明涉及用于扩增靶核酸的聚合酶链式反应(pcr)组合物,该组合物包含:i)至少一种能够与靶核酸杂交的靶特异性引物;ii)至少一种替代靶,其包含与靶核酸区域结合的序列以及不与靶核酸结合的任意序列,其中所述靶核酸区域与所述靶特异性引物不结合;和iii)至少一种能够扩增替代靶的扩增引物。在本发明中,组合物可进一步包含辅助引物,该辅助引物和与靶特异性引物杂交的靶核酸链相反的链杂交。即,如果靶特异性引物与靶核酸的有义链杂交,则辅助引物与靶核酸的反义链杂交。如本文所用,术语“样品”包括各种样品。优选地,使用本发明的方法分析生物样品。更优选地,样品可以是含有病毒种类的样品,或者是来自被病毒感染的个体(例如人、哺乳动物和鱼等)的样品,并且也可以分析植物、动物、人、真菌、细菌和病毒来源的生物学样品。当分析哺乳动物或人类来源的样品时,该样品可以源自特定的组织或特定的器官。组织的典型示例包括结缔组织、皮肤组织、肌肉组织或神经组织。器官的典型示例包括眼、脑、肺、肝、脾、骨髓、胸腺、心脏、淋巴液、血液、骨骼、软骨、胰腺、肾脏、胆囊、胃、小肠、睾丸、卵巢、子宫、直肠、神经系统、腺体和内部血管。待分析的生物样品包括来自生物来源的任何细胞、组织或流体,或可通过本发明有利地分析的任何其他介质,包括从人类患者采集的样品、从动物采集的样品或从旨在供人或动物食用的食物中提取的样品。此外,要分析的生物学样品包括体液样品,包括但不限于血液、血清、血浆、淋巴液、母乳、尿液、粪便、眼液、唾液、精液、脑提取物(例如脑匀浆)、脊髓液、阑尾、脾和扁桃体组织提取物。在另一方面,本发明涉及用于检测核酸的试剂盒,该试剂盒包含组合物。在本发明中,试剂盒可以任选地包含进行靶核酸扩增反应(例如pcr)所需的试剂,例如缓冲液、dna聚合酶、dna聚合酶辅因子和脱氧核苷酸-5-三磷酸酯(dntp)。或者,本发明的试剂盒还可以包含各种寡核苷酸分子、逆转录酶、各种缓冲液和试剂以及抑制dna聚合酶活性的抗体。另外,已经实施本文阐述的公开内容的本领域技术人员可以容易地确定试剂盒中特定反应中使用的试剂的最佳量。通常,本发明的试剂盒可以制成包含上述成分的单独包装或隔室制造。在一个实施方案中,试剂盒可包括包含样品的分隔的载体装置、包含试剂的容器、包含替代靶和引物的容器以及包含用于检测扩增子的探针的容器。该载体装置适于被分隔成一个或多个容器,例如小瓶、试管等,每个容器包括要在本发明的方法中使用的分开的元件。在本发明的说明书中,本领域技术人员可以容易地在容器中分配必要的试剂。在下文中,将参考实施例更详细地描述本发明。对于本领域技术人员而言显而易见的是,这些实施例仅用于说明本发明,并且本发明的范围不受这些实施例的限制。实施例1.表皮生长因子受体(egfr)基因的扩增和检测1.1引物、替代靶和探针的制备已知人egfr基因编码在人体信号系统中起作用的膜蛋白和受体蛋白,如果egfr基因发生突变,则可能引起癌症(zhang,h.等,j.clin.invest.2007.117:2051-2058)。为了通过本发明的新型靶核酸扩增方法有效地扩增和检测上述人egfr基因,设计能够与egfr基因的外显子20的密码子790附近的区域特异性杂交的靶特异性引物1和替代靶1,并且设计和制备能够与替代靶1杂交的扩增引物1(integrateddnatechnologies,inc.,usa)。另外,探针1的设计和制备使其可以检测由设计的引物和替代靶(韩国panageneinc.)产生和扩增的融合扩增子。表1和表2示出了每种引物、替代靶和探针的核苷酸序列。[表1]引物和替代靶的序列[表2]检测探针的序列名称seqidno核苷酸序列(n端→c端)探针1seqidno18[dabcyl]-cacaggcttc-[o接头]-[k]-[rox]替代靶1被制备为具有56个核苷酸的长度的单链寡核苷酸,并且在替代靶1的5′端和3′端分别存在由六个胸腺嘧啶(t)碱基和六个腺嘌呤(a)碱基组成的寡核苷酸,以防止替代靶直接起引物的作用。在替代靶1的核苷酸序列中,带下划线的核苷酸序列与人egfr基因的靶核苷酸序列互补,并且斜体的核苷酸序列与扩增引物1的核苷酸序列互补。探针1制备为10个核苷酸的pna,淬灭剂[dabcyl]和报道分子[rox]分别连接在pna的n端和c端。pna和[rox]通过[o接头]和[k(赖氨酸)]相互连接。当探针1与具有互补核苷酸序列的融合扩增子杂交时,淬灭剂和报道分子之间的距离最长,此时,来自报道分子的信号(荧光)值达到最大,因此可以通过测量信号检测融合扩增子。探针1具有与替代靶1的一部分相同的核苷酸序列,由此探针1不直接与替代靶1杂交,但是可以与通过扩增引物1与替代靶1杂交产生的核酸聚合产物杂交。然而,由于在聚合酶链式反应(pcr)中添加的替代靶1的量非常小,因此仅通过探针1与通过扩增引物1与替代靶1的简单杂交产生的核酸聚合物的杂交就不会在扩增曲线上发出可检测信号。为了通过探针1发出扩增曲线上的可检测信号,应产生包含替代靶1核苷酸序列一部分的融合扩增子,并且与探针1杂交的核酸聚合产物的量应该通过靶特异性引物1和扩增引物1与融合扩增子的杂交以及融合子的扩增而大幅增加。1.2融合扩增子的产生和鉴定为了在其中存在约10,000个拷贝的靶核酸的条件下形成预期的融合扩增子,制备了包含1.5pmole的靶特异性引物1、30pmole的扩增引物1、10fmol的替代靶1和2pmole的探针1的聚合酶链式反应(pcr)组合物。聚合酶链式反应组合物含有通常用于聚合酶链式反应的dna聚合酶,以及例如缓冲液、脱氧核苷酸-5-三磷酸酯(dntp)、氯化钾(kcl)、氯化镁(mgcl2)和去污剂等成分。通过热循环仪进行聚合酶链式反应的温度控制,并且聚合酶链式反应在以下条件下进行:初始变性[在95℃持续15分钟],然后进行45个循环,每个循环包括变性[在95℃持续10秒]-退火[在60℃持续20秒]-延伸[在72℃持续20秒]。对于每个循环,通过测量rox通道的荧光值获得扩增曲线。在聚合酶链式反应之后,为了获得反应产物的熔解曲线,使反应产物变性[在95℃持续5分钟]-退火[在35℃持续5分钟]-熔解[以0.5℃的间隔从35℃至75℃],并且分析在熔解步骤中测得的荧光值以获得熔解峰结果。结果,在存在约10,000个靶核酸的条件下,观察到扩增曲线上的荧光信号上升,在不存在靶核酸的条件下,荧光信号没有升高。因此,这两个条件可以清楚地相互区分。另外,在存在靶核酸的条件下,在56℃附近出现非常高的熔解峰,而在不存在靶核酸的条件下,虽然在56℃附近观察到了熔解峰,但是其高度明显较低。因此,还可以通过熔解曲线上的熔解峰的高度的差异来区分这两个条件(图9)。实施例2.使用包含辅助引物的组合物扩增和检测表皮生长因子受体2.1辅助引物的合成为了使用本发明的靶核酸扩增方法以高灵敏度检测上述人egfr基因,设计并制备了靶特异性引物1、替代靶1、扩增引物1、探针1和能够与egfr基因特异性杂交的辅助引物1(integrateddnatechnologies,inc.,美国)。表3和表4显示了每种引物、替代靶和探针的核苷酸序列。[表3]引物和替代靶的序列[表4]检测探针的序列名称seqidno核苷酸序列(n端→c端)探针1seqidno:18[dabcyl]-cacaggcttc-[o接头]-[k]-[rox]2.2包含辅助引物的融合扩增子的产生和鉴定为了在其中存在约10到10,000个靶核酸拷贝的条件下形成预期的融合扩增子,制备包含1.5pmole的靶特异性引物1、30pmole的扩增引物1、0.5pmole的辅助引物1、10fmol的替代靶1和2pmole的探针1的聚合酶链式反应(pcr)组合物。聚合酶链式反应组合物含有通常用于聚合酶链式反应的dna聚合酶,以及例如缓冲液、脱氧核苷酸-5-三磷酸酯(dntp)、氯化钾(kcl)、氯化镁(mgcl2)和去污剂等成分。使用一般的热循环仪进行聚合酶链式反应的温度控制,并且聚合酶链式反应在以下条件下进行:初始变性[在95℃持续15分钟],然后进行15个循环,每个循环包括变性[在95℃持续10秒]-退火[在64℃持续20秒]-延伸[在72℃持续20秒],这是第一个循环步骤,随后是30个循环,每个循环都由变性[在95℃持续10秒钟]-退火[在60℃持续20秒]-延伸[在72℃持续20秒],这是第二个循环步骤。对于第二循环步骤中的每个循环,通过测量rox通道的荧光值获得扩增曲线。在聚合酶链式反应后,为了获得反应产物的熔解曲线,使反应产物变性[在95℃持续5分钟]-退火[在35℃持续5分钟]-熔解[以0.5℃的间隔从35℃至75℃],并且分析在熔解步骤中测得的荧光值以获得熔解峰结果。结果,在存在约10至10,000拷贝的靶核酸的所有条件下,在扩增曲线上观察到荧光信号的升高,并且在靶核酸不存在的条件下,荧光信号没有升高。因此,这两个条件可以清楚地区分。另外,在存在靶核酸的条件下,在56℃附近出现非常高的熔解峰,而在不存在靶核酸的条件下,即使在56℃附近观察到熔解峰,其高度也显著降低。因此,还可以通过熔解曲线上的熔解峰的高度的差异来区分这两个条件(图10)。实施例3.使用各种类型的替代靶扩增和检测表皮生长因子受体3.1引物、替代靶和探针的制备为了使用各种类型的替代靶扩增和检测上述人egfr基因,设计了靶特异性引物2、替代靶1、替代靶2、替代靶3以及辅助引物1,其能够特异性地与egfr基因的外显子20的密码子790附近的区域杂交,并且设计和制备了扩增引物1,其能够与替代靶1或2杂交并与替代靶3的核苷酸序列的一部分相同的核苷酸序列杂交(integrateddnatechnologies,inc.,美国)。另外,探针2的设计和制备使其可以检测由设计的引物和替代靶(panageneinc.,韩国)产生和扩增的融合扩增子。每个引物、每个替代靶和探针的核苷酸序列示于表5和6。[表5]引物和替代靶的序列[表6]检测探针的序列名称seqidno核苷酸序列(n端→c端)探针2seqidno:19[dabcyl]-ctcatcatgcag-[k]-[fam]替代靶2制备为长度为50个核苷酸的单链寡核苷酸,为了防止替代靶作为引物直接起作用,在替代靶2的3′端存在一个由六个腺嘌呤(a)碱基组成的序列。在替代靶2的核苷酸序列中,带下划线的核苷酸序列与人egfr基因的靶核苷酸序列互补,并且斜体的核苷酸序列与扩增引物1的核苷酸序列互补。替代靶3被制备为具有44个核苷酸的长度的单链寡核苷酸。替代靶3中下划线标记的核苷酸序列与人egfr基因的靶标核苷酸序列互补,并且斜体核苷酸序列与扩增引物1的核苷酸序列相同。探针2被制备为12个核苷酸的pna,并且淬灭剂[dabcyl]和报道分子[fam]分别连接在pna的n端和c端。pna和[fam]通过[k]链接。当探针2与具有互补核苷酸序列的融合扩增子杂交时,淬灭剂和报道分子之间的距离最长,此时,来自报道分子的信号(荧光)值达到最大,因此可以通过测量该信号检测融合扩增子。3.2融合扩增子的产生和鉴定为了在存在约100个拷贝的靶核酸的条件下形成预期的融合扩增子,制备包含1.5pmole的靶特异性引物2、30pmole的扩增引物1和4pmole的探针2的聚合酶链式反应(pcr)组合物。另外,添加10fmol的从替代靶1、替代靶2和替代靶3中选择一种,或者将10fmol的替代靶2和10fmol的替代靶3一起添加。聚合酶链式反应组合物包含通常用于聚合酶链式反应的dna聚合酶,以及例如缓冲液、脱氧核苷酸-5-三磷酸酯(dntp)、氯化钾(kcl)、氯化镁(mgcl2)和去污剂等成分。在替代靶1的情况下,可以通过包括图5和图6所示的机制的方法形成融合扩增子。在替代靶2的情况下,可以通过包括图4所示的机制的方法形成融合扩增子,在替代靶3的情况下,可以通过包括图7所示机制的方法产生融合扩增子。聚合酶链式反应的温度控制可以通过一般的热循环仪进行,聚合酶链式反应在以下条件下进行:初始变性[在95℃持续15分钟],然后进行15个循环,每个循环包括变性[在95℃持续10秒]-退火[在64℃持续30秒]-延伸[在72℃持续20秒],这是第一循环步骤,随后是35个循环,每个循环由变性[在95℃持续10秒]-退火[在60℃持续20秒]-延伸[在72℃持续20秒],这是第二循环步骤。对于第二循环步骤中的每个循环,通过测量fam通道的荧光值获得扩增曲线。在聚合酶链式反应后,为了获得反应产物的熔解曲线,将反应产物进行变性[在95℃持续5分钟]-退火[在35℃持续5分钟]-熔解[以0.5℃的间隔从35℃至75℃],并且分析在熔解步骤中测得的荧光值以获得熔解峰结果。结果,在存在约100个拷贝的靶核酸的所有扩增条件下,在扩增曲线上观察到荧光信号的升高,而在不存在靶核酸的条件下没有观察到荧光信号的升高。因此,这两个条件可以清楚地区分。另外,在存在靶核酸的条件下,在52℃附近出现非常高的熔解峰,而在不存在靶核酸的条件下,在52℃附近未观察到熔解峰。因此,也可以通过该差异来区分这两个条件(图11)。实施例4.人hras基因中高gc含量区域的扩增4.1引物、替代靶和探针的制备已知人类hras基因编码一种参与细胞内信号传导系统的蛋白质,并且在对应于hras基因密码子12、13和61的区域中的突变与各种癌症的发生有关(rajasekharan,s.k.和raman,t.cent.eur.j.biol.2013.8:609-624)。与上述人hras基因的外显子2的密码子12和13相对应的区域具有接近70%的高的平均g/c含量,因此可能难以通过常规聚合酶链式反应(pcr)方法来高效扩增。因此,为了通过本发明的新型靶核酸扩增方法有效地扩增和检测该区域,设计了靶特异性引物3、替代靶4和辅助引物2,其能够与hras基因特异性杂交,设计并制备了能够与替代靶4杂交的扩增引物2(integrateddnatechnologies,inc.,美国)。另外,探针3的设计和制备使其可以检测由设计的引物和替代靶(panageneinc.,韩国)产生和扩增的融合扩增子。表7和表8显示了每种引物、替代靶和探针的核苷酸序列。[表7]引物和替代靶的序列[表8]检测探针的序列名称seqidno核苷酸序列(n端→c端)探针3seqidno:20[dabcyl]-[k]-[dabcyl]-cac^cg^ctgg-[o接头]-[k]-[rox]替代靶4被制备为具有56个核苷酸的长度的单链寡核苷酸,并且在替代靶4的5′端和3′端分别存在由六个胸腺嘧啶(t)碱基和六个腺嘌呤(a)碱基组成的寡核苷酸,以阻止替代靶直接作为引物起作用。在替代靶4的核苷酸序列中,带下划线的核苷酸序列与人hras基因的靶核苷酸序列互补,并且斜体的核苷酸序列与扩增引物2的核苷酸序列互补。探针3制备为9个核苷酸的pna,两个通过[k(赖氨酸)]相互连接的淬灭剂[dabcyl]连接在pna的n末端,并在pna的c端连接了报道分子[rox]。pna和[rox]通过[o接头]和[k(赖氨酸)]相互连接。另外,在探针3的核苷酸序列中由[^]表示的部分,将带正电的官能团(谷氨酸)连接至pna主链,从而将电荷引入到最初不带电的pna主链中。当探针3与具有互补核苷酸序列的融合扩增子杂交时,淬灭剂和报道分子之间的距离最长,此时,来自报道分子的信号(荧光)值达到最大,因此可以通过测量该信号检测融合扩增子。探针3的核苷酸序列的特征在于它不与靶特异性引物3、扩增引物2、替代靶4和辅助引物2中的任何一个互补,但与由辅助引物2引起的靶核酸扩增子以及在包含替代靶4的核苷酸序列的一部分的融合扩增子中的扩增引物2引起的扩增子链互补。但是,由于辅助引物2的添加量非常小,并且靶特异性引物3(其与辅助引物配对)的添加量相对较大,仅通过探针3与辅助引物2引起的靶核酸扩增子链的杂交就不能发出可检测的信号。另一方面,可扩增融合扩增子扩增引物2被大量添加,并且配对的靶特异性引物3以相对少量添加,因此当探针3与在融合扩增子中的由扩增引物2引起的扩增子链杂交时,可以有效地发射信号,从而仅融合扩增子可以被选择性地检测。4.2融合扩增子的产生和鉴定为了在其中存在约25ng的提取的人基因组dna的条件下形成预期的融合扩增子,制备包含1.5pmole的靶特异性引物3、30pmole的扩增引物2、0.5pmole的辅助引物2、10fmole的替代靶4和4pmole的探针3的聚合酶链式反应组合物。聚合酶链式反应组合物含有通常用于聚合酶链式反应的dna聚合酶,以及例如缓冲液、脱氧核苷酸-5-三磷酸酯(dntp)、氯化钾(kcl)、氯化镁(mgcl2)和去污剂等成分。使用常规热循环仪进行聚合酶链式反应的温度控制,并在以下条件下进行聚合酶链式反应:初始变性[在95℃持续15分钟],然后进行15个循环,每个循环包括变性[在95℃持续10秒]-退火[在64℃持续20秒]-延伸[在72℃持续20秒],这是第一个循环步骤,随后是35个循环,每个循环均由变性[在95℃持续10秒]-退火[在60℃持续20秒]-延伸[在72℃持续20秒],这是第二个循环步骤。对于第二循环步骤中的每个循环,通过测量rox通道的荧光值获得扩增曲线。此外,为了与本发明的用于检测对应于hras基因的外显子2的密码子12和13的区域靶核酸扩增方法的性能进行比较,还使用常规聚合酶链式反应检测相同区域作为对照,并且通过从聚合酶链式反应组合物中排除替代靶4和扩增引物2并且将辅助引物2的量增加至30pmole,制备了用于控制聚合酶链式反应的组合物。使用常规热循环仪进行对照聚合酶链式反应的温度控制,并在以下条件下进行对照聚合酶链式反应:初始变性[在95℃持续15分钟],然后进行50个循环,每个循环包括变性[在95℃持续10秒]-退火[在60℃持续20秒]-延伸[在72℃持续20秒]。对于每个循环,通过测量rox通道的荧光值获得扩增曲线。结果证实,在存在约25ng提取的人类基因组dna的条件下,当使用本发明的靶核酸扩增方法时,对应于具有高g/c含量的hras外显子2的密码子12和13的区域的扩增效率明显变高。即,显示了通过使用包含替代靶4和扩增引物2的组合物形成融合扩增子来检测靶核酸的方法,与通过直接扩增检测靶核酸的常规方法相比,在检测具有高g/c含量的核酸时扩增曲线斜率急剧增加1.5倍,并且也显示出更高的扩增曲线高度(图12)。还通过由两个不同的荧光阈值引起的两个ct值之间的差计算扩增曲线的斜率,结果示于下表9中。[表9]本发明的靶核酸扩增方法与常规方法之间的扩增曲线斜率的比较实施例5.人类hras基因中高gc含量区域的扩增和检测5.1引物、替代靶和探针的制备为了有效地扩增和检测对应于人hras基因外显子2的密码子12和13的区域(该区域由于高g/c含量,难以通过常规的聚合酶链式反应(pcr)方法进行扩增和检测),通过本发明的新型靶核酸扩增方法,设计了靶特异性引物3、替代靶5、替代靶6和辅助引物2,其能够与hras基因特异性杂交,并且设计和制备了能够与替代靶5和替代靶6杂交的扩增引物1(integrateddnatechnologies,inc,美国)。另外,探针3的设计和制备使其可以检测由设计的引物和替代靶(panageneinc.,韩国)产生和扩增的融合扩增子。每种引物、每种替代靶和探针的核苷酸序列示于下表10和11中。[表10]引物和替代靶的序列[表11]检测探针的序列名称seqidno核苷酸序列(n端→c端)探针3seqidno:22[dabcyl]-[k]-[dabcyl]-cac^cg^ctgg-[o接头]-[k]-[rox]替代靶5被制备为具有50个核苷酸的长度的单链寡核苷酸。在替代靶5的核苷酸序列中,带下划线的核苷酸序列与人hras基因的靶核苷酸序列互补,并且斜体的核苷酸序列与扩增引物1的核苷酸序列相同。替代靶6被制备为具有60个核苷酸的长度的单链寡核苷酸。在替代靶6的核苷酸序列中,带下划线的核苷酸序列与人hras基因的靶核苷酸序列互补,并且斜体的核苷酸序列与扩增引物1的核苷酸序列相同。探针3被制备为9个核苷酸的pna,并且两个通过[k(赖氨酸)]彼此连接的淬灭剂[dabcyl]被连接在pna的n-末端,并且报道分子[rox]被连接在pna的c端。pna和[rox]通过[o接头]和[k(赖氨酸)]相互连接。另外,在探针3的核苷酸序列中由[^]表示的部分,将带正电的官能团(谷氨酸)连接至pna主链,从而将电荷引入到最初不带电的pna主链中。当探针3与具有互补核苷酸序列的融合扩增子杂交时,淬灭剂和报道分子之间的距离最长,此时,来自报道分子的信号(荧光)值达到最大,因此可以通过测量该信号检测融合扩增子。探针3的核苷酸序列的特征在于其与靶特异性引物3、扩增引物1、替代靶5、替代靶6和辅助引物2中的任何一个都不互补,但是与在包含替代靶5或替代靶6的核苷酸序列的一部分的融合扩增子中的由辅助引物2引起的靶核酸扩增子链以及由扩增引物引起的扩增子链互补。但是,由于添加的辅助引物2的量非常小并且靶特异性引物3(其与辅助引物配对)的添加量相对较大,仅通过探针3与辅助引物2引起的靶核酸扩增子链的杂交就不能发出可检测的信号。另一方面,扩增融合扩增子的扩增引物1被大量添加,并且配对的靶特异性引物3以相对少量添加,因此,当探针3与在融合扩增子中的由扩增引物1引起的扩增子链杂交时,可以有效地发射信号,从而仅融合扩增子可以被选择性地检测。5.2融合扩增子的产生和鉴定为了在存在约25ng的提取的人基因组dna的条件下形成预期的融合扩增子,制备了包含1.5pmole的靶特异性引物3、30pmole的扩增引物1、0.5pmole的辅助引物2、50fmole的替代靶5或替代靶6,以及4pmole的探针3的聚合酶链式反应组合物。聚合酶链式反应组合物包含通常用于聚合酶链式反应的dna聚合酶,以及例如缓冲液、脱氧核苷酸-5-三磷酸酯(dntp)、氯化钾(kcl)、氯化镁(mgcl2)和去污剂等成分。通过通用热循环仪进行聚合酶链式反应的温度控制,并且聚合酶链式反应在以下条件下进行:初始变性[在95℃持续5分钟],然后进行15个循环,每个循环包括变性[在95℃持续20秒]-退火[在64℃持续20秒]-延伸[在72℃持续20秒],作为第一个循环步骤,随后是35个循环,每个循环均由变性[在95℃持续20秒]-退火[在60℃持续20秒]-延伸[在72℃持续20秒],作为第二个循环步骤。在聚合酶链式反应后,为了获得反应产物的熔解曲线,使反应产物变性[在95℃持续5分钟]-退火[在25℃持续5分钟]-熔解[以0.5℃的间隔从25℃至75℃],并分析在熔解步骤中测得的rox通道的荧光值,以获得熔解峰结果。此外,为了与用于检测与hras基因的外显子2的密码子12和13相对应的区域的本发明的靶核酸扩增方法的性能进行比较,也进行了使用常规聚合酶链式反应检测相同区域作为对照,并且用于对照的聚合酶链式反应的组合物通过从该聚合酶链式反应组合物中排除替代靶5、替代靶6和扩增引物1并增加包含辅助引物2的对照引物的添加量至30pmole来制备。所用对照引物的核苷酸序列示于下表12。[表12]对照引物的序列使用常规热循环仪进行控制聚合酶链式反应的温度控制,并在以下条件下进行聚合酶链式反应:初始变性[在95℃持续5分钟],然后进行15个循环,每个循环包括变性[在95℃持续20秒]-退火[在64℃持续20秒]-延伸[在72℃持续20秒],作为第一个循环步骤,随后是35个循环,每个循环由变性[在95℃持续20秒]-退火[在60℃持续20秒]-延伸[在72℃持续20秒],作为第二循环步骤。在聚合酶链式反应后,为了获得反应产物的熔解曲线,使反应产物变性[在95℃持续5分钟]-退火[在25℃持续5分钟]-熔解[以0.5℃的间隔从25℃至75℃],分析在熔解步骤中测得的rox通道的荧光值,得出熔解峰结果。此外,为了检查通过本发明的靶核酸扩增方法检测hras的外显子2的密码子12和13以及对照聚合酶链式反应是否可能是假阳性的,在其中存在约25ng的提取的人类基因组dna的条件下以及在其中不添加靶核酸的条件下(无模板对照(ntc)),进行了测试。结果,证实了当使用本发明的靶核酸扩增方法时,在添加人基因组dna的条件下,可以正常实现具有高g/c含量的hras外显子2的密码子12和13的区域的扩增和检测,并且在未添加靶核酸的条件下,未在熔解曲线上形成熔解峰,这表明没有假阳性。此时,已确认融合扩增子中靶核酸区域的g/c含量高达63.1%,但是使用任何替代靶5和替代靶6的核苷酸序列获得的融合扩增子的g/c含量分别降至55.8%和52.4%。另一方面,当使用常规的聚合酶链式反应作为对照时,试图通过产生g/c含量分别为63.1%,68.4%和69.8%的三种类型的扩增子来检测靶核酸,但是出现了许多假阳性,导致难以相信该检测结果(当通过扩增子1和扩增子2检测靶核酸时)。另外,在这种情况下,由熔解峰显示的熔解温度超出正常范围(当通过扩增子2检测靶核酸时),或者熔解峰异常形成(当通过扩增子3检测靶核酸时),因此,难以扩增和检测靶核酸(图13)。实施例6.调节人表皮生长因子受体基因检测的灵敏度6.1引物、替代靶和探针的制备当通过本发明的靶核酸扩增方法检测上述人egfr基因时,为了任意地调节检测灵敏度,同时使对扩增效率的影响最小化,设计并制备了靶特异性引物4、替代靶7和辅助引物1,其能够与egfr基因特异性杂交,并且设计并制备了能够与替代靶7特异性杂交的扩增引物3,以及能够与包含替代靶7的一部分的产生的融合扩增子杂交的探针2(引物和替代靶由美国integrateddnatechnologies,inc.制造,探针由韩国panageneinc.制造)。每种引物、替代靶和探针的核苷酸序列示于下表13和14中。[表13]引物和替代序列[表14]检测探针的序列名称seqidno核苷酸序列(n端→c端)探针2seqidno:21[dabcyl]-ctcatcatgcag-[k]-[fam]替代靶7被制备为具有52个核苷酸长度的单链寡核苷酸,并且在替代靶7的5′端和3′端分别存在由六个胸腺嘧啶(t)碱基和六个腺嘌呤(a)碱基组成的寡核苷酸,以防止替代靶作为引物直接起作用。在替代靶7的核苷酸序列中,带下划线的核苷酸序列与人egfr基因的靶核苷酸序列互补,并且斜体的核苷酸序列与扩增引物3的核苷酸序列互补。6.2具有调节的替代靶的添加量的融合扩增子的产生和扩增的确认为了在存在约1,000,000个拷贝的靶核酸的情况下形成预期的融合扩增子的同时调节由ct值表示的靶核酸检测的灵敏度,添加了不同量(0.01至10fmole)的替代靶7至聚合酶链式反应组合物,该组合物包含1.5pmole的靶特异性引物4、30pmole的扩增引物3、0.5pmole的辅助引物1和4pmole的探针2。即,最初以10fmole的量添加的替代靶7被稀释1倍、0.1倍、0.01倍和0.001倍,分别以10fmole、1fmole、0.1fmole和0.01fmole的量添加。聚合酶链式反应组合物含有通常用于聚合酶链式反应的dna聚合酶,以及例如缓冲液、脱氧核苷酸-5-三磷酸酯(dntp)、氯化钾(kcl)、氯化镁(mgcl2)和去污剂等成分。通过常规热循环仪进行聚合酶链式反应的温度控制,并且聚合酶链式反应在以下条件下进行:初始变性[在95℃持续15分钟],然后进行15个循环,每个循环包括变性[在95℃持续10秒]-退火[在64℃持续20秒]-延伸[在72℃持续20秒],这是第一个循环步骤,随后是35个循环,每个循环都由变性[在95℃持续10秒]-退火[在58℃持续20秒]-延伸[在72℃持续20秒],这是第二个循环步骤。对于第二循环步骤中的每个循环,通过测量fam通道的荧光值获得扩增曲线。此外,为了与本发明的靶核酸扩增方法用于调节egfr基因检测的灵敏度方面的性能进行比较,也进行了使用常规的聚合酶链式反应作为对照来对同一区域的检测和灵敏度调节。通过从聚合酶链式反应组合物中排除替代靶7和扩增引物3,将靶特异性引物1.5pmole和辅助引物30pmole稀释1倍、0.5倍、0.25倍、0.1倍和0.01倍,然后添加稀释液,制备用于对照的聚合酶链式反应组合物。使用常规热循环仪进行对照聚合酶链式反应的温度控制,并在以下条件下进行对照聚合酶链式反应:初始变性[在95℃持续15分钟],然后进行50个循环,每个循环包括变性[在95℃持续10秒]-退火[在58℃持续20秒]-延伸[在72℃持续20秒]。对于每个循环,通过测量fam通道的荧光值获得扩增曲线。结果,观察到,当使用本发明的靶核酸扩增方法时,随着替代靶7的添加量的减少,扩增曲线的上升被持续延迟,因此通过逐渐增加ct值来调整灵敏度。此外,在这种情况下,可以确认,即使扩增曲线的上升被延迟,扩增曲线的斜率也几乎保持恒定,因此对扩增效率的影响最小化。另一方面,在对照的常规方法中,其中调节了靶特异性引物和辅助引物的添加量,观察到类似地出现了扩增曲线的上升被延迟的现象,但是随着扩增曲线的上升被延迟,扩增曲线的斜率明显降低。由此,证实了在常规方法中,灵敏度的调节对扩增效率具有很大的影响,并且当引物的添加量显著减少时,不会发生靶核酸扩增(图14)。实施例7.人表皮生长因子受体基因和hras基因的多重扩增和检测7.1引物、替代靶和探针的制备为了有效地同时扩增和检测上述人egfr基因和hras基因,设计了靶特异性引物2、替代靶2、替代靶3和辅助引物1,其能够与egfr基因外显子20的790位密码子附近的区域特异性杂交,并设计和制备了能够与替代靶2杂交并且具有与替代靶3的核苷酸序列的一部分相同的序列的扩增引物1(integrateddnatechnologies,inc.,美国)。另外,探针2的设计和制备使其可以检测由设计的引物和替代靶(panageneinc.,韩国)产生和扩增的融合扩增子。此外,设计了靶特异性引物5、替代靶8、替代靶9和辅助引物2,其能够与hras基因的外显子2的密码子12和13对应的区域特异性杂交,并设计和制备了扩增引物1,其能够与替代靶8杂交并且具有与替代靶9的核苷酸序列的一部分相同的序列(integrateddnatechnologies,inc.,美国)。另外,设计并制备了探针3,以使其可以检测由设计的引物和替代靶产生和扩增的融合扩增子(panageneinc.,韩国)。每种引物、每种替代靶和每种探针的核苷酸序列示于下表15和16中。[表15]引物和替代靶的序列[表16]检测探针的序列名称seqidno核苷酸序列(n端→c端)探针2seqidno:21[dabcyl]-ctcatcatgcag-[k]-[fam]探针3seqidno:22[dabcyl]-[k]-[dabcyl]-cac^cgg^ctgg-[o接头]-[k]-[rox]替代靶8被制备为具有48个核苷酸长度的单链寡核苷酸,并且在替代靶8的3′端存在由六个腺嘌呤(a)碱基组成的寡核苷酸,以防止替代靶作为引物直接起作用。在替代靶8的核苷酸序列中,带下划线的核苷酸序列与人hras基因的靶核苷酸序列互补,并且斜体的核苷酸序列与扩增引物1的核苷酸序列互补。替代靶9被制备为具有42个核苷酸长度的单链寡核苷酸。在替代靶9的核苷酸序列中,带下划线的核苷酸序列与人hras基因的靶核苷酸序列互补,并且斜体的核苷酸序列与扩增引物1的核苷酸序列相同。7.2通过产生融合扩增子进行多重检测为了通过在其中约1,000,000份拷贝的人egfr基因靶标与10、100、1,000、10,000份拷贝的人hras基因靶标混合的条件下或者在其中100,000份拷贝的人hras基因靶标与10、100、1,000、10,000份拷贝的人egfr基因靶标的条件下形成预期的融合扩增子同时检测人egfr基因靶标和人hras基因靶标,制备了聚合酶链式反应组合物,其包含1.5pmole的靶特异性引物2、1.5pmole的靶特异性引物5、30pmole扩增引物1、0.5pmole的辅助引物1、0.5pmole的辅助引物2,10fmol的替代靶2,10fmole替代靶3、10fmol的替代靶8、10fmole的替代靶9、4pmole的探针2和4pmole的探针3。聚合酶链式反应组合物包含通常用于聚合酶链式反应的dna聚合酶,以及例如缓冲液、脱氧核苷酸-5-三磷酸酯(dntp)、氯化钾(kcl)、氯化镁(mgcl2)和去污剂等成分。使用常规热循环仪进行聚合酶链式反应的温度控制,并在以下条件下进行聚合酶链式反应:初始变性[在95℃持续15分钟],然后进行15个循环,每个循环包括变性[在95℃持续10秒]-退火[在64℃持续30秒]-延伸[在72℃持续20秒],这是第一个循环步骤,随后是35个循环,每个循环由变性[95℃持续10秒]-退火[在60℃持续20秒]-延伸[在72℃持续20秒],这是第二个循环步骤。在聚合酶链式反应之后,为了获得反应产物的熔解曲线,使反应产物变性[在95℃持续5分钟]-退火[在35℃持续5分钟]-熔解[以0.5℃的间隔从35℃至75℃],并分析在熔解步骤中测量的fam通道和rox通道的荧光值,以获得熔解峰结果。结果,观察到当使用本发明的靶核酸扩增方法时,即使在多个靶核酸不均匀混合的条件下,也可以同时完全检测出两个靶,即,在其中hras基因靶标的数量远远小于egfr基因靶标的数量(即1/10、1/100、1/1,000或1/10,000)的条件下)的条件下,或者在其中egfr基因靶标的数量远小于hras基因靶标的数量(即1/10、1/100、1/1,000或1/10,000)的条件下。而在作为对照的常规方法中,以相对大的量添加的基因靶标的检测是容易的,但是相对少量的基因靶标中混合有以相对大的量添加的基因靶标的同时检测是不稳定的(图15)。尽管已经参考特定特征详细描述了本发明,但是对于本领域技术人员而言显而易见的是,该描述仅是其优选实施例,并且不限制本发明的范围。因此,本发明的实质范围将由所附权利要求及其等同物来限定。工业实用性根据本发明的靶核酸扩增方法,可以任意调节聚合酶链式反应(pcr)产物的核苷酸序列的一部分,因此,对靶核酸的核苷酸序列的依赖被最小化。因此,即使由于区域的g/c含量过高而难以扩增的靶核酸的靶区域,也可以有效地进行其扩增。另外,由于可以在靶核酸互补核苷酸序列部分和替代靶的扩增引物互补核苷酸序列之间插入任意核苷酸序列,因此可以制备与该任意核苷酸序列杂交的通用探针。因此,即使改变靶核酸的核苷酸序列,该通用探针也可以有利地连续使用,因此可用于分子诊断、产前诊断、早期诊断、癌症诊断、遗传相关诊断、遗传特征诊断、感染性细菌的诊断、耐药菌的鉴定、法医学、生物种类鉴定等。另外,根据本发明的靶核酸扩增方法,可以通过控制添加的替代靶的量来容易地调节靶核酸扩增的灵敏度,并且,同时可以将该调节对扩增效率的影响最小化,因此可以更高效地执行诊断产品开发过程中的优化过程。序列表<110>帕那金股份有限公司<120>用于扩增靶核酸的方法及用于扩张靶核酸的组合物<130>pp-b2128<150>kr10-2017-0161453<151>2017-11-29<160>24<170>patentin版本3.5<210>1<211>17<212>dna<213>t790m-dfp23<400>1ctccaccgtgcagctca17<210>2<211>19<212>dna<213>t790m-dfp29<400>2acctccaccgtgcagctca19<210>3<211>17<212>dna<213>hrase2_drp10<400>3agcgcactcttgcccac17<210>4<211>17<212>dna<213>t790m-dfp14<400>4gccgcctgctgggcatc17<210>5<211>18<212>dna<213>hrase2_drp19<400>5ggtcagcgcactcttgcc18<210>6<211>20<212>dna<213>des1-dfp11<400>6catcaggagcagttacgaag20<210>7<211>19<212>dna<213>des1-dfp9<400>7aaccttagcacgaatagcg19<210>8<211>19<212>dna<213>des1-drp6<400>8gctgttgcttccgctattc19<210>9<211>56<212>dna<213>t790m-dat22:des1-dat-sf11<400>9ttttttctggactatgtccgggaacacaggcttcgtaactgctcctgatgaaaaaa56<210>10<211>50<212>dna<213>t790m-dat26:des1-dat-sf11<400>10ctggactatgtccgggaacacaggcttcgtaactgctcctgatgaaaaaa50<210>11<211>44<212>dna<213>t790m-dat_as6:des1-dat-sf11<400>11catcaggagcagttacgaagcctgtgttcccggacatagtccag44<210>12<211>56<212>dna<213>hrase2_dat-as4:des1-dat-sf9<400>12ttttttatattccgtcatcgctcctcaggaccgctattcgtgctaaggttaaaaaa56<210>13<211>50<212>dna<213>hrase2_dat17:des1-dat-sf11<400>13catcaggagcagttacgaagaataatgatgtgaggagcgatgacggaata50<210>14<211>60<212>dna<213>hrase2_dat18:des1-dat-sf11<400>14catcaggagcagttacgaagaataatgatgaataatgatgtgaggagcgatgacggaata60<210>15<211>52<212>dna<213>t790m-dat4:des1-dat-sr6<400>15ttttttcagctcatgcccttcggctaggaatagcggaagcaacagcaaaaaa52<210>16<211>48<212>dna<213>"hrase2_dat-as16:des1-dat-sf11"<400>16atattccgtcatcgctcctcggcttcgtaactgctcctgatgaaaaaa48<210>17<211>42<212>dna<213>hrase2_dat14:des1-dat-sf11<400>17catcaggagcagttacgaagccgaggagcgatgacggaatat42<210>18<211>21<212>dna<213>t790m-drp6<400>18gctatcccaggagcgcagacc21<210>19<211>22<212>dna<213>hrase2_dfp16<400>19tgtgggtttgcccttcagatgg22<210>20<211>10<212>dna<213>t790m-ddp1_22-sf11<400>20cacaggcttc10<210>21<211>12<212>dna<213>t790m-dp-chi3<400>21ctcatcatgcag12<210>22<211>9<212>dna<213>g12s_4_as<400>22caccgctgg9<210>23<211>20<212>dna<213>hrase2_dfp24<400>23tgaggagcgatgacggaata20<210>24<211>18<212>dna<213>hrase2_dfp26<400>24cctgtaggaggaccccgg18当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1