有机蓝色荧光材料及其制备方法、有机电致发光器件与流程
本发明属于有机光电材料应用技术领域,具体涉及一种有机蓝色荧光材料及其制备方法、有机电致发光器件。
背景技术:
有机电致发光器件(oled)具有轻薄美观、环境适应性强、可柔性显示等优势,作为新一代平面显示器具有广阔的市场应用前景。相比于红光和绿光材料而言,蓝光由于其带隙较宽,不利于电子和空穴的注入和传输,所以其器件效率较低,性能较差,不能实现商业化应用。为此,本专利旨在设计并合成新型结构的有机蓝色发光材料,进一步提高器件效率及其稳定性,达到改善器件性能的目的。
在有机电致发光器件(oled)中,外量子效率是评价器件性能的关键参数。影响外量子效率的因素很多,其中,激子利用率(ηs)和激子的发光效率(ηpl)是其中较为重要的影响因素。基于重金属原子配合物的有机磷光材料,其激子利用率(ηs)可接近100%,但其存在重金属原料价格昂贵、污染严重、高电流密度下器件外量子效率衰减严重等问题;相比于有机磷光材料而言,有机荧光材料具有成本低,污染小的优越性,便于推广应用和产业化生产,因而具有高外量子效率的有机荧光材料成为近几年的研究热点。众所周知,在有机荧光材料中,热活化延迟荧光(tadf)材料的三线态激子通过t1到s1的反向系间窜跃转换成单线态激子,从而有效地提高了激子的利用率(ηs),其激子利用率(ηs)超过90%,然而,这种材料的激子的发光效率(ηpl)较低,这对于外量子效率的提高也是不利的。为此,需要探索新的材料体系来有效平衡激子利用率(ηs)和激子发光效率(ηpl),在保证较高的激子利用率(ηs)的前提下,同时实现高的激子发光效率(ηpl),进一步提高外量子效率,从而有效地改善器件性能。
技术实现要素:
针对现有技术的缺陷,本发明的目的之一在于提供一种有机蓝色荧光材料。
本发明的目的之二在于提供一种有机蓝色荧光材料的制备方法。
本发明的目的之三在于提供一种有机电致发光器件。
为实现上述目的,本发明采用以下技术方案:
一种有机蓝色荧光材料,具有如下式i、式ii、式iii或式iv的结构通式:
d-π-a,式i;
a-π-d-π-a,式ii;
其中,d代表有机蓝色荧光材料的电子给体基团,π代表有机蓝色荧光材料的中间连接π桥基团,a代表有机蓝色荧光材料的电子受体基团。
在所述式i、式ii、式iii、式iv中,优选地,所述d的结构为如下结构之一:
其中,r为c4~c8的烷基;更优选地,所述d基团为咔唑基团、三苯胺基团或螺二芴基团,相应的结构如下:
更优选地,r为已基。
在上述有机蓝色荧光材料中,优选地,在所述式i、式ⅱ、式ⅲ、式ⅳ中,所述π为芴基团
更优选地,r为c4~c8的烷基,更优选地,r为辛烷基。
在上述有机蓝色荧光材料中,优选地,在所述式i、式ii、式iii、式iv中,所述a为苯甲腈
在上述有机蓝色荧光材料中,优选地,在所述结构通式ⅰ代表的有机蓝色荧光材料中,所述有机蓝色荧光材料的结构式如下式ⅴ:
其中,己基-咔唑为电子给体d基团,9,9-二辛基芴为π基团,苯甲腈为电子受体a基团。
在上述有机蓝色荧光材料中,优选地,在所述结构通式ii代表的有机蓝色荧光材料中,所述有机蓝色荧光材料的结构式如下式vi:
其中,己基-咔唑为电子给体d基团,9,9-二辛基芴为π基团,苯甲腈为电子受体a基团。
在上述有机蓝色荧光材料中,优选地,在所述结构通式iii代表的有机蓝色荧光材料中,所述有机蓝色荧光材料的结构式如下式vii:
其中,三苯胺为电子给体d基团,9,9-二辛基芴为π基团,苯甲腈为电子受体a基团。
在上述有机蓝色荧光材料中,优选地,在所述结构通式ⅵ代表的有机蓝色荧光材料中,所述有机蓝色荧光材料的结构式如下式viii:
其中,螺二芴为电子给体d基团,9,9-二辛基芴为π基团,苯甲腈为电子受体a基团。
一种有机蓝色荧光材料的制备方法,包括:
π基团和a基团的连接步骤:将用于连接有机蓝色荧光材料电子给体d基团和电子受体a基团的π基团的溴化物、含所述电子受体a基团的化合物、碱性溶液及溶剂混合,在保护气氛下,加入催化剂,之后升温至回流温度进行suzuki反应,得到π-a基团的溴化物;
π-a基团和电子给体d基团连接的步骤:将所述π-a基团的溴化物或硼化物和含电子给体d基团的化合物、碱性溶液及溶剂混合,在保护气氛下,加入催化剂,之后升温至回流温度进行suzuki反应,即得到有机蓝色荧光材料。
在上述有机蓝色荧光材料的制备方法中,优选地,在所述π基团和a基团的连接步骤中,所述反应的时间为8~10h,优选地,所述反应的温度为100~110℃;优选地,所述碱性溶液为2mol/l的碳酸钾溶液;优选地,所述催化剂为四(三苯基膦)钯;优选地,所述π基团的溴化物为9,9’-二辛基-2,7-二溴代芴;优选地,所述含电子受体a基团的化合物为4-氰基苯硼酸;优选地,所述溶剂为甲苯;优选地,所述π基团的溴化物:含所述电子受体a基团的化合物的摩尔比为1:1~1:1.5;优选地,所述保护气氛为氮气气氛。
在上述有机蓝色荧光材料的制备方法中,优选地,在所述π-a基团和电子给体d基团连接的步骤中,所述含电子给体d基团的化合物为咔唑溴化物或硼化物,三苯胺的溴化物和螺芴的溴化物;优选地,所述碱性溶液为2mol/l的碳酸钾溶液,优选地,所述催化剂为四(三苯基膦)钯,所述反应的时间为8~10h,优选地,所述反应的温度为100~110℃;优选地,所述溶剂为甲苯;优选地,所述π-a基团的溴化物或硼化物中的活性官能团:含电子给体d基团的化合物中的活性官能团的摩尔比为1:1;更优选地,所述π-a基团的溴化物中的溴基团:含电子给体d基团的化合物中的硼基团的摩尔比为1:1;更优选地,所述π-a基团的硼化物中的硼基团:含电子给体d基团的化合物中的溴基团的摩尔比为1:1。
在上述咔唑作为电子给体d基团的有机蓝色荧光材料的制备方法中,优选地,在所述π-a基团和电子给体d基团连接的步骤中,所述含电子给体d基团的化合物为电子给体d基团的溴化物和联硼酸频那醇酯在催化剂作用下反应而得,更优选地,所述电子给体d基团的溴化物为3-溴咔唑、3,6-二溴咔唑、三-(4-溴苯)胺或2,2',7,7'-四溴-9,9'-螺二芴;更优选地,制备所述含电子给体d基团的化合物的反应是在醋酸钾和n,n-二甲基甲酰胺中进行;更优选地,制备所述含电子给体d基团的化合物使用的催化剂为1,1′-双(二-苯基膦基)二茂铁二氯化钯;更优选地,制备所述含电子给体d基团的化合物的反应的温度为50~60℃;更优选地,制备所述含电子给体d基团的化合物的反应的时间为10~12h。
在有机蓝色荧光材料的制备方法中,优选地,在所述π-a基团和电子给体d基团连接的步骤后,还包括有机蓝色荧光材料的稳定化步骤:将所述有机蓝色荧光材料在催化剂的作用下和溴己烷反应;更优选地,所述催化剂为四丁基溴化铵;更优选地,所述反应的时间为3~5h;更优选地,所述反应的温度为100~110℃;更优选地,所述反应为在氢氧化钾水溶液和甲苯中进行;更优选地,所述反应为在氮气保护气氛下进行。
上述有机蓝色荧光材料作为有机电致发光材料的应用。
一种有机电致发光器件,所述有机电致发光器件包括上述有机蓝色荧光材料,优选地,所述有机蓝色荧光材料作为发光器件的发光层材料。
从分子骨架结构分析,具有电子给体-π桥-电子受体型结构的分子,可通过电子给/受体和中间的π桥基团来增加电子给/受体单元间电子相互作用和分子的共轭结构,从而更有效地控制分子电子云分布,具有“推拉效应”的电子给/受体型分子,此类分子具有较大的斯托克斯位移,同时,可以通过调整分子内部的电子云分布,来抑制三线态激子的非辐射跃迁失活,提高辐射跃迁几率,从而保证更多的三线态激子参与发光,达到提高激子利用率(ηs)和激子发光效率(ηpl)的目的,获得较高的外量子效率,进一步改善器件性能。
本发明与现有技术相比具有如下有益效果:
本发明的有机蓝色荧光材料表现出了良好的蓝光发射,具有优异的蓝光性能;本发明的有机电致发光器件具有较高的外量子效率,对之后材料的设计具有指导意义。
附图说明
图1为实施例1得到的有机蓝色荧光材料的核磁共振氢谱。
图2为实施例2得到的有机蓝色荧光材料的核磁共振氢谱。
图3为实施例3得到的有机蓝色荧光材料的核磁共振氢谱。
图4为实施例4得到的有机蓝色荧光材料的核磁共振氢谱。
图5为实施例1得到的有机蓝色荧光材料在溶液中的紫外吸收光谱和荧光发射光谱。
图6为实施例1得到的有机蓝色荧光材料制备的有机发光器件在不同电压下的电致发光光谱。
图7为实施例1得到的有机蓝色荧光材料制备的有机发光器件的外量子效率随亮度变化的曲线。
图8为实施例2得到的有机蓝色荧光材料在溶液中的紫外吸收光谱和荧光发射光谱。
图9为实施例2得到的有机蓝色荧光材料在薄膜状态下的紫外吸收光谱和荧光发射光谱。
图10为实施例2得到的有机蓝色荧光材料制备的有机发光器件在不同电压下的电致发光光谱。
图11为实施例2得到的有机蓝色荧光材料制备的有机发光器件的外量子效率随亮度变化的曲线。
图12为实施例3得到的有机蓝色荧光材料在溶液中的紫外吸收光谱和荧光发射光谱。
图13为实施例4得到的有机蓝色荧光材料在溶液中的紫外吸收光谱和荧光发射光谱。
图14为实施例4得到的有机蓝色荧光材料制备的有机发光器件在不同电压下的电致发光光谱。
图15为实施例4得到的有机蓝色荧光材料制备的有机发光器件的外量子效率随亮度变化的曲线。
具体实施方式
下述实施方式仅为本发明的优选技术方案,并不用于对本发明进行任何限制。在以下实施例中所涉及的试剂,如无特别说明,均购自常规化学试剂商店;所涉及的测试、制备方法,如无特别说明,均为常规方法。
实施例1
一种如下式结构的有机蓝色荧光材料:
上述有机蓝色荧光材料的合成路线如下:
将9,9’-二辛基-2,7-二溴代芴(7.5mmol,4.125g),4-氰基苯硼酸(5mmol,735mg),2m碳酸钾水溶液(10ml)和50ml的甲苯溶剂加入到250ml的两口烧瓶中,室温下缓慢搅拌,抽真空通氮气,在氮气气氛下,加入四(三苯基膦)钯(pd(pph3)4)(288mg),继续抽真空通氮气,缓慢升温至110℃回流,待反应完成之后停止反应,冷却至室温。用水和二氯甲烷进行萃取,收集有机层,加入适量无水硫酸镁除去多余水分,过滤,将液体旋干浓缩后,通过层析柱分离提纯得到产物m1。
将3-溴咔唑(10mmol,2.45g),四丁基溴化铵(0.201g),氢氧化钾水溶液(1.74g,7ml)、50ml的甲苯溶剂加入到250ml的两口烧瓶中,室温下缓慢搅拌,抽真空通氮气,在氮气气氛下,加入溴己烷(12mmol,1.98g),继续抽真空通氮气,缓慢升温至110℃回流,待反应完成之后停止反应,冷却至室温。用水和二氯甲烷进行萃取,收集有机层,加入适量无水硫酸镁除去多余水分,过滤,将液体旋干浓缩后,通过层析柱分离提纯得到产物。将产物(10mmol,3.29g),联硼酸频那醇酯(10mmol,2.54g),醋酸钾(2g)和50ml的n,n-二甲基甲酰胺溶剂加入到250ml的两口烧瓶中,室温下缓慢搅拌,抽真空通氮气,在氮气气氛下,加入1,1′-双(二-苯基膦基)二茂铁二氯化钯(pd(dppf)cl2)(365mg),继续抽真空通氮气,缓慢升温至60℃,待反应完成之后停止反应,冷却至室温。用水和二氯甲烷进行萃取,收集有机层,加入适量无水硫酸镁除去多余水分,过滤,将液体旋干浓缩后,通过层析柱分离提纯得到产物m2。
将m1(5mmol,1.885g),m2(5mmol,2.845g),2m碳酸钾水溶液(10ml)和50ml的甲苯溶剂加入到250ml的两口烧瓶中,室温下缓慢搅拌,抽真空通氮气,在氮气气氛下,加入四(三苯基膦)钯(pd(pph3)4)(288mg),继续抽真空通氮气,缓慢升温至110℃回流,待反应完成之后停止反应,冷却至室温。用水和二氯甲烷进行萃取,收集有机层,加入适量无水硫酸镁除去多余水分,过滤,将液体旋干浓缩后,通过层析柱分离提纯得到最终产物。
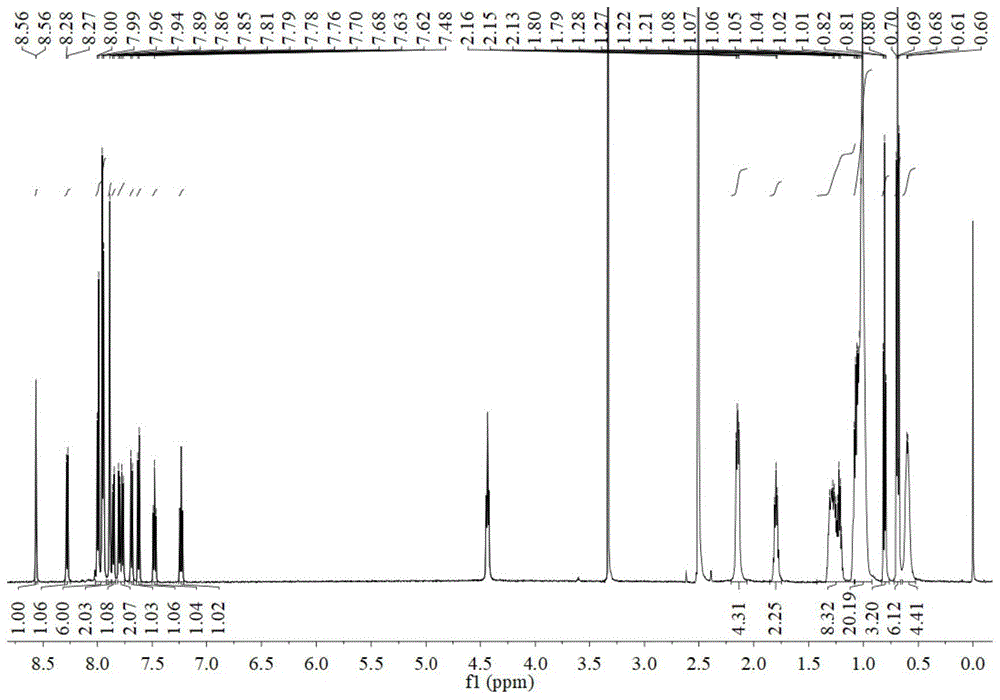
实施例1得到的有机蓝色荧光材料的核磁共振氢谱如图1所示:
1hnmr(600mhz,dmso)δ8.56(d,j=1.0hz,1h),8.28(d,j=7.7hz,1h),7.97(dd,j=27.5,8.3hz,6h),7.89(s,2h),7.85(d,j=8.5hz,1h),7.79(dd,j=17.9,7.9hz,2h),7.69(d,j=8.5hz,1h),7.63(d,j=8.2hz,1h),7.48(t,j=7.6hz,1h),7.23(t,j=7.4hz,1h),2.20–2.07(m,4h),1.86–1.74(m,2h),1.37–1.14(m,8h),1.14–0.93(m,20h),0.81(t,j=7.1hz,3h),0.69(t,j=7.0hz,6h),0.60(d,j=6.0hz,4h)。
将实施例1得到的有机蓝色荧光材料配置成10-5mol/l浓度的甲苯溶液,其中用hitachi公司的u-3900紫外光谱仪测试溶液的紫外吸收光谱,用法国horibajobinyvon公司的fluoromax-4荧光光谱仪测定溶液的荧光发射光谱,以表征其溶液状态下的光物理性能。
图5为实施例1得到的有机蓝色荧光材料的溶液紫外吸收光谱和荧光发射光谱图。由图可见,材料最大吸收峰位于417nm,最大发射峰位于371nm处,表现出了明显的蓝光发射特征,证明实施例1得到的材料为有机蓝色荧光材料。
取适量的实施例1得到的有机蓝色荧光材料的固体粉末制备有机发光器件,制备成结构为ito/moo3(3nm)/tcta(40nm)/发光层(20nm)/tpbi(50nm)/lif(1nm)/al的有机电致发光器件,其中,发光层选用cbp作为主体材料,掺杂了25wt%的实施例1得到的有机蓝色荧光材料。有机发光器件的电致发光光谱是利用美国photoresearch公司的spectrascanpr655光谱辐射仪进行测量的;外量子效率是通过数据计算得到的。所有测量均在室温条件下进行。
图6为实施例1得到的有机蓝色荧光材料制备的有机发光器件在不同电压下的电致发光光谱。如图所示,器件的最大发射峰位于432nm处,表现出高质量的深蓝光发射,而且随着电压的升高,器件的光谱稳定性良好,表现出优异的电致发光性能。
图7为实施例1得到的有机蓝色荧光材料制备的有机发光器件的外量子效率随亮度变化的曲线。从图中可以看出,随着亮度的增加,器件的最大外量子效率高达到4.7%,器件也没有表现出明显的效率滚降,表现出了优异的蓝光性能。
实施例2
一种如下式结构的有机蓝色荧光材料:
上式结构所示的有机蓝色荧光材料的合成路线如下:
具体制备方法为:
产物m1的制备,同实施例1。
将3,6-二溴咔唑(10mmol,3.24g),四丁基溴化铵(201mg),氢氧化钾水溶液(1.74g,7ml)和50ml的甲苯溶剂加入到250ml的两口烧瓶中,室温下缓慢搅拌,抽真空通氮气,在氮气气氛下,加入溴己烷(12mmol,1.98g),继续抽真空通氮气,缓慢升温至110℃回流,待反应完成之后停止反应,冷却至室温。用水和二氯甲烷进行萃取,收集有机层,加入适量无水硫酸镁除去多余水分,过滤,将液体旋干浓缩后,通过层析柱分离提纯得到产物m3。
将m3(7mmol,2.856g),联硼酸频那醇酯(15mmol,3.8g),醋酸钾(2g)和50ml的n,n-二甲基甲酰胺溶剂加入到250ml的两口烧瓶中,室温下缓慢搅拌,抽真空通氮气,在氮气气氛下,加入1,1′-双(二-苯基膦基)二茂铁二氯化钯(pd(dppf)cl2)(548mg),继续抽真空通氮气,缓慢升温至60℃,待反应完成之后停止反应,冷却至室温。用水和二氯甲烷进行萃取,收集有机层,加入适量无水硫酸镁除去多余水分,过滤,将液体旋干浓缩后,通过层析柱分离提纯得到产物m4。
将m1(2mmol,1,141g),m4(1mmol,409mg),2m碳酸钾水溶液(10ml)和50ml的甲苯溶剂加入到250ml的两口烧瓶中,室温下缓慢搅拌,抽真空通氮气,在氮气气氛下,加入四(三苯基膦)钯(pd(pph3)4)(115mg),继续抽真空通氮气,缓慢升温至110℃回流,待反应完成之后停止反应,冷却至室温。用水和二氯甲烷进行萃取,收集有机层,加入适量无水硫酸镁除去多余水分,过滤,将液体旋干浓缩后,通过层析柱分离提纯得到最终产物。
实施例2得到的有机蓝色荧光材料的核磁共振氢谱如图2所示:
1hnmr(600mhz,cdcl3)δ8.20(d,j=8.0hz,2h),7.85(t,j=7.2hz,4h),7.77(q,j=8.5hz,10h),7.71(s,2h),7.67(s,2h),7.61(d,j=7.8hz,2h),7.58(d,j=7.3hz,4h),2.10(m,8h),2.01(m,2h),1.52(d,j=9.4hz,3h),1.17(m,8h),1.09(m,32h),0.88(m,8h),0.79(t,j=7.2hz,20h)。
将实施例2得到的有机蓝色荧光材料配置成10-5mol/l浓度的甲苯溶液,其中用hitachi公司的u-3900紫外光谱仪测试溶液的紫外吸收光谱,用法国horibajobinyvon公司的fluoromax-4荧光光谱仪测定溶液的荧光发射光谱,以表征其溶液状态下的光物理性能。
图8为实施例2得到的有机蓝色荧光材料的溶液紫外吸收光谱和荧光发射光谱图。由图可见,材料最大吸收峰位于355nm,最大发射峰位于413nm处,表现出了明显的蓝光发射特征,说明实施例2得到的材料为有机蓝色荧光材料。
将实施例2得到的有机蓝色荧光材料配置成10mg/ml的甲苯溶液,利用旋涂工艺以1500转/分钟的转速在石英玻璃上旋涂成膜,将其制成薄膜,用hitachi公司的u-3900紫外光谱仪测试溶液的紫外吸收光谱,用法国horibajobinyvon公司的fluoromax-4荧光光谱仪测定溶液的荧光发射光谱,以表征其薄膜状态的光物理性能。
图9为实施例2得到的有机蓝色荧光材料的薄膜紫外吸收光谱和荧光发射光谱图。由图可见,最大吸收峰位于358nm,最大发射峰位于446nm处,与溶液相比,最大发射峰有33nm的红移,这是因为在薄膜状态下,分子处于高聚集状态,共轭增加,所以发生了红移现象。
取适量的实施例2得到的有机蓝色荧光材料的固体粉末制备有机发光器件,制备成结构为ito/moo3(3nm)/tcta(40nm)/发光层(20nm)/tpbi(50nm)/lif(1nm)/al的有机电致发光器件,其中,发光层选用cbp作为主体材料,掺杂了15wt%的实施例2得到的有机蓝色荧光材料。有机发光器件的电致发光光谱是利用美国photoresearch公司的spectrascanpr655光谱辐射仪进行测量的;外量子效率是通过数据计算得到的。所有测量均在室温条件下进行。
图10为实施例2得到的有机蓝色荧光材料制备的有机发光器件在不同电压下的电致发光光谱。如图所示,器件的最大发射峰位于440nm处,表现出高质量的深蓝光发射,而且随着电压的升高,器件的光谱稳定性良好,表现出优异的电致发光性能。
图11为实施例2得到的有机蓝色荧光材料制备的有机发光器件的外量子效率随亮度变化的曲线。从图中可以看出,随着亮度的增加,器件的最大外量子效率高达到7.3%,超过了传统荧光材料外量子效率低于5%【参考approachesforfabricatinghighefficiencyorganiclightemittingdiodes,jmater.chem.c2015,3,2974】的限制。器件优异的性能可以归因于两点:一是主体材料cbp向客体材料高效率的能量转移;另一个是掺杂后,相邻分子之间的距离进一步增加,由分子堆积造成的荧光猝灭大大减弱。此外,器件也没有表现出明显的效率滚降,表现出了优异的蓝光性能。
实施例3
一种如下式结构的有机蓝色荧光材料:
上述结构的有机蓝色荧光材料的合成路线如下:
具体制备方法为:
产物m1的制备,同实施例1。
将m1(5mmol,2.845g),联硼酸频那醇酯(5mmol,1.27g),醋酸钾(2g)和50ml的n,n-二甲基甲酰胺溶剂加入到250ml的两口烧瓶中,室温下缓慢搅拌,抽真空通氮气,在氮气气氛下,加入1,1′-双(二-苯基膦基)二茂铁二氯化钯(pd(dppf)cl2)(183mg),继续抽真空通氮气,缓慢升温至60℃,待反应完成之后停止反应,冷却至室温。用水和二氯甲烷进行萃取,收集有机层,加入适量无水硫酸镁除去多余水分,过滤,将液体旋干浓缩后,通过层析柱分离提纯得到产物m5。
将三-(4-溴苯)胺(1mmol,480mg),m5(3mmol,1.851g),2m碳酸钾水溶液(10ml)和50ml的甲苯溶剂加入到250ml的两口烧瓶中,室温下缓慢搅拌,抽真空通氮气,在氮气气氛下,加入四(三苯基膦)钯(pd(pph3)4)(173mg),继续抽真空通氮气,缓慢升温至110℃回流,待反应完成之后停止反应,冷却至室温。用水和二氯甲烷进行萃取,收集有机层,加入适量无水硫酸镁除去多余水分,过滤,将液体旋干浓缩后,通过层析柱分离提纯得到最终产物。
实施例3得到的有机蓝色荧光材料的核磁共振氢谱如图3所示:
1hnmr(600mhz,cdcl3)δ7.84–7.79(m,2h),7.78–7.74(m,4h),7.66–7.58(m,5h),7.56(s,1h),7.31(d,2h),2.07(m,4h),1.22–1.16(m,20h),0.79(t,j=7.2hz,3h),0.72(m,4h)。
将实施例3得到的有机蓝色荧光材料配置成10-5mol/l浓度的甲苯溶液,其中用hitachi公司的u-3900紫外光谱仪测试溶液的紫外吸收光谱,用法国horibajobinyvon公司的fluoromax-4荧光光谱仪测定溶液的荧光发射光谱,以表征其溶液状态下的光物理性能。
图12为实施例3得到的有机蓝色荧光材料的溶液紫外吸收光谱和荧光发射光谱图。由图可见,材料最大吸收峰位于380nm,最大发射峰位于438nm处,表现出了明显的蓝光发射特征,说明实施例3得到的材料为有机蓝色荧光材料。
实施例4
一种如下式结构的有机蓝色荧光材料:
上式结构的有机蓝色荧光材料的合成路线如下:
具体制备方法如下:
产物m1的制备,同实施例1。
产物m5的制备,同实施例3。
将2,2',7,7'-四溴-9,9'-螺二芴(1mmol,631mg),m5(4mmol,2.468g),2m碳酸钾水溶液(10ml)和50ml的甲苯溶剂加入到250ml的两口烧瓶中,室温下缓慢搅拌,抽真空通氮气,在氮气气氛下,加入四(三苯基膦)钯(pd(pph3)4)(231mg),继续抽真空通氮气,缓慢升温至110℃回流,待反应完成之后停止反应,冷却至室温。用水和二氯甲烷进行萃取,收集有机层,加入适量无水硫酸镁除去多余水分,过滤,将液体旋干浓缩后,通过层析柱分离提纯得到最终产物。
实施例4得到的有机蓝色荧光材料的核磁共振氢谱如图4所示:
1hnmr(600mhz,cdcl3)δ8.05(d,j=7.8hz,4h),7.78(dd,j=8.0,1.6hz,4h),7.73(d,j=9.2hz,20h),7.65(d,j=8.0hz,4h),7.54(dd,j=7.9,1.7hz,4h),7.52(s,4h),7.50(d,j=1.3hz,4h),7.44(dd,j=8.0,1.6hz,4h),7.21(d,j=1.4hz,4h),2.01–1.97(m,16h),1.12(dd,j=14.2,7.2hz,16h),1.07–0.97(m,64h),0.75(t,j=7.2hz,24h),0.65(s,16h)。
将实施例4得到的有机蓝色荧光材料配置成10-5mol/l浓度的甲苯溶液,其中用hitachi公司的u-3900紫外光谱仪测试溶液的紫外吸收光谱,用法国horibajobinyvon公司的fluoromax-4荧光光谱仪测定溶液的荧光发射光谱,以表征其溶液状态下的光物理性能。
图13为实施例4得到的有机蓝色荧光材料的溶液紫外吸收光谱和荧光发射光谱图。由图可见,材料最大吸收峰位于370nm,最大发射峰位于411nm处,表现出了明显的蓝光发射特征,说明实施例4得到的材料为有机蓝色荧光材料。
取适量的实施例4得到的有机蓝色荧光材料的固体粉末制备有机发光器件,将浓度为10mg/ml的有机蓝色荧光材料的氯苯溶液以1500转/分钟的转速旋涂成膜,制备成结构为ito/pedot:pss(40nm)/发光层(40nm)/tpbi(30nm)/lif(1nm)/al(100nm)的有机电致发光器件,发光层选用cbp作为主体材料,掺杂了10wt%的实施例4得到的有机蓝色荧光材料。有机发光器件的电致发光光谱是利用美国photoresearch公司的spectrascanpr655光谱辐射仪进行测量的;外量子效率是通过数据计算得到的。所有测量均在室温条件下进行。
图14为实施例4得到的有机蓝色荧光材料制备的有机发光器件在不同电压下的电致发光光谱。如图所示,器件的最大发射峰位于424nm处,表现出高质量的深蓝光发射,而且随着电压的升高,器件的光谱稳定性良好,表现出优异的电致发光性能。
图15为实施例4得到的有机蓝色荧光材料制备的有机发光器件的外量子效率随亮度变化的曲线。从图中可以看出,随着亮度的增加,器件的最大外量子效率可达1.3%。
- 还没有人留言评论。精彩留言会获得点赞!