一种含有羟脯氨酸的化合物及其制备方法和应用与流程
本发明涉及一种含有羟脯氨酸的化合物及其制备方法和应用。
背景技术:
慢性粒细胞白血病(cml)是一种发生于骨髓造血干细胞的恶性克隆增生性疾病,在成年白血病患者中所占比例高达15%~20%,其特征是cml患者体内能检测出ph染色体。ph染色体是由人体正常的22号染色体和9号染色体相互易位形成的断裂点聚集簇-艾尔贝逊(bcr-abl)融合基因,此融合基因编码产生酪氨酸激酶活性持续激活的bcr-abl融合蛋白。目前市场上上市了针对bcr-abl为靶标的小分子酪氨酸激酶抑制剂,但都存在耐药性以及其他临床不良反应等问题。随之,研究与开发新型的bcr-abl酪氨酸激酶抑制剂已成为药学领域的热点之一。
技术实现要素:
本发明的目的在于提供一种含有羟脯氨酸的化合物及其制备方法和应用。
为实现上述目的,本发明采用如下的技术方案:
一种含有羟脯氨酸的化合物,该化合物的结构式如下:
其中,r为
一种含有羟脯氨酸的化合物的制备方法,包括以下步骤:
1)5-溴-2-氨基吡啶与酰氯化合物发生酰化反应制备酰化的5-溴-2-氨基吡啶;
2)n2保护下,5-溴烟酸与氯化亚砜以及胺类化合物发生反应制备氨化的5-溴烟酸;
3)在四三苯基膦钯催化下,酰化的5-溴-2-氨基吡啶或氨化的5-溴烟酸与对羧基苯硼酸发生suzuki偶联反应得到联苯化合物;
4)boc保护的羟脯氨酸与3-三氟甲基-4-氯苯胺缩合生成叔丁基-(2r,4s)-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)-4-羟基吡咯烷基-1-羧酸酯;
5)叔丁基-(2r,4s)-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)-4-羟基吡咯烷基-1-羧酸酯与甲磺酰氯发生酰化反应生成叔丁基-(2r,4s)-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)-4-((甲磺酰基)氧)吡咯烷基-1-羧酸酯;
6)在n2保护下,叔丁基-(2r,4s)-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)-4-((甲磺酰基)氧)吡咯烷基-1-羧酸酯与叠氮化钠发生反应生成叔丁基-(2r,4r)-4-叠氮-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)吡咯烷基-1-羧酸酯;
7)叔丁基-(2r,4r)-4-叠氮-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)吡咯烷基-1-羧酸酯还原生成叔丁基-(2r,4r)-4-氨基-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)吡咯烷基-1-羧酸酯;
8)联苯化合物与叔丁基-(2r,4r)-4-氨基-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)吡咯烷基-1-羧酸酯发生缩合反应生成含有羟脯氨酸的化合物。
本发明进一步的改进在于,所述步骤1)的具体过程为:5-溴-2-氨基吡啶溶于无水二氯甲烷中,加入三乙胺,在冰浴条件下,滴加乙酰氯,待滴加完毕后,升至室温反应12,反应结束后,进行后处理,得到白色固体,即为酰化的5-溴-2-氨基吡啶(n-(5-溴吡啶-2-基)乙酰胺)。
本发明进一步的改进在于,所述步骤2)的具体过程为:在n2保护下,将氯化亚砜滴加入到5-溴烟酸中,滴加完后,加热回流2-3h至溶液澄清,减压旋除氯化亚砜,得淡黄色固体,将该固体溶入到无水二氯甲烷中,然后滴加到环丙基胺的二氯甲烷溶液中,滴加完后,室温反应12h,反应结束后,进行后处理,得到白色固体,即为氨化的5-溴烟酸(5-溴-n-环丙基烟酰胺)。
本发明进一步的改进在于,所述步骤3)的具体过程为:将酰化的5-溴-2-氨基吡啶与对羧基苯硼酸加入到反应容器中,或将氨化的5-溴烟酸与对羧基苯硼酸加入到反应容器中,再依次加入碳酸铯与四三苯基膦钯,然后再加入乙腈/水的混合溶液,n2保护下在90℃反应48h,反应结束后,进行后处理,得到联苯化合物。
本发明进一步的改进在于,所述步骤4)的具体过程为:n-boc-l-羟基脯氨酸溶于二氯甲烷中,加入三乙胺,在冰浴条件下,滴加氯甲酸乙酯的二氯甲烷溶液,反应30min,反应完后,在冰浴条件下滴加3-三氟甲基-4-氯苯胺的二氯甲烷溶液,滴加完后,室温反应12h,反应结束后,进行后处理,得到叔丁基-(2r,4s)-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)-4-羟基吡咯烷基-1-羧酸酯。
本发明进一步的改进在于,所述步骤5)的具体过程为:将叔丁基-(2r,4s)-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)-4-羟基吡咯烷基-1-羧酸酯溶于无水二氯甲烷中,降至0℃,加入三乙胺,搅拌15min,然后逐滴滴加甲磺酰氯,滴加完后,室温反应12,反应结束后,加水终止反应,进行后处理,得到叔丁基-(2r,4s)-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)-4-((甲磺酰基)氧)吡咯烷基-1-羧酸酯;
所述步骤6)的具体过程为:将叔丁基-(2r,4s)-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)-4-((甲磺酰基)氧)吡咯烷基-1-羧酸酯溶于无水dmf中,加入叠氮化钠,氮气保护,65-70℃反应16h,反应结束后,进行后处理,得到叔丁基-(2r,4r)-4-叠氮-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)吡咯烷基-1-羧酸酯。
本发明进一步的改进在于,所述步骤7)的具体过程为:将叔丁基-(2r,4r)-4-叠氮-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)吡咯烷基-1-羧酸酯溶于无水甲醇中,加入pd/c,h2保护还原,反应12h,进行后处理,得到叔丁基-(2r,4r)-4-氨基-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)吡咯烷基-1-羧酸酯;
所述步骤8)的具体过程为:将联苯化合物溶于无水四氢呋喃中,加入4-甲基吗啉,冰浴条件下,滴加氯甲酸异丁酯的无水四氢呋喃溶液,滴加完后,冰浴反应30-40min后进行后处理,得到含有羟脯氨酸的化合物。
一种含有羟脯氨酸的化合物在制备abl激酶、t315i突变abl激酶抑制剂中的应用。
一种含有羟脯氨酸的化合物在制备抗肿瘤药物中的应用。
与现有技术相比,本发明具有的有益效果:本发明利用酰化、suzuki偶联、偶氮反应、氢化还原、缩合等反应合成目标化合物,并构建了化合物库,该类化合物是具有新型分子结构的bcr-abl小分子酪氨酸激酶抑制剂,并通过ms、nmr等手段表征了目标化合物的结构。本发明基于对前期的bcr-abl酪氨酸激酶抑制剂以及bcr-abl蛋白与配体的相互作用分析研究发现,以联苯吡啶为新型的结合片段,并采用片段药物的设计策略,引入l-羟脯氨酸为柔性linker,以构建具有激酶抑制活性的类肽类小分子化合物库,并通过adp-glo等试验筛选发现具新型结构的酪氨酸激酶抑制剂。激酶筛选试验表明该类化合物对abl激酶、t315i突变abl激酶具有一定的抑制活性,其中r为
附图说明
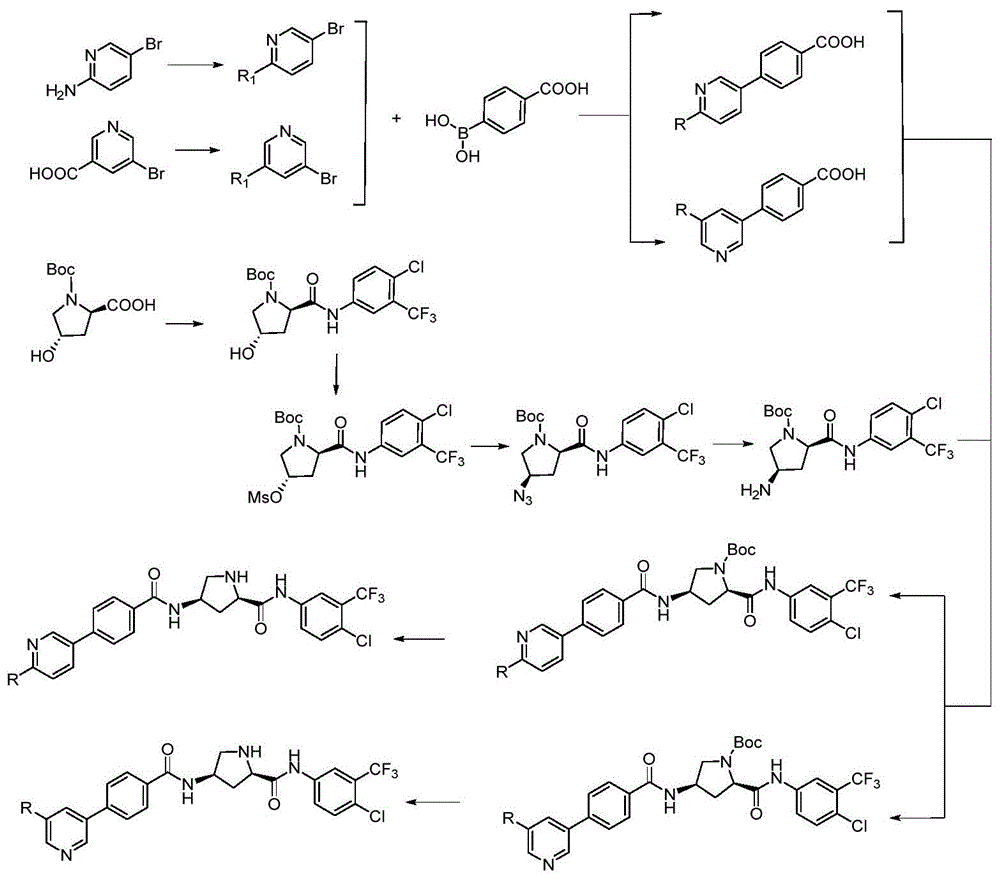
图1为本发明的合成路线图。
具体实施方式
下面结合附图对本发明进行详细说明。
参见图1,本发明的一种含有羟脯氨酸的化合物的结构式为:
其中,r具体详见表
表1本发明的化合物的具体结构
参见图1,如上述结构的含有羟脯氨酸的化合物的制备方法,包括以下步骤:
1)5-溴-2-氨基吡啶与相应的酰氯化合物发生酰化反应制备被酰化的5-溴-2-氨基吡啶;
2)n2保护下,5-溴烟酸与氯化亚砜以及相应的胺类化合物发生反应制备被氨化的5-溴-烟酸;
3)在四三苯基膦钯催化下,酰化的5-溴-2-氨基吡啶或氨化的5-溴烟酸与对羧基苯硼酸发生suzuki偶联反应得到联苯化合物;
4)boc保护的羟脯氨酸与3-三氟甲基-4-氯苯胺缩合生成叔丁基-(2r,4s)-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)-4-羟基吡咯烷基-1-羧酸酯;
5)叔丁基-(2r,4s)-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)-4-羟基吡咯烷基-1-羧酸酯与甲磺酰氯发生酰化反应生成叔丁基-(2r,4s)-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)-4-((甲磺酰基)氧)吡咯烷基-1-羧酸酯;
6)在n2保护下,叔丁基-(2r,4s)-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)-4-((甲磺酰基)氧)吡咯烷基-1-羧酸酯与叠氮化钠发生反应生成叔丁基-(2r,4r)-4-叠氮-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)吡咯烷基-1-羧酸酯;
7)叔丁基-(2r,4r)-4-叠氮-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)吡咯烷基-1-羧酸酯还原生成叔丁基-(2r,4r)-4-氨基-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)吡咯烷基-1-羧酸酯;
8)联苯化合物与叔丁基-(2r,4r)-4-氨基-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)吡咯烷基-1-羧酸酯发生缩合反应生成一种羟脯氨酸类肽衍生物。
所述步骤1)的具体操作为:将5-溴-2-氨基吡啶溶于无水二氯甲烷中,加入三乙胺。在冰浴条件下,将乙酰氯缓慢滴加到上述溶液中,待滴加完毕后,撤去冰浴升至室温反应12h。反应结束后,加入二氯甲烷稀释,水洗,饱和碳酸氢钠水洗,饱和氯化钠水洗。无水硫酸钠干燥,减压蒸馏,柱色谱分离,得到白色固体,即为酰化的5-溴-2-氨基吡啶。
所述步骤2)的具体操作为:在n2保护下,将氯化亚砜滴加入到5-溴烟酸中,滴加完后,加热回流2-3h至溶液澄清,减压旋除氯化亚砜,得淡黄色固体。将该固体溶入到无水二氯甲烷中,并将此活性中间体溶液在冰浴条件下缓慢滴加到环丙基胺的二氯甲烷溶液中。滴加完后,升至室温反应过夜(本发明中反应过夜即反应12h)。反应结束后,向反应体系中加入k2co3溶液。分液取二氯甲烷相,水相用二氯甲烷萃取,合并有机相,无水na2so4干燥。柱色谱分离纯化得到白色固体,即为氨化的5-溴烟酸。
所述步骤3)的具体操作为:将酰化的5-溴-2-氨基吡啶(即n-(5-溴吡啶-2-基)乙酰胺)与对羧基苯硼酸加入到梨形瓶中,或将氨化的5-溴烟酸(即5-溴-n-环丙基烟酰胺)与对羧基苯硼酸加入到梨形瓶中,再依次加入碳酸铯,四三苯基膦钯。向上述混合物中加入乙腈/水的混合溶液。n2保护,油浴升温至90℃反应48h。反应结束后,将反应液降至室温,抽滤。滤液用盐酸调至ph4,析出白色固体,抽滤,滤饼真空干燥得产物,即为联苯化合物。
所述步骤4)的具体操作为:n-boc-l-羟基脯氨酸溶于二氯甲烷中,加入三乙胺,在冰浴条件下,将氯甲酸乙酯的二氯甲烷溶液滴加到上述溶液中,反应30min。反应完后,将3-三氟甲基-4-氯苯胺的二氯甲烷溶液在冰浴条件下滴加到上述反应体系中,滴加完后,撤去冰浴升至室温反应过夜。反应结束后,加二氯甲烷稀释,饱和nahco3溶液洗,水洗,饱和nacl溶液洗,无水na2so4干燥。柱色谱分离得到产物,即为叔丁基-(2r,4s)-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)-4-羟基吡咯烷基-1-羧酸酯。
所述步骤5)的具体操作为:叔丁基-(2r,4s)-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)-4-羟基吡咯烷基-1-羧酸酯溶于无水二氯甲烷中,降至0℃,加入三乙胺,搅拌15min,然后逐滴滴加甲磺酰氯,滴加完后,升至室温反应过夜。反应结束后,加水终止反应,饱和nacl洗涤,无水na2so4干燥。抽滤,减压旋除溶剂,得产物即为叔丁基-(2r,4s)-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)-4-((甲磺酰基)氧)吡咯烷基-1-羧酸酯。
所述步骤6)的具体操作为:在n2保护下,将叔丁基-(2r,4s)-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)-4-((甲磺酰基)氧)吡咯烷基-1-羧酸酯溶于无水dmf中,加入叠氮化钠,氮气保护,65-70℃反应16h。反应结束后,冷却反应液,倾入冰水中,析出白色固体,乙酸乙酯萃取,合并有机相,饱和nacl洗涤,无水na2so4干燥。柱色谱分离得到产物,即为叔丁基-(2r,4r)-4-叠氮-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)吡咯烷基-1-羧酸酯。
所述步骤7)的具体操作为:叔丁基-(2r,4r)-4-叠氮-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)吡咯烷基-1-羧酸酯溶于无水甲醇中,加入pd/c,h2保护还原,反应过夜,tlc检测。反应结束后,过滤,甲醇洗涤,滤液旋除溶剂得到产物即为叔丁基-(2r,4r)-4-氨基-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)吡咯烷基-1-羧酸酯。
所述骤8)的具体操作为:联苯化合物溶于无水四氢呋喃中,加入4-甲基吗啉,冰浴条件下,滴加氯甲酸异丁酯的无水四氢呋喃溶液,滴加完后,冰浴反应30-40min,tlc监测。反应完后,滴加叔丁基-(2r,4r)-4-氨基-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)吡咯烷基-1-羧酸酯和4-甲基吗啉的四氢呋喃溶液,滴加完后,升至室温反应过夜。反应完后,减压旋除四氢呋喃,剩余物中加入乙酸乙酯溶解,水洗,饱和nacl溶液洗,无水na2so4干燥。柱色谱分离得到目标产物。
本发明的含有羟脯氨酸的化合物具有抑制abl激酶、t315i突变abl激酶活性的作用,可用于制备abl激酶、t315i突变abl激酶抑制剂。
本发明的含有羟脯氨酸的化合物在制备抗肿瘤药物中的应用。
实施例1
一种含有羟脯氨酸的化合物,其特征在于,r为
1)n-(5-溴吡啶-2-基)乙酰胺的合成:5-溴-2-氨基吡啶(5.19g,30mmol)溶于100ml无水二氯甲烷中,加入三乙胺20ml。在冰浴条件下,将乙酰氯(2.54ml)缓慢滴加到上述溶液中,待滴加完后,撤去冰浴,升至室温反应过夜。反应结束后,加入二氯甲烷稀释,水洗(30ml×3),饱和nahco3溶液洗(30ml×3),饱和nacl洗(30ml),有机相无水na2so4干燥。柱色谱分离得白色固体5.65g,产率88%。mp78-81℃;ei-ms(m/z):214[m]+。
2)4-(6-(乙酰氨基)吡啶-3-基)苯甲酸的合成:n-(5-溴吡啶-2-基)乙酰胺(4.30g,20mmol)、对羧基苯硼酸(3.66g,22mmol)加入到250ml梨形瓶中,再依次加入碳酸铯(13.0g,40mmol),四三苯基膦钯(1.2g,1mmol)。向上述混合物中加入乙腈/水(v:v=3:2)200ml。n2保护,油浴升温至90℃反应48h。反应结束后,将反应液降至室温,抽滤。滤液用6mol/l盐酸调至ph4,析出白色固体,抽滤,滤饼真空干燥得产物3.89g,产率76%。mp156-158℃;ei-ms(m/z):256[m]+。
3)叔丁基-(2r,4s)-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)-4-羟基吡咯烷基-1-羧酸酯的合成:n-boc-l-羟基脯氨酸(3.48g,15.31mmol)溶于二氯甲烷中,加入三乙胺(1.5ml,15.31mmol),在冰浴条件下,将氯甲酸乙酯(2ml,15.31mmol)的二氯甲烷溶液滴加到上述溶液中,反应30min。反应完后,将3-三氟甲基-4-氯苯胺(2.7g,13.92mmol)的二氯甲烷溶液在冰浴条件下滴加到上述反应体系中,滴加完后,撤去冰浴升至室温反应过夜。反应结束后,加二氯甲烷稀释,饱和nahco3溶液洗,水洗,饱和nacl溶液洗,无水na2so4干燥。柱色谱分离(石油醚:乙酸乙酯=3:1),得产品4.26g,产率75%。ei-ms(m/z):407[m-h]-。
4)叔丁基-(2r,4s)-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)-4-((甲磺酰基)氧)吡咯烷基-1-羧酸酯的合成:化合物叔丁基-(2r,4s)-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)-4-羟基吡咯烷基-1-羧酸酯(3.79g,9.27mmol)溶于无水二氯甲烷中,降至0℃,加入三乙胺(1.55ml,11.12mmol),搅拌15min,然后逐滴滴加甲磺酰氯(0.86ml,11.12mmol),滴加完后,升至室温反应过夜。反应结束后,加水终止反应,饱和nacl洗涤,无水na2so4干燥。抽滤,减压旋除溶剂,得产品3.87g,产率86%。ei-ms(m/z):485[m-h]-。
5)叔丁基-(2r,4r)-4-叠氮-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)吡咯烷基-1-羧酸酯的合成:叔丁基-(2r,4s)-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)-4-((甲磺酰基)氧)吡咯烷基-1-羧酸酯(3.78g,7.76mmol)溶于10ml无水dmf中,加入叠氮化钠(0.99g,15.52mmol),氮气保护,65-70℃反应16h。反应结束后,冷却反应液,倾入冰水中,析出白色固体,乙酸乙酯萃取(80ml×3),合并有机相,饱和nacl洗涤,无水na2so4干燥。柱色谱分离(石油醚:乙酸乙酯=5:1),得产品2.69g,产率80%。ei-ms(m/z):434[m+h]+,432[m-h]-。
6)叔丁基-(2r,4r)-4-氨基-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)吡咯烷基-1-羧酸酯的合成:叔丁基-(2r,4r)-4-叠氮-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)吡咯烷基-1-羧酸酯(2.77g)溶于25ml无水甲醇中,加入0.54g5%pd/c,h2保护还原,反应过夜,tlc检测。反应结束后,过滤,甲醇洗涤,滤液旋除溶剂,剩余物留待下一步反应。
7)(2r,4r)-4-(4-(6-乙酰胺基吡啶-3-基)苯甲酰胺基)-n-(4-氯-3-(三氟甲基)苯基)吡咯烷烷基-2-甲酰胺(q1)的合成:4-(6-(乙酰氨基)吡啶-3-基)苯甲酸(2.5mmol)溶于无水四氢呋喃中,加入4-甲基吗啉(0.85ml,7.5mmol),冰浴条件下,滴加氯甲酸异丁酯(0.55ml,3.75mmol)的无水四氢呋喃溶液,滴加完后,冰浴反应30-40min,tlc监测。反应完后,滴加叔丁基-(2r,4r)-4-氨基-2-((4-氯-3-(三氟甲基)苯基)氨基甲酰基)吡咯烷基-1-羧酸酯(0.8g,3mmol)和4-甲基吗啉(0.85ml)的四氢呋喃溶液,滴加完后,升至室温反应过夜。反应完后,减压旋除四氢呋喃,剩余物中加入乙酸乙酯溶解,水洗,饱和nacl溶液洗,无水na2so4干燥。柱色谱分离得到目标产物。白色固体0.19g,产率14%。mp249-251℃;ei-ms(m/z):546[m]+;1hnmr(400mhz,dmso-d6)δ10.65(s,1h),10.42(s,1h),8.67(d,j=2.4hz,1h),8.45(d,j=6.6hz,1h),8.21–8.10(m,3h),7.95(d,j=8.1hz,1h),7.89(d,j=8.4hz,2h),7.73(d,j=8.5hz,2h),7.58–7.54(m,1h),7.41(d,j=7.7hz,1h),4.39–4.34(m,1h),3.87–3.83(m,1h),3.23–3.18(m,1h),2.90–2.86(m,1h),2.48–2.44(m,1h),2.12(s,3h),2.02–1.95(m,1h);13cnmr(101mhz,dmso-d6)δ174.37,169.87,166.20,152.28,146.36,139.81,139.79,136.71,133.66,130.37,130.36,130.01,129.69,128.49,126.32,125.96,123.47,123.25,120.16,116.02,115.98,113.61,60.05,51.97,51.67,36.77,24.40。
实施例2
一种含有羟脯氨的化合物,其特征在于,r为
1)5-溴-n-环丙基烟酰胺的合成:在n2保护下,将氯化亚砜(36ml,494mmol)滴加入到5-溴烟酸(5.00g,24.7mmol)中,滴加完后,加热回流2-3h至溶液澄清,减压旋除氯化亚砜,得淡黄色固体。将该固体溶入到30ml无水二氯甲烷中,并将此活性中间体溶液在冰浴条件下缓慢滴加到环丙基胺(3.77ml)二氯甲烷(30ml)溶液中。滴加完后,升至室温反应过夜。反应结束后,向反应体系中加入2mol/lk2co3溶液20ml。分液取二氯甲烷相,水相用二氯甲烷萃取(15ml×3),合并有机相,无水na2so4干燥。柱色谱分离纯化。(石油醚:乙酸乙酯=1:1),得白色固体5.27g,产率89%。mp140-142℃;ei-ms(m/z):240[m]+。
步骤2)~步骤7)与实施例1相同,得到一种含有羟脯氨酸的化合物,白色固体0.19g,产率13%。mp162-165℃;ei-ms(m/z):572[m]+;1hnmr(400mhz,dmso-d6)δ10.42(s,1h),9.04(d,j=2.1hz,1h),8.97(d,j=1.9hz,1h),8.75(d,j=3.8hz,1h),8.51(d,j=6.6hz,1h),8.43–8.42(m,1h),8.21(s,1h),7.95(d,j=8.4hz,3h),7.83(d,j=8.4hz,2h),7.58–7.54(m,1h),7.41(d,j=7.8hz,1h),4.40–4.35(m,1h),3.88–3.84(m,1h),3.22–3.19(m,1h),2.91–2.86(m,2h),2.49–2.41(m,1h),2.04–1.95(m,1h),0.77–0.71(m,2h),0.64–0.58(m,2h);13cnmr(101mhz,dmso-d6)δ174.33,166.28,166.11,150.21,148.28,139.82,139.36,134.58,134.51,133.16,130.38,130.35,130.01,129.70,125.95,123.47,123.24,120.15,116.02,115.98,60.08,51.98,51.72,36.72,23.53,6.22。
化合物q2-q4的制备步骤同化合物q1。
化合物q2:白色固体0.84g,产率57%。mp178-180℃;ei-ms(m/z):588[m]+;1hnmr(400mhz,dmso-d6)δ10.72(s,1h),9.98(s,1h),8.70(d,j=1.2hz,1h),8.57(d,j=6.5hz,1h),8.19–8.15(m,3h),7.92(d,j=8.4hz,3h),7.77(d,j=8.4hz,2h),7.60–7.56(m,1h),7.44(d,j=7.8hz,1h),4.49–4.44(m,1h),4.11–4.07(m,1h),3.32–3.29(m,1h),3.08–3.04(m,1h),2.67–2.55(m,1h),2.10–2.05(m,1h),1.26(s,9h);13cnmr(101mhz,dmso-d6)δ177.77,172.58,171.99,166.31,152.53,146.08,139.89,139.73,136.60,133.47,130.46,130.42,130.06,129.74,128.56,126.39,125.90,123.51,123.19,120.37,116.07,114.39,59.73,51.11,50.76,36.25,27.32,21.59。
化合物q3:白色固体0.43g,产率29%。mp130-133℃;ei-ms(m/z):582[m]+;1hnmr(400mhz,dmso-d6)δ10.43(s,1h),8.61(s,1h),8.45(d,j=6.6hz,1h),8.21(s,1h),8.09(d,j=8.6hz,1h),7.95(d,j=8.1hz,1h),7.89(d,j=8.3hz,2h),7.70(d,j=8.2hz,2h),7.58–7.54(m,1h),7.42(d,j=7.7hz,1h),7.08(d,j=8.6hz,1h),4.39–4.34(m,1h),3.88–3.84(m,1h),3.33(s,3h),3.23–3.18(m,1h),2.90–2.86(m,1h),2.48–2.44(m,1h),2.04–1.94(m,1h);13cnmr(101mhz,dmso-d6)δ174.31,166.23,152.59,145.60,139.81,139.65,137.48,133.71,130.34,130.02,129.68,129.05,128.49,126.30,125.96,123.47,123.25,120.12,116.03,115.98,112.76,60.04,51.95,51.65,42.20,36.78.
化合物q4:白色固体0.44g,产率35%。mp170-172℃;ei-ms(m/z):505[m+h]+;1hnmr(400mhz,dmso-d6)δ10.45(s,1h),8.62(s,2h),8.20(s,1h),7.95–7.91(m,2h),7.85(d,j=8.5hz,2h),7.65(d,j=8.4hz,2h),7.58–7.54(m,1h),7.42(d,j=7.8hz,1h),6.90(s,2h),4.40–4.35(m,1h),3.90–3.87(m,1h),3.24–3.20(m,1h),2.94–2.85(m,1h),2.48–2.41(m,1h),2.04–1.94(m,1h);13cnmr(101mhz,dmso-d6)δ173.85,172.63,166.26,163.60,156.57,139.79,138.39,132.87,130.38,130.02,128.57,128.47,126.37,125.04,123.48,121.45,120.20,116.03,115.99,59.97,51.78,51.43,36.65。
化合物q6、q7制备同化合物q5。
化合物q6:白色固体0.19g,产率13%。mp162-165℃;ei-ms(m/z):572[m]+;1hnmr(400mhz,dmso-d6)δ10.42(s,1h),9.04(d,j=2.1hz,1h),8.97(d,j=1.9hz,1h),8.75(d,j=3.8hz,1h),8.51(d,j=6.6hz,1h),8.43–8.42(m,1h),8.21(s,1h),7.95(d,j=8.4hz,3h),7.83(d,j=8.4hz,2h),7.58–7.54(m,1h),7.41(d,j=7.8hz,1h),4.40–4.35(m,1h),3.88–3.84(m,1h),3.22–3.19(m,1h),2.91–2.86(m,2h),2.49–2.41(m,1h),2.04–1.95(m,1h),0.77–0.71(m,2h),0.64–0.58(m,2h);13cnmr(101mhz,dmso-d6)δ174.33,166.28,166.11,150.21,148.28,139.82,139.36,134.58,134.51,133.16,130.38,130.35,130.01,129.70,125.95,123.47,123.24,120.15,116.02,115.98,60.08,51.98,51.72,36.72,23.53,6.22。
化合物q7:白色固体0.50g,产率34%。mp145-146℃;ei-ms(m/z):589[m+h]+;1hnmr(400mhz,dmso-d6)δ10.42(s,1h),8.99(d,j=2.2hz,1h),8.59(d,j=1.9hz,1h),8.50(d,j=6.6hz,1h),8.21(s,1h),8.10–8.09(m,1h),7.95(d,j=8.0hz,1h),7.93(d,j=8.0hz,2h),7.81(d,j=8.4hz,2h),7.58–7.54(m,1h),7.40(d,j=7.7hz,1h),4.39–4.35(m,1h),3.87–3.83(m,1h),3.51–3.47(m,2h),3.24–3.22(m,2h),3.22–3.17(m,1h),2.90–2.86(m,1h),2.49–2.46(m,1h),2.05–1.94(m,1h),1.19(t,j=6.4hz,3h),1.08(t,j=6.2hz,3h);13cnmr(101mhz,dmso-d6)δ174.47,167.84,166.09,148.50,146.47,139.83,139.20,134.74,134.53,133.68,132.25,130.33,130.00,129.69,128.54,127.18,125.95,123.46,123.25,120.07,116.02,115.98,60.07,52.01,51.75,43.48,36.81,14.50,13.26。
下面对本发明制得的具有抗肿瘤活性的含有羟脯氨酸的化合物进行bcr-abl激酶抑制活性筛选。
测定方法具体如下:
激酶abl1、abl(t315i)和底物abltide购自signal-chem公司,选用promega公司的adp-glotmkinaseassays检测试剂盒检测目标化合物的抑酶活性,操作方法按照试剂盒说明进行。
abl实验中,将atp(1mm)用buffer(2×)(tris80mm,mgcl220mm,bsa0.2mg/ml,dtt2mm)稀释80倍配制成atp(125μm)的buffer(2×)溶液;将125μm的atp溶液和abltide溶液体积1:1混合配制成atp(62.5μm)-abltide(0.5μg/μl)的混合溶液备用;abl1激酶溶液用buffer(1×)(tris40mm,mgcl210mm,bsa0.1mg/ml,dtt1mm)稀释100倍配制成abl1(1ng/μl)的buffer(1×)溶液备用。
abl(t315i)实验中的atp-abltide以及abl1(t315i)的配制步骤同上,不同的是atp浓度为12.5μm,abl1(t315i)的浓度是2ng/μl
将目标化合物和阳性对照药(imatinib)用buffer(1×)分别配制成1.5×10-5,1.5×10-6,1.5×10-7,1.5×10-8,1.5×10-9,1.5×10-10mol/l浓度梯度的样品溶液,于384孔板上每孔依次加入2μlatp-abltide的混合溶液,1μl样品溶液,2μl酶溶液;空白孔加3μl缓冲液和2μlatp-abltide的混合溶液;对照孔加2μlatp-abltide的混合溶液,1μl缓冲液,2μl酶溶液,加毕,30℃下孵育60min;加入adp-glo试剂5μl,在25℃下孵育40min;加入kinasedetection试剂,再在25℃下孵育30min。采用perkinelmer多功能酶标仪的化学发光模块测定每孔的发光值,计算化合物对abl的抑制率和ic50。
本发明的含有羟脯氨酸的化合物的结构式为:
abl激酶活性:
表1含有羟脯氨酸的化合物对bcr-abl/bcr-ablt315i抑制活性ic50(μm)
由上表中可以看出,大部分化合物对bcr-abl、bcr-ablt315i都具有抑制活性,其中,化合物q2(ic50=2.64μm)、q3(ic50=0.15μm)、q4(ic50=9.18μm)、q6(ic50=7.40μm)、q7(ic50=4.23μm)对bcr-abl的抑制活性在0~10μm之间,并且化合物q3活性最好。对于bcr-ablt315i的抑制活性来讲,化合物q1(ic50=12.99μm)、q4(ic50=14.10μm)、q7(ic50=22.10μm)的抑制活性在0~20μm之间,除此之外其他化合物活性较差。活性结果显示,取代基类型不同都对生物活性影响较大。
下面测定含有丙氨酸的类肽类化合物对肿瘤细胞的生长抑制活性。采用mtt法检验含有丙氨酸的类肽类化合物对肿瘤细胞的生长抑制活性作用。
本发明提供的含有丙氨酸的类肽类化合物具有抗肿瘤的作用。对肿瘤细胞具有体外抑制增值活性效果,在人白血病细胞(k562细胞)中具有抑制肿瘤细胞的增值活性效果,可用于对白血病的治疗。
取对数生长期的人白血病细胞(k562细胞),用rpmi1640培养基稀释成104个/ml数量级的细胞溶液,平行接种于96孔培养板中(2000-4000个/孔),每孔接种体积为180μl,37℃、5%co2培养箱中培养12h;
每孔加入不同浓度的待测化合物20μl,使孔中化合物的终浓度为:1.5×10-7mol/l,1.5×10-6mol/l,1.5×10-5mol/l,1.5×10-4mol/l,每个浓度设3个复孔,阴性对照加细胞不加化合物,设6个复孔,尼罗替尼或伊马替尼为阳性对照,继续培养48h;
每孔加入mtt(5mg/ml)20μl,使孔中mtt的终浓度0.5mg/ml,37℃培养箱孵育4h,小心吸弃上清,每孔加dmso150μl,振荡15min,酶联免疫检测仪测量各孔490nm处的紫外吸收值(od值),然后计算细胞抑制率,并根据抑制率采用线性回归法计算求出化合物的ic50值;
细胞抑制率的计算公式为:
抑制率%=(对照孔平均od值-用药组平均od值)/对照孔平均od值×100%
检测结果显示:与阴性对照组相比,含有丙氨酸的类肽类化合物对上述肿瘤细胞具有不同程度的体外抑制作用,如表2所示
k562细胞增殖活性:
表2含有羟脯氨酸的化合物对k562细胞抑制活性ic50(μm)
细胞活性筛选试验表明,化合物对k562细胞具有一定的细胞增值抑制活性,ic50的范围4.56~65.30μm之间。其中,化合物活性最好的是q7(ic50=4.56μm),活性与阳性药伊马替尼相当。而其他化合物的抗k562细胞增值抑制活性稍差。结果表明,吡啶环上引入不同的取代基,对生物活性的影响存在较大的差异。
本发明以联苯吡啶为铰链区结合基团,并采用片段药物的设计策略,引入l-羟脯氨酸为柔性linker,以构建具有激酶抑制活性的类肽类小分子化合物库,并通过adp-glo等试验筛选发现具有bcr-abl激酶抑制活性的酪氨酸激酶抑制剂。该化合物能够用于制备抗肿瘤(慢性粒细胞白血病)药物中,具有抑制bcr-abl、bcr-ablt315i激酶活性,并且对k562细胞具有细胞增值抑制活性。同时,活性结果显示,引入l-羟脯氨酸结构对化合物的抑制活性具有一定作用,可以作为bcr-abl酪氨酸激酶抑制剂的新型linker药效片段。
- 还没有人留言评论。精彩留言会获得点赞!