海绵来源杂萜类化合物Dysiarenone及其制备方法与应用与流程
本发明涉及医药技术领域,具体涉及海绵来源杂萜类化合物dysiarenone及其制备方法与应用。
背景技术:
海绵是一种低等的多细胞动物,有5亿多年的演化史,在海洋严酷的竞争环境中形成了独特的化学防御机制,能够高效地产生活性物质,每年从海绵中发现结构新颖的活性物质约占海洋天然产物的三分之一以上,目前美国fda批准上市的7个海洋药物中,有3个源自海绵,因此,海绵已成为海洋药物的重要来源,一直是海洋天然产物化学家的研究热点。
倔海绵(dysideaarenaria)为海绵属寻常纲(demospongiae)网角海绵(dictyoceratida)掘海绵科(dysideidae)海绵。国内外学者已经对该属海绵进行过较为系统的化学成分和生物活性研究。具有21个碳的杂萜是倔海绵属海绵最重要的一类代谢产物,该类型化合物由一个15个碳的倍半萜连接一个6个碳的对苯醌或氢醌构成,代表性的化合物有avarone和avarol。其混合的生源合成途径和多变的结构引起了国内外学者的广泛关注,许多该类型的杂萜化合物从海绵中被发现。结构的变化主要发生在倍半萜、醌/氢醌以及它们的连接方式,比如boliaquinone[1]、avinosol[2]、adociaquinol[3]、frondosins[4]和dysidavarones[5]。该类型杂萜类化合物具有广泛的生物活性,包括抗菌[6]、抗真菌[7]、抗肿瘤[8]、抗氧化[9]、抗炎[10]以及抗过敏活性[11]。该类型化合物广泛的生物活性和多变的结构引起了化学家和生物学家的持续关注[12]。(文献:[1]deguzman,f.s.;copp,b.r.;mayne,c.l.;concepcion,g.p.;mangalindan,g.c.;barrows,l.r.;ireland,c.m.bolinaquinone:anovelcytotoxicsesquiterpenehydroxyquinonefromaphilippinedysideasponge.j.org.chem.1998,63,8042–8044.;[2]diaz-marrero,a.r.;austin,p.;soest,r.v.;matainaho,t.;roskelley,c.d.;roberge,m.;andersen,r.j.avinosol,ameroterpenoid-nucleosideconjugatewithantiinvasionactivityisolatedfromthemarinespongedysideasp.org.lett.2006,8,3749–3752.;[3]west,l.m.;faulkner,d.j.hexaprenoidhydroquinonesfromthespongehaliclona(akaadocia)sp.j.nat.prod.2006,69,1001-1004.;[4]patil,a.d.;freyer,a.j.;killmer,l.;offen,p.;carte,b.;jurewicz,a.j.;johnson,r.k.frondosins,fivenewsesquiterpenehydroquinonederivativeswithnovelskeletonsfromthespongedysideafrondosa:inhibitorsofinterleukin-8receptors.tetrahedron1997,53,5047-5060.;[5]jiao,w.h.;huang,x.j.;yang,j.s.;yang,f.;piao,s.j.;gao,h.;li,j.;ye,w.c.;yao,x.s.;chen,w.s.;lin,h.w.dysidavaronesa-d,newsesquiterpenequinonesfromthemarinespongedysideaavara.org.lett.2012,14,202-205.;[6](a)urban,s.;capon,r.j.5-epi-isospongiaquinone,anewsesquiterpene/quinoneantibioticfromanaustralianmarinesponge,spongiahispida.j.nat.prod.1992,55,1638–1642.(b)schmalzbauer,b.;herrmann,j.;müller,r.;menche,d.totalsynthesisandantibacterialactivityofdysidavaronea.org.lett.2013,15,964-967.;[7]ciavatta,m.l.;lopezgresa,m.p.;gavagnin,m.;romero,v.;melck,d.;manzo,e.;guo,y.w.;vansoest,r.;cimino,g.studiesonpuupehenone-metabolitesofadysideasp.:structureandbiologicalactivity.tetrahedron2007,63,1380–1384.;[8](a)daletos,g.;devoogd,n.j.;müller,w.e.g.;wray,v.;lin,w.;feger,d.;kubbutat,m.;aly,a.h.;proksch,p.cytotoxicandproteinkinaseinhibitingnakijiquinonesandnakijiquinolsfromthespongedactylospongiametachromia.j.nat.prod.2014,77,218-226.(b)hwang,i.h.;oh,j.;zhou,w.;park,s.;kim,j.h.;chittiboyina,a.g.;ferreira,d.;song,g.y.;oh,s.;na,m.;hamann,m.t.cytotoxicactivityofrearrangeddrimanemeroterpenoidsagainstcoloncancercellsviadown-regulationofβcateninexpression.j.nat.prod.2015,78,453-461.;[9]utkina,n.k.;denisenko,v.a.;krasokhin,v.b.sesquiterpenoidaminoquinonesfromthemarinespongedysideasp.j.nat.prod.2010,73,788–791.;[10]mcnamara,c.e.;larsen,l.;perry,n.b.;harper,j.l.;berridge,m.v.;chia,e.w.;kelly,m.;webb,v.l.anti-inflammatorysesquiterpene-quinonesfromthenewzealandspongedysideacf.cristagalli.j.nat.prod.2005,68,1431–1433.;[11]jiao,w.h.;cheng,b.h.;shi,g.h.;chen,g.d.;gu,b.b.;zhou,y.j.;hong,l.l.;yang,f.;liu,z.q.;qiu,s.q.;liu,z.g.;yang,p.c.;lin,h.w.dysivillosinsa–d,unusualantiallergicmeroterpenoidsfromthemarinespongedysideavillosa.sci.rep.2017,7,8947.;[12](a)fukui,y.;narita,k.;katoh,t.enantioselectivetotalsynthesisofdysidavaronea,anovelsesquiterpenoidquinonefromthemarinespongedysideaavara.chem.-eur.j.2014,20,2436–2439.(b)moosmann,p.;ueoka,r.;grauso,l.;mangoni,a.;morinaka,b.i.;gugger,m.;piel,j.cyanobacterialent-sterol-likenaturalproductsfromadeviatedubiquinonepathway.angew.chem.int.ed.2017,56,4987–4990.)
但是至今未见具有抑制cox-2酶的表达抑制peg2产生的杂萜化合物的报道。
技术实现要素:
本发明的第一目的在于公开一种海绵来源杂萜类化合物dysiarenone,其化学结构式如下:
本发明的第二目的在于公开所述的海绵来源杂萜类化合物dysiarenone的制备方法,其包括步骤:
(a)用75-95%(优选95%)乙醇冷浸提取倔海绵,再将提取液浓缩得到浸膏;
(b)将浸膏用水混悬,然后用有机溶剂萃取,萃取液减压浓缩后依次经:
减压硅胶柱色谱分离,采用石油醚-乙酸乙酯梯度洗脱,合并含有倍半萜醌类化合物的馏分;
sephadexlh-20凝胶柱分离,采用石油醚-二氯甲烷-甲醇系统洗脱,进一步富集倍半萜醌类化合物;
反相中压ods柱色谱分离,采用甲醇-水系统梯度洗脱,获得含有倍半萜类化合物的精细馏分;
高效液相色谱法分离,采用95%乙腈水洗脱,得到化合物dysiarenone。
较佳的,步骤(a)中,倔海绵浸提前先经冷冻并切碎。
较佳的,步骤(b)中,萃取用的所述有机溶剂选自二氯甲烷、三氯甲烷、二氯乙烷和乙酸乙酯中的一种或多种;优选二氯甲烷。
较佳的,步骤(b)中,sephadexlh-20凝胶柱采用的石油醚-二氯甲烷-甲醇体积比为4:1:5。
较佳的,步骤(b)中,反相中压ods柱采用的甲醇-水系统梯度为50:50~100:0。
较佳的,高效液相色谱法分离时,流速2.0ml/min,检测波长290nm。
本发明的第三目的在于公开所述的海绵来源杂萜类化合物dysiarenone的应用,尤其是在制备抗炎药物或抗肿瘤药物中的应用。
体外活性试验证明,本发明化合物dysiarenone对cox-2酶的表达和炎症介质pge2的释放显示出很强的抑制活性,cox-2酶和pge2对炎症的发生、对肿瘤的血管生成和凋亡都具有密切的关系,因此可用于制备抗炎和抗肿瘤药物。
所述的抗炎药物是指直接用于预防、诊断、检测、保护、治疗和研究机体炎症反应及其直接相关疾病的产品中的一种或多种,所述的炎症包括与cox-2酶相关或可能相关的炎症,指变质性炎症、渗出性炎症、增生性炎症、妇科炎症或特异性炎症中的一种或多种。
所述的渗出性炎症是浆液性炎、纤维素性炎、化脓性炎、出血性炎、坏死性炎或卡他性炎中的一种或多种。
所述的特异性炎症是结核、梅毒、麻风或淋巴肉芽肿中的一种或多种。
所述的妇科性炎症是盆腔炎、阴道炎或宫颈炎中的一种或多种。
所述的抗肿瘤药物是指直接用于预防、诊断、检测、保护、治疗和研究肿瘤及其直接相关疾病的药物中的一种或多种,是抗肺癌药物、抗宫颈癌药物或抗结肠癌药物中的一种或多种;所述的肿瘤是肺癌、宫颈癌或结肠癌中的一种或多种。
所述的抗肺癌药物是指直接用于预防、诊断、检测、保护、治疗和研究肺癌及其直接相关疾病的药物中的一种或多种,所述的肺癌是指非小细胞肺癌和小细胞肺癌中的一种或多种,所述的非小细胞肺癌是磷癌、腺癌或大细胞肺癌中的一种或多种。
所述的抗宫颈癌药物是指直接用于预防、诊断、检测、保护、治疗和研究宫颈癌及其直接相关疾病的药物中的一种或多种,所述的宫颈癌是非典型增生、原位癌、镜下早期浸润癌或浸润癌中的一种或多种。
所述的抗结肠癌药物是指直接用于预防、诊断、检测、保护、治疗和研究结肠癌及其直接相关疾病的药物中的一种或多种,所述的结肠癌是指左半结肠癌、右半结肠癌或直肠癌中的一种或多种。
本发明的有益效果在于:本发明制备方法简单,通过该方法制备得到的化合物dysiarenone对cox-2酶的表达和炎症介质pge2的释放抑制活性显著。本发明为研究和开发新的抗炎、抗肿瘤药物提供了新的先导化合物,为开发利用我国海洋药用资源提供了科学依据。
附图说明
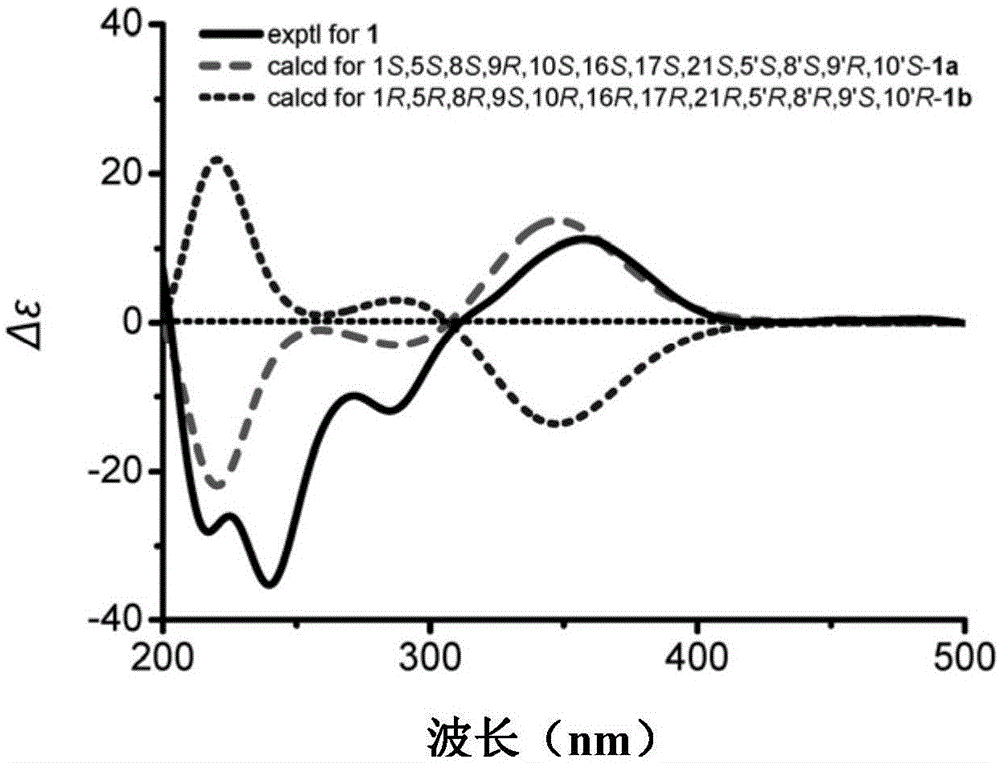
图1为本发明化合物dysiarenone的实测ecd曲线和两种构型计算ecd曲线;
图2a显示dysiarenone对脂多糖诱导cox-1、cox-2和β-actin表达的抑制活性;
图2b显示dysiarenone对脂多糖诱导raw264.7小鼠巨噬细胞释放pge2的抑制活性;
图3显示dysiarenone、avarol以及地塞米松对脂多糖诱导raw264.7小鼠巨噬细胞释放pge2的抑制活性。
具体实施方式
以下结合具体实施例,对本发明作进一步说明。应理解,以下实施例仅用于说明本发明而非用于限定本发明的范围。
实施例1化合物dysiarenone的制备
取预先冷冻并切碎的倔海绵(湿重520g),分别用95%乙醇(1l)冷浸提取8次,每次一周,合并提取液,提取液经减压浓缩得总浸膏,将总浸膏混悬到水中,再用等体积二氯甲烷进行萃取5次,合并萃取液,减压浓缩,得到二氯甲烷萃取物(2.7g)。
将上述二氯甲烷萃取物(2.7g)用减压硅胶柱色谱分离,采用石油醚-乙酸乙酯梯度洗脱,根据薄层色谱tlc分析结果,得到含有倍半萜醌类化合物的馏分,再用sephadexlh-20凝胶柱对该馏分进行进一步富集,采用石油醚-二氯甲烷-甲醇(4:1:5)系统,得到进一步富集倍半萜醌类化合物的馏分,然后对该馏分再进行反相中压ods柱色谱分离,采用甲醇-水系统梯度洗脱(10:90、30:70、50:50、70:30、80:20、90:10和100:0),对于获得的含有倍半萜类化合物的精细馏分,再用高效液相色谱法进行分离(95%乙腈水,流速2.0ml/min,检测波长280nm),得到化合物dysiarenone(c42h56o4)。
dysiarenone的理化性质和核磁共振数据如下:
淡黄色固体;
表1化合物dysiarenone的核磁共振谱数据(cdcl3)
图1示出化合物dysiarenone(1)的实测ecd曲线以及两种构型(1a和1b)的计算ecd曲线,确定该化合物(parta:c-1-c-21)的绝对构型为1s,5s,8s,9r,10s,16s,17s,21s,partb(c-1′-c-21′)的绝对构型为5′s,8′s,9′r,10′s。结构式如下,
实施例2体外抑制脂多糖(lps)诱导raw264.7小鼠巨噬细胞释放pge2实验
分别以本发明化合物dysiarenone、avarol和地塞米松(dexamethasone,人工合成抗炎药)作为样品进行体外抑制脂多糖诱导的raw264.7小鼠巨噬细胞释放pge2实验,同时进行未添加样品的空白组(control)平行实验。样品用dmso溶解,低温保存,dmso在最终体系中的浓度控制在不影响检测活性的范围之内。每个样品浓度在测试中均设置3个复孔。
具体实验步骤:
购自上海生命科学院的raw264.7小鼠巨噬细胞在rpmi1640(包括10%(v/v)fbs、100u/ml青霉素、100μg/ml的链霉素)中培养;培养温度为37℃,通5%(v/v)co2。把细胞从25cm2的培养皿取出,将细胞在96孔板上铺板(5×105)。首先用cck-8法检测细胞化合物对巨噬细胞的毒性。将小鼠巨噬细胞(5×105cells/well,100μl/well)铺在96孔板上,加2-32μm浓度范围的样品培养。培养24h后,将10μl的cck-8培养液加入细胞培养基中,37℃孵育4h。在450nm测试吸光度。空白组的细胞设置为100%,通过检测发现化合物dysiarenone在2-8μm浓度范围不显示细胞毒性。
为了评价化合物dysiarenone对脂多糖诱导的小鼠巨噬细胞raw264.7释放pge2的抑制活性,采用标准的elisa方法,去细胞的上清液用于炎症因子pge2释放活性的检测。pge2的释放采用纯化后的anti-rattnf-抗体检测。细胞的浓度在450nm波长下测定,在540nm波长条件下校正。
结果如下:
图2a显示化合物dysiarenone对脂多糖诱导的raw264.7小鼠巨噬细胞中cox-2的表达具有选择性的抑制活性,且具有很好的量效关系,但是对正常细胞释放cox-1却没有显著影响,化合物dysiarenone在2-8μm浓度范围不显示细胞毒性。
图2b显示化合物dysiarenone对脂多糖诱导的raw264.7小鼠巨噬细胞释放pge2具有很强的抑制活性,具有显著性差异,4μm时p<0.01,8μm时p<0.001。
图3所示为不同浓度的dysiarenone、avarol和dexamethasone对pge2抑制率和半数有效抑制浓度ic50值。由图3可知,化合物dysiarenone对脂多糖诱导的raw264.7小鼠巨噬细胞释放炎症介质pge2具有很强的抑制活性,ic50值为6.4μm,约为avarol的10倍,为阳性药dexamethasone的25倍,因此可用于制备抗炎药物和抗肿瘤药物。本发明为研制新的抗炎药物和抗肿瘤药物提供了新的先导化合物。
以上已对本发明创造的较佳实施例进行了具体说明,但本发明创造并不限于所述实施例,熟悉本领域的技术人员在不违背本发明创造精神的前提下还可做出种种的等同的变型或替换,这些等同的变型或替换均包含在本申请权利要求所限定的范围内。
- 还没有人留言评论。精彩留言会获得点赞!