一种以四苯乙烯吲哚衍生物为光敏剂的纳米复合材料及制备方法和在肿瘤治疗方面的应用与流程
本发明涉及一种四苯乙烯吲哚类光敏剂的设计与合成以及通过聚多巴胺载体的引入,构建纳米复合材料,用于细胞和动物水平上光动力和光热协同治疗抗肿瘤。
背景技术:
光动力疗法是基于光敏剂分子被特定波长的光源激活,发生能量转移,从而产生活性氧分子的方法,其中单线态氧分子是常被利用的一类活性氧分子,单线态氧的过表达会导致细胞大分子(例如蛋白质、脂质体和dna)的损伤和破坏,最终引起细胞凋亡和坏死。传统的光敏剂包括卟啉衍生物、蒽醌、噻吩嗪、花青素和姜黄素等,良好的光动力治疗效果与光敏剂性能密切相关,扩展的离域电子系统是构建高效光敏剂时优先考虑的结构,然而,π-π堆积又容易引起光敏剂在水性环境中发生聚集,从而影响活性氧分子产生的能力,降低光动力治疗的效果。为了克服这一局限性,纳米尺寸的载体被用于将光敏剂输送到细胞中,避免在运输过程中发生聚集和沉降,提高药物在靶点部位的富集量。
线粒体是真核细胞内重要细胞器之一,它的一个主要功能是产生atp,具有“细胞发电站”的称号。除了能产生能量外,线粒体还发挥着许多其他作用,诸如参与细胞分化、细胞信息传递和细胞凋亡等过程,并拥有调控细胞生长和细胞周期的能力。癌细胞的死亡与线粒体的功能也有着很大的关系,最近许多科研工作者专注于将药物分子靶向递送到线粒体上进行肿瘤探索治疗。促进线粒体内活性氧的产生以诱导癌细胞死亡可以达到改善化疗效果的目的,因此光敏剂向线粒体部位的传递有助于通过单线态氧的过表达来消除肿瘤细胞。
聚集诱导发光探针在细胞中呈现强烈的荧光并且在聚集状态下依然保持有效的光敏性能,因此已经被应用到作为光敏剂产生活性氧分子用于癌细胞和肿瘤部位的消除。大部分聚集诱导发光基光敏剂是疏水性的,因此主要通过将聚集诱导发光分子从有机溶剂转移到水环境中制备纳米尺寸的粒子,聚集诱导发光探针本身既是载体又是光敏剂。然而,通过此方法制备得到的纳米级光敏剂形态不均匀,在水环境下稳定性不好,限制了其在生物体内的应用。而且迄今为止有关聚集诱导基光敏剂被用于靶向细胞器以达到增强光动力治疗效果的报道很少,仍然面临着一些挑战。
技术实现要素:
为解决上述技术问题,本发明的目的是提供一种基于聚集诱导发光结构,具有线粒体靶向功能,并具有较高单线态氧量子产率的水溶性光敏剂。然后选择合适的纳米载体,构建纳米复合体系,达到细胞和动物水平上肿瘤部位有效消除的目的。
本发明的一种聚集诱导发光基光敏剂具有如下的结构式:
其中,r1=-ch3,-cooh,-no2,-oc2h5,或-och3中的任意一个;r2=clo3-,cl-,i-,或br-中的任意一个,r3=-h,-ch3,-c2h5,-och3,或-oc2h5中的任意一个。
本发明的纳米载体优选聚多巴胺纳米载体,粒径为100nm-200nm。
进一步的,优选聚多巴胺材料作为光敏剂的载体,粒径为100nm-200nm,构建具有线粒体靶向成像、光动力和光热双重活性的纳米复合材料的制备方法,包括一下步骤:
1)聚多巴胺纳米材料的制备:
首先配制盐酸多巴胺单体的水溶液(浓度为2-4mg/ml),温度升至45℃-65℃时加入氢氧化钠水溶液调节反应体系的ph至8.5-9.0,反应5-8小时后高速离心,去掉上清液,保留沉淀部分用去离子水洗涤三次,去掉未反应的盐酸多巴胺单体和低聚物分子,最后在4000r/min的条件下低速离心,保留上清液,即可得到粒径在100nm-200nm左右的聚多巴胺纳米材料;
2)复合纳米材料的制备:
在聚多巴胺水溶液中加入氨水调节ph至10-11,然后加入平均分子量为5kda的mpeg-sh,室温条件下搅拌12小时,将所得混合溶液高速离心、洗涤,重复操作3次,然后将所得纳米材料溶解到水溶液中,加入权利要求1所述的四苯乙烯吲哚衍生物,室温下搅拌24小时,将所得混合物离心洗涤,在冻干机真空环境下干燥得到粉末状具有线粒体靶向成像、光动力和光热双重活性的纳米复合材料。
通过上述方案,本发明具有如下优点:
以四苯乙烯基作为骨架引入吸电子基团和给电子基团得到的聚集诱导发光基光敏剂,由于电子供体和受体结构的存在,降低了分子的能隙值,因此具有较高的单线态氧量子产率,是一个高效的光敏剂分子,然后将此分子通过氢键和π-π键的作用连接到聚多巴胺纳米粒子表面形成的纳米复合材料,具有良好的水溶性和生物相容性。光敏剂分子上的吲哚基团具有识别和靶向线粒体的功能,因此纳米复合材料在吲哚基团的引导下可以成功被细胞的线粒体内化,作为载体结构的聚多巴胺纳米材料在近红外激光的照射下能产生热量,可用于光热治疗,光敏剂分子在白色光源的照射下能产生单线态氧,可用于光动力治疗,因此本发明构建出一种具有线粒体靶向成像、光动力和光热双重活性的纳米复合材料,并且在细胞和动物水平印证了纳米复合材料在光照作用下光动力和光热治疗的协同效应,实现了光诱导肿瘤消融。
附图说明
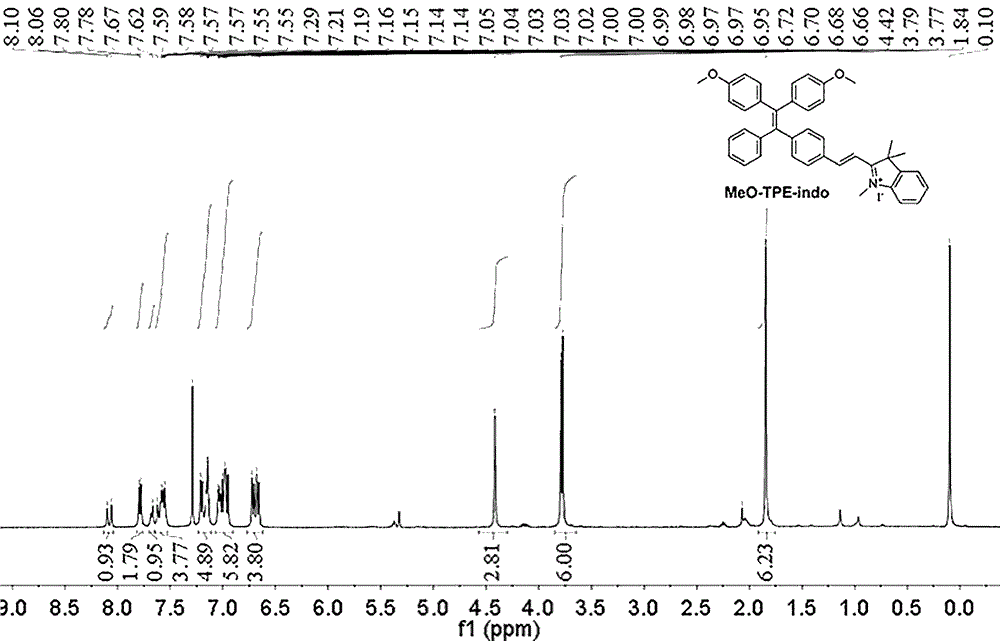
图1是本发明实施例二甲氧基四苯乙烯吲哚分子的氢谱核磁图。
图2是本发明实施例二甲氧基四苯乙烯吲哚分子的质谱图。
图3是本发明实施例二甲氧基四苯乙烯吲哚分子在溶液中产生单线态氧的检测曲线。
图4是本发明实施例二甲氧基四苯乙烯吲哚分子对细胞内线粒体靶向和成像图片。
图5是本发明实施例制备的纳米复合材料的sem图片。
图6是本发明实施例制备的纳米复合材料的温度时间曲线。
图7是本发明实施例制备的纳米复合材料在不同溶液中的药物释放曲线。
图8是本发明实施例制备的纳米复合材料的细胞毒性实验结果图。
图9是本发明实施例制备的纳米复合材料在小鼠体内各器官的分布图片。
图10是本发明实施例制备的纳米复合材料的抑制小鼠肿瘤生长图片。
具体实施方式
下面通过具体实施例对本发明进行详细的说明,但本发明并不局限于此。
二甲氧基四苯乙烯吲哚分子(mti)的制备方法:
1)将4-溴二苯甲酮(3.0g,11.5mmol),4,4-二甲氧基二苯甲酮(2.78g,11.5mmol)和锌粉(5.97g,92mmol)溶于新蒸馏的四氢呋喃(150ml)中,连接冷凝装置,密封反应体系,利用氮气排除反应体系内的空气,冰水浴维持低温环境,然后将四氯化钛(8.72g,46mmol)加入上述体系中搅拌0.5小时,将反应体系加热至75-85℃保持回流9小时,然后冷却至室温,加入水,将反应混合物用二氯甲烷进行萃取,重复操作三次,加入无水硫酸钠干燥获得的有机物混合溶液。以石油醚/二氯甲烷(体积比为5:1)作为洗脱剂,将粗产物用硅胶柱纯化,得到meo-tpe-indo;
2)将第一中间产物(1g,2.1mmol)溶于新蒸馏的四氢呋喃(30ml)中,将上述反应体系放置于丙酮浴中,加入液氮冷却,然后加入n-丁基锂溶液(4.80ml,7.56mmol)并在相同温度下搅拌1小时,在体系温度恢复至室温后,加入n,n-二甲基甲酰胺(0.99ml,12.6mmol),将反应体系在室温下搅拌10h,将水加入反应体系中,用二氯甲烷进行萃取,重复操作三次,加入无水硫酸钠以干燥获得的有机物混合溶液,使用石油醚/乙酸乙酯(体积比为5:1)作为洗脱剂,将粗产物用硅胶柱纯化,得到meo-tpe-fm;
3)将第二中间产物(50.00mg,0.12mmol)和吲哚盐(43.35mg,0.14mmol)溶解在新蒸馏的甲苯(20ml)中,加入几滴三乙胺,将上述反应体系保持回流48小时,冷却至室温后,将水加入反应体系中,用二氯甲烷进行萃取,重复操作三次,加入无水硫酸钠以干燥获得的有机物混合溶液,使用乙酸乙酯/二氯甲烷/甲醇(体积比为15:5:1)作为洗脱剂,将粗产物用硅胶柱纯化,得到mti。
pda-mti纳米复合材料的制备:
1)首先,将180mg盐酸多巴胺溶解在90ml去离子水中,加入到250ml圆底烧瓶中,将反应体系放在水浴锅中加热,设定加热温度为50℃,待温度到达指定温度后,加入780μlnaoh(1m)溶液调节混合体系ph为8.5,搅拌,5小时后,停止反应,将反应体系分装入离心管中,在12000r/min条件下离心15min,去掉上清液,在沉淀中加入去离子水,重新分散,洗涤、离心,重复操作3次后,在沉淀加入去离子水,重新分散,于4000r/min条件下离心3分钟,去掉沉淀物质,保留上清液,得到粒径为100nm左右的pda球形材料;
2)将得到的pda颗粒溶解在去离子水中,得到浓度为1mg/ml的溶液,然后加入nh4oh溶液(28wt%)调节溶液的ph至10.3,最后,将100mg甲氧基-聚-(乙二醇)硫醇(mpeg-sh,5kda)加入上述碱性溶液中;室温下剧烈搅拌,12小时后,在12000r/min的条件下离心15min,去掉上清液,在沉淀中加入去离子水,洗涤3次,得到peg分子修饰的pda球形材料;
3)将浓度为0.2mg/ml的mti与pda-peg(2mg/ml)溶液混合,在室温下反应12小时,然后离心洗涤,最终通过冷冻干燥方法获得pda-mti粉末。
单线态氧量子产率测量:
用9,10-蒽二基-双(亚甲基)二甲酸(abda)作为单线态氧指示剂,玫瑰红(rb)被用作标准光敏剂;将mti溶解在去离子水中得到浓度为10μmol/l的溶液;将adba溶液(160μl,2m)与2mlmti溶液混合,然后用白色光源(100mw/cm2)照射混合物10分钟;每隔20秒用uv-vis分光光度计中记录一次在波长范围为320~420nm的吸收曲线;用与mti相同的方法检测pda-mti溶液的单线态氧量子产率,pda-mti的浓度为200μg/ml。
不同浓度的pda-mti溶液光热转换能力探究实验:
在96孔板中分别加入一系列浓度梯度的pda-mti溶液(浓度分别为0μg/ml,100μg/ml,200μg/ml,400μg/ml),用808nm激光分别照射溶液10min,用红外热成像仪实时记录
每个孔板中溶液的温度变化情况,对比不同浓度下溶液升温速率,拟出温度时间曲线。
细胞毒性试验:
在96孔板中以1×104个细胞/孔的密度接种hela细胞,24小时后,细胞贴壁,用含有不同浓度的pda-mti的新鲜培养基替换旧培养基。孵育4小时后,用白光源照射96孔板10分钟,然后将孔板放在37℃,5%co2环境下进行孵育,24小时后,去除含有pda-mti的培养基,加入mtt溶液,用酶标仪测定溶液在490nm处的吸光度。
共聚焦成像实验:
将hela细胞以3×105个/ml的密度接种在35mm玻璃底皿中,孵育24小时后,将浓度为40μmol/l的mti培养基溶液加入细胞中,与hela细胞共同孵育20分钟,用pbs洗涤细胞三次,加入mito-trackergreen(50nmol/l)溶液共同孵育30分钟,用pbs洗涤细胞三次,然后用共聚焦显微镜拍照,观察mti和mito-trackergreen的共定位情况。
小鼠肿瘤治疗实验:
购买4-5周的雄性balb/c小鼠,注射4t1细胞进行肿瘤模型的建立,当肿瘤体积达到约100mm3时,将小鼠分成4组,每组5只,分别为:空白组,照射(808nm+白光源)组,mti+照射组,pda-mti+照射组,pbs,mti和pmti溶液(300μg/ml,100μl)采用尾静脉注射的方法注射到小鼠体内,6小时后,用光源照射肿瘤10分钟,每天观察和记录小鼠肿瘤部位的体积,2周后,结束实验。
药物在体内各器官分布实验:
采用荷瘤balb/c小鼠来检测pda-mti纳米颗粒在生物体内的分布。利用尾静脉注射的方法将药物注射到小鼠体内,然后在不同的时间间隔(6h,12h,24h,48h)利用取出器官(心,肝,脾,肺,肾,肿瘤),利用活体成像仪检测来自mti分子的荧光强度来对pmti纳米颗粒在生物体内的分布进行定量。
- 还没有人留言评论。精彩留言会获得点赞!