用于酶促水解木质纤维素材料的方法与流程
本发明涉及用于酶促水解木质纤维素材料的方法。
背景技术:
木质纤维素植物材料在本文中也称为原料(feedstock)或含纤维素材料,其是糖形式的可再生能源,其可被转化为有价值的产物,例如生物燃料,例如生物乙醇。该过程期间,通过(半)纤维素分解酶,原料(例如麦秸、玉米秆、稻壳等)中存在的(木质或半)纤维素被转化为还原糖,然后通过微生物(比如酵母、细菌和真菌)被转化为有价值的产物例如乙醇。
鉴于(半)纤维素是结晶的并包埋在木质素网中,向还原糖的转化通常是慢的且不完全的。典型地,酶促水解未处理原料产生少于理论量的20%的糖。通过应用化学和热物理预处理,(半)纤维素对(半)纤维素分解酶而言更可及,因而转化更快且产率更高。
来自源于经预处理玉米秆的葡萄糖的典型乙醇产率是40加仑乙醇/1000kg干玉米秆(badger,p,ethanolfromcellulose:ageneralreview,trendsinnewcropsandnewuses,2002,j.janick和a.whipkey(编)ashspress,alexandria,va)或0.3g乙醇/g原料。基于纤维素的乙醇的最大产率是约90%。
纤维素分解酶(它们中的大多由比如trichoderma、humicola和aspergillus的物种产生)在商业上被用来将预处理的原料转化为含有不可溶的(半)纤维素、其制得的还原糖以及木质素的糊状物(mash)。然后,这种糊状物被用在发酵中,发酵期间还原糖被转化为酵母生物质(细胞)、二氧化碳和乙醇。以这种方式产生的乙醇被称为生物乙醇。
从预处理的木质纤维素原料生产糖的一般生产中,水解(还被称为液化、预糖化或糖化)典型地在45-50℃的升高的温度(kumar,s.,chem.eng.technol.32(2009)517-526)和非灭菌条件下的持续6-168小时的方法中进行(kumar,s.,chem.eng.technol.32(2009)517-526;murray,p.等人,enzymemicrobialtechnol29(2001)90-98)。在该水解期间,存在的纤维素被部分(典型地30-95%,可取决于酶活性和水解条件)转化为还原糖。在酶被预处理原料中存在的化合物和被释放的糖抑制的情况下,以及为了使热失活最小化,该升高的温度的时间尽可能地短。
水解后的发酵在相同或不同容器中在单独的厌氧处理步骤中发生,其中温度被调至30-33℃(嗜温方法)以适应生长和通过微生物生物质(通常为酵母)生产乙醇。在该发酵方法期间,通过来自水解步骤的已存在的酶,剩余的(半)纤维素材料被转化为还原糖,同时产生微生物生物质和乙醇。因此,这种类型的发酵通常被称为同时糖化和发酵(simultaneouslysaccharificationandfermentation,ssf)。一旦(半)纤维素材料被转化为可发酵糖并且所有可发酵糖被转化为乙醇、二氧化碳和微生物细胞,发酵完成。
这样获得的发酵糊状物由非可发酵糖、非可水解(半)纤维素材料、木质素、微生物细胞(最通常为酵母细胞)、水、乙醇、溶解的二氧化碳组成。在连续步骤中,从糊状物中蒸馏并进一步纯化乙醇。剩余的固体悬浮物被干燥并被用作例如燃烧燃料、肥料或牛饲料。
就每批原料而言,添加酶以使给定的处理时间期间从预处理的木质纤维素原料释放可发酵糖的产率和速率最大化。通常,生产酶的成本、原料到乙醇的产率和投资是总生产成本中的主要成本因素(kumar,s.chem.eng.technol.32(2009)517-526)。迄今为止,通过应用来自单一微生物来源或来自多种微生物来源(wo2008/008793)的具有更宽和/或更高(特异性)水解活性的酶产物来实现酶使用成本降低,使用所述酶目的在于更低的酶需求、更快的转化速率和/或更高的转化产率和因而总体上更低的生物乙醇生产成本。这需要在研究和开发这些酶产物中的大量投资。在由来自多种微生物来源的酶构成的酶产物情况下,生产各单个酶化合物需要大的资本投资。
因此期望改进涉及水解和发酵的上述方法。
来源于talaromyces的热稳定纤维素分解酶已被用于降解木质纤维素原料,已知这些酶具有热稳定性(在wo2007091231中)。然而,没有给出怎样优化水解和发酵方法的公开。
技术实现要素:
本发明的一个目的是提供用于水解含纤维素的生物质的方法,其包括:
-液化步骤,其中加入第一酶或第一酶组合物以液化所述生物质中存在的至少部分固体并在所述液化步骤中将所述含纤维素的生物质的粘度保持在低于1000cp、优选地低于800cp、更优选地低于600cp;然后
-糖化步骤,其中加入第二酶组合物以形成低聚糖和/或单体糖;以及
其中,所述第一酶或第一酶组合物与所述第二酶组合物不同;
其中,所述第一酶或第一酶组合物包含内切葡聚糖酶;
其中,所述第二酶组合物包含纤维素酶;和
其中,所述第一酶或第一酶组合物比所述第二酶组合物包含更多的内切葡聚糖酶(以蛋白质重量%表示)。
本发明的另一个目的是提供用于水解含纤维素的生物质的方法,其包括:
-液化步骤,其中加入第一酶或第一酶组合物以液化所述生物质中存在的至少部分固体并在所述液化步骤中获得至少2、至少4、至少6、至少10、至少15或至少20的粘度降低因子(viscosityreductionfactor);然后
-糖化步骤,其中加入第二酶组合物以形成低聚糖和/或单体糖;以及
其中,所述第一酶或第一酶组合物与所述第二酶组合物不同;
其中,所述第一酶或第一酶组合物包含内切葡聚糖酶;
其中,所述第二酶组合物包含纤维素酶;和
其中,所述第一酶或第一酶组合物比所述第二酶组合物包含更多的内切葡聚糖酶(以蛋白质重量%表示)。
优选地,液化步骤发生在这样的反应器(液化反应器)中,其体积小于糖化步骤所发生的反应器(糖化反应器)的体积,优选地,所述液化反应器的体积与所述糖化反应器的体积的比率在1:2和1:50之间,更优选地在1:3和1:40之间。
根据本发明的另一方面,液化反应器和/或糖化反应器的体积大于1m3,优选地体积在10-5000m3之间。
有利地,与形成低聚糖和/或单体糖的步骤中或单体糖水解反应器中相比,在液化步骤中或在液化反应器中,每反应器体积加入较少的酶(基于蛋白质干物质)。
根据本发明的另一方面,第二酶组合物包含至少两种不同的纤维二糖水解酶和任选地β-葡糖苷酶和/或gh61。
优选地,第一酶或第一酶组合物和/或第二酶或酶组合物包含热稳定酶。
根据一个优选的实施方式,以补料分批、半连续或连续模式,更优选地以连续模式完成液化步骤。
根据另一个优选的实施方式,以补料分批、半连续或分批模式,更优选地以分批或补料分批模式完成糖化步骤。
在液化步骤中,优选地维持干物质含量为5重量%或更高、8重量%或更高、10重量%或更高、11重量%或更高、12重量%或更高、13重量%或更高、14重量%或更高、15重量%或更高、20重量%或更高、25重量%或更高、30重量%或更高、35重量%或更高或40重量%或更高,以及优选地低于42重量%。
优选地,液化步骤在50℃或更高、55℃或更高、60℃或更高、65℃或更高、或者70℃或更高的温度下进行;更优选地,液化步骤在65℃-110℃之间、甚至更优选地在65℃-90℃之间、仍然更优选地在65℃-80℃之间且最优选地在70℃-80℃之间的温度下进行。
附图说明
图1:利用内切葡聚糖酶预液化的效果。
图2:在不同温度((◆=62℃,▲=70℃,●=75℃)下,木质纤维素原料液化期间的粘度下降。
具体实施方式
发明详述
本发明涉及在水解含纤维素的生物质的方法中降低操作成本,例如酶成本、反应器成本和能量成本。可通过使用较少酶来降低酶成本并同时维持高生产结果例如高水平的糖、乙醇、生物气或其它期望产物(全部与已知水解工艺相比)。可通过选择导致与已知水解工艺相比较小的总反应器体积的工艺条件来降低反应器成本。根据本发明,通过至本发明方法的能量供应需要较低可实现节能。
木质纤维素材料
本文中的木质纤维素材料包括任何木质纤维素材料和/或半纤维素材料。适于用作本发明原料或含纤维素材料的木质纤维素材料包括生物质,例如原初生物质(virginbiomass)和/或非原初生物质如农业生物质,商业有机物,建筑和拆除碎片,市政固体废弃物,废纸和庭院废弃物。常见的生物质形式包括树木,灌木丛(shrubs)和草,小麦,麦秸,甘蔗渣,柳枝稷,芒草(miscanthus),玉米,玉米秆(cornstover),玉米壳,玉米芯(corncobs),芸苔茎,大豆茎,高粱,玉米粒(包括来自玉米粒的纤维),来自谷物如玉米、小麦和大麦研磨(包括湿磨和干磨)的通常称作“麸或纤维”的产物和副产物,以及市政固体废弃物,废纸和庭院废弃物。生物质也可以是但不限于草本材料,农业残余物,林业残余物,市政固体废弃物,废纸,和浆和造纸厂残余物。“农业生物质”包括树枝,灌木(bushes),藤蔓(canes),玉米和玉米壳,能量作物,森林,水果,花,谷物,草,草本作物,叶,树皮,针叶,原木,根,树苗,短期轮种木本作物(short-rotationwoodycrops),灌木丛,柳枝稷,树木,蔬菜,水果皮,蔓藤(vines),甜菜浆,小麦麸皮(wheatmidlings),燕麦壳,和硬木材和软木材(不包括带有有害材料的木材)。另外,农业生物质包括由农业加工产生的有机废弃物材料,所述农业加工包括农业和林业活动,尤其包括林业木材废弃物。农业生物质可以是前述任一或其任何组合或混合物。
预处理
任选地,原料可以以本领域中已知的任何方式用热、机械、微生物、酶促和/或化学改性或这些方法的任何组合预处理,以增强底物对酶促水解的可及性和/或水解半纤维素和/或使半纤维素和/或纤维素和/或木质素溶解。在一种实施方式中,通过用蒸汽喷发、热水处理或用稀酸或稀碱处理木质纤维素进行预处理。
清洗步骤
任选地,根据本发明的方法包括清洗步骤。任选的清洗步骤可被用来去除可能作为发酵步骤的抑制剂的水溶性化合物。清洗步骤可以以已知的方式进行。
液化步骤
根据本发明的方法包括原料的液化。在该步骤中,使任选地预处理的和任选地清洗的木质纤维素材料与第一酶或第一酶组合物接触。
根据木质纤维素材料和预处理,技术人员可调节不同的反应条件例如温度、酶剂量、水解反应时间和干物质浓度,以实现期望的木质纤维素转化。一些指标在下文给出。
优选地,在液化步骤中,加入第一酶或第一酶组合物以液化生物质中存在的至少部分固体并在该步骤中使含纤维素的生物质的粘度保持在低于1000cp、优选地低于800cp、更优选地低于600cp。优选地,在该步骤中,含纤维素的生物质的干物质含量在12-35重量%之间、更优选地在15-30重量%之间。
干物质含量为5%或更高(例如,20重量%)的含纤维素的生物质的粘度将高于1000cp,例如2000cp。
根据另一个优选的实施方式,在液化步骤中加入第一酶或第一酶组合物以液化所述生物质中存在的至少部分固体从而在所述液化步骤中获得至少2、至少4、至少6、至少10、至少15或至少20的粘度降低因子。通常,粘度降低因子将小于50。粘度降低因子表示:进入液化步骤的生物质的粘度除以离开液化步骤的生物质的粘度(cp/cp)。
为了在液化步骤中获得高固体含量和低粘度,在启动阶段,液化反应器可包含的水和含纤维素的生物质(和第一酶或第一酶组合物)的量使得粘度低于1000cp、优选地低于800cp、更优选地低于600cp。在粘度由于加入的酶而降低之后,可加入更多的含纤维素的生物质,从而液化步骤中的干物质含量将增加。可进行该启动程序直至达到液化反应器中期望的干物质含量。随后,可以以补料分批、半连续或连续模式继续液化步骤。
另一种启动方式是下述程序,其中液化步骤中含纤维素的生物质的初始粘度高于500cp。在该程序中,仅在第一酶或第一酶组合物已使粘度降低至低于1000cp、优选地低于800cp、更优选地低于600cp后,以补料分批、半连续或连续模式继续液化步骤。在该程序中,在启动阶段中有利地的是,在启动阶段中定量加入(每含纤维素的生物质的干物质量)比随后的补料分批、半连续或连续模式中更多的第一酶或第一酶组合物。
在液化步骤中加入的第一酶或第一酶组合物与糖化步骤中使用的第二酶组合物不同。
第一酶或第一酶组合物包含内切葡聚糖酶。
第一酶或第一酶组合物包含多于第二酶组合物的内切葡聚糖酶(以蛋白质重量%表示)。
在本发明的一方面,液化步骤在50℃或更高、55℃或更高、60℃或更高、65℃或更高、或者70℃或更高的温度下进行;优选地,液化步骤在65℃-110℃之间、更优选地在65℃-90℃之间、仍然更优选地在65℃-80℃之间且最优选地在70℃-80℃之间的温度下进行。液化期间的高温具有许多优势,包括:在酶组合物的最适温度下进行、降低(细菌)污染的风险、酶活性较高、液化步骤后粘度较低、液化步骤期间粘度下降较多、需要较少量冷却水、使用较高温度的冷却水、酶的再使用较容易和更多优势(所有优势相对于在液化步骤中采用较低温度的情况)。
在本发明的另一方面,加入的第一酶或第一酶组合物的量(在本文中也称为酶剂量或酶载量)低。在一种实施方式中,在液化步骤中加入的酶的量为6mg蛋白质/g干物质重量或更低、5mg蛋白质/g干物质或更低、4mg蛋白质/g干物质或更低、3mg蛋白质/g干物质或更低、2mg蛋白质/g干物质或更低或1mg蛋白质/g干物质或更低(表示为mg蛋白质/g干物质形式的蛋白)。在一种实施方式中,酶量为0.5mg酶/g干物质重量或更低、0.4mg酶组合物/g干物质重量或更低、0.3mg酶/g干物质重量或更低、0.25mg酶/g干物质重量或更低、0.20mg酶/g干物质重量或更低、0.18mg酶/g干物质重量或更低、0.15mg酶/g干物质重量或更低或0.10mg酶/g干物质重量或更低(表示为mg酶/g干物质形式的总纤维素酶)。
在本发明的另一方面,液化时间为10小时或更短、5小时或更短、3小时或更短、或2小时或更短。在另一方面,液化时间为10小时至1分钟、5小时至3分钟或3小时至5分钟。由于酶或酶组合物的稳定性,酶或酶组合物将在接下来的(糖化)步骤中保持活性。
液化期间的ph可由技术人员选择。在本发明的另一个方面中,液化期间的ph可以是3.0-6.4。本发明的稳定酶可被选择为具有高达2个ph单位、高达3个ph单位、高达5个ph单位的宽ph范围。最适ph可位于ph2.0-8.0、3.0-8.0、3.5-7.0、3.5-6.0、3.5-5.0、3.5-4.5、4.0-4.5的界限内或为约4.2。
显著地,本发明的方法可在液化步骤中使用高水平的(木质纤维素材料的)干物质进行。因此,本发明可利用5重量%或更高、8重量%或更高、10重量%或更高、11重量%或更高、12重量%或更高、13重量%或更高、14重量%或更高、15重量%或更高、20重量%或更高、25重量%或更高、30重量%或更高、35重量%或更高、或40重量%或更高且优选地低于42重量%的干物质含量进行。在另一种实施方式中,液化步骤中的干物质含量是14重量%、15重量%、16重量%、17重量%、18重量%、19重量%、20重量%、21重量%、22重量%、23重量%、24重量%、25重量%、26重量%、27重量%、28重量%、29重量%、30重量%、31重量%、32重量%、33重量%或更多或14-33重量%。
优选地,液化反应器的体积为1m3或更大、优选地大于10m3且最优选地50m3或更大。通常,液化反应器将小于3000m3或5000m3。
糖化
根据本发明的方法包括酶促糖化步骤。酶促水解包括但不限于为了水解为了从液化的原料释放糖的水解。在该步骤中,维持任选地预处理的和任选地清洗的木质纤维素材料在液化后与第二酶组合物接触。
根据木质纤维素材料、预处理和液化步骤,技术人员可调节不同的反应条件例如温度、存在或任选地定量加入的酶、水解反应时间和干物质浓度,以实现木质纤维素向糖的期望转化。一些指标在下文给出。
在糖化步骤中,加入第二酶组合物以形成低聚糖和/或单体糖;且第二酶组合物包含纤维素酶。第二酶组合物优选地包含至少两种不同的纤维二糖水解酶和任选地β-葡糖苷酶和/或gh61。
在本发明的一方面,糖化在50℃或更高、55℃或更高、60℃或更高、65℃或更高、或者70℃或更高的温度下进行。水解期间的高温具有许多优势,包括:在酶组合物的最适温度下进行、降低(细菌)污染的风险、需要较少量冷却水、使用较高温度的冷却水、酶的再使用和更多优势。
在本发明的另一方面,任选加入的第二酶组合物的量(在本文中也称为酶剂量或酶载量)低。在一种实施方式中,在糖化步骤中加入的酶的量为6mg蛋白质/g干物质重量或更低、5mg蛋白质/g干物质或更低、4mg蛋白质/g干物质或更低、3mg蛋白质/g干物质或更低、2mg蛋白质/g干物质或更低、或1mg蛋白质/g干物质或更低(表示为mg蛋白质/g干物质形式的蛋白)。在一种实施方式中,酶量为0.5mg酶/g干物质重量或更低、0.4mg酶组合物/g干物质重量或更低、0.3mg酶/g干物质重量或更低、0.25mg酶/g干物质重量或更低、0.20mg酶/g干物质重量或更低、0.18mg酶/g干物质重量或更低、0.15mg酶/g干物质重量或更低、或0.10mg酶/g干物质重量或更低(表示为mg酶/g干物质形式的总纤维素酶)。低酶剂量是可行的,因为由于酶的活性和稳定性,可以增加糖化反应时间。
在本发明的另一个方面中,糖化步骤中的糖化反应时间为40小时或更长、50小时或更长、60小时或更长、70小时或更长、80小时或更长、90小时或更长、100小时或更长、120小时或更长、130小时或更长。在另一方面中,水解反应时间为40-130小时、50-120小时、60-120小时、60-110小时、60-100小时、70-100小时、70-90小时或70-80小时。由于酶组合物的稳定性,更长水解反应时间是可以的,这对应更高的糖产率。
在糖化步骤中,水解期间的ph可由技术人员选择。在本发明的另一个方面中,水解期间的ph可以是3.0-6.4。本发明的稳定酶可具有高达2个ph单位、高达3个ph单位、高达5个ph单位的宽ph范围。最适ph可位于ph2.0-8.0、3.0-8.0、3.5-7.0、3.5-6.0、3.5-5.0、3.5-4.5、4.0-4.5的界限内或为约4.2。
在本发明的另一个方面中,进行糖化步骤直到木质纤维素材料中的70%或更多、80%或更多、85%或更多、90%或更多、92%或更多、95%或更多的可利用糖被释放。
显著地,本发明的方法可在糖化步骤中使用高水平的(木质纤维素材料的)干物质进行。因此,本发明可利用5重量%或更高、8重量%或更高、10重量%或更高、11重量%或更高、12重量%或更高、13重量%或更高、14重量%或更高、15重量%或更高、20重量%或更高、25重量%或更高、30重量%或更高、35重量%或更高、或40重量%或更高且优选地低于42重量%的干物质含量进行。在另一种实施方式中,糖化步骤中的干物质含量是14重量%、15重量%、16重量%、17重量%、18重量%、19重量%、20重量%、21重量%、22重量%、23重量%、24重量%、25重量%、26重量%、27重量%、28重量%、29重量%、30重量%、31重量%、32重量%、33重量%或更多或14-33重量%。
优选地,糖化反应器的体积为1m3或更大、优选地大于10m3且最优选地50m3或更大。通常,糖化反应器小于3000m3或5000m3。
在最佳温度条件下使用热稳定酶
在一种实施方式中,本发明涉及在分离的液化和糖化(sls)工艺中使用热稳定酶(例如talaromyces的纤维素分解酶),用于在(但不限于)乙醇生产中从预处理的木质纤维素原料生产还原糖。应用于预处理的木质纤维素原料的talaromyces的纤维素分解酶显示出在50-70℃范围内的温度下的最大转化速率。酶在这些环境下保持活性达14天及更久,而没有完全停止活性。
通过使用最佳温度条件,最大量的还原糖能在尽可能短的水解时间内从原料释放(完全水解)。以这种方式,在利用0.175ml(6mg蛋白质)/g原料干物质的酶剂量的sls工艺中,在不到5天实现了葡萄糖形式的纤维素的100%转化。在ssf条件下在33℃下,木质纤维素原料中的纤维素的总转化将持续约168小时并且这些嗜温条件决定从原料的最大乙醇生产所需要的工艺时间。
在热稳定纤维素分解酶(例如来自talaromyces)被用于利用嗜热的生产乙醇的微生物的ssf工艺的情况下,发酵时间会更短,因为talaromyces的纤维素分解酶在更高的温度下比在嗜温温度下更快地释放还原糖。
在ssf操作中,产物浓度(g/l)取决于产生的葡萄糖量,但因为在ssf中糖被转化成产物,所以这是不可见的,并且产物浓度可以通过与理论最大产率相乘而与基础的葡萄糖浓度相关。
rasamsonia是新属,其包含耐热性和嗜热性talaromyces和geosmithia种(j.houbraken等人,如上所述)。基于表型、生理和分子数据,houbraken等人建议将t.emersonii、t.byssochlamydoides、t.eburneus、g.argillacea和g.cylindrospora种转移至rasamsonia新属。talaromycesemersonii、penicilliumgeosmithiaemersonii和rasamsoniaemersonii在本文中可交换使用。
在本发明的一方面,第二酶组合物包含纤维素酶、优选地至少2种纤维素酶、更优选地两种不同的纤维二糖水解酶和任选地gh61。优选地,至少3种不同酶中的至少一种、更优选地至少2种、甚至更优选地至少3种是热稳定的。
“热稳定”酶表示:酶的最适温度为60℃或更高,例如70℃或更高,例如75℃或更高,例如80℃或更高,例如85℃或更高。技术人员可利用一般知识选择合适的多核苷酸。例如,它们可分离自嗜热微生物,或者可由本领域技术人员设计和人工合成。在一种实施方式中,多核苷酸可分离自嗜热或耐热丝状真菌或者分离自非嗜热或非耐热但被发现为热稳定的真菌。
在本文中,纤维素酶是能够降解或改性纤维素的任何多肽。能够降解纤维素的多肽是能够催化下述过程的多肽:将纤维素降解成更小的单元,例如部分地降解成纤维素糊精,或者完全降解成葡萄糖单体。与纤维素酶接触时,根据本发明的纤维素酶可得到纤维素糊精与葡萄糖单体的混合类群。此类降解将典型地通过水解反应而发生。
根据最新文献,gh61(糖苷水解酶家族61或有时被称为egiv)蛋白是氧依赖性多糖单加氧酶(pmo’s)。文献中通常提及这些蛋白增强纤维素酶对木质纤维素底物的作用。基于一个家族成员中极低的内切-1,4-β-d-葡聚糖酶活性测量,gh61最初被归类为内切葡聚糖酶。本文所使用的术语“gh61”将被理解为这样的酶家族,其共有将被归类到得到确认的cazygh分类系统(http://www.cazy.org/gh61.html)的家族61中的共有保守序列部分和折叠。糖苷水解酶家族61是糖苷水解酶ec3.2.1家族的成员。gh61在本文中被用作纤维素酶的一部分。
本文中,半纤维素是能够降解或改性半纤维素的任何多肽。也就是说,半纤维素酶可以能够降解或改性木聚糖、葡糖醛酸木聚糖、阿拉伯木聚糖、葡甘露聚糖和木葡聚糖之一种或多种。能够降解半纤维素的多肽是能够催化下述过程的多肽:将半纤维素降解成更小的多糖,例如部分地降解成寡糖,或者完全降解成糖单体,例如己糖或戊糖单体。与半纤维素酶接触时,根据本发明的半纤维素酶可得到寡糖与糖单体的混合类群。此类降解将典型地通过水解反应而发生。
本文中,果胶酶是能够降解或改性果胶的任何多肽。能够降解果胶的多肽是能够催化下述过程的多肽:将果胶降解成更小的单元,例如部分地降解成寡糖,或者完全降解成糖单体。与果胶酶接触时,根据本发明的果胶酶可得到寡糖与糖单体的混合类群。此类降解将典型地通过水解反应而发生。
本文中,纤维二糖水解酶(ec3.2.1.91)是能够催化纤维素或纤维四糖中1,4-β-d-葡糖苷键水解、从链末端释放纤维二糖的任何多肽。这种酶也可以被称作纤维素酶1,4-β-纤维二糖苷酶(1,4-β-cellobiosidase),1,4-β-纤维二糖水解酶,1,4-β-d-葡聚糖纤维二糖水解酶,微晶纤维素酶(avicelase),外切-1,4-β-d-葡聚糖酶,外切纤维二糖水解酶或外切葡聚糖酶。
本文中,内切-β-1,4-葡聚糖酶(ec3.2.1.4)是能够催化纤维素、地衣淀粉或谷类β-d-葡聚糖中1,4-β-d-葡糖苷键内切水解的任何多肽。这种多肽也可以能够水解也含有1,3-键的β-d-葡聚糖中的1,4-键。这种酶也可以被称作纤维素酶、微晶纤维素酶、β-1,4-内切葡聚糖水解酶、β-1,4-葡聚糖酶、羧甲基纤维素酶、纤维糊精酶、内切-1,4-β-d-葡聚糖酶、内切-1,4-β-d-葡聚糖水解酶、内切-1,4-β-葡聚糖酶或内切葡聚糖酶。
本文中,β-葡糖苷酶(ec3.2.1.21)是能够催化末端、非还原性β-d-葡萄糖残基水解并释放β-d-葡萄糖的任何多肽。这种多肽可具有针对β-d-葡糖苷的广泛特异性,并且也可以水解以下一种或多种:β-d-半乳糖苷、α-l-阿拉伯糖苷、β-d-木糖苷或β-d-岩藻糖苷。这种酶也可以被称作苦杏仁苷酶、β-d-葡糖苷葡糖水解酶、纤维二糖酶或龙胆二糖酶。
本文中,β-(1,3)(1,4)-葡聚糖酶(ec3.2.1.73)是能够催化含有1,3-和1,4-键的β-d-葡聚糖中1,4-β-d-葡糖苷键水解的任何多肽。此类多肽可作用于地衣淀粉和谷类β-d-葡聚糖,但不作用于仅含1,3-或1,4-键的β-d-葡聚糖。所述酶也可以被称作地衣淀粉酶(licheninase),1,3-1,4-β-d-葡聚糖4-葡聚糖水解酶,β-葡聚糖酶,内切-β-1,3-1,4葡聚糖酶,地衣多糖酶(lichenase)或混合键β-葡聚糖酶。这类酶的替代方案是被描述为内切-1,3(4)-β-葡聚糖酶的ec3.2.1.6。当下述葡萄糖残基在c-3处被自身取代时,这类酶水解β-d-葡聚糖酶中的1,3-键或1,4-键,所述葡萄糖残基的还原基团涉及要水解的键。替代性的名称包括内切-1,3-β-葡聚糖酶,昆布多糖酶,1,3-(1,3;1,4)-β-d-葡聚糖3(4)葡聚糖水解酶,底物包括昆布多糖,地衣淀粉和谷类β-d-葡聚糖。
本发明的方法中可使用半纤维素酶,例如内切木聚糖酶、β-木糖苷酶、α-l-阿拉伯呋喃糖苷酶、α-d-葡糖醛酸糖苷酶、乙酰木聚糖酯酶、阿魏酸酯酶、香豆酸酯酶、α-半乳糖苷酶、β-半乳糖苷酶、β-甘露聚糖酶或β-甘露糖苷酶。
本文中,内切木聚糖酶(ec3.2.1.8)是能够催化木聚糖中1,4-β-d-木糖苷键内切水解的任何多肽。所述酶也可以被称作内切-1,4-β-木聚糖酶或1,4-β-d-木聚糖木聚糖水解酶。一种替代是ec3.2.1.136,葡糖醛酸阿拉伯木聚糖内切木聚糖酶,一种能够水解葡糖醛酸阿拉伯木聚糖中1,4木糖苷键的酶。
本文中,β-木糖苷酶(ec3.2.1.37)是能够催化1,4-β-d-木聚糖的水解、从非还原性末端去除相继的d-木糖残基的任何多肽。这类酶也可以水解木二糖。所述酶也可以被称作木聚糖1,4-β-木糖苷酶、1,4-β-d-木聚糖木糖水解酶、外切-1,4-β-木糖苷酶或木二糖酶。
本文中,α-l-阿拉伯呋喃糖苷酶(ec3.2.1.55)是能够作用于α-l-阿拉伯呋喃糖苷、含(1,2)和/或(1,3)-和/或(1,5)-键的α-l-阿拉伯聚糖、阿拉伯木聚糖和阿拉伯半乳聚糖的任何多肽。所述酶也可以被称作α-n-阿拉伯呋喃糖苷酶、阿拉伯呋喃糖苷酶或阿拉伯糖苷酶。
本文中,α-d-葡糖醛酸糖苷酶(ec3.2.1.139)是能够催化以下形式反应的任何多肽:α-d-葡糖醛酸苷+h2o=醇+d-葡糖醛酸酯。所述酶也被称作α-葡糖醛酸糖苷酶或α-葡糖苷酸酶。这些酶也可水解可作为木聚糖中取代基存在的4-o-甲基化的葡糖醛酸。替代方式是ec3.2.1.131:木聚糖α-1,2-葡糖醛酸糖苷酶,其催化α-1,2-(4-o-甲基)葡糖醛酰基连接的水解。
本文中,乙酰基木聚糖酯酶(ec3.1.1.72)是能够催化木聚糖和木寡糖脱乙酰化的任何多肽。这种多肽可催化来自多聚木聚糖、乙酰化木糖、乙酰化葡萄糖、α-萘基乙酸酯或对硝基苯基乙酸酯的乙酰基水解,但是一般不催化来自于三乙酰基丙三醇的乙酰基水解。这种多肽一般不作用于乙酰化的甘露聚糖或果胶。
本文中,阿魏酸酯酶(ec3.1.1.73)是能够催化以下形式反应的任何多肽:阿魏酸基-糖+h2o=阿魏酸酯+糖。糖可以是例如寡糖或多糖。其典型地可以催化来自酯化的糖的4-羟基-3-甲氧基肉桂酰(阿魏酰)基的水解,所述糖通常是“天然”底物中的阿拉伯糖,对硝基苯酚乙酸酯和阿魏酸甲基酯是典型地更弱的底物。所述酶也可以被称作肉桂酰基酯水解酶,阿魏酸酯酶或羟基肉桂酰基酯酶。也可以被称作半纤维素附属酶,因为其可帮助木聚糖酶和果胶酶分解植物细胞壁半纤维素和果胶。
本文中,香豆酰基酯酶(ec3.1.1.73)是能够催化以下形式反应的任何多肽:香豆酰基-糖+h2o=香豆酸酯+糖。糖可以是例如寡糖或多糖。所述酶也可以被称作反式-4-香豆酰基酯酶、反式-对香豆酰基酯酶、对香豆酰基酯酶或对香豆酸酯酶。所述酶也落入ec3.1.1.73中,从而也可以被称作阿魏酸酯酶。
本文中,α-半乳糖苷酶(ec3.2.1.22)是能够催化α-d-半乳糖苷(包括半乳糖寡糖、半乳甘露聚糖、半乳聚糖和阿拉伯半乳聚糖)中末端、非还原性α-d-半乳糖残基水解的任何多肽。此类多肽也可以能够水解α-d-岩藻糖苷。所述酶也可以被称作蜜二糖酶。
本文中,β-半乳糖苷酶(ec3.2.1.23)是能够催化β-d-半乳糖苷中末端非还原性β-d-半乳糖残基水解的任何多肽。这样的多肽也可以能够水解α-l-阿拉伯糖苷。所述酶也可以被称作外切-(1->4)-β-d-半乳聚糖酶或乳糖酶。
本文中,β-甘露聚糖酶(ec3.2.1.78)是能够催化甘露聚糖、半乳甘露聚糖和葡甘露聚糖中1,4-β-d-甘露糖苷键随机水解的任何多肽。所述酶也可以被称作甘露聚糖内切-1,4-β-甘露糖苷酶或内切-1,4-甘露聚糖酶。
本文中,β-甘露糖苷酶(ec3.2.1.25)是能够催化β-d-甘露糖苷中末端非还原性β-d-甘露糖残基水解的任何多肽。所述酶也可以被称作甘露聚糖酶或甘露糖酶。
酶组合物可包含任何果胶酶,例如内切多聚半乳糖醛酸酶,果胶甲基酯酶,内切-半乳聚糖酶,β-半乳糖苷酶,果胶乙酰基酯酶,内切-果胶裂合酶,果胶酸裂合酶,α-鼠李糖苷酶,外切-半乳糖醛酸酶,外切多聚半乳糖醛酸酯裂合酶,鼠李半乳糖醛酸聚糖水解酶,鼠李半乳糖醛酸聚糖裂合酶,鼠李半乳糖醛酸聚糖乙酰基酯酶,鼠李半乳糖醛酸聚糖半乳糖醛酸水解酶,木半乳糖醛酸酶。
本文中,内切-多聚半乳糖醛酸酶(ec3.2.1.15)是能够催化果胶酸酯和其他半乳糖醛酸聚糖中1,4-α-d-半乳糖醛酸键的随机水解的任何多肽。所述酶也可以被称作多聚半乳糖醛酸酶果胶解聚酶,果胶酶,内切多聚半乳糖醛酸酶,果胶酶(pectolase),果胶水解酶,果胶多聚半乳糖醛酸酶,多聚-α-1,4-半乳糖醛酸苷聚糖水解酶,内切半乳糖醛酸酶;内切-d-半乳糖醛酸酶或多聚(1,4-α-d-半乳糖醛酸苷)聚糖水解酶。
在本文中,果胶甲基酯酶(ec3.1.1.11)是能够催化下述反应的任何酶:果胶+nh2o=n甲醇+果胶酸酯。所述酶也已知为果胶酯酶(pectinesterase),果胶脱甲氧基酶,果胶甲氧基酶,果胶甲基酯酶,果胶酶,果胶酯酶(pectinoesterase)或果胶果酰基水解酶(pectinpectylhydrolase)。
在本文中,内切-半乳聚糖酶(ec3.2.1.89)是能够催化阿拉伯半乳聚糖中1,4-β-d-半乳糖苷键的内切水解的任何酶。所述酶也已知为阿拉伯半乳聚糖内切-1,4-β-半乳糖苷键,内切-1,4-β-半乳聚糖酶,半乳聚糖酶,阿拉伯半乳聚糖酶或阿拉伯半乳聚糖4-β-d-半乳聚糖水解酶。
本文中,果胶乙酰基酯酶在本文中被定义为下述任何酶,所述酶具有催化果胶gaiua残基羟基处乙酰基的脱乙酰基作用的乙酰基酯酶活性。
本文中,内切-果胶裂合酶(ec4.2.2.10)是能够催化(1→4)-α-d-半乳糖醛酸聚糖甲基酯的清除性切割,得到在其非还原末端具有4-脱氧-6-o-甲基-α-d-半乳-4-糖醛酰基的寡糖。所述酶也可已知为果胶裂合酶,果胶反式消除酶(trans-eliminase),内切果胶裂合酶,多聚甲基半乳糖醛酸反式消除酶,果胶甲基反式消除酶,果胶酶(pectolyase),pl,pnl或pmgl或(1→4)-6-o-甲基-α-d-半乳糖醛酸聚糖裂合酶。
本文中,果胶酸裂合酶(ec4.2.2.2)是能够催化(1→4)-α-d-半乳糖醛酸聚糖的消除性切割,得到在其非还原性末端具有4-脱氧-α-d-半乳-4-糖醛酰基的任何酶。该酶也可以已知为多聚半乳糖醛酸反式消除酶,果胶酸反式消除酶,多聚半乳糖醛酸酯裂合酶,内切果胶甲基反式消除酶,果胶酸反式消除酶,内切半乳糖醛酸酯反式消除酶,果胶酸裂合酶,果胶裂合酶,α-1,4-d-内切多聚半乳糖醛酸裂合酶,pga裂合酶,ppase-n,内切-α-1,4-多聚半乳糖醛酸裂合酶,多聚半乳糖醛酸裂合酶,果胶反式消除酶,多聚半乳糖醛酸反式消除酶或(1→4)-α-d-半乳糖醛酸聚糖裂合酶。
本文中,α-鼠李糖苷酶(ec3.2.1.40)是能够催化α-l-鼠李糖苷或鼠李半乳糖醛酸聚糖中末端非还原性α-l-鼠李糖残基水解的任何多肽。所述酶也可以已知为α-l-鼠李糖苷酶t,α-l-鼠李糖苷酶n或α-l-鼠李糖苷鼠李糖水解酶。
本文中,外切-半乳糖醛酸酶(ec3.2.1.82)是能够从非还原性末端水解果胶酸、释放二半乳糖醛酸的任何多肽。酶也可以已知为外切-多聚-α-半乳糖醛酸苷酶(exo-poly-α-galacturonosidase)、外切多聚半乳糖醛酸苷酶(exopolygalacturonosidase)或外切多聚聚半乳糖醛酸苷酶(exopolygalacturanosidase)。
本文中,外切-半乳糖醛酸酶(ec3.2.1.67)是能够催化以下的任何多肽:(1,4-α-d-半乳糖醛酸苷)n+h2o=(1,4-α-d-半乳糖醛酸苷)n-1+d-半乳糖醛酸酯。所述酶也可以已知为半乳糖醛1,4-α-半乳糖醛酸苷酶(galacturan1,4-α-galacturonidase),外切多聚半乳糖醛酸酶,多聚(半乳糖醛酸酯)水解酶,外切-d-半乳糖醛酸酶,外切-d-半乳糖醛酸聚糖酶,外切多聚-d-半乳糖醛酸酶或多聚(1,4-α-d-半乳糖醛酸苷)半乳糖醛酸水解酶。
本文中,外切多聚半乳糖醛酸酯裂合酶(ec4.2.2.9)是能够催化从果胶酸(即脱脂化的果胶)的还原末端消除性切割4-(4-脱氧-α-d-半乳-4-糖醛酰基)-d-半乳糖醛酸酯的任何多肽。所述酶可已知为果胶酸二糖裂合酶,果胶酸外切裂合酶,外切果胶酸反式消除酶,外切果胶酸裂合酶,外切多聚半乳糖醛酸-反式-消除酶,pate,外切-pate,外切-pgl或(1→4)-α-d-半乳糖醛酸聚糖还原末端二糖裂合酶。
本文中,鼠李半乳糖醛酸聚糖水解酶是能够在严格交替出现的鼠李半乳糖醛酸聚糖结构中以内切方式水解半乳基糖醛酸酸和吡喃鼠李糖基之间键的任何多肽,所述鼠李半乳糖醛酸聚糖结构由二糖[(1,2-α-l-鼠李糖基-(1,4)-α-半乳糖醛酸]组成。
本文中,鼠李半乳糖醛酸聚糖裂合酶是能够以内切方式在鼠李半乳糖醛酸聚糖中通过β-消除切割α-l-rhap-(1→4)-α-d-galpa键的任何多肽。
本文中,鼠李半乳糖醛酸聚糖乙酰基酯酶是能够催化鼠李半乳糖醛酸聚糖中交替出现的鼠李糖和半乳糖醛酸残基主链的脱乙酰化的任何多肽。
本文中,鼠李半乳糖醛酸聚糖半乳糖醛酸水解酶是能够以外切方式、从严格交替出现的鼠李半乳糖醛酸聚糖结构的非还原性末端水解半乳糖醛酸的任何多肽。
本文中,木半乳糖醛酸酶是通过以内切方式切割β-木糖取代的半乳糖醛酸主链而作用于木半乳糖醛酸聚糖的任何多肽。所述酶也可以已知为木半乳糖醛酸聚糖水解酶。
本文中,α-l-阿拉伯糖呋喃糖苷酶(ec3.2.1.55)是能够作用于α-l-阿拉伯呋喃糖苷、含有(1,2)和/或(1,3)-和/或(1,5)-键的α-l-阿拉伯聚糖、阿拉伯木聚糖和阿拉伯半乳聚糖的任何多肽。所述酶也可以被称作α-n-阿拉伯糖呋喃糖苷酶,阿拉伯糖呋喃糖苷酶或阿拉伯糖苷酶。
本文中,内切阿拉伯聚糖酶(ec3.2.1.99)是能够催化1,5-阿拉伯聚糖中1,5-α-阿拉伯呋喃糖苷键内切水解的任何多肽。所述酶也已知为内切阿拉伯糖酶,阿拉伯聚糖内切-1,5-α-l-阿拉伯糖苷酶,内切-1,5-α-l-阿拉伯聚糖酶,内切-α-1,5-阿拉伯聚糖酶;内切-阿拉伯聚糖酶或1,5-α-l-阿拉伯聚糖1,5-α-l-阿拉伯聚糖水解酶。
一种酶组合物可包含至少一种纤维素酶和任选地至少一种半纤维素酶和任选地至少一种果胶酶(其中之一是根据本发明的多肽)。第二酶组合物可包含gh61,纤维二糖水解酶,内切葡聚糖酶和/或β-葡糖苷酶。这种组合物也可以包含一种或多种半纤维素酶和/或一种或多种果胶酶。
另外,本发明的方法中可以使用淀粉酶、蛋白酶、脂肪酶、木质酶、己糖基转移酶、葡糖醛酸糖苷酶或扩展蛋白(expansin)或纤维素诱导蛋白或纤维素整合蛋白或类似蛋白质中的一种或多种(例如两种、三种、四种或所有)(这些被称作上文的辅助活性)。
“蛋白酶”包括水解肽键的酶(肽酶),以及水解肽和其它部分如糖之间键的酶(糖肽酶)。许多肽酶根据ec3.4表征,适合在本发明中使用并且通过引用并入本文。一些特定类型的蛋白酶包括半胱氨酸蛋白酶(包括胃蛋白酶,木瓜蛋白酶)和丝氨酸蛋白酶(包括糜蛋白酶,羧肽酶和金属内切蛋白酶)。
“脂肪酶”包括水解脂质、脂肪酸和酰基甘油酯(包括磷酸甘油酯)、脂蛋白、二酰基甘油等等的酶。在植物中,脂质被用作结构组分,来限制水损失和病原体感染。这些脂质包括来自脂肪酸的蜡质,以及角质和木栓素(suberin)。
“木质酶”包括能够水解或分解木质素聚合物结构的酶。能够分解木质素的酶包括木质素过氧化物酶、锰过氧化物酶、漆酶和阿魏酸酯酶,和在本领域中已知解聚或以其他方式分解木质素聚合物的描述的其他酶。还包括在内的是能够水解在半纤维素糖(主要是阿拉伯糖)和木质素之间形成的键的酶。木质酶包括但不限于以下组的酶:木质素过氧化物酶(ec1.11.1.14)、锰过氧化物酶(ec1.11.1.13)、漆酶(ec1.10.3.2)和阿魏酸酯酶(ec3.1.1.73)。
“己糖基转移酶”(2.4.1-)包括能够催化转移酶反应但也能够催化例如纤维素和/或纤维素降解产物的水解反应的酶。可以在本发明中使用的己糖基转移酶的例子是β-葡聚糖基转移酶。这种酶可以能够催化(1,3)(1,4)葡聚糖和/或纤维素和/或纤维素降解产物的降解。
“葡糖醛酸糖苷酶”包括催化葡糖醛酸苷(例如β-葡糖醛酸苷)水解得到醇的酶。许多葡糖醛酸糖苷酶已被表征,并可适合在本发明中使用,例如β-葡糖醛酸糖苷酶(ec3.2.1.31),透明质酸酶葡糖醛酸糖苷酶(ec3.2.1.36),葡糖醛酰基-二硫葡糖胺葡糖醛酸糖苷酶(3.2.1.56),甘草酸β-葡糖醛酸糖苷酶(3.2.1.128)或α-d-葡糖醛酸糖苷酶(ec3.2.1.139)。
用于本发明的组合物可包含扩展蛋白多肽或扩展蛋白样多肽,如膨胀因子(swollenin)(见salheimoetal.,eur.j.biohem.269,4202-4211,2002)或膨胀因子样多肽。
扩展蛋白涉及植物细胞生长期间细胞壁结构的松弛。已经提出扩展蛋白破坏纤维素和其他细胞壁多糖之间的氢键,但不具有水解活性。认为它们通过这种方式允许纤维素纤维的滑动和细胞壁的扩大。一种扩展蛋白样蛋白——膨胀因子,含有n端碳水化合物结合模块家族1结构域(cbd)和c端扩展蛋白样结构域。就本发明的目的而言,扩展蛋白样蛋白或膨胀因子样蛋白可包含此类结构域中的一种或两种和/或可破坏细胞壁的结构(如破坏纤维素结构),任选地不生产可检测量的还原糖。
在本发明的方法中,可使用上文提到的每种酶种类的成员、一个酶种类的若干成员、或这些酶种类或辅助蛋白(即,本文提到的本身不具有酶活性,但是帮助木质纤维素降解的那些蛋白质)的任何组合。
在本发明的方法中,可使用来自以下的酶:(1)供应商;(2)经克隆的表达酶的基因;(3)复合培养液(例如由培养基中微生物菌株的生长得到的,其中所述菌株向培养基中分泌蛋白质和酶);(4)如(3)中培养的菌株的细胞裂解物;和/或(5)表达酶的植物材料。本发明组合物中不同的酶可获自不同的来源。
酶可以在微生物、酵母、真菌、细菌或植物中外源产生,然后分离并加入例如木质纤维素原料中。或者,酶可以被生产但不分离,并可将粗制细胞群发酵液或植物材料(如玉米秆或麦秸)等等加入例如原料中。或者,可以处理粗制细胞群或酶生产培养基或植物材料,以防止进一步的微生物生长(例如通过加热或添加抗微生物剂),然后添加至例如原料。这些粗制酶混合物可包含生产酶的生物体。或者,酶可以在下述发酵中生产,所述发酵使用(预处理的)原料(例如玉米秆或麦秸)对生产酶的生物体提供营养。通过这种方式,生产酶的植物自身可以作为木质纤维素原料,并且被添加进木质纤维素原料中。
发酵
根据本发明的方法还可包括发酵步骤。在另一个方面中,本发明任选地包括发酵方法,其中微生物被用于发酵包含糖(例如葡萄糖、l-阿拉伯糖和/或木糖)的碳源。碳源可包括包含l-阿拉伯糖、木糖或葡萄糖单元的任何碳水化合物寡聚体或多聚体,例如木质纤维素、木聚糖、纤维素、淀粉、阿拉伯聚糖等等。为了从这种碳水化合物释放木糖或葡萄糖单元,可将适宜的碳水化合物酶(例如木聚糖酶、葡聚糖酶、淀粉酶等等)添加至发酵培养基或其可通过经修饰的宿主细胞对其进行生产。在后者的情况下,经修饰宿主细胞可被遗传工程改造,以生产并分泌这种碳水化合物酶。使用葡萄糖的寡聚体或多聚体来源的另外优势是,其能在发酵期间保持低的(较低的)游离葡萄糖浓度,例如通过使用限制速率的碳水化合物酶的量。这继而会防止对非葡萄糖的糖(例如木糖)代谢和运送所需体系的抑制。在一个优选的方法中,经修饰宿主细胞发酵l-阿拉伯糖(任选地木糖)和葡萄糖二者,优选地同时发酵,这种情况下优选地使用经修饰的宿主细胞,所述宿主细胞对葡萄糖抑制不敏感,以防止二次生长(diauxicgrowth)。除了l-阿拉伯糖来源,任选地木糖(和葡萄糖)作为碳源之外,发酵培养基将进一步包含经修饰宿主细胞生长所需的适宜成分。用于微生物(例如酵母或丝状真菌)生长的发酵培养基的组成在本领域众所周知。
在相同条件下的发酵时间可比在常规发酵中更短,其中部分酶促水解在发酵期间仍必须进行。在一种实施方式中,就50g/l葡萄糖和来自木质纤维素原料的相应其它糖(例如50g/l木糖、35g/l的l-阿拉伯糖和10g/l的半乳糖)的糖组合物而言,发酵时间是100小时或更短、90小时或更短、80小时或更短、70小时或更短、或60小时或更短。对于更稀的糖组合物,可相应减少发酵时间。
发酵方法可以是需氧或厌氧发酵方法。厌氧发酵方法在本文中被定义为下述发酵方法,所述发酵方法在没有氧或基本上没有氧被消耗的情况下进行,优选地少于5、2.5或1mmol/l/h、更优选地0mmol/l/h(即氧消耗未被检测出)的氧被消耗的情况下进行,并且其中有机分子既作为电子供体又作为电子受体。没有氧时,在糖酵解和生物质形成中产生的nadh不可被氧化磷酸化所氧化。为解决该问题,许多微生物使用丙酮酸或其衍生物之一作为电子和氢受体,因此再产生nad+。因而,在一个优选的厌氧发酵方法中,丙酮酸被用作电子(和氢受体)并被还原为发酵产物,例如乙醇、乳酸、3-羟基丙酸、丙烯酸、乙酸、琥珀酸、柠檬酸、苹果酸、延胡索酸、氨基酸、1,3-丙烷-二醇、乙烯、甘油、丁醇、甲烷或生物气、β-内酰胺抗生素和头孢菌素。在一个优选的实施方式中,发酵方法是厌氧的。厌氧方法是有利的,因为其比需氧方法更便宜:需要较少专门的设备。而且,预计厌氧方法给出比需氧方法更高的产品产出。在需氧条件下,通常生物质产率比在厌氧条件下更高。因而,通常在需氧条件下,期望的产物产率比在厌氧条件下更低。
在另一实施方式中,发酵方法在限氧条件下。更优选地,发酵方法是需氧的并在限氧条件下。限氧发酵方法是这样的方法,其中氧消耗被氧从气体至液体的转化所限制。氧限制的程度由进入气流的量和组成以及使用的发酵设备的实际的混合/质量转移特性确定。优选地,在限氧条件下的方法中,氧消耗速率为至少5.5,更优选地至少6和甚至更优选地至少7mmol/l/h。
发酵方法优选地在对经修饰细胞而言最佳的温度下运行。因而,对于大多数酵母或真菌细胞而言,发酵方法在低于42℃,优选地低于38℃下的温度下进行。对于酵母或丝状真菌宿主细胞而言,发酵方法优选地在低于35、33、30或28℃的温度下并在高于20、22或25℃的温度下进行。
在本发明的一种实施方式中,用能够发酵至少一种c5糖的微生物进行发酵。在一种实施方式中,所述方法是用于乙醇生产的方法,其中,所述方法包括步骤d),步骤d)包括用能发酵至少一种c5糖的微生物发酵含糖培养基,其中宿主细胞能将葡萄糖、l-阿拉伯糖和木糖发酵为乙醇。在一种其实施方式中,能发酵至少一种c5糖的微生物是酵母。在一种实施方式中,酵母属于saccharomyces属,优选地是saccharomycescerevisiae种。
在一种实施方式中,用于生产乙醇的发酵方法是厌氧的。厌氧已在本文上文定义过。在另一优选的实施方式中,用于生产乙醇的发酵方法是需氧的。在另一优选的实施方式中,用于生产乙醇的发酵方法在限氧条件下,更优选地需氧并在限氧条件下。限氧条件已在本文上文定义过。
在这种方法中,乙醇体积生产率优选地为至少0.5、1.0、1.5、2.0、2.5、3.0、5.0或10.0g乙醇/升/小时。方法中基于l-阿拉伯糖和任选的木糖和/或葡萄糖的乙醇产率优选地为至少20、25、30、35、40、45、50、60、70、80、90、95或98%。乙醇产率在本文中被定义为理论最大产率的百分比,对于葡萄糖、l-阿拉伯糖和任选的木糖,理论最大产率为0.51g乙醇/g葡萄糖或木糖。
在一个方面中,与已知乙醇发酵方法相比,导致乙醇生产的可选发酵方法具有若干优势:
-厌氧方法是可行的;
-限氧条件也是可行的;
-可获得较高的乙醇产率和乙醇生产速率;
-使用的菌株可以能够使用l-阿拉伯糖和任选地木糖。
替代上述发酵方法,可使用至少两种有区别的细胞,这表示该方法是共发酵方法。如上所述的发酵方法的所有优选实施方式也是该共发酵方法的优选实施方式:发酵产物为何、l-阿拉伯糖来源和木糖来源为何、发酵条件(需氧或厌氧条件、限氧条件、方法进行的温度、乙醇生产力、乙醇产率)。
可进行发酵方法而不对发酵期间ph的调节有任何需要。也就是说,所述方法是不用添加任何酸或碱即可进行的方法。然而,这排除了可添加酸的预处理步骤。关键是本发明的组合物能在低ph下起作用,因而不需要为了糖化可发生而调整酸预处理原料的酸的ph。因此,本发明的方法可以是仅使用有机产物不需要无机化学输入的零废物方法。
总反应时间
根据本发明,可减少总反应时间(即:液化步骤和水解步骤,和任选地发酵步骤合起来的反应时间)。在一种实施方式中,90%葡萄糖产率下的总反应时间为150小时或更少、140小时或更少、130小时或更少、120小时或更少、110小时或更少、100小时或更少、90小时或更少、80小时或更少、75小时或更少、或约72小时。相应地,在较低的葡萄糖产率下可达到较少总时间。这不依赖于slh模式中进行的工艺的模式。
发酵产物
可根据本发明生产的发酵产物包括氨基酸、维生素、药物、动物饲料补充物、特种化学品、化学原料、塑料、溶剂、燃料例如甲烷或生物气和乙醇,或其它有机聚合物、乳酸,包括燃料乙醇(术语“乙醇”被理解为包括乙基醇(ethylalcohol)或乙基醇和水的混合物)。
可通过本发明的方法生产的具体的价值增加产物包括但不限于,生物燃料(包括乙醇和丁醇);乳酸;3-羟基-丙酸;丙烯酸;乙酸;1,3-丙烷-二醇;乙烯;甘油;塑料;特种化学品;有机酸,包括柠檬酸、琥珀酸和马来酸;溶剂;动物饲料补充物;药物例如β-内酰胺抗生素或头孢菌素;维生素;氨基酸,例如赖氨酸、甲硫氨酸、色氨酸、苏氨酸和天冬氨酸;酶例如蛋白酶、纤维素酶、淀粉酶、葡聚糖酶、乳糖酶、脂肪酶、裂解酶、氧化还原酶、转移酶或木聚糖酶;化学原料;或动物饲料补充物。
分离发酵产物
根据本发明的方法任选地包括回收发酵产物。可以以任何已知的方式从发酵液中分离发酵产物。对于每种发酵产物,技术人员能选择合适的分离技术。例如,可以以常规方式通过蒸馏(例如蒸汽蒸馏/真空蒸馏)将乙醇从酵母发酵液中分离出。
以下将更详细地描述本发明的某些实施方式,但绝非限制本发明的范围。
利用稳定酶水解后再循环酶
水解结束时,酶活性表现为低的,因为一旦几乎所有纤维素被转化,几乎没有还原糖被释放出。但是,存在的酶促活性的量仅减少少许,假设这主要是由于酶对底物的吸收。通过在水解后应用固液分离,例如离心、过滤、沉降等等,溶液中的酶活性的60%或更多,例如70%可被回收并被再利用用于在下一水解期间液化或水解新的预处理的木质纤维素原料。
而且,固液分离后,溶液中的酶可从含有还原糖和来自酶促作用的其它水解产物的溶液中分离。可借助或不借助首先将酶吸附到任何类型的载体上,通过但不限于(超和微)过滤、离心、沉淀、沉降进行该分离。
例如,用0.175ml/g原料干物质的酶载量对预处理的原料水解20小时后,还原糖的理论最大量的50%被释出,相同水解72小时后,还原糖的理论最大量的90%被释出。通过离心和超滤,在渗余物中回收60-70%的酶活性,而滤液含有超过80%的释出的还原糖。通过再利用渗余物自身或被进一步纯化和/或浓缩后的渗余物,在下一水解步骤期间的酶剂量可被减少60-70%。以这种方式通过使用稳定纤维素分解酶(例如talaromyces的那些)实现成本降低起因于需要更少的酶剂量。
利用稳定酶液化后再循环酶
液化结束时,可使用类似于如上文所述的关于水解后再循环的方式再循环液化中使用的酶(液化和糖化)。
利用稳定酶的水解后酶再循环与酶生产和酵母细胞再循环的组合
包括如上文所述的水解后再循环酶的方法可与发酵后再循环生产乙醇的微生物相组合,其中在酶生产发酵中使用含还原糖的滤液作为底物(纯化的和/或浓缩的或稀释的)和作为底物用于培养生产乙醇的微生物。
利用稳定酶的真空蒸馏后再循环酶
酶(比如来自talaromyces的那些)的热稳定性导致在糟水(thinstillage)中的水解、发酵和真空蒸馏后剩余的纤维素分解活性。酶的总活性在三个连续的方法步骤期间以10-15个底物单位/g干物质原料降低且不依赖于初始的酶剂量。真空蒸馏后获得的糟水可因而被再利用作为酶来源,用于将预处理麦秸转化为乙醇的新开始的水解-发酵-蒸馏处理循环。糟水可被以浓缩形式或(未)稀释形式和/或被纯化并有或没有额外的酶补充的形式被使用。糟水(任选地纯化的糟水)可被再利用于纤维素材料的液化或水解。
通过下述实施例进一步描述本发明,其不应被解释为限制本发明的范围。
实施例
材料&方法
粘度测定
使用带有塑料桨(paddle)的newportrva-4快速粘度分析仪进行rva(快速粘度分析仪)测量(参见:d.l.goode等人,journaloftheinstituteofbrewing,第111卷,第2期,2005)。
酶
根据wo2011/000949中所述的接种和发酵程序发酵tec-210纤维素酶组合物。
rasamsonia(talaromyces)emersonii菌株于1964年12月保藏在荷兰真菌培养物保藏中心(centraalbureauvoorschimmelcultures)乌普萨兰8,p.o.box85167,nl-3508ad乌特勒支,荷兰,登录号为cbs393.64。
本实施例中可同样使用其它合适菌株以显示本发明的效果和优势。例如,tec-101、tec-147、tec-192、tec-201或tec-210是合适的rasamsonia菌株,它们在wo2011/000949被描述。
通过如下产生内切葡聚糖酶(eg):如wo2011/098577中所述在aspergillusniger中过表达eba8,随后发酵aspergillusniger转化体。eba8是rasamsoniaemersonii(talaromycesemersonii)内切葡聚糖酶,其在wo2011/098577中被鉴定为t.emersoniiβ-葡聚糖酶cea(eg)且在wo2011/098577中由seqidno:3表示。
制备酸预处理的玉米秆底物
如schell,d.j.,appliedbiochemistryandbiotechnology(2003),105-108卷,69-85页中所述获得稀酸预处理的玉米秆(acs)。使用中试规模预处理反应器,并在190℃、1分钟停留时间和液相中1.45%(重量/重量)的有效h2so4酸浓度的稳态条件下操作。
实施例1
木质纤维素原料水解期间内切葡聚糖酶的效果
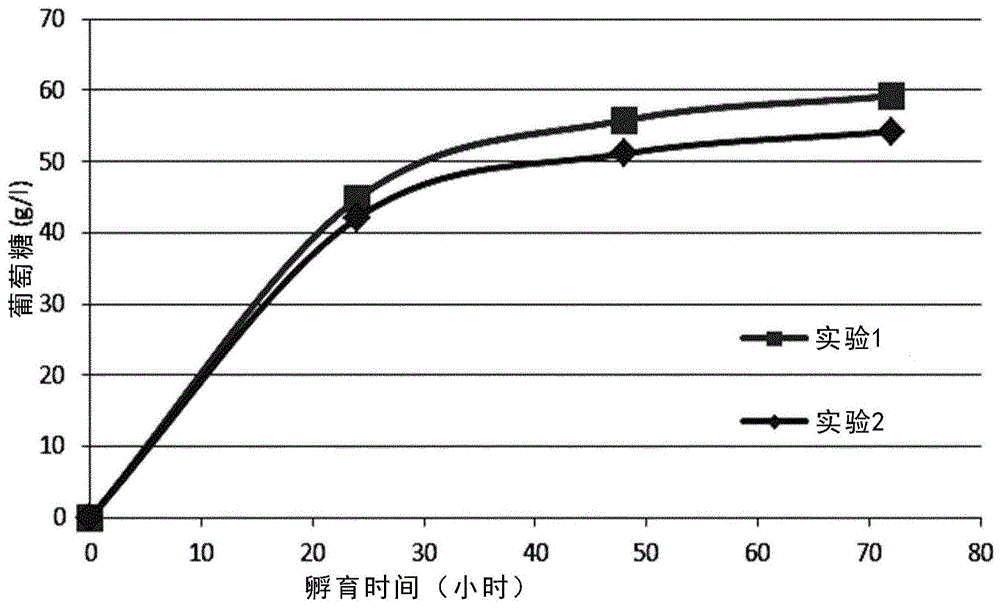
根据下述程序描述木质纤维素原料水解期间内切葡聚糖酶的效果。利用酸预处理的玉米秆(acs)原料进行水解反应。用4mnaoh溶液将原料的ph调节至ph4.5。以2个阶段进行水解反应:
1.以半连续模式操作的液化步骤
2.以分批模式操作的糖化步骤
如下进行液化:用1kg10%(重量/重量)预处理的玉米秆原料填充液化反应器。在恒定搅拌、ph控制(ph4.5,4nnaoh)和62℃下操作反应器。填充后,直接定量加入(参见表1)酶以启动水解反应。接下来,在恒定排出反应器内容物的条件下,每10分钟向液化反应器中加入55g额外量的30%干物质原料以保持反应器填充水平恒定在1升。此外,另外的酶与额外原料一起定量加入以在反应期间维持恒定的酶/底物比。约3小时后,反应器中达到约20%(重量/重量)的干物质水平,且加入的原料干物质降低至20%(重量/重量)以保持反应器中的干物质水平在约20%(重量/重量)。开始液化后6小时,将液化反应器的排出物引入糖化反应器中用于进一步处理。在液化反应器中的停留时间为平均约3小时。
如下进行糖化:用来自液化反应器的排出物填充糖化反应器至总反应体积为约1升。这耗费约3小时。在恒定搅拌、ph控制(ph4.5,4nnaoh)和62℃下操作反应器。在填充期间,如表1中所示,在一个实验中同时加入酶。糖化反应进行约70小时。
表1:酶剂量方案
·纤维素酶混合物:tec-210
·内切葡聚糖酶:eba8
·酶剂量:mgtca蛋白质/g原料干物质
水解之后,在冰上冷却样品并立即在1450μli级水中稀释50μl每种上清液。随后过滤稀释的上清液(0.45μm滤器,pallpn454)并如下所述分析滤液的糖含量。
如下测量稀释样品的糖浓度:使用带有aminexhpx-87p柱(biorad#1250098)的hplc,用85℃水以0.6ml/分钟的流速洗脱,通过整合利用葡萄糖标准溶液校正的来自示差折光检测(r.i.)的葡萄糖信号来定量。
图1中展示的数据显示:与来自同时加入内切葡聚糖酶和tec-210纤维素酶混合物的原料的葡萄糖释放相比,来自用内切葡聚糖酶预处理的原料的葡萄糖释放较快并导致较高水平(例如,72小时之后)。
基于这些结果,结论是:利用含内切葡聚糖酶的酶组合物液化木质纤维素原料改善了纤维素酶混合物的纤维分解性能。
实施例2
液化步骤中内切葡聚糖酶的效果
在newportrva-4中,在62℃下,以低搅拌速率预加热水中的ph为4.5的20%干物质预处理的原料的样品(酸预处理的玉米秆)持续1小时。在测量时间=0时加入酶,在62℃下在随后的2小时期间记录粘度降低并通过连接的电脑登记。
表2中展示的结果显示:eg(eba8)改进了生物质底物的粘度降低,且分批启动程序可被用于启动本发明的方法。
表2
实施例3
温度对木质纤维素原料液化的影响
这个实验证明了温度对通过内切葡聚糖酶的木质纤维素原料液化的影响。使用获自nrel(国家可再生能源实验室)的酸预处理的玉米秆原料(acs)进行液化实验。
在newportrva-4中,以低搅拌速率预热水中的ph为4.5的24%干物质预处理的原料的样品持续1小时。在测量时间=0时加入酶(0.2mgeg[eba8]/g干物质),在随后的60分钟期间记录粘度降低并通过连接的电脑登记。在62℃、70℃和75℃下进行孵育。
表2中展示的结果显示:eg(eba8)能够在高达75℃的温度下液化木质纤维素原料,且较高温度导致较低粘度。
- 还没有人留言评论。精彩留言会获得点赞!