一种多吡啶钌金属配合物及其制备方法和用途与流程
本发明涉及化学领域,具体涉及金属配位化合物。
背景技术:
microrna(mirna)是一类由18~25个核苷酸组成,并且参与基因调控的内源性rna分子,其广泛表达于各种组织和器官,在细胞的增殖和凋亡、器官形成、发育等生命过程中发挥着重要的作用,不同发育阶段的不同组织中mirna的表达水平有着显著差异。mirna通过与靶基因互补配对,在翻译水平上对目标基因的表达进行调控。近年来有科学家研究发现,很多疾病的发生与mirna的表达水平息息相关,如2015年shu&liu等发现胃癌患者外周血中microrna-185(mir-185)表达显著上调,并推断mir-185很可能作为潜在的胃癌诊断的生物标记物。我们初步探讨了金属钌配合物应用于与多种癌症相关mir-185的检测研究,但是众所周知,某种特定癌症并不仅仅与单一的mirna相关,其可能与多种mirna表达密切相关。例如jancbrase等课题组发现在乳腺癌患者发病早期,乳腺癌细胞内microrna-221(mir-221)与microrna-222(mir-222)表达量存在明显上调,mir-221和mir-222可作为乳腺癌早期诊断的生物标记物。
检测mirna最常用的方法有灵敏度高的qrt-pcr(实时荧光定量pcr)特异性强的northernblot(诺瑟杂交法),高效快速的microarrays(基因芯片),但这些方法需经过逆转录过程来识别,过程复杂,成本高且耗时。近年来所报道的诸如rca(滚环扩增法),lamp(环介导等温扩增法)及lcr(连接酶链式反应)等方法虽然在一定程度上提高了识别灵敏度,但仍未克服耗时长且成本高等缺点。同步荧光分析法是通过同时扫描激发和发射两个单色器波长,并由测得的荧光强度信号与对应的激发波长(或发射波长)构成的方法技术,具有谱图简化、光散射干扰小及操作简便等优点,该方法一般可用于多组分物质的测定。考虑到单独的mirna异常表达的检测不足以作为临床诊断的根据,多种mirna的联合检测相比起来更具有可靠性和指导意义。因此,本发明以ru1为基础设计了p-dna@ru1复合材料,同时在常用荧光分析方法的基础上开展了同步荧光分析法对在乳腺癌中表达明显上调的mir-221(t1)和mir-222(t2)进行了检测研究,该研究对于乳腺癌的早期诊断方面研究意义重大。
多吡啶钌金属配合物作为一种高效的荧光淬灭剂,常被应用于一些荧光光谱学实验当中,但大部分研究内容集中于核酸分子探针以及dna光裂解方面,尚未见报道多吡啶钌金属配合物应用于多种mirna同步检测方面的研究。
技术实现要素:
本发明所要解决的技术问题是提供一种多吡啶钌金属配合物ru1,ru1具有良好的水溶性,可同步检测乳腺癌患者高表达的mir-221(t1)和mir-222(t2)。
本发明解决上述问题的技术方案是:
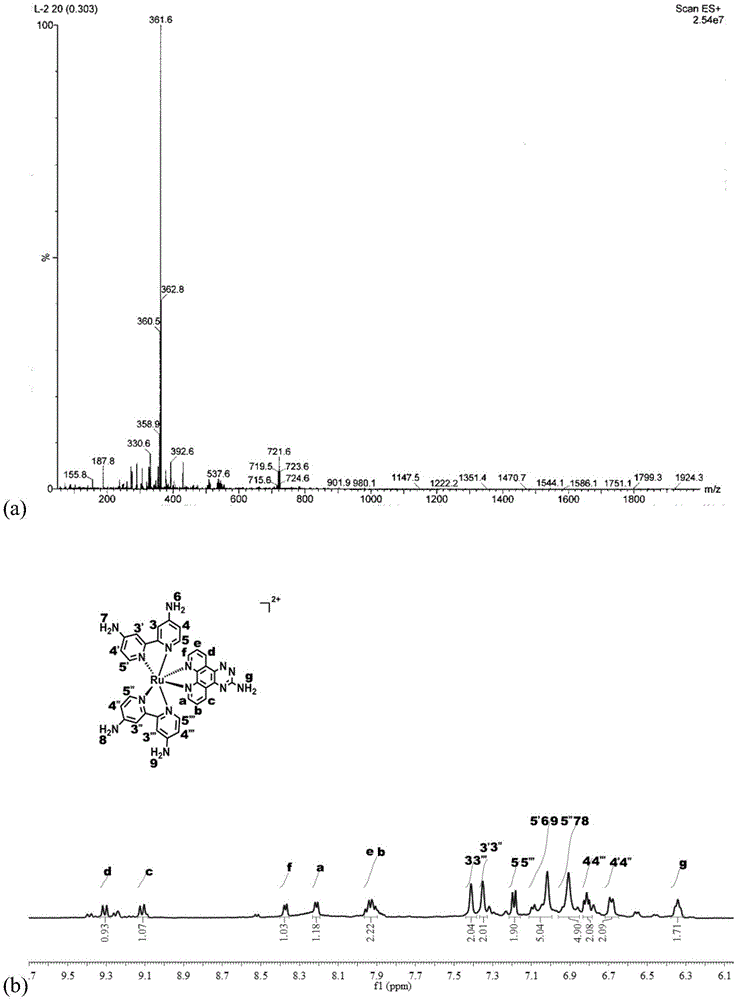
一种多吡啶钌金属配合物ru1,该金属配合物的结构为下式(ⅰ)所示,该配合物的核磁共振氢谱数据为:1hnmr(400mhz,dmso-d6):δ9.31(d,j=8.4hz,1h),9.25(d,j=8.8hz,1h),9.11(m,1h),8.38(d,j=5.2hz,1h),8.22(d,j=5.2hz,1h),7.92(m,2h),7.42(s,2h),7.36(s,2h),7.19(d,j=6.4hz,2h),7.03(m,5h),6.92(m,5h),6.82(m,2h),6.69(d,j=6.4hz,2h),6.35(t,j=6.0hz,2h).
本发明所述的多吡啶钌金属配合物ru1的分子式为[ru(bpyn)2(amtp)]cl2,式中的bpyn为4,4'-二氨基-2,2'-联吡啶,amtp为配体3-氨基-1,2,4-三嗪并[5,6-f]1,10-邻菲罗啉。上述多吡啶钌金属配合物在常温下为黑红色固体粉末,具有较好的水溶性和水稳定性。
本发明所述的多吡啶钌金属配合物采用本领域常用的制备方法,如将配体3-氨基-1,2,4-三嗪并[5,6-f]1,10-邻菲罗啉与前体ru(bpyn)2cl2反应得到。本发明人推荐的方法,由以下步骤组成:
(1)将1,10-邻菲罗啉-5,6-二酮与氨基胍盐酸盐于30ml冰醋酸中加热回流6h,冷却至室温后,用120ml水稀释,再滴加浓氨水至中性,抽滤后得大量黄绿色沉淀,该沉淀为主配体3-氨基-1,2,4-三嗪并[5,6-f]1,10-邻菲罗啉(amtp)。
(2)将rucl3·3h2o、4,4'-二氨基-2,2'-联吡啶和氯化锂一并溶解于dmf中,惰性气体保护下120℃回流,待反应完全后冷却至室温,加入丙酮后冷冻过夜后于室温下抽滤,抽滤所得的沉淀用丙酮洗净,真空干燥得前体ru(bpyn)2cl2(二-(4,4'-二氨基-2,2'-联吡啶)钌二氯盐);
(3)将前体溶于乙醇:水=3:1(v:v)的混合体系中,加入约1.1倍摩尔量的主配体,升温至120℃反应12h,然后冷却至室温,旋蒸大部分溶剂后将剩余固体产物溶于乙腈/乙醇,用中性氧化铝(200mesh)柱分离即可得到所述黑红色固体[ru(bpyn)2(amtp)]cl2(ru1)。
本发明的所述的多吡啶钌金属配合物(ru1)具有体外同步检测乳腺癌患者中高表达的mir-221(t1)和mir-222(t2)的性能。检测原理如下:两种不同荧光染料rox与fam的斯托克斯位移一致,由于荧光物质fam的激发波长为492nm,发射波长为518nm,而荧光物质rox的激发波长为578nm,发射波长为604nm,它们的stokesshift(△λ)均为26nm,因此fam和rox可用于恒波长同步荧光扫描技术中。首先将两种荧光染料分别标记待检测的mirna的互补靶向核酸序列probe-dna(简称为p-dna),分别为rox修饰的p-dna-1(靶向mir-221)和fam修饰的p-dna-2(靶向mir-222)。金属钌配合物ru1通过静电作用,π-π堆积及氢键作用与p-dna形成p-dna@ru1体系,使p-dna的荧光发生淬灭;当加入对应靶向的mirna(t)后,由于p-dna与t可以通过碱基互补配对作用形成p-dna@t杂交双链,该杂交双链p-dna@t与ru1相互之间的作用力比p-dna单链与ru1之间的作用力要弱,结果导致二者分离,荧光得以恢复。当荧光测定方法选择恒波长同步荧光扫描模式,即可实现对mir-221(t1)和mir-222(t2)的同步检测。
与现有技术相比,本发明具有以下优点:
(1)本发明产物原料价格低廉,容易获取;
(2)本发明产物合成方法的反应步骤较少,时间短,合成过程中溶剂无需特殊处理;
(3)本发明所述的多吡啶钌金属配合物中氯离子的引入显著增强了金属配合物ru1的水溶性,为进一步的生物活性研究提供了前提条件。ru1与p-dnas构筑的p-dnas@ru复合材料体系不仅可用于目标mir-221(t1)和mir-222(t2)的单独荧光检测,而且具备同步检测两种目标t1&t2的能力,两种检测方法均具有较高的灵敏度、选择性及快速检测优势。实验结果证明,本发明所述的多吡啶钌金属配合物ru1在体外对乳腺癌患者中高表达的t1和t2具有良好的检测作用。
附图说明
图1(a)是本发明所述多吡啶钌金属配合物ru1的低分辨质谱图(esi-ms),图1(b)是ru1的核磁共振氢谱(1hnmr)图。
图2是本发明所述多吡啶钌金属配合物ru1在不同的浓度下与荧光标记的p-dna-1(a)和p-dna-2(b)的荧光淬灭图。
图3是本发明所述多吡啶钌金属配合物ru1,rucl3,辅助配体bpyn,主配体amtp在不同的浓度下分别对p-dna-1(a)和p-dna-2(b)的荧光淬灭图。
图4是本发明所述p-dna@ru1复合材料分别对t1(a)和t2(b)的荧光复苏检测时间图。
图5是本发明所述p-dna@ru1复合材料对不同浓度下的t1(a)和t2(b)的荧光复苏变化图。
图6是本发明所述p-dnas@ru1复合材料的构建完成时荧光淬灭图。
图7是本发明所述p-dnas@ru1复合材料对t1和t2的荧光复苏检测时间图。
图8是本发明所述p-dnas@ru1复合材料同步荧光检测不同浓度下t1和t2的荧光复苏变化图。
图9是本发明所述p-dnas@ru1复合材料对t1和t2的特异选择性实验。
图10是本发明所述不同温度下ru1与p-dna-1(a)与p-dna-2(b)的荧光淬灭stern-volmer图。
图11(a)是p-dna-1(p-1),p-1@t1加入ru1前后荧光各向异性变化柱状图,图11(b)是p-dna-2(p-2),p-2@t2加入ru1前后荧光各向异性变化柱状图。
具体实施方式
实施例1配合物的制备
(1)将1,10-邻菲罗啉-5,6-二酮与氨基胍盐酸盐于30ml冰醋酸中加热回流6h,冷却至室温后,用120ml水稀释,再滴加浓氨水至中性,抽滤后得大量黄绿色沉淀,该沉淀为主配体3-氨基-1,2,4-三嗪并[5,6-f]1,10-邻菲罗啉(amtp)。
(2)将rucl3·3h2o、4,4'-二氨基-2,2'-联吡啶和氯化锂一并溶解于dmf中,惰性气体保护下120℃回流,待反应完全后冷却至室温,加入丙酮后冷冻过夜后于室温下抽滤,抽滤所得的沉淀用丙酮洗净,真空干燥得前体ru(bpyn)2cl2(二-(4,4'-二氨基-2,2'-联吡啶)钌二氯盐);
(3)将前体溶于乙醇:水=3:1(v:v)的混合体系中,加入约1.1倍摩尔量的主配体,升温至120℃反应12h,然后冷却至室温,旋蒸大部分溶剂后将剩余固体产物溶于乙腈/乙醇,用中性氧化铝(200mesh)柱分离即可得到所述黑红色固体[ru(bpyn)2(amtp)]cl2(ru1)。
配合物的核磁共振氢谱数据为:1hnmr(400mhz,dmso-d6):δ9.31(d,j=8.4hz,1h),9.25(d,j=8.8hz,1h),9.11(m,1h),8.38(d,j=5.2hz,1h),8.22(d,j=5.2hz,1h),7.92(m,2h),7.42(s,2h),7.36(s,2h),7.19(d,j=6.4hz,2h),7.03(m,5h),6.92(m,5h),6.82(m,2h),6.69(d,j=6.4hz,2h),6.35(t,j=6.0hz,2h).
实施例2金属配合物ru1对p-dna荧光单独淬灭能力的研究
用100μmtris-hcl缓冲溶液将100μm的p-dna溶液稀释成50nm,作为待滴定液;将金属钌配合物溶解在100μmtris-hcl缓冲溶液配成500μm(含50nmp-dna)的溶液为滴定液。取p-dna待滴定液2ml于常量荧光比色皿中,将滴定液按体积梯度加入比色皿中,记录体系荧光强度的变化(设置fam激发波长=492nm,发射波长=518nm;rox激发波长=578nm,发射波长=604nm)直到荧光淬灭达到饱和。荧光淬灭效率qe用公式1.1计算。
qe=(1-fm/f0)×100%(1.1)
其中f0为p-dna在不同荧光染料发射波长下的初始荧光强度;fm是加入钌配合物ru1后形成p-dna@ru1复合材料后在不同荧光染料发射波长下荧光淬灭达到饱和时的荧光强度。
ru1的主配体amtp,辅助配体bpyn和金属钌离子(rucl3)对p-dnas(p-dna-1&p-dna-2)的荧光淬灭实验亦采用此方法完成。
实施例3mirna(t:t1/t2)对p-dna@ru复合材料荧光单独复苏能力的研究
mirna(t)对p-dna@ru1复合材料荧光复苏检测时间的研究:将稀释后的待考察的t溶液(10μm)加入到上述荧光淬灭饱和的p-dna@ru1复合材料中,使t在材料体系中浓度达到25nm,监测荧光强度随时间的变化,确定p-dna@ru1复合材料通过荧光复苏检测待测t的最佳时间。
荧光复苏效率的测定:以p-dna@ru1复合材料的最佳检测时间为标准,记录复合材料的荧光强度随t浓度增加而复苏的程度,直到荧光复苏达到饱和。荧光复苏效率re用公式1.2计算。
re=ft/fm-1(1.2)
其中ft为p-dna@ru1复合材料加入t后在不同荧光染料发射波长下荧光复苏达到饱和时的强度。
检测限的计算:用公式1.3计算p-dna@ru1复合材料对t的检测限(limitofdetection,lod)。
lod=3σ/s(1.3)
其中σ为10次空白实验的背景荧光强度的标准偏差,s为校正荧光复苏曲线斜率。
实验结果参见表1
表1p-dna@ru1复合体系的相关数值以及其单独检测t1和t2结果。
注:time单位为min,lod单位为nm,淬灭浓度单位为μm
ru1主配体具有芳香环面积和提供氢键能力的氨基基团,在辅助配体上引入四个氨基以增大其氢键作用,分别考察ru1配合物对p-dna-1/p-dna-2的荧光淬灭效果。
将ru1加入p-dna待滴定液中,实验结果如表1和图2所示。对p-dna-1,ru1的最大淬灭率约为94%,荧光强度淬灭△f值为773.3,当荧光淬灭至饱和时,体系内ru1的浓度为2.0μm;对于p-dna-2,ru1最大淬灭率约为83%,荧光强度淬灭△f值为658.8,当荧光淬灭至饱和时,体系内ru1的浓度为1.5μm。
实验结果表明,ru1对于p-dna-1和p-dna-2的荧光淬灭率和荧光强度淬灭△f值均较好,且达到荧光淬灭饱和所用配合物浓度减小,证明ru1的设计达到初步成效。
接下来分别研究配合物各有机配体及金属钌离子对p-dna淬灭能力,实验结果如图3所示。与ru1相比,各配体均不能对两种p-dna进行有效淬灭,但金属钌离子对两种p-dna的淬灭率可达到95%以上,这充分说明金属钌离子在整个淬灭过程中发挥了关键作用。
完成荧光淬灭实验之后,接下来需要确定这两种配合物所构筑的p-dna@ru体系用于t1和t2的检测时间,实验结果如图4所示,我们确定p-dna-1@ru1和p-dna-2@ru1对t1和t2的检测时间分别为1min和2min。
接下来进行荧光复苏浓度依赖实验,通过不断加入t1和t2直至荧光强度复苏达到饱和,利用公式1.3计算出检测限,实验结果如图5所示,对于ru1,当t1和t2浓度分别达到90nm和70nm,体系荧光复苏至饱和,re值分别为7.7和2.3,荧光复苏的荧光强度变化值△f分别为402.5和310.7;在p-dna-1@ru1和p-dna-2@ru1两种体系存在下,t1和t2分别在0-60nm和0-40nm范围内存在线性关系,检测限分别为0.16nm和0.14nm。该实验结果证明相对于ru1所形成检测体系对t1和t2的检测效果上有很好的效果。
实施例4p-dna@ru1同步荧光检测平台的构建及对mirnas(ts:t1&t2)
检测能力的考察
rox与fam的斯托克斯位移一致,分别采用rox和fam修饰两种不同待检测的mir-221(t1)和mir-222(t2)的互补靶向核酸序列probe-dna得到p-dna-1和p-dna-2(p-dnas),p-dnas与金属钌配合物ru1构筑p-dnas@ru1检测体系,并用于同步检测目标mirnas(ts:t1&t2)。荧光测定时选择恒波长同步荧光扫描模式,设定△λ为26nm,狭缝宽度为10nm。具体检测步骤与实例2类似。
表2p-dnas@ru1复合体系的相关数值以及其同步检测t1和t2结果。
注:time单位为min,lod单位为nm,淬灭浓度单位为μm
利用同步荧光分析法分别考察ru1与p-dnas构筑的p-dnas@ru体系对t1和t2的检测效果。首先进行同步荧光淬灭实验,结果如图6和表2所示。ru1对p-dna-1和p-dna-2的最大淬灭率均为91%,荧光强度淬灭的△f值为893.6和387.3,当荧光淬灭至饱和时,体系内ru1的浓度为3.0μm。
接下来考察p-dnas@ru体系对t1和t2的检测时间和检测效果,当体系内加入最小浓度的t1和t2时,p-dnas@ru1的检测时间为2min(图7),这与单独检测时间一致。以确定的检测时间为基础,分别进行荧光复苏浓度依赖实验,结果如图8所示,对于ru1,当t1和t2浓度分别达到90nm时,体系荧光复苏至饱和,其re值分别为4.7和2.6,荧光复苏的荧光强度变化值△f分别为423.4和96.8,t1和t2都在0-80nm范围内存在线性关系,检测限分别为0.28nm和1.03nm。
以上实验结果证明ru1和p-dnas复合体系具有同时检测t1和t2的能力。另外,我们考察ru1体系对t1和t2的选择性,实验结果如图9所示,图a为加入t1和t2后复苏至饱和时的荧光强度;图b为仅加入t1时,其对应的rox荧光强度增强,fam荧光强度变化不大;图c为只加入t2,其对应的fam荧光强度增强,rox荧光强度变化也不明显。由以上实验结果可知ru1构筑的复合体系能同时检测出t1和t2,且两种mirna之间并不相互干扰。
通过对比ru1单独和同步荧光数据可以发现,p-dna@ru体系对mir-222同步荧光检测限要高于单独检测值,而对mir-221检测限相近似。检测限计算公式为lod=3σ/s,其中σ为加入t1之前的荧光强度标准偏差,s为校正荧光复苏曲线的斜率,在单独和同步检测中σ值相近,决定检测限高低因素为s值。对于rox,单独和同步荧光检测中荧光复苏强度相近,其s值相近,因此二者检测限近似;对于fam,由于单独检测荧光复苏强度远高于为同步检测,其s值为同步检测的5-7倍,因此p-dna@ru体系对mir-222同步荧光检测限要高于单独检测值,但仍在一个数量级之内。另外,单独与同步检测所需时间相近。同步检测法的操作更为简便,实验过程更为省时省力,该方法是我们课题组较之前检测方法上的一大创新之处。
实施例5ru1与p-dna和p-dna@t结合常数的测定
结合常数可以直接反映出分子间结合力的强弱,本专利采用stern-volmer方程计算金属钌配合物ru1与p-dna之间的结合常数。首先通过公式1.4判断配合物ru1对p-dna的荧光淬灭类型为动态淬灭或静态淬灭。
f0/f=ksv[q]+1(1.4)
f0与f分别为不存在与存在配合物ru1时复合材料体系的荧光强度;ksv为stern-volmer猝灭常数;[q]为配合物ru1的浓度。
可以根据ksv随温度变化的规律来判断荧光淬灭类型。动态淬灭是指淬灭剂在荧光寿命期间扩散至荧光物并发生相互作用,此时ksv值会随着温度的升高而变大;静态淬灭是指基态荧光分子与淬灭剂之间通过弱的结合生成复合物从而产生荧光淬灭,温度升高使得该复合物稳定性下降,导致ksv值变小。
如果淬灭类型只有静态淬灭,可采用双对数回归曲线方程1.5进行相应结合常数的计算。
lg(f0-f)/f=lgka+nlg[q](1.5)
lg(f0-f)/f对lg[q]作线性回归,斜率和截距即分别为两个分子之间的结合位点数n和结合常数ka的对数。
表3ru1在不同温度下对p-dna-1和p-dna-2的结合常数ka值
表4ru1在293k下对p-dna和p-dna@t的结合常数ka值
根据上述实验结果,推测钌配合物可通过静电作用,π-π堆积以及氢键作用等方式与p-dna相互作用,通过光诱导能量转移产生淬灭作用。当加入待检测靶向mirna后,由于碱基互补配对作用可形成dna/rna杂交双链,而钌配合物与dna/rna杂交双链的结合力减弱,因此dna/rna杂交双链脱离了金属钌配合物的约束,体系荧光得以恢复。
结合常数可作为判断分子间作用力强弱的直观表现形式。我们分别测定了ru1与p-dna及dna/rna杂交双链的结合常数。通过控温实验确定p-dna与配合物的结合方式,分别测定了不同温度条件(288k,298k,310k)下配合物与p-dna的结合曲线(图10)。由实验结果可判断为静态结合方式(方法步骤见上公式),利用相关公式计算出其静态结合常数,详细数据见表3。
接下来进行了配合物与杂交双链(p-dna-1@t1和p-dna-2@t2)的结合常数实验,发现是静态结合方式。通过上述实验将所得配合物与p-dna单链及杂交双链结合常数汇总得表3和4。分析表3和表4实验结果,在室温(298k)条件下,比较ru1与p-dna单链和杂交双链的结合常数,我们发现对于p-dna-1:ru1与单链的静态结合常数分别为p-dna-1@t1杂交双链的5.6倍;对于p-dna-2:ru1与单链的静态结合常数分别为p-dna-2@t2杂交双链4.8倍。该实验结果证明了配合物与单链p-dna的结合力要远强于其与杂交双链的结合力,这为钌配合物检测mirna的机理推测提供了实验数据支持。
实施例6荧光各向异性的测定
室温条件下,设定fam激发波长=492nm,发射波长=518nm;rox激发波长=578nm,发射波长=604nm,利用perkinelmer公司ls55荧光分光光度计测定ru1加入前后p-dna(50nm)或p-dna@t(50nm/50nm)的荧光各向异性值。
接下来通过荧光各向异性(fa)实验进一步验证上述假设。分别测定p-dna(p-dna-1和p-dna-2),p-dna+ru,p-dna@t+ru,p-dna@t(p-dna-1@t1和p-dna-2@t2)的fa值(图11)。对于p-dna-1(p-1),随着ru1加入后,其fa值分别为p-dna-1的2.7倍;对于p-dna-2(p-2),随着ru1加入之后,体系fa值分别为p-dna-2的3.0倍。fa值增大的原因是由于配合物与p-dna-1和p-dna-2形成复合物,由于复合物体积增大,分子转动速度变慢导致fa值增大;同样将配合物加入p-dna@t的双链体系中可以发现其fa值比p-dna@t稍有增大,但远小于p-dna+ru的fa值。以上荧光各向异性实验结果进一步证明了钌配合物与单链p-dna及杂交双链p-dna@t之间结合力的差异性。
sequencelisting
<110>南方医科大学
<120>一种多吡啶钌金属配合物及其制备方法和用途
<130>cp11901003c
<160>4
<170>patentinversion3.3
<210>1
<211>23
<212>dna
<213>人工序列
<400>1
gaaacccagcagacaatgtagct23
<210>2
<211>21
<212>dna
<213>人工序列
<400>2
acccagtagccagatgtagct21
<210>3
<211>23
<212>rna
<213>人工序列
<400>3
agcuacauugucugcuggguuuc23
<210>4
<211>21
<212>rna
<213>人工序列
<400>4
agcuacaucuggcuacugggu21
- 还没有人留言评论。精彩留言会获得点赞!