一种大豆圣豆9号GmPK6基因盐诱导启动子及其应用的制作方法
本发明属于生物基因工程技术领域,尤其涉及一种大豆(glycinemax(l.)merr)圣豆9号中lammer型蛋白激酶基因----gmpk6盐诱导启动子及其应用。
背景技术:
大豆是我国重要的粮油作物,在我国粮食结构中占据重要地位,其种植面积仅次于水稻,玉米,小麦,居第四位。同时,我国是大豆第一进口大国,面临着严重依赖进口危机,因此提高大豆产量成为了我国农业生产方面的重要问题。
土壤盐碱化会影响大豆的生长和许多农艺性状,最终影响其产量。目前,利用现代分子生物学技术挖掘耐盐相关基因或元件,对于提高农作物耐盐性,改良农作物产量具有重要意义。
蛋白激酶级联是植物中普遍存在的信号传导模块,其作为分子开关,在植物的生长和发育过程中起着重要作用。诸多研究发现,通过蛋白激酶的网络整合信息调控复杂的细胞行为是不同信号通路之间实现对话的重要方式。目前已知的酶联受体类型包括受体酪氨酸激酶;受体丝氨酸/苏氨酸激酶;受体酪氨酸磷酸酯酶;受体鸟苷酸环化酶和酪氨酸蛋白激酶联受体。其中lammar型蛋白家族激酶是一种双重特异性受体蛋白激酶,传统观点认为丝氨酸/苏氨酸蛋白激酶作用于底物的丝氨酸残基或苏氨酸残基,酪氨酸蛋白激酶则特异性作用于酪氨酸残基,它打破了原有的两种蛋白激酶的传统观点,发现该种蛋白激酶兼可作用于酪氨酸与丝氨酸/苏氨酸残基上,从而使某些蛋白磷酸化而活化,目前在动物方面研究发现,某些lammer家族蛋白激酶在信号通路中与细胞周期和细胞分化有关,如果蝇中的doa蛋白在细胞的有丝分裂至减数分裂的转换过程中起到了调节作用,pflammer蛋白在调节寄生虫的性分化过程中起到重要作用。在模式植物拟南芥中的lammer家族成员afc1功能仅在酵母中报道,其在植物中是否参与到耐逆过程尚未见报道。
启动子是指rna聚合酶识别,结合和开始转录的一段dna序列。启动子作为顺式作用元件,在基因的表达和调控过程中起着重要的作用。真核生物启动子主要包括三类,分别由rna聚合酶i,ii和iii进行转录。多种转录因子和rna聚合酶在起点上形成前起始复合物而进行转录。其中盐诱导启动子属于类别ii启动子,包括基本启动子、起始子、上游元件和应答元件。基本启动子序列较为保守,其功能与rna聚合酶的定位有关,dna双链在此解开并决定转录的起始位点,许多转录因子将作用于该启动子区域以调节转录的起始;起始子即在转录的起始位点处有一保守序列,dna在此解开并起始转录。基本启动子和转录因子对于rna聚合酶ii的转录是必要不充分条件,它们单独只能给出微弱的效率,而要达到适宜水平的转录还需要一些上游元件和应答元件的参与,这些元件的不同组合,再加上其他序列的变化,构成了数量十分庞大的各种启动子。
lammer型蛋白激酶基因----gmpk6是一种双重特异性底物激酶,是由申请人从大豆圣豆9号品种中克隆获得,并发现其在拟南芥中过表达具有良好的耐盐性(见专利申请号:201611079609.8)。然而,检索发现截止到目前,对该基因的启动子的序列及生物学功能尚未有深入报道。
技术实现要素:
针对现有技术的不足,本发明的目的是提供一种大豆圣豆9号gmpk6基因盐诱导启动子及其应用。
本发明所述的大豆圣豆9号gmpk6基因盐诱导启动子,其特征在于:所述启动子的核苷酸序列是下列核苷酸序列之一:
(a)序列表中seqidno:1的dna序列;
(b)与序列表中seqidno:1的dna序列具有90%以上同源性,且具有相同功能的dna序列。
其中,进一步优选的实施方式是:所述启动子的核苷酸序列如seqidno:1所示。
本发明还公开了一种含有上述大豆圣豆9号gmpk6基因盐诱导启动子的报告基因luc表达载体,其特征在于:所述表达载体命名为pgmpk6::pgreenii-800luc。
本发明所述大豆圣豆9号gmpk6基因盐诱导启动子在受盐胁迫诱导高效启动目标基因表达中的应用。
利用酶切连接将gmpk6基因启动子连接到pgreenii-0800luc载体中,通过拟南芥和大豆叶肉细胞原生质体瞬时转染体系,验证gmpk6基因启动子功能。
实验证实:本发明所述圣豆9号gmpk6基因启动子能够在盐诱导条件下上调目标基因的表达,可望用于转基因耐盐植物的培育。其中:所述植物优选大豆或拟南芥;进一步的,所述拟南芥是col-0野生型,大豆品种是williams82。
本发明有益效果体现在:利用pcr克隆技术,本发明首次克隆得到了大豆圣豆9号gmpk6基因启动子,通过拟南芥和大豆叶肉细胞原生质体瞬时转染体系,经过比较分析证明,转基因拟南芥和大豆原生质体能在盐诱导下较非盐条件下能更高效的表达报告基因。预示本发明所述的基因可广泛用于培育抗盐的植物品种。
附图说明
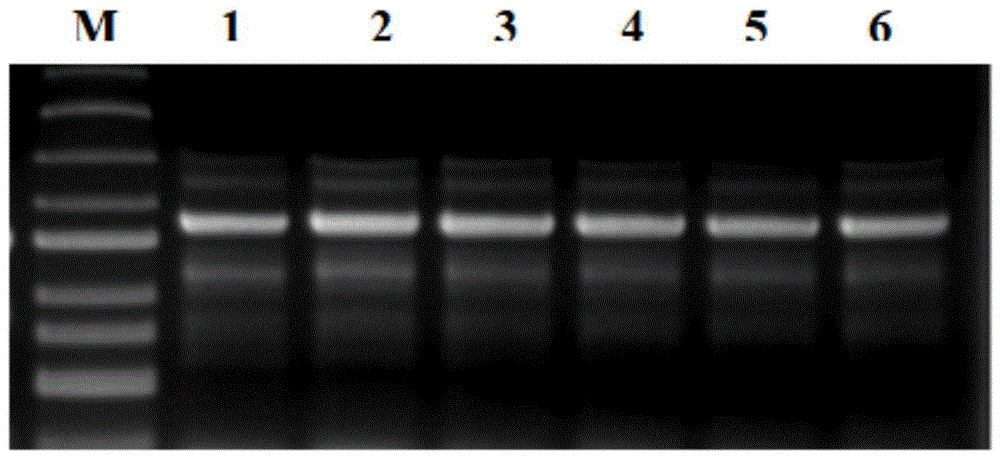
图1为pcr克隆大豆圣豆9号gmpk6基因启动子电泳图,其中:m为marker,泳道1、2、3、4、5、6为启动子dna。
图2为pgreenii-0800luc载体t-dna插入区示意图。
图3为gmpk6启动子在盐和非盐条件下相对荧光素酶测定结果,其中,mock为pgreenii-0800luc空载体转化原生质体正常培养6h的相对荧光素酶活性比值,mocknacl为pgreenii-0800luc空载体转化原生质体50mmnacl处理6h的相对荧光素酶活性比值,gmpk6promoter为gmpk6启动子转化原生质体正常培养6h的相对荧光素酶活性比值,gmpk6promoternacl为gmpk6启动子转化原生质体50mmnacl处理6h的相对荧光素酶活性比值。
具体实施方式
下面结合具体实施例对本发明内容进行详细说明。如下所述例子仅是本发明的较佳实施方式而已,并非对本发明作任何形式上的限制,凡是依据本发明的技术实质对实施方式所做的任何简单修改,等同变化与修饰,均属于本发明技术方案的范围内。
一般性说明:实施例中所用材料和试剂均为市售产品。
实施例1大豆gmpk6基因启动子的获得
根据ncbi网站上查到的gmpk6基因转录起始位点atg上游1826kb序列,设计启动子引物(f:5’-attatgtgcgaaaggatgagt-3’,r:5’-gatgcagagaactacgaaaacttcaaag-3’)。利用ctab法提取圣豆9号基因组dna,将提取的基因组dna稀释到100ug/ul,用作扩增启动子模板。利用高保真酶hifi(takara),扩增gmpk6基因启动子。
1.1圣豆9号基因组dna提取
(1)将ctab提取液水浴预热到65℃;
(2)将圣豆9号植物材料放入研钵中,利用液氮将其研磨成粉末;
(3)等液氮挥发后,立即将100-200mg植物粉末转入到1.5ml离心管中,然后迅速的加入1ml预热的ctab提取液,轻柔颠倒混匀,65℃水浴30min;
(3)12,000rpm,离心10min,将0.6ml上清液转移到新的1.5ml离心管中,待提取液降低到室温,再加入0.36ml酚/氯仿/异戊醇(24:23:1)轻柔混匀5min,室温放置10min使液体分层;
(4)12,000rpm,离心10min,将0.4ml上清液转移到新的1.5ml离心管中,再加入0.4ml异丙醇,轻柔上下翻转15次混匀溶液,室温放置15mim;
(5)12,000rpm,离心10min,弃上清,加入1ml75%的乙醇洗涤沉淀,弹起沉淀,12,000rpm,离心5min,重复两次;
(6)弃上清,开盖干燥dna约10min,加入50μl灭菌水,在60℃中充分溶解rna10min;
(7)用紫外分光光度计测dna样品的od值和浓度,a260/a280达到1.7-2.0,a230/a260达到2.0-2.2,并将提取的dna吸取10μl浓度稀释到100μg/μl用作pcr模板,其他放置-20℃备用。
1.2gmpk6基因启动子克隆
高保真酶hifi扩增的反应体系如下(20μl体系):
扩增条件如下:
反应结束后,反应液于0.8%tae琼脂糖凝胶电泳检测。
1.3克隆基因片段的纯化回收(天根试剂盒)
1)将切下带有目的片段的凝胶放入1.5ml离心管并称凝胶重量,加入3倍体积的溶胶液,60℃溶胶10min,溶胶期间不断的翻转;
2)凝胶完全融化后,全部吸取到回收柱中,放置片刻;
3)室温,12000rpm,离心30sec,弃溶液;
4)在柱中加入700μl的漂洗液,12000rpm,离心1min,弃漂洗液;
5)在柱中加入500μl的漂洗液,12000rpm,离心1min,弃漂洗液;
6)空柱,12000rpm,离心2min;
7)回收柱开盖晾干1-2min,放入新的干净的1.5ml离心管,加入60℃预热的40μl灭菌水或者eb缓冲液,放置2min;
8)12000rpm离心1min,所得溶液即为回收片段。
1.4连接gmpk6启动子与t载体
反应体系如下(20μl体系):
16℃过夜连接。
1.5大肠杆菌的质粒转化(无菌操作)
(1)将1-5μl质粒dna或者连接产物加入50μl的感受态细胞中,轻弹离心管混匀,冰浴30min;
(2)42℃,温水浴热激90sec,立即冰浴2-3min;
(3)加入1mllb培养基,37℃培养40-50min;
(4)室温,4000rpm,离心3min,收集菌体;
(5)将菌涂布于含有相应抗生素的培养平板上,37℃倒置培养过夜。
1.6大肠杆菌pcr验证
反应体系如下(20μl体系):
扩增条件如下:
反应结束后,反应液于0.8%tae琼脂糖凝胶电泳检测。
1.7dna测序
挑取含有重组质粒的阳性单菌落用含有amp(50mg/l)的液体lb摇过夜,然后送华大基因有限公司测序,得到测序结果,启动子dna序列如序列表seqidno.1所示。
经过序列分析,上述dna序列(seqidno.1)与大豆willms82的核苷酸同源96.11%,三次实验证明所述dna序列(seqidno.1)就是大豆圣豆9号gmpk6基因启动子。
1.8大肠杆菌质粒dna的提取得到pgmpk6::t质粒(天根试剂盒)
(1)将测序正确的菌接种于10ml含有氨苄霉素的lb液体培养基中,37℃培养8小时-过夜;
(2)室温,12000rpm,离心1min,收集菌体;
(3)弃上清,加入250μl低温预冷的p1,振荡悬浮菌体;
(4)加250溶液p2轻柔颠倒混匀,静置5min;
(5)溶液澄清后加入350μl溶液p3,轻轻混匀后放置5min;
(6)12000rpm,离心12min,同时在过滤柱中加入600μlbl平衡液,室温放置2min,12000rpm离心1min,将收集管中的液体倒掉;
(7)转移质粒提取管中上层水相于过滤柱中,室温2min,12000rpm离心1min,将收集管中的液体倒掉;
(8)在过滤柱中加入600μl漂洗液pw,室温2min,12000rpm离心1min,将收集管中的液体倒掉,重复一次;
(9)将吸附柱cp3放入收集管中,12000rpm离心5min;
(10)将吸附柱cp3置于一个干净的离心管中,向吸附柱的中间部位滴加55μl预热55℃的灭菌水,室温放置2min,12000rpm离心2min将质粒溶液收集到离心管中,-20℃保存备用。
2.大豆圣豆9号gmpk6基因启动子序列分析
利用place(http://www.dna.affrc.go.jp/place/)及plantcare(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线分析系统对圣豆9号gmpk6基因启动子序列中可能存在的顺式作用元件进行分析。gmpk6基因启动子所含有的胁迫相关顺式作用元件如表1所示,表明该启动子上含有丰富的胁迫相关顺式作用元件,可能受到多种转录因子的调控,参与植物对多种生物和非生物胁迫响应。
表1:gmpk6基因启动子所含有的胁迫相关顺式作用元件
实施例2.利用拟南芥原生质体瞬时转化技术验证gmpk6启动子受盐诱导。
2.1gmpk6启动子pgreenii-800luc载体的构建
2.1.1克隆含有酶切位点的gmpk6启动子片段
利用双酶切-连接法构建gmpk6启动子的双荧光报告载体pgreenii-800luc。利用primer5对圣豆9号gmpk6启动子上的限制性酶切位点分析,与pgreenii-800luc上的多克隆位点(如图2所示)进行比较,筛选出可用酶切位点为hindiii和bamhi。
利用gmpk6含有酶切位点的引物
(f:5’-cccaagcttattatgtgcgaaaggatgagt-3’,
r:5’-cgggatccgatgcagagaactacgaaaacttcaaag-3’)pcr扩增gmpk6启动子,
高保真酶hifi扩增的反应体系如下(20μl体系):
扩增条件如下:
反应结束后,反应液于0.8%tae琼脂糖凝胶电泳检测。
2.1.2胶回收pcr产物
1)将切下带有目的片段的凝胶放入1.5ml离心管并称凝胶重量,加入3倍体积的溶胶液,60℃溶胶10min,溶胶期间不断的翻转;
2)凝胶完全融化后,全部吸取到回收柱中,放置片刻;
3)室温,12000rpm,离心30sec,弃溶液;
4)在柱中加入700μl的漂洗液,12000rpm,离心1min,弃漂洗液;
5)在柱中加入500μl的漂洗液,12000rpm,离心1min,弃漂洗液;
6)空柱,12000rpm,离心2min;
7)回收柱开盖晾干1-2min,放入新的干净的1.5ml离心管,加入60℃预热的40μl灭菌水或者eb缓冲液,放置2min;
8)12000rpm离心1min,所得溶液即为回收片段。
2.1.3hindiii和bamhi分别双酶切pcr产物和pgreenii-800luc载体过夜。
反应体系如下:
37℃过夜充分酶切。
3.1.4第二天胶回收酶切产物及pgreenii-800luc载体
1)将切下带有目的片段的凝胶放入1.5ml离心管并称凝胶重量,加入3倍体积的溶胶液,60℃溶胶10min,溶胶期间不断的翻转;
2)凝胶完全融化后,全部吸取到回收柱中,放置片刻;
3)室温,12000rpm,离心30sec,弃溶液;
4)在柱中加入700μl的漂洗液,12000rpm,离心1min,弃漂洗液;
5)在柱中加入500μl的漂洗液,12000rpm,离心1min,弃漂洗液;
6)空柱,12000rpm,离心2min;
7)回收柱开盖晾干1-2min,放入新的干净的1.5ml离心管,加入60℃预热的40μl灭菌水或者eb缓冲液,放置2min;
8)12000rpm离心1min,所得溶液即为回收片段。
3.1.5将回收的酶切产物和载体进行连接反应过夜。
3.1.6大肠杆菌感受态质粒转化
(1)将1-5μl质粒dna或者连接产物加入50μl的感受态细胞中,轻弹离心管混匀,冰浴30min;
(2)42℃,温水浴热激90sec,立即冰浴2-3min;
(3)加入1mllb培养基,37℃培养40-50min;
(4)室温,4000rpm,离心3min,收集菌体;
(5)将菌涂布于含有相应抗生素的培养平板上,37℃倒置培养过夜。
3.1.7大肠杆菌pcr验证
反应体系如下(20μl体系):
扩增条件如下:
反应结束后,反应液于0.8%tae琼脂糖凝胶电泳检测。
3.1.8dna测序
挑取含有重组质粒的阳性单菌落用含有amp(50mg/l)的液体lb摇过夜,然后送华大基因有限公司测序,得到测序结果。
验证连接到pgreenii-800luc中的gmpk6启动子克隆区域核苷酸序列如seqidno.1所示。
3.1.9大肠杆菌质粒dna的提取得到pgmpk6::pgreenii-800luc质粒:无内毒素质粒纯化dna纯化体系(nucleobondxtramidief)(macherey-nagel)
(1).菌体培养收集:4500×g,15min,4℃
(2).菌体裂解:8mlbufferres-ef彻底重悬菌体,加入8mlbufferlys-ef裂解菌体,轻柔混匀,常温裂解5min;
(3).平衡柱子和滤头:15mlbufferequ-ef
(4).中和:8mlneu-ef,轻柔混合10-15次,冰上放置5min
(5).净化和装柱裂解液:颠倒试管3次,将裂解液倒入柱子中
(6).1st洗:5mlbufferfil-ef
(7).去除过滤柱:去除nucleobondxtracolumnfilter
(8).2ed洗:35mlbufferendo-ef
(9).溶解:5mlelu-ef
(14)沉淀:3.5ml异丙醇,15000g,4℃,30min
(15)清洗和干燥dna沉淀:2ml70%乙醇常温,5min,15000g,常温,5min
(16).溶解dna:加入适量体积的h2o-ef,使dna浓度达到1000ug/ml,-20℃保存。
3.2.1gmpk6启动子拟南芥及大豆叶肉细胞原生质体瞬时转化
(1)准备在土里生长的3~4周拟南芥幼苗(拟南芥未受胁迫,未抽苔,生长良好),取5-8片展开的真叶;(大豆采用三叶一心时期的真叶)
(2)用新的单面刀片将叶片的中部切成0.5-1mm的小条,保证切片没有组织的挤压;
(3)将叶片条迅速且轻柔的转移到备好的酶液中,用平头镊子将叶条两边的切面都浸入酶液;
(4)将叶条在黑暗中抽真空30min黑暗中酶解3小时,轻摇后酶液呈绿色,说明原生质体解离下来;
(5)用显微镜检查原生质体,正常拟南芥叶肉细胞原生质体应约为30-50μm;
(6)用w5溶液将酶/原生质体等体积稀释;
(7)用水将75μm尼龙网上的乙醇洗净并吸去多余水分,并用w5浸湿,然后过滤上述混合物;
(8)将上清转入30ml圆底离心管,200g离心2min,尽可能去除上清,并轻柔转动重悬原生质体;
(9)用血球计数板在100倍显微镜下对原生质体计数,按2×105个/ml的比例用w5重悬原生质体,冰上静止30min;
(10)用移液器尽量吸去w5,不要碰到沉淀。按照2×105个/ml的比例用mmg重悬原生质体,并放置室温;
(11)在2ml离心管中加入10ulpgmpk6::pgreenii-800luc质粒;
(12)加入100ul原生质体(2×104个),轻柔混合;
(13)加入110ulpeg溶液,轻敲离心管充分混合,室温放置10min;
(14)在6孔板的每个孔中加入1ml5%的牛血清溶液,晃动几下,使溶液覆盖好孔的内壁(防止原生质体贴壁),将牛血清移去,加入1mlw5溶液清洗六孔板,移去w5溶液;
(16)在转化体系中加入440ulw5稀释,轻柔混合以终止转化反应;
(17)100g离心2min,去除上清,加入200ulw5溶液悬浮原生质体;
(18)在六孔板中加入1mlw5溶液,将转化后的原生质体转入刘孔板中,黑暗中过夜培养;
(19)重悬原生质体,100g离心2min收集,去上清,留100ul左右的液体,直接进行luc测定,或放入-80℃保存。
3.3gmpk6启动子相对荧光素酶活性测定
利用promegadual-
序列表
<110>山东大学
<120>一种大豆圣豆9号gmpk6基因盐诱导启动子及其应用
<141>2019-3-1
<160>1
<210>1
<211>1757
<212>dna
<213>大豆属大豆(glycinemax.)
<221>大豆圣豆9号gmpk6基因盐诱导启动子核苷酸序列
<222>(1)…(1757)
<400>1
attatgtgcgaaaggatgagtttatcttcagtttgtttaaatttatttattaaaataaat60
atttatatattttttaatgtatttgtctaagttatttttgttaaaaaagtaaaattttat120
ttatttaaaaaaacaattttatctgattcttcaaaaaacaattatataaaaaacgttatt180
ttaacattatctttttaagtttaactaaatttattatacatttaatcggataagtttaaa240
tttaaaaatgtgaaatcaaagtaaattgacagaattcactaaataagttatcataaatca300
ttttaggagttacaagagattgatcttggggttaaagggagaagaagagagagataaaac360
ttaggtttatatttttttactaacaataactaataaattaataactaatatttgttaata420
aaaaaatcataaattattgttgtcaaatttgtgttgagttatttatttcattaaagttat480
gtttgataaaatatttaagttaatttttattttttttactaactaaaaaagttatttaac540
tatttgataaataagtttttttatatctttttagtgattttcaatattttttgaaatatt600
aattaaagtaatatttttttaaaactaacttctaactttttatatttttttcacttttat660
tcttaatataattatttattttccttgttacatttttaaataaattatgatttaattatt720
tttctgtcatttcaaacttttaagctactttaacagttaattttatcaaacacttatatt780
ttaataagttaattttttaattattaacttctaacaaactttctaaatttcaactaattt840
tttaattaattttatcaaagaatttctcaaaaagtatatatgtccatactaatatgatga900
tatatactaaatgaatccaatactaataagttgatgtagtaaaaaaaatgccactaagtt960
gatgcgctaaaacaaataccaataatttctatttacttttgatttgtaaaagtaacaact1020
gtaatattaaaccaaacaaaaatttaagtagaaaaaataattataatttttgtttcagaa1080
agtgataggtgacctcgccgtatcatcaccaaagtgcctatgaatttgattcaatgaacc1140
tctaagttgacattgaatttaattaaaaaaaagtttaaatatgaatttaatttatgtaag1200
tggacaatttttaaattttggtccttttaagttttatgtttatttttattttctgcatgt1260
ttatgtttttttaattttagttcgtttatattttttaatattgatttcctaaaataaaaa1320
cttacataaatcaaaaataaaaaaaaaacaaacttatacaagttataaattcaactttaa1380
gcacggactttttagcttcttttgaaacatagcgatctttaaaagaaaaaactagtcgtc1440
ggcatttttgcaatattttattccattccgcagctccaccaaacctaaccgaaccatggt1500
taaaaggattagcaagatttaaccatagtctacattagacagcacaatccagccactcga1560
acaagatgctccaatgcgttgacacgtggacggggagatttcatcccagccgcctccacg1620
gtcgttattattaggctaacatcgcgtttagggttcctgaagccgaggctctatcttccc1680
aaaatcatataattctctttcatctgaattttccctttcaaatctcttcctttgaagttt1740
tcgtagttctctgcatc1757
- 还没有人留言评论。精彩留言会获得点赞!