免疫原性多肽以及抗TTC36抗体BP1-7及应用的制作方法
本发明涉及免疫领域,更特别地,涉及一种免疫原性多肽及其应用,还涉及一种杂交瘤细胞、所述杂交瘤细胞产生的抗体及其应用,以及一种非诊断目的检测样品中的ttc36蛋白的方法。
背景技术:
ttc36(tetratricopeptiderepeatdomain36)蛋白含有3个trp模序(tetratricopeptide),无其他结构域,属于tpr样结构蛋白。我们通过进化树分析发现,ttc36的氨基酸序列在哺乳动物类高度保守,可见其在生物体内执行重要的功能。
jiang,l.等研究发现ttc36蛋白在人肝癌组织标本中表达下调,如果在肝癌细胞中过表达ttc36基因可促进肝癌细胞凋亡。jamesanathan的研究显示ttc36可能参与细胞内蛋白泛素化。
目前ttc36蛋白的研究报道并不多,市场上已有一些针对ttc36的多克隆抗体,但是尚未有文献报道使用ttc36单克隆抗体研究,市场上也还没有针对人ttc36蛋白的单克隆抗体出售。
由于单克隆抗体的高度特异性,利用单克隆抗体进行相关机制研究,开发体外诊断性试剂盒,或制备抗体药物已成为制药和生物制剂行业中增长最快、获利最大的市场之一。因此,需要研发出针对ttc36蛋白的单克隆抗体用于相关用途。
技术实现要素:
为解决以上问题,本发明提供了一种免疫原性多肽,其序列如seqidno:1所示。
本发明还提供了上述免疫原性多肽用于制备抗ttc36抗体的应用。
本发明还提供了一种制备ttc36抗体的方法,包括使用上述多肽刺激实验动物免疫系统,使所述实验动物产生抗体的步骤。
本发明还提供了一种杂交瘤细胞,所述杂交瘤细胞于2018年10月17日保藏于中国典型培养物保藏中心(cctcc),保藏号cctccno:c2018205。
本发明还提供了一种单克隆抗体,由上述杂交瘤细胞产生。
本发明还提供了上述单克隆抗体用于检测非病理样品中的ttc36蛋白的应用。
本发明还提供了上述抗体用于制备疾病诊断试剂的应用。
在一个优选实施方案中,所述疾病为癌症。
在一个优选实施方案中,所述疾病为肝癌。
本发明还提供了一种非诊断目的检测样品中的ttc36蛋白的方法,包括以下步骤:
s1:使所述样品暴露抗原;
s2:使用上述单克隆抗体孵育所述样品;
s3:显示与所述样品特异性结合的所述单克隆抗体。
本发明的截短的免疫原性多肽可有效诱导人或动物产生抗ttc36蛋白的抗体,本发明的抗体可高效并且特异地结合样品中的ttc36蛋白,与多克隆抗体相比,具有更高特异性和亲和力。为ttc36蛋白功能研究,相关疾病的研究,诊断和治疗提供更好的抗体工具。
生物材料保藏
本发明设计的单克隆抗体由杂交瘤细胞产生,杂交瘤细胞已于2018年10月17日保藏于中国湖北省武汉市武汉大学的中国典型培养物保藏中心(cctcc),保藏号cctccno:c2018205,命名为杂交瘤细胞株bp1-7。
附图说明
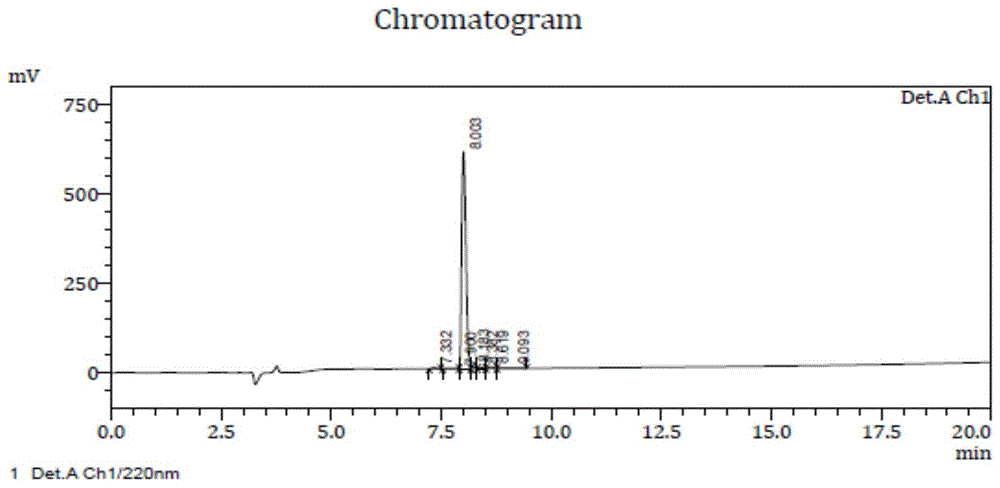
图1为合成多肽(aynnraqarrlqgdvaga)色谱鉴定图;
图2为免疫抗原gst-ttc36纯化产物电泳图,其中,泳道m为marker,泳道1为0.5mg/mlbsa,泳道2为稀释2倍的gst-ttc36;
图3为elisa法检测杂交瘤细胞培养上清结合力和特异性结果;
图4为免疫印迹法检测杂交瘤细胞培养物上清结合力结果,泳道m为marker,泳道1-5分别为杂交瘤细胞bp1-1、bp1-5、bp1-7、bp1-6、bp1-9的培养物上清染色结果;
图5为elisa法检测纯化后bp1-7抗体效价结果;
图6为肝癌与癌旁组织石蜡切片免疫检测结果,左边为肝癌组织切片的照片,右边为癌旁组织切片的照片;
图7为肝癌与癌旁组织免疫印迹检测结果,泳道1为癌旁组织,泳道2为肝癌组织。
具体实施方式
以下结合附图对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。
1.抗原制备
1.1免疫抗原制备
根据ttc36的蛋白序列,合成多段多肽,其中之一为第87-104位氨基酸,序列为aynnraqarrlqgdvaga(seqidno:1)。合成的多肽进行色谱鉴定,结果如图1所示,多肽序列正确,并且纯度为96.28%。将该多肽偶联klh,形成偶联蛋白ttc36(87-104aa)-klh。偶联到牛血清白蛋白(bsa),形成“多肽-bsa”偶联蛋白,然后定量2.0mg/ml,命名为:ttc361(87-104aa)-bsa。
1.2阳性抗原ttc36蛋白的原核表达
1.2.1基因片段的合成与克隆
对ttc36的编码基因全程进行密码子优化,并在c端连上gst标签的编码基因以利于纯化,得到的序列如seqidno:2所示。在该序列的两端分别加上ecori和xhoi位点,以便于克隆。
合成上述序列,并以ta方式克隆到puc57质粒载体中,选取测序正确的克隆进行下一步实验。
1.2.2构建表达载体和表达菌株
片段酶切:取43μlttc36-puc57重组质粒,1μlecori,1μlxhoi,5μl10×buffer,37℃过夜反应(使用琼脂糖凝胶dna回收试剂盒,bpi);载体酶切:取43μl载体(pgex-4t-1)质粒,1μlecori,1μlxhoi,5μl10×buffer,37℃过夜反应(琼脂糖凝胶dna回收试剂盒,bpi)。
连接转化:取1μl载体(pgex-4t-1),3μl片段,1μl连接酶(bpi),5μl2×rapidbuffer,混匀,室温反应30min,得到ttc36蛋白表达载体。
取出-80℃保存的感受态细胞(bl21),放在冰上缓慢解冻。将感受态细胞加入连接产物中混匀,冰上放置30min。42℃热激90s。冰浴2min后,加入800μl无抗性的lb培养基。37℃培养45min。5000rpm离心3min,弃大部分上清,留约100-150μl,重悬菌体,选择有相应抗性的lb平板,涂板。晾干,于37℃培养箱中倒置培养过夜。挑取阳性克隆,检验无误后即得到ttc36蛋白表达菌株。
1.2.3ttc36的表达与纯化
1.2.3.1蛋白表达
(1)按照1:50比例接菌到相应抗性lb液体培养基中,37℃培养,200rpm。
(2)将培养的菌液按照1:50比例转接到1000ml相应抗性lb液体培养基中,37℃,200rpm,培养至od=0.6-0.8,iptg(0.5mm)37℃诱导2h。
(3)收菌:8000rpm,离心6min。弃上清。
(4)超声破菌:菌体用20-30ml10mmtris-hcl(ph8.0)溶液吹散,超声波破碎(500w,180次,每次5s,间隔5s)。
(5)电泳确定表达形式:取100μl超声后的菌悬液,12000rpm,离心10min,取50μl上清至另一ep管,上清去除干净后沉淀用50μl10mmtris-hcl(ph8.0)溶液吹散。电泳检测。
1.2.3.2蛋白质纯化
(1)按照每8mggst融合蛋白需要1mlglutathionesepharose4bbead的比例吸取柱料,并向其中加入5mlpbs(ph7.4),重悬,2000rpm离心2min,重复3-5次。
(2)每500ml菌液的菌体加入20mlpbs(ph7.4)重悬,超声波破碎,12000rpm离心10min。
(3)取上清与经过处理的bead混合摇匀,4℃翻转摇动过夜结合。
(4)2000rpm离心2min,上清转至另一管中,留样电泳(为穿柱),bead转入10mlep管。
(5)用5ml裂解液洗3次(2000rpm离心2min,加液后重悬)。
(6)用5ml洗脱液(10mmreducedglutathione、50mmtris-hcl,ph8.0)重悬bead,4℃条件下翻转摇动2-3h,2000rpm离心2min,上清转至另一管中。重复两次。
(7)用5ml洗脱液(60mmreducedglutathione、50mmtris-hcl,ph8.0)重悬bead,4℃条件下翻转摇动过夜,2000rpm离心10min,上清转至另一管中。重复两次。
(8)取样50μl,电泳检测蛋白纯化效果。
(9)用样品体积200倍的透析buffer(1×pbs),4℃透析。每次3h,透析3次。
(10)12000rpm离心10min,取上清,电泳检测。
结果如图2所示,蛋白大小与理论值相符(46kda),纯度高于85%,可用于免疫和筛选。
2.免疫小鼠
用“多肽-klh”偶联蛋白,按60μg蛋白/只小鼠的量,皮下初次免疫4只spf级balb/c雌性小鼠,编号为:1#、2#、3#、4#。每间隔2周,分别免疫第二次第三次,免疫量为30μg蛋白/只。第三次免疫后第7天,眼眶取血,测血清效价,结果显示3#小鼠效价最高。一周后用免疫原50μg,腹腔冲击3#小鼠。
用0.1m碳酸盐缓冲液(ph9.6)的包被液稀释“多肽-bsa”偶联蛋白,2μg/ml,以2μg/ml的浓度包被96孔elisa板,每孔加入100μl,4℃过夜;pbst(0.05%吐温-20,pbs)洗涤5次,每次3min,然后用含3%脱脂奶粉的pbs缓冲液封闭,37℃孵育2h;pbst洗涤5次,每次3min,备用。
血清从200倍开始2倍梯度稀释,空白对照(blank)为pbs,阴性对照(negative)为阴性血清(未免疫小鼠血清)200倍稀释。每孔加100μl,37℃孵育2h,pbst洗涤5次,每次3min,再每孔加入100μl的hrp标记羊抗鼠igg抗体(1:5000稀释),37℃孵育1h;pbst洗涤5次,每次3min,tmb显色液100μl/孔,室温避光孵育15分钟后,用50μl的2m硫酸中止反应,检测采用双波长450nm/630nm。检测结果如表1所示,3#小鼠效价最高。
表1小鼠血清效价检测结果
3.杂交瘤细胞的制备与筛选
(1)制备融合细胞
取3#小鼠脾细胞与sp2/0细胞,采用peg法进行融合。融合完细胞用半固体培养基(含hat)进行筛选培养。挑10板×93个细胞单克隆,培养于96孔细胞培养板(预先用小鼠胸腺细胞铺板,100μl/孔)。
(2)杂交瘤细胞筛选
elisa法:用0.1m碳酸盐缓冲液(ph9.6)的包被液稀释“多肽-bsa”偶联蛋白,以1μg/ml的浓度包被96孔elisa板,每孔加入100μl,4℃过夜;pbst洗涤5次,每次3min,用含3%bsa的pbs缓冲液封闭,37℃孵育2h;pbst洗涤5次,每次3min;每个孔中加入100μl杂交瘤细胞培养上清,37℃2h,pbst洗涤5次,每次3min,再用1:5000稀释的hrp标记羊抗鼠igg抗体100μl/孔,37℃孵育1h;pbst洗涤5次,每次3min,tmb显色液100μl/孔,室温下15分钟后用2m硫酸中止反应,检测采用双波长450nm/630nm。
稳定分泌抗体的杂交瘤细胞株的筛选策略:采用elisa方法和免疫印迹法,用“多肽-bsa”偶联蛋白包板,做第一次筛选,得到阳性杂交瘤细胞株12株。将阳性细胞进行亚克隆,再用elisa方法,以“多肽-bsa”偶联蛋白包板,做第二次筛选,得到稳定分泌抗体的杂交瘤细胞株5株。最后再用免疫印迹法和“gst-ttc36”融合蛋白进行筛选。
实验结果见图3所示:编号为bp1-1、bp1-5、bp1-6、bp1-7、bp1-9的杂交瘤细胞株培养上清具有“ttc36(87-104aa)-bsa”多肽结合特异性,bp1-7结合力最高。
免疫印迹法:制备4-12%丙烯酰胺胶;gst-ttc36蛋白处理后,每个孔10μl/50ng,电泳参数为恒压60-120v,60min,然后转印到0.45μmpvdf膜,转印参数为恒流200ma,60min.然后用细胞上清作为一抗(1:4稀释)进行检测。
结果如图4所示,所有杂交瘤细胞分泌含抗体的上清均在46kda左右有特异性条带,与理论值相符,说明能与gst-ttc36蛋白特异结合。其中,bp1-7结合条带最深,说明bp1-7杂交瘤产出的抗体最多或者亲和力最强。
(3)单克隆抗体亚型鉴定
使用southernbiotech抗体分型试剂盒,将筛选出来的阳性细胞株产生的抗体进行亚型鉴定。结果如表2所示,其中bp1-7为igg2a,κ型。
表2抗体亚型检测结果
4.杂交瘤细胞的保藏
以上实验结果显示,杂交瘤细胞bp1-7产生的单克隆抗体特异性高,亲和力最好。2018年10月17日将该杂交瘤细胞株保藏于中国湖北省武汉市武汉大学的中国典型培养物保藏中心(cctcc),保藏号cctccno:c2018205,命名为杂交瘤细胞株bp1-7。
5.抗体制备与纯化
将bp1-7培养至对数期,用hanks液洗涤后悬起定量,每只鼠(balb/c雌性小鼠)腹腔注射5×105个细胞,打完腹水后,7-10天后取腹水。
用偶联缓冲液以1:3稀释小鼠腹水,12000rpm4℃离心10min,然后用0.22μm滤膜过滤,除去脂肪、细胞残渣及小颗粒物质。用5-10倍柱体积的相应偶联缓冲液平衡含有proteing琼脂糖胶粒(proteingagarose)的柱子。用注射器把过滤后的腹水注入柱子上端接口,收集流出液于50ml离心管中。用5倍柱体积的偶联缓冲液过柱冲洗;取中和液加入离心管;滴加洗脱液到1.0ml,混匀后检测ph值。根据结果调整中和液的量,使中和结果ph为7.0。用5倍柱体积洗脱缓冲液洗脱抗体,收集于离心管中,检测抗体浓度,将纯化的抗体浓度调节到1mg/ml标准,用于后续功能检测实验。
6.elisa检测效价
用2μg/ml“多肽-bsa偶联蛋白”,4℃包被过夜;2%脱脂牛奶37℃封闭2h;将纯化的抗体(1mg/ml)从200倍开始2倍梯度稀释,空白对照(blank)为pbs,阴性对照(negative)为培养基200倍稀释。效价判定:大于最大od二分之一的最小od读数所对应的最大稀释度。
每孔加100μl样品,37℃孵育2h,pbst洗涤5次,每次3min,再每孔加入100μl的hrp标记羊抗鼠igg抗体(1:5000稀释),37℃孵育1h;pbst洗涤5次,每次3min,tmb显色液100μl/孔,室温避光孵育15分钟后,用50μl的2m硫酸中止反应,采用双波长450/630nm检测。
结果如图5所示,bp1-7抗体效价能达到12800以上。
7.bp1-7抗体用于病理样品的免疫检测
以下检测方法既可用于病理样品的检测,也可用于样品的非诊断目的性检测。
(1)肝癌组织的免疫组化检测
取人肝癌与癌旁正常肝组织石蜡包埋块,5μm切片,加热法修复抗原,用4%的甲醛固定10min,然后滴加500ng/50μl纯化后的抗人ttc36抗体(稀释液为1%bsa的pbs),25℃室温孵育2h,然后用pbst洗5次,滴加hrp标记羊抗鼠igg抗体,室温孵育1h,然后he复染,于显微镜下观察。
结果如图6所示,bp1-7抗体检测到,肝脏中的ttc36蛋白,主要位于肝细胞的细胞质中,并且与癌旁组织相比,ttc36蛋白在肝癌组织中的表达明显下降。
(2)肝癌组织免疫印迹检测
肝癌组织免疫印迹(western-bloting)检测:制备4-12%丙烯酰胺胶,将肝癌组织和癌旁正常组织裂解,将组织裂解液用5×loadingbuffer处理后,每个胶孔上样200ng/10μl,电泳参数设置为恒压60-120v,60min,然后转印到0.45μmpvdf膜,转印参数设置为恒流200ma,60min,然后用纯化抗体作为一抗(1:2000稀释),β-actin作为内参,hrp标记羊抗鼠igg为二抗(1:2000稀释),进行检测。
结果如图7所示,与正常肝组织相比,肝癌组织的ttc36条带明显颜色更浅,说明bp1-7抗体能够有效检测到ttc36在肝癌组织表达明显下降。
由上述检测结果可知,ttc36可作为检测组织是否癌变的分子标志,并且,bp1-7抗体可有效并且特异地检测病理组织中ttc36蛋白。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
序列表
<110>深圳市龙华区人民医院
刘运洪
<120>免疫原性多肽以及抗ttc36抗体bp1-7及应用
<160>2
<170>siposequencelisting1.0
<210>1
<211>18
<212>prt
<213>人工序列(artificialsequence)
<400>1
alatyrasnasnargalaglnalaargargleuglnglyaspvalala
151015
glyala
<210>2
<211>567
<212>dna
<213>人工序列(artificialsequence)
<400>2
atgggcaccccgaatgaccaagcggttctgcaagcgattttcaacccggacaccccgttt60
ggcgatattgtgggcctggacctgggcgaggaagcggagaaagaggagcgtgaggaagat120
gaagtgttcccgcaggcgcaactggagcagagcaaagcgctggaactgcaaggtgttatg180
gcggcggaggcgggcgacctgagcaccgcgctggaacgttttggtcaggcgatctgcctg240
ctgccggagcgtgcgagcgcgtacaacaaccgtgcgcaggcgcgtcgtctgcaaggtgat300
gtggcgggtgcgctggaggacctggaacgtgcggttgaactgagcggtggccgtggtcgt360
gcggcgcgtcagagcttcgtgcaacgtggtctgctggcgcgtctgcagggtcgtgacgat420
gacgcgcgtcgtgatttcgagcgtgcggcgcgtctgggcagcccgtttgcgcgtcgtcaa480
ctggttctgctgaacccgtatgcggcgctgtgcaaccgtatgctggcggatatgatgggt540
caactgcgtcgcccgcgtgatagccgt567
- 还没有人留言评论。精彩留言会获得点赞!