多肽Ahf-caltide的新用途的制作方法
本发明属于医药生物技术领域,具体涉及一种多肽ahf-caltide的用途,即多肽ahf-caltide能够穿透多种哺乳动物细胞的细胞膜的用途。
背景技术:
生物膜作为天然的渗透屏障,对于活细胞的生存和功能是必不可少的。然而,这些天然屏障可能成为药物在细胞内能有效发挥作用的主要障碍。因此,有效跨越细胞膜的化合物是提高非透性药物治疗价值和靶向特异性的关键。近二十年来,通过引入多肽(cell-penetratingpeptides,cpps)或者蛋白质转导域(proteintransductiondomains,ptds),将多肽作为细胞内“货物”传递的新载体受到越来越多的关注,提高了细胞内传递的效率。cpps是一种具有多种结构和理化性质的多肽,他们有一些共同的特点:(1)它们都是含有5-30个氨基酸的短肽;(2)它们还具有跨越细胞膜的能力,这种能力不受dna、rna、反义核苷酸、质粒、脂质体、蛋白质、纳米颗粒等分子共价非共价结合的限制。cpps通常指一类小的阳离子肽,它们可以穿过许多哺乳动物细胞的质膜,具有跨细胞膜转运的能力,这些多肽在药物传递过程中的重要性在于它们能够将具有生物活性的大分子如蛋白质或寡核苷酸均匀转运到在标准培养条件下生长的哺乳动物的细胞群中,且对宿主细胞没有明显的毒副作用,可以作为核酸、蛋白质、sirna、治疗剂、纳米颗粒等多种“货物”的合适载体。
根据cpps的来源,可以分为三大类:(1)生物产生的天然肽;(2)嵌合肽,它们是修饰的天然蛋白质;(3)实验室完全设计和合成的合成肽,基于他们的物理化学性质,cpps还可以分为如下三组:(1)长度为6-12个氨基酸的阳离子肽,主要由精氨酸、赖氨酸和/或鸟氨酸残基组成;(2)疏水性肽,如分泌生长因子或细胞因子的前导序列;(3)将疏水肽与核定位信号连接得到的两亲性肽。迄今为止,cpps的数量众多,已被广泛应用于多种领域,如将化疗药物或生物制剂用于靶向肿瘤、改善病毒感染、增强非病毒介导的基因传递、向细胞系传递小干扰rna、体内成像法等。由于cpps具有较低的细胞毒性和免疫原性,已应用于体外或体内实验并取得了良好的效果。cpps已经成为提高细胞内传递效率的潜在工具,但它可能引起由于膜通透性的变化而导致的细胞质纰漏以及由与两亲性cpps相互作用而导致的膜蛋白功能障碍的异常,与传统的人类免疫缺陷病毒(humanimmunodeficiencyvirus,hiv)-i的转录活化因子(transcriptionalactivator,tat)穿膜肽hivtat49-57序列rkkrrqrrr相比,我们的穿膜肽来自于哺乳动物细胞内源性蛋白质的一部分序列,未诱导任何毒性且能进入多种细胞如肿瘤细胞、大鼠心肌细胞等,在多种疾病治疗中有更为潜在的应用。
本发明涉及的多肽ahf-caltide是由3glu、1gly、3lys、2pro、1his、1thr这11个氨基酸组成的,其序列为egkpkehtepk,分子量为1279.43,其中碱性氨基酸为4个,占整个多肽的36.36%。本人通过研究证实了,多肽ahf-caltide对多种哺乳动物细胞的细胞膜的穿透作用。目前,关于多肽ahf-caltide能够穿透多种哺乳动物细胞的细胞膜的用途并未见报道。
技术实现要素:
本发明的目的在于提供一种多肽ahf-caltide,其具有细胞膜穿透能力。
本发明所述多肽由3glu、1gly、3lys、2pro、1his、1thr组成的,序列为egkpkehtepk(seqid1),分子量为1279.43。
一种多肽ahf-caltide具有穿透细胞膜的功能,能够携带蛋白等跨膜进入体外多种细胞内,是一种极具开发前景的蛋白、核酸等生物活性分子的跨膜运输载体。
本发明还提供了所述多肽ahf-caltide可用作药物运输载体的用途或在制备药物运输载体中的应用,特别是用作细胞内药物运输载体的应用,其中所述药物运输载体携带生物活性分子跨膜进入细胞。
其中,所述多肽ahf-caltide对细胞无毒性。
其中,所述细胞为心肌细胞、胰腺癌细胞、肺腺癌细胞、结肠癌细胞或人源神经母细胞瘤细胞。
其中,所述生物活性分子可以是dna、sirna、核酸、蛋白质、治疗剂、纳米颗粒。
本发明还提供了包含药物运输载体的复合物,其特征在于所述药物运输载体为所述的多肽ahf-caltide。所述复合物适合用于生产药物、保健品、美容或护肤品原料、转染试剂或诊断试剂。
本发明还提供了包含药物运输载体的细胞内药物,其特征在于所述药物运输载体为所述的多肽ahf-caltide。
其中,实验过程中用到的细胞如下:原代培养的新生大鼠心肌细胞,成年大鼠h9c2肌细胞系(来源:中国科学院上海细胞库),人正常胰腺导管上皮细胞hpde6-c7(来源:中国科学院上海细胞库),人胰腺癌细胞panc-1(来源:中国科学院上海细胞库)、miapaca-2(来源:北京协和医学院)、sw1990(来源:中国科学院上海细胞库),人肺腺癌细胞h441(来源:中国科学院上海细胞库),人结肠癌细胞hct116(来源:中国科学院典型培养物保藏委员会细胞库),人源神经母细胞瘤细胞系sh-sy5y(来源:中国科学院上海细胞库)。
与现有的穿膜肽相比,本发明具有如下技术优点:
(1)本发明的多肽ahf-caltide具有分子量小,易于人工合成,易于进入多种细胞,无细胞毒性,是一种安全、高效、理想的穿膜肽。
(2)本发明的多肽ahf-caltide可作为工具细胞发挥携带药物、治疗基因、蛋白、生物大分子等作用,能应用于各种不同的领域,大大推进了分子生物学、细胞生物学、药学等的发展,具有非常好的应用前景。
为了便于理解,以下将通过具体的附图和实例对本发明多肽ahf-caltide的穿膜作用进行详细的描述。需要特别指出的是,具体实例和附图仅是为了说明,显然本领域的普通技术人员可以根据文本说明,在本发明的范围内对本发明做出各种各样的修正和改变,这些修正和改变也纳入本发明的范围内。
附图说明
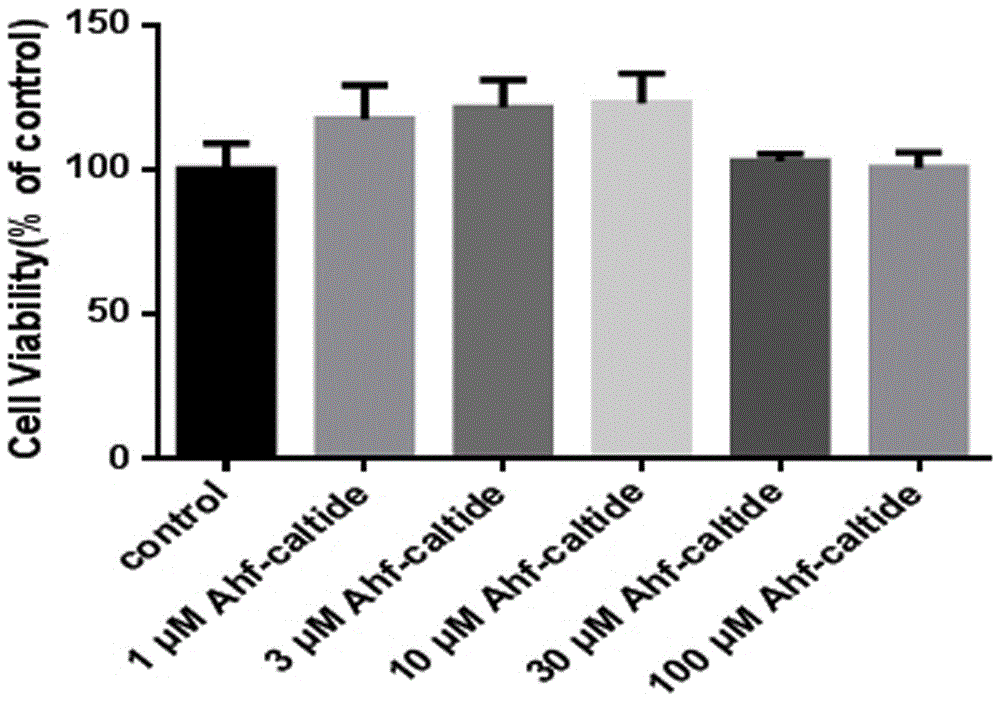
图1是ahf-caltide不同浓度均不具有细胞毒性图。
图2是ahf-caltide多肽进入原代心肌细胞的荧光图。
图3是不同浓度的ahf-caltide多肽处理h9c2细胞24h后的荧光图。
图4是10µmahf-caltide多肽加入到h9c2细胞的不同时间点的荧光图。
图5是20µmahf-caltide多肽进入人正常胰腺导管上皮细胞24h后的荧光图。
图6是20µmahf-caltide多肽进入三种不同人胰腺癌细胞24h后的荧光图。
图7是10µmahf-caltide多肽进入人肺腺癌细胞24h后的荧光图。
图8是10µmahf-caltide多肽进入人结肠癌细胞24h后的荧光图。
图9是10µmahf-caltide多肽进入人源神经母细胞瘤细胞24h后的荧光图。
图10是10µmahf-caltide多肽加入到不同浓度异丙肾上腺素(isoproterenol,iso)处理的h9c2细胞24h后的荧光图。
图11是携带罗丹明的ahf-caltide多肽的高效液相色谱图(highperformanceliquidchromatography,hplc)。
图12是携带罗丹明ahf-caltide多肽的质谱图(massspectrum,ms)。
具体实施方式
通过以下详细说明结合附图可以进一步阐述本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
实施例1。
细胞培养:
原代心肌细胞的培养:取出生一周以内的新生大鼠的心脏于装有少量培养基(iscove'smodifieddulbecco'smedium,imdm)的50ml离心管中,剪碎心脏后待组织沉淀下来后弃去上清,先用胰酶洗去血液,洗2次,再用胰酶消化收集上清并加入等体积的完全培养基终止消化,重复5-6次,过滤并离心,弃去上清液,用含有20%的胎牛血清(fetalbovineserum,fbs)的imdm重悬细胞并接种于大皿,置于37℃、5%co2的孵箱中培养,待细胞状态良好时,用胰酶消化后接种于24孔板中,每孔加入1ml细胞悬液,置于37℃、5%co2的孵箱中继续培养,以备使用。
其他种类的细胞培养:h9c2用含有10%fbs和1%青霉素链霉素(penicillin/streptomycin,p/s)的培养基(dulbecco'smodifiedeaglemedium,dmem),人胰腺癌细胞panc-1、人胰腺癌细胞miapaca-2、人胰腺癌细胞sw1990、人肺腺癌细胞h441、人正常胰腺导管上皮细胞hpde6-c7都用含有10%fbs和1%p/s的培养基(roswellparkmemorialinstitute,rpmi-1640),将这些细胞置于37℃、5%co2的孵箱中培养,以备使用。
细胞活性检测:
待h9c2细胞状态良好时,用胰酶消化后接种于96孔板中,每孔加入100µl的细胞悬液,置于37℃、5%co2的孵箱中继续培养,待细胞贴壁并长至80%-90%时,弃去培养液,并换成无血清的培养液,同时加入ahf-caltide多肽(终浓度分别为1µm、10µm、30µm、100µm),置于孵箱中继续培养24h后加入10µlcck-8溶液(货号:k1018;厂家:apexbio),再置于孵箱中培养1h,用酶标仪测量450nm处的吸光度。结果如附图1所示,1~100µm浓度的ahf-caltide多肽对h9c2细胞无毒性作用。
荧光检测:
由上海吉尔多肽有限公司制备连接有rodamine的ahf-caltide多肽,当细胞贴壁并长至80%-90%时,弃去培养液并换成无血清的培养液后,根据实验加入相应的多肽并放入孵箱继续培养一定的时间,细胞核用hoechst33342染色液染色(货号:c0030;厂家:solarbio),再放入孵箱中培养20-30min,弃去染色液,用磷酸缓冲盐溶液(phosphatebuffersaline,pbs)洗涤2-3次,使用荧光显微镜(olympusth4-200)进行荧光检测。
原代心肌细胞:待细胞贴壁并长至80%-90%时,弃去培养液,并换成无血清的培养液,加入100µm的rodamine-ahf-caltide多肽,24h后弃去培养液,加入250µl的hoechst33342染色液,避光孵育30min后,于荧光显微镜下观察。结果如附图2所示,100µmahf-caltide在作用24h后都能够穿透细胞膜进入h9c2细胞内,并且均匀分布在胞浆中。
h9c2细胞:待h9c2细胞状态良好时,用胰酶消化后接种于24孔板中,每孔加入1ml细胞悬液,置于37℃、5%co2的孵箱中继续培养,待细胞贴壁并长至80%-90%时,弃去培养液,并换成无血清的培养液,同时加入不同浓度的多肽rodamine-ahf-caltide(终浓度为0.1µm、1µm、10µm、100µm),24h后弃去培养液,加入250µl的hoechst33342染色液,结果见附图3所示,不同浓度的ahf-caltide在作用24h后都能够穿透细胞膜进入h9c2细胞内,并且均匀分布在胞浆中,随着ahf-caltide浓度的增加,ahf-caltide进入到细胞的荧光量也逐渐增强,证明ahf-caltide能够穿透细胞膜进入到h9c2细胞,且具有浓度依赖性,浓度越大,穿透效率越高,更有利于其携带相关治疗药物进入细胞,从而促进细胞的增值和修复,有利于细胞血管的生成,发挥其生物学特性,起到明显的治疗作用。
ahf-caltide多肽对h9c2细胞时间依赖性作用:待h9c2细胞生长状态良好时,用胰酶消化后接种于24孔板中,每孔加入1ml的细胞悬液,置于37℃、5%co2的孵箱中继续培养,待细胞贴壁并长至80%-90%时,弃去培养液,并换成无血清的培养液,从6h开始依次根据相应的时间(6h,12h,18h,24h,48h)加入终浓度均为10µm的ahf-caltide多肽,加好多肽后置于孵箱中继续培养,48h后弃去培养液,加入250µl的hoechst33342染色液进行上述的荧光实验,结果见附图4所示,10µm的ahf-caltide多肽在不同的作用时间点都能穿透细胞膜进入到h9c2细胞,并且均匀分布在胞浆中,只是作用时间为6h时,ahf-caltide穿透细胞膜进入到胞浆的能力相对较弱,随着作用时间的延长,穿透细胞膜进入到细胞内的ahf-caltide的量也越多,说明穿膜能力越强,具有明显的时间依赖性。细胞内加入多肽24小时和48小时的荧光强度接近,说明24小时ahf-caltide多肽穿膜基本达到饱和。
人正常胰腺导管上皮细胞:待hpde6-c7细胞生长状态良好时,用胰酶消化后接种于24孔板中,每孔加入500µl的细胞悬液,置于37℃、5%co2的孵箱中继续培养,待细胞贴壁并长至80%-90%时,弃去培养液,并换成无血清的培养液,加入终浓度均为20µm的ahf-caltide多肽,置于孵箱中继续培养,24h后弃去培养液,加入250µl的hoechst33342染色液进行上述的荧光实验,结果见附图5所示,20µm的ahf-caltide作用24h后都能够穿透细胞膜进入到hpde6-c7细胞,有意思的是,这种人正常胰腺导管上皮细胞的荧光图与h9c2细胞的荧光图略有不同,穿过细胞膜进入到细胞的ahf-caltide集中聚集在细胞核的一侧,更有利于其携带治疗胰腺癌的生物大分子药物进入细胞,从而改善药物在局部或者全身传递后进入细胞的情况,达到治疗癌症或者炎性疾病的目的。
多种人胰腺癌细胞:待panc-1细胞、miapaca-2细胞和sw1990细胞生长状态良好时,用胰酶消化后接种于24孔板中,每孔加入500µl的细胞悬液,置于37℃、5%co2的孵箱中继续培养,待细胞贴壁并长至80%-90%时,弃去培养液,并换成无血清的培养液,加入终浓度均为20µm的ahf-caltide多肽,置于孵箱中继续培养,24h后弃去培养液,加入250µl的hoechst33342染色液进行上述的荧光实验,结果见附图6所示,20µm的ahf-caltide作用于几种人胰腺癌细胞24h后都能够穿透细胞膜进入到各种胰腺癌细胞中,与hpde6-c7细胞相同的是,穿过细胞膜进入到这三种人胰腺癌细胞的ahf-caltide也集中聚集在细胞核的一侧,特别是miapaca-2细胞,其荧光图很清晰明显,更有利于其携带治疗胰腺癌的药物进入细胞,提高其递送效率,从而特异性地到达癌细胞并递送抗癌药物的活性分子,实现促进细胞的修复,达到治疗疾病的目的。
人肺腺癌细胞:待h441细胞生长状态良好时,用胰酶消化后接种于24孔板中,每孔加入1ml的细胞悬液,置于37℃、5%co2的孵箱中继续培养,待细胞贴壁并长至80%-90%时,弃去培养液,并换成无血清的培养液,加入终浓度均为10µm的ahf-caltide多肽,置于孵箱中继续培养,24h后弃去培养液,加入250µl的hoechst33342染色液进行上述的荧光实验,结果见附图7所示,10µm的ahf-caltide作用24h后也能够穿透细胞膜进入到h441细胞,与上述观察到的人胰腺癌的荧光图类似,也是聚集在细胞核的一侧,从荧光图的结果来看,ahf-caltide进入到h441细胞的几率几乎为100%,更加有利于其将携带治疗肺腺癌的“货物”高效地运入进入细胞中,促进了它们的融合,细胞状况得以改善,,从而达到治疗肺癌的目的。
人结肠癌细胞:待hct116细胞生长状态良好时,用胰酶消化后接种于24孔板中,每孔加入1ml的细胞悬液,置于37℃、5%co2的孵箱中继续培养,待细胞贴壁并长至80%-90%时,弃去培养液,并换成无血清的培养液,加入终浓度均为10µm的ahf-caltide多肽,置于孵箱中继续培养,24h后弃去培养液,加入250µl的hoechst33342染色液进行上述的荧光实验,结果见附图8所示,10µm的ahf-caltide作用24h后也能够穿透细胞膜进入到hct116细胞,有利于其携带治疗结肠癌的生物大分子或者蛋白质等进入细胞,有利于发挥其治疗作用,突出了此穿膜肽在结肠癌治疗方面的独特潜力。
人源神经母细胞瘤细胞:待sh-sy5y细胞生长状态良好时,用胰酶消化后接种于24孔板中,每孔加入1ml的细胞悬液,置于37℃、5%co2的孵箱中继续培养,待细胞贴壁并长至80%-90%时,弃去培养液,并换成无血清的培养液,加入终浓度均为10µm的ahf-caltide多肽,置于孵箱中继续培养,24h后弃去培养液,加入250µl的hoechst33342染色液进行上述的荧光实验,结果见附图9所示,10µm的ahf-caltide作用24h后也能够穿透细胞膜进入到sh-sy5y细胞,且均匀分布在胞浆中,有利于其携带治疗瘤的药物等进入细胞,促进了细胞的增值与修复,让药物发挥其应有的治疗作用,体现出了此穿膜肽的独特作用,为治疗各种疾病提供了一种新方法。
ahf-caltide对iso诱导损伤的h9c2细胞作用:待h9c2细胞生长状态良好时,用胰酶消化后接种于24孔板中,每孔加入1ml的细胞悬液,置于37℃、5%co2的孵箱中继续培养,待细胞贴壁并长至80%-90%时,弃去培养液,并换成无血清的培养液,先加入终浓度均为10µm的ahf-caltide多肽,置于孵箱中继续培养半小时后,再加入相应浓度的iso(终浓度为3µm、10µm、30µm、100µm、300µm),24h后弃去培养液,加入250µl的hoechst33342染色液进行上述的荧光实验,结果见附图10所示,10µm的ahf-caltide在用不同浓度的iso处理24h后都能够穿透细胞膜进入到h9c2细胞内,并且均匀分布在胞浆中,随着iso浓度的增加,ahf-caltide进入到细胞的荧光量也逐渐减弱,提示即使受损的心肌细胞,我们的穿膜肽仍能穿过细胞膜进入细胞内,只是当细胞损伤严重的情况下,如100µm的iso处理组,进入细胞内多肽亦相应减少,这也与心血管疾病的病理生理学特征相符。
另一方面,从附图2到附图10可以看出,在荧光显微镜下能观察得到多肽ahf-caltide在细胞中的位置,这表明我们的多肽ahf-caltide是可以携带rodamine分子进入细胞,为我们的多肽ahf-caltide携带蛋白质、核酸、纳米颗粒、sirna、大分子药物等生物活性分子提供了可靠的依据。
色谱条件:
色谱柱:4.6×250mm,venusilmpc18-5;流动相为溶剂a:100%乙腈中的0.1%三氟乙酸溶液和溶剂b:100%水中的0.1%三氟乙酸溶液,梯度洗脱(0.01min,30%a,70%b;25min,55%a,45%b;25.1min,100%a,0%b;30min,stop),流速:1ml/min,检测波长:220nm,进样量:5µl。在该条件下,ahf-caltide的待测成分的色谱峰分离得比较好,如附图11所示,在时间为3-4min有一个小峰可忽略不计,而在11-12min时,有一个很大的色谱峰,我们对此峰进行了分析发现即为我们的ahf-caltide多肽,由此可以说明我们的ahf-caltide多肽纯度较高。
质谱条件:
离子源:电喷雾离子源(esi源);毛细管电压:3.00kv;锥孔电压:50v;萃取锥孔电压:5v;脱溶剂温度:350;锥孔气流速度:350;检测模式:正离子模式监测;扫描方式:es+。在该条件下我们对ahf-caltide多肽进行质谱分析结果见附图12所示,在母离子m/z400-1900区间,共出现了多个多肽峰,但在m/z853.09([m+2h]2+)的特征离子峰多且强度较高,于是我们对其进行定性定量分析,确定其相对分子质量为1704.1。
ahf-caltide作为一种穿膜肽,能用于携带多种“货物”,如蛋白质、核酸、纳米颗粒、sirna、大分子药物等生物活性分子的跨膜运输,使得这些生物活性分子能够进入细胞内发挥相应的治疗作用。同时,ahf-caltide不受分子共价与非共价结合的限制,能够应用于多种领域,是治疗多种疾病的一种潜在的有效工具。
sequencelisting
<110>中国医科大学
<120>多肽ahf-caltide的新用途
<130>1
<160>1
<170>patentinversion3.3
<210>1
<211>11
<212>prt
<213>未知
<400>1
gluglylysprolysgluhisthrgluprolys
1510
- 还没有人留言评论。精彩留言会获得点赞!