一种抗肿瘤的多肽及其应用的制作方法
本发明实施例涉及生物技术领域,具体涉及一种抗肿瘤的多肽及其应用。
背景技术:
wnt/β-连环蛋白(β-catenin,β-cat)途径是wnt途径中的一种,该途径会导致β-连环蛋白在细胞质中积累并最终会作为属于tcf的转录因子的转录共激活因子/lef家族易位至细胞核。没有wnt,β-连环蛋白不会在细胞质中积累,因为有一种破坏复合物通常会降解它。该破坏复合物包括以下蛋白质:axin,腺瘤病大肠杆菌(apc),蛋白磷酸酶2a(pp2a),糖原合成酶激酶3(gsk3)和酪蛋白激酶1α(ck1α)。它通过将β-连环蛋白靶向泛素化而降解β-连环蛋白,随后将其送至蛋白酶体进行消化。
wnt/β-连环蛋白途径在癌症发生和发展中起关键作用。研究表明wnt/β-cat在逃避免疫监视方面的新兴作用。因此,在肿瘤治疗中靶向该途径具有很好的治疗前景。然而,迄今为止测试的大多数wnt抑制剂具有有限的功效或产生显着的不良副作用。
除了靶向治疗之外,目前还有免疫检查点抑制剂,用于癌症治疗;然而,虽然一小部分患者对免疫疗法表现出前所未有的持久反应,但大多数患者没有反应。
技术实现要素:
为此,本发明实施例提供一种抗肿瘤的多肽,以解决现有技术中wnt抑制剂具有有限的功效和不良副作用,以及现有免疫疗法适应患者不响应的问题。
为了实现上述目的,本发明实施例提供如下技术方案:
根据本发明实施例的第一方面提供一种抗肿瘤的多肽,所述多肽的氨基酸序列如seqidno:1所示,或该序列经替换、缺失或添加一个或几个氨基酸形成的具有同等功能的氨基酸序列。
在本发明中对所述多肽的制备方法不做严格限制,例如,可以通过人工合成的方法制备得到。
根据本发明实施例的第二方面提供一种多肽抑制剂,所述多肽抑制剂包括所述的多肽。
根据本发明实施例第三方面提供一种所述多肽抑制剂在抑制wnt/β-cat途径中的应用。
根据本发明实施例第四方面提供一种所述多肽或所述多肽抑制剂在制备wnt/β-cat途径依赖性肿瘤药物中的应用。
进一步地,所述肿瘤为结直肠癌、乳腺癌、肺癌、黑色素瘤或肝癌。
根据本发明实施例第五方面提供一种抗肿瘤药物,所述抗肿瘤药物包括所述多肽或所述多肽抑制剂。
根据本发明实施例第六方面提供一种所述抗肿瘤药物和pd-1抗体药物联用在制备治疗wnt/β-cat依赖性肿瘤药物中的应用。
进一步地,所述肿瘤为结直肠癌、乳腺癌、肺癌、黑色素瘤或肝癌。
本发明实施例具有如下优点:
本发明提供的多肽能够强有力地抑制β-cat的转录活性并抑制癌细胞的生长,并通过减少调节性t细胞(treg)和增加cd103+树突细胞来促进细胞毒性t细胞的肿瘤内浸润,从而使癌细胞对免疫检查点抑制剂敏感。
本发明提供的多肽还能够增加树突状细胞(dc)浸润,并增加结肠癌模型中活性cd8+t细胞,提高抗肿瘤的效果。
附图说明
为了更清楚地说明本发明的实施方式或现有技术中的技术方案,下面将对实施方式或现有技术描述中所需要使用的附图作简单地介绍。显而易见地,下面描述中的附图仅仅是示例性的,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图引伸获得其它的实施附图。
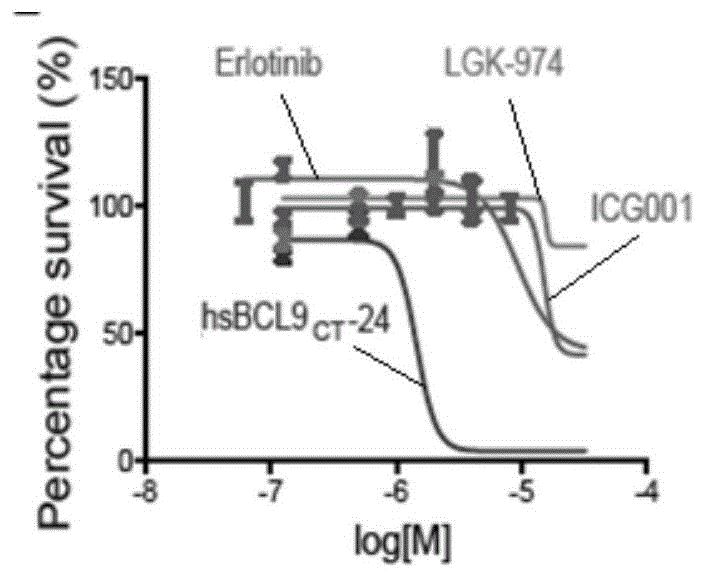
图1为本发明实验例1中不同浓度的多肽、icg-001、lgk-974和厄洛替尼与colo320dm细胞存活率的关系图;
图2为本发明实验例1中不同浓度的5-fu,5-fu和多肽与colo320dm细胞存活率的关系图;
图3为本发明实验例1中多肽对不同肿瘤细胞株的增殖统计图;
图4为本发明实验例2中多肽处理荷瘤小鼠不同天数肿瘤体积变化图;
图5为本发明实验例3中多肽对treg细胞在ct26肿瘤内浸润的影响;
图6为本发明实验例3中多肽对treg细胞在llc1肿瘤内浸润的影响;
图7为本发明实验例3中多肽对treg细胞在4t1肿瘤内浸润的影响;
图8为本发明实验例4中与多肽预处理的ct26细胞共培养的treg细胞的迁移情况;
图9为本发明实验例4中与用靶向β-cat的对照非靶向(nt)shrna或shrna转导的ct26细胞共培养的treg细胞的迁移情况;
图10为本发明实验例4中多肽对ct26细胞中ccl20、ccl22和tgf-β的mrna表达的影响;
图11为本发明实验例4中靶向β-cat的对照非靶向(nt)shrna或shrna转导的ct26细胞中ccl22、ctnnb1、tgf-β的mrna表达水平;
图12为本发明实验例5中多肽处理和未处理的小鼠肿瘤组织中的cd103+树突状细胞所占比例;
图13为本发明实验例5中、野生型、ct26-nt和ct26-shrna的小鼠肿瘤组织中的cd103+树突状细胞所占比例;
图14为本发明实验例5中多肽组和对照组的小鼠模型肿瘤组织中的cd8+/cd45+的表达情况;
图15为本发明实验例5中多肽组和对照组的小鼠模型肿瘤组织中的cd8+/treg的表达情况;
图16为本发明实验例5中多肽组和对照组的小鼠模型肿瘤组织中的granzymeb+cd8+的表达情况;
图17为本发明实验例5中野生型、ct26-nt和ct26-shrna的小鼠模型肿瘤组织中的granzymeb+cd8+的表达情况;
图18为本发明实验例5中多肽组和对照组的小鼠模型肿瘤组织中的效应性cd8+的表达情况;
图19为本发明实验例5中野生型、ct26-nt和ct26-shrna的小鼠模型肿瘤组织中的效应性cd8+的表达情况;
图20为本发明实验例5中多肽对ct26细胞中ccl4的mrna表达水平的影响;
图21为本发明实验例5中靶向β-cat的对照非靶向(nt)shrna或shrna转导的ct26细胞中ccl4的mrna表达水平;
图22为本发明实验例6中不同药物处理llc1模型肿瘤体积变化图;
图23为本发明实验例6中不同药物处理4t1模型肿瘤体积变化图。
图中:*为p<0.5;**为p<0.01;***为p<0.001。
具体实施方式
以下由特定的具体实施例说明本发明的实施方式,熟悉此技术的人士可由本说明书所揭露的内容轻易地了解本发明的其他优点及功效,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明实施例为一种抗肿瘤多肽,该抗肿瘤多肽的氨基酸序列如seqidno.1所示,共由12个氨基酸组成,具体为:leuglnthrleuargxaaileglnargxaaleuala,其中,xaa为任意氨基酸,第12位丙氨酸为2-萘基丙氨酸(2-naphthylalanine);
在本发明的其他实施例中,本发明提供的多肽是如seqidno.1所示氨基酸序列经替换、缺失或添加一个或几个氨基酸形成的具有同等功能的氨基酸序列。
上述多肽用常规的fmoc方法合成(meienhoferj.hormonalproteinsandpeptides.academicpress,newyork.1973.schroderg.lupkek.thepeptides.acacemicpress,newyork.1965.)。
本发明又一实施例提供一种多肽抑制剂,该抑制剂包括上述的多肽。
本发明提实施例还提供一种上述多肽抑制剂在抑制wnt/β-cat途径中的应用。
本发明实施例还提供一种利用上述多肽或多肽抑制剂在制备wnt/β-cat依赖性肿瘤药物中的应用。特别是针对wnt/β-cat依赖性的结直肠癌、乳腺癌、肺癌、黑色素瘤或肝癌药物中的应用。
本发明实施例还提供一种抗肿瘤药物,该抗肿瘤药物包括上述的多肽多肽抑制剂。
本发明实施例还提供一种上述抗肿瘤药物和pd-1抗体药物联用在制备治疗wnt/β-cat依赖性肿瘤药物中的应用;特别是针对wnt/β-cat依赖性的结直肠癌、乳腺癌、肺癌、黑色素瘤或肝癌。
实验例1
一、采用brdu法(brduelisa试剂盒购自roche)检测不同浓度的氨基酸序列如seqidno.1所示的多肽(hsbcl9ct-24)、icg-001、lgk-974和厄洛替尼分别对colo320dm细胞增殖和细胞活力的影响:hsbcl9ct-24由anaspec公司合成;
实验材料:
选取colo320dm人结肠癌肿瘤细胞株,来源americantypeculturecollection(atcc);dmem培养基(购自hyclone);10%胎牛血清(购自gibco);
实验方法:
配置溶液:brdulabellingsolution用opti-mem按1:100比例稀释;workingsolution为anti-brdu-pod用antibodydilutionsolution按1:100比例稀释;washingsolution用ddh2o按1:10比例稀释;
(1)将colo320dm细胞接种到培养皿中,待培养皿中的colo320dm细胞长到80%以上,加入2ml胰酶(购自sigma公司)消化,放置在37℃,5%二氧化碳培养箱培养,1min后在显微镜下观察细胞消化完成,加入2ml培养基终止消化后以1100rpm/min离心5min;离心后弃上清液,加入培养基轻轻吹打,使细胞均匀地分散在培养基中;并用细胞计数器计算细胞个数,并添加培养基调整细胞浓度至5×104ml-1;
(2)取细胞悬液铺板,每个孔加入100μl,每孔细胞数目5000个,其中有三孔只添加培养基不加细胞作为空白组,然后放置在37℃,5%二氧化碳培养箱孵育18小时;孵育结束后,用2%血清培养基分别配置不同浓度的hsbcl9ct-24、icg-001、lgk-974和厄洛替尼,加入96孔板,与细胞孵育24小时;反应结束后,将现配置的brdu溶液避光加入96孔板中,每孔各加10μl,放入细胞培养箱孵育24小时;孵育结束后将96孔板以300g/min离心10min,并完全弃掉上清;每孔加入200μlfixdenat,20℃避光静置30分钟;弃掉上清并每孔加入100μlanti-brdu-podworkingsolution,20℃避光静置90分钟;弃掉上清,每孔各加入200μlwashsolution洗涤三遍;弃掉上清,每孔各加入100μlsubstratesolution,20℃反应20min,用酶标仪检测在370、492nm的od值;通过od值分别计算各实验组细胞存活率,计算结果如图1所示;
由图1可知,本发明hsbcl9ct-24在抑制colo320dm的细胞生长方面比icg-001、lgk-974和厄洛替尼片有效12倍。
二、按照本实验例(一)的方法检测不同浓度5-氟尿嘧啶(5-fu)与2μmhsbcl9ct-24混合物和单独5-fu分别对colo320dm细胞增殖和细胞活力的影响:检测结果如图2所示:
由图2可知,本发明提供的hsbcl9ct-24能够使结肠癌细胞对5-fu处理敏感。
三、按照本实验例(一)的方法检测浓度为8μmhsbcl9ct-24分别对colo320dm、ls174t、hct116d、sw48人结肠癌肿瘤细胞株,以及mcf-7、mda231人乳腺癌细胞株的细胞增殖和细胞活力的影响,其中,各细胞株来源于americantypeculturecollection(atcc):检测结果如图3所示;
由图3可知,本发明hsbcl9ct-24能够抑制wnt/β-cat依赖性细胞系sw48、colo320dm和mda231的生长,然而并不能抑制wnt/β-cat非依赖性细胞系mcf-7、hct116d和ls174t的生长。
实验例2
肿瘤细胞培养:
选取ct26细胞(来源americantypeculturecollection),按照atcc说明培养细胞(相应培养基+10%fbs+1%双抗),置于37℃,5%二氧化碳培养箱培养;
消化细胞:待培养皿中的细胞密度达到80%以上,加入2ml胰酶(购自sigma公司)消化,放在37℃,5%二氧化碳培养箱培养,1min后在显微镜下观察细胞消化完成,加入2ml培养基终止消化并离心,离心转速、时间分别为1100rpm/min,5min;弃掉上清液,加入灭菌过滤(0.22μm的滤膜过滤)后的pbs轻轻吹打,使细胞均匀地分散在pbs中;用细胞计数器计算细胞个数,并添加pbs调整细胞浓度至4×106ml-1;
小鼠异位皮下种瘤:订购4-6周龄的雌性balb/c小鼠(体重为18-20g),在小鼠右侧腹背用剃毛器或脱毛膏脱毛,每只小鼠种瘤体积为100μl;
选取hsbcl9ct-24,采用2.5%dmso和5%葡萄糖溶液配置工作浓度为5mg/ml;
小鼠种瘤后随时观察是否成瘤,待移植肿瘤肉眼可见,用电子游标卡尺测量肿瘤长度以及宽度并计算其体积(肿瘤体积=(长度*宽度*宽度/2),体积达到30mm3进行分组,分为两组,一组为对照,一组为hsbcl9ct-24处理,每组小鼠为8只;分组后进行小鼠体重称量,并根据体重计算腹腔注射体积,注射剂量为25mg/kg,注射方式为腹腔注射,hsbcl9ct-24处理组注射浓度为5mg/ml的hsbcl9ct-24溶液,对照组注射等量的不含hsbcl9ct-24的溶液,每天一次,测量方式为每天测量,连续测量7天;测量结果如图4所示;
由图4可知,hsbcl9ct-24能够阻断balb/c小鼠中ct26的肿瘤形成,说明hsbcl9ct-24能够抑制肿瘤细胞的生长。
实验例3
一、hsbcl9ct-24对treg细胞在肿瘤内浸润的影响:
肿瘤细胞培养:
选取ct26细胞(来源americantypeculturecollection),按照atcc说明培养细胞(相应培养基+10%fbs+1%双抗),置于37℃,5%二氧化碳培养箱培养;
消化细胞:待培养皿中的细胞密度达到80%以上,加入2ml胰酶(购自sigma公司)消化,放在37℃,5%二氧化碳培养箱培养,1min后在显微镜下观察细胞消化完成,加入2ml培养基终止消化并离心,离心转速、时间分别为1100rpm/min,5min;弃掉上清液,加入灭菌过滤(0.22μm的滤膜过滤)后的pbs轻轻吹打,使细胞均匀地分散在pbs中;用细胞计数器计算细胞个数,并添加pbs调整细胞浓度至4×106ml-1;
小鼠异位皮下种瘤:订购4-6周龄的雌性balb/c小鼠(体重为18-20g),在小鼠右侧腹背用剃毛器或脱毛膏脱毛,每只小鼠种瘤体积为100μl;
选取hsbcl9ct-24(由anaspec公司合成),采用2.5%dmso和5%葡萄糖溶液配置工作浓度为5mg/ml;
小鼠种瘤后随时观察是否成瘤,待移植肿瘤肉眼可见,用电子游标卡尺测量肿瘤长度以及宽度并计算其体积(肿瘤体积=(长度*宽度*宽度/2),体积达到30mm3进行分组,分为两组,一组为对照,一组为hsbcl9ct-24处理,每组小鼠为8只;分组后进行小鼠体重称量,并根据体重计算腹腔注射体积,注射剂量为20mg/kg,注射方式为腹腔注射,hsbcl9ct-24处理组注射浓度为5mg/ml的hsbcl9ct-24溶液,对照组注射等量的不含hsbcl9ct-24的溶液,每天一次;
待给药两周后分离肿瘤组织并用手工研磨的方法分离细胞悬液,在4℃下,以2000rpm离心15min;弃上清并在细胞沉淀中加入3倍体积的红细胞裂解液(购自碧云天)冰上裂红4分钟;4℃离心后得到的细胞沉淀,再用pbs重悬,以2000rpm离心15min,每个样本体积为100μl,细胞数为1×106;
染表面抗原:在样本中分别加入所需的流式抗体;所对应的流式抗体为:cd45-percp-cyanine5.5(购自ebioscience)、cd4-fitc(购自ebioscience)、cd25-pe(购自biolegend);4℃染色30min,每10min混匀,表面染色结束后,每个样本加入200μl1xpermeabilizationbuffer(购自ebioscience)于4℃下,以8000rpm离心5min,反复操作清洗表面染料3次;
破膜采用intracellularfixation&permeabilizationbufferset(购自ebioscience),每个样本各加入试剂盒中破膜液100μl,常温避光孵育30min,每隔10min震荡混匀;加入1ml的pbs清洗染料,在4℃下,以8000rpm离心5min;重复上述操作3次;
foxp3染色:加入100μlpbs重悬细胞,并加入所需流式抗体foxp3-apc(购自ebioscience);4℃避光孵育30min,每隔10min震荡混匀;加入1ml的pbs清洗染料,在4℃下,以8000rpm离心5min;重复上述操作3次;加入200μlpbs重悬细胞并进行上机检测;
首先选择所有细胞中的活细胞,然后选出其中的cd45+cd4+阳性细胞,从该双阳细胞中再选择cd25+foxp3+阳性细胞;各自计算其treg/cd45+的比例,计算结果如图5所示;
由图5可知,本发明hsbcl9ct-24能够使得肿瘤内整个cd45+t细胞群中treg细胞计数的显著降低,降低了ct26肿瘤中的treg浸润。
二、采用本实验例(一)的方法分别检测hsbcl9ct-24对llc1细胞或4t1细胞(来源americantypeculturecollection)中treg在肿瘤内浸润的影响:检测结果如图6、图7所示:
由图6、图7可知,本发明hsbcl9ct-24能够使得肿瘤内整个cd45+t细胞群中treg细胞计数的显著降低,降低了llc1或4t1肿瘤中的treg浸润。
实验例4
一、与本发明hsbcl9ct-24预处理的ct26细胞共培养的treg细胞的迁移实验:
实验材料
treg细胞的分离:
无菌分离4-6周龄的雌性balb/c小鼠的胸腺、脾脏、腋下及腹股沟淋巴结于预冷的含2%fbs(购自gibco公司)的1640培养基(购自hyclone公司)中;在冰上用研磨棒研磨后后过10μm的筛网并用1ml注射器吹打混匀使其充分成为单细胞悬液;按照美天旎公司的cd4+、cd25+regulatorytcellisolationkit(货号:130-091-041)的使用说明,从研磨后的细胞悬液中分离treg细胞;
treg细胞的培养:
根据美天旎公司tcellactivation/expansionkit(货号:130-093-627)的使用说明,将分离得到的treg细胞置于24孔板中培养,每孔细胞数为2×106,培养体积为2ml,培养体系为含10%fbs、1%双抗的1640完全培养基,并补充1000u/ml的il-2(购自r&d)和5ng/ml的tgf-beta(购自r&d);
将ct26结肠癌细胞均匀的铺于24孔板中,数量为2×105;放在37℃,5%二氧化碳培养箱孵育16-18小时;待ct26细胞完全贴壁后进行处理,空白组仅添加培养基(无细胞),实验组为用2%血清培养基配置5μm的hsbcl9ct-24,对照组为同比例的dmso;分别将treg细胞加入到transwell小室(购自corningcostar)上室,treg数量为1.5×105,上室培养液体积为100μl,下室培养液体积为500μl;轻轻地将放有小室的24孔板拿到37℃,5%二氧化碳培养箱中培养;观察24h下室中treg细胞的迁移情况;观察结果如图8所示;
由图8可知,本发明hsbcl9ct-24明显抑制肿瘤微环境中treg的迁移。
二、与用靶向β-cat的对照非靶向(nt)shrna或shrna转导的ct26细胞共培养的treg细胞的迁移实验:
实验方法与本实验例(一)中的实验方法基本相同,区别是将ct26细胞替换为ct26-nt(ctnnb1表达无影响)和ct26-shrna细胞;ct26-nt(ctnnb1表达无影响)和ct26-shrna细胞通过鼠源ctnnb1敲低的gipz慢病毒质粒(购自dharmacon)采用lipo2000(购自invitrogen)转染体系获得;treg细胞的迁移情况如图9所示:
由图9可知,靶向敲低ctnnb1表达后能明显抑制肿瘤微环境中treg的迁移。
三、本发明hsbcl9ct-24对ct26细胞中ccl20、ccl22和tgf-β的mrna表达的影响:
分别将培养得到的ct26细胞分为两组,一组为dmso对照组,一组为2%血清培养基配置5μm的hsbcl9ct-24处理组;处理24h后收取细胞用传统trizol法提取rna,并进行qpcr检测两组ccl20、ccl22和tgf-β的mrna表达水平;检测结果如图10所示;
由图10可知,本发明hsbcl9ct-24能够显著降低肿瘤细胞中ccl20、ccl22、tgf-β的mrna表达水平。
四、按照本实验例(三)中的方法分别检测ct26-nt和ct26-shrna细胞中ccl22、ctnnb1和tgf-β的mrna表达水平;检测结果如图11所示;
由图11可知,靶向敲低ctnnb1表达后能够显著降低肿瘤细胞中ccl22、ctnnb1和tgf-β的mrna表达水平。
实验例5
一、采用流式细胞技术检测不同模型肿瘤细胞的cd103+树突状细胞的表达:
小鼠模型构建:如实验例3所述获得小鼠异位皮下种瘤3周左右的对照和hsbcl9ct-24处理的小鼠、野生型、ct26-nt和ct26-shrna的小鼠;
分离上述小鼠的肿瘤组织并用手工研磨的方法分离细胞悬液,在4℃下,以2000rpm离心15min;弃上清并在细胞沉淀中加入3倍体积的红细胞裂解液(购自碧云天)冰上裂红4分钟;4℃离心后得到的细胞沉淀,再用pbs重悬,以2000rpm离心15min,每个样本体积为100μl,细胞数为1×106;
在样本中分别加入所需的流式抗体;所对应的检测cd103+树突状细胞流式抗体为:cd45-percp-cyanine5.5(购自ebioscience)、
由图12可知,本发明hsbcl9ct-24明显提高肿瘤微环境中cd103+树突状细胞的表达;
由图13可知靶向降低ctnnb1的表达能够明显提高肿瘤微环境中cd103+树突状细胞的表达。
二、采用流式细胞技术检测不同模型肿瘤细胞的杀伤性cd8+细胞的表达:
在样本中分别加入所需的流式抗体;所对应的检测杀伤性cd8+细胞流式抗体为:cd45-percp-cyanine5.5(购自ebioscience)、
由图14可知,本发明hsbcl9ct-24明显提高肿瘤微环境中cd8+细胞的表达;
由图15可知本发明hsbcl9ct-24明显提高肿瘤微环境中cd8+细胞、treg细胞的比例;
由图16可知本发明hsbcl9ct-24明显提高肿瘤微环境中granzymeb+cd8+细胞的表达;
由图17可知靶向降低ctnnb1的表达明显提高肿瘤微环境中granzymeb+cd8+细胞的表达。
三、采用流式细胞技术检测不同模型肿瘤细胞的效应性cd8+细胞的表达:
在样本中分别加入所需的流式抗体;所对应的检测效应性cd8+细胞流式抗体为:cd45-percp-cyanine5.5(购自ebioscience)、
由图18可知,本发明hsbcl9ct-24明显提高肿瘤微环境中效应性cd8+细胞的表达;
由图19可知,靶向降低ctnnb1的表达明显提高肿瘤微环境中效应性cd8+细胞的表达。
四、检测不同处理的细胞中ccl4的mrna表达水平:
选取本实验例4中获得的ct26对照和hsbcl9ct-24处理组、ct26-nt和ct26-shrna的细胞,用传统trizol法提取rna,并进行qpcr检测两组ccl4的mrna表达水平;检测结果如图20、图21所示;
由图20可知,本发明hsbcl9ct-24能够显著提高肿瘤细胞中ccl4的mrna表达水平;
由图21可知,靶向降低ctnnb1的表达能够显著提高肿瘤细胞中ccl4的mrna表达水平。
实验例6
按照实验例3中的模型构建方法,分别构建llc1模型和4t1模型,待皮下种植llc1细胞的小鼠肿瘤体积达到30mm3,或4t1细胞的小鼠肿瘤体积达到20mm3;将llc1模型和4t1模型小鼠分别分为4组,每组5只,每种模型小鼠分别用igg、20mg/kghsbcl9ct-24、10mg/kgpd-1抗体(购自bioxcell)以及20mg/kghsbcl9ct-24+10mg/kgpd-1抗体(用hsbcl9ct-24处理24小时后注射pd-1抗体)处理小鼠,igg、hsbcl9ct-24为每天腹腔注射,pd-1抗体为一周两次腹腔注射;llc1模型组处理6天,每天测量肿瘤体积,测量结果如图22所示;
4t1模型组处理2周,前4天每天测量,从第7天开始隔天测量肿瘤体积,测量结果如图23所示;
由图22可知,本发明hsbcl9ct-24与pd-1抗体联用后能够显著抑制llc1肿瘤体积的增长;
由图23可知,本发明hsbcl9ct-24与pd-1抗体联用后能够显著抑制4t1肿瘤体积的增长。
虽然,上文中已经用一般性说明及具体实施例对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
sequencelisting
<110>复旦大学
<120>一种抗肿瘤的多肽及其应用
<130>2019
<160>1
<170>patentinversion3.3
<210>1
<211>12
<212>prt
<213>artificial
<220>
<221>site
<222>(12)..(12)
<223>第12位丙氨酸为2-萘基丙氨酸
<220>
<221>site
<222>(6)..(6)
<223>xaacanbeanynaturallyoccurringaminoacid
<220>
<221>site
<222>(10)..(10)
<223>xaacanbeanynaturallyoccurringaminoacid
<400>1
leuglnthrleuargxaaileglnargxaaleuala
1510
- 还没有人留言评论。精彩留言会获得点赞!