一种尿嘧啶类衍生物的简易合成方法与流程
本申请涉及药物合成领域,尤其是一种尿嘧啶类衍生物的快速制备方法。
背景技术:
尿嘧啶是rna特有的碱基,相当于dna中的胸腺嘧啶(t)。是组成rna四种构成的碱基之一。尿嘧啶是2,4-二羟基嘧啶的稳定酮式结构。它是合成抗肿瘤药物5-氟尿嘧啶及其衍生药物如替加氟、双呋氟尿嘧啶、去氧氟尿苷、卡莫氟和抗病毒5-碘2'-脱氧尿苷的重要中间体。自从1957年,c.heidelberger等人首次合成5-氟尿嘧啶并发现其良好的生理活性以来,(nature,1957,179,633)化学家及药物学家们对其做了大量的研究。到目前为止,5-氟尿嘧啶已经广泛用于多种肿瘤的临床治疗,如治疗消化系统癌、头颈部癌、妇科癌症、肝癌、膀肤癌、胰腺癌、皮肤癌等疾病。
目前工业上常采用β-二羰基化合物或其类似物和尿素或硫脲发生缩合反应制备尿嘧啶类化合物,但是若以尿素为原料,则对β-二羰基化合物的活性要求较高,限制了反应的应用范围。当前,通过多组分反应合成尿嘧啶类的化合物报道较少,急需广大有机合成工作者关注和研究。
技术实现要素:
本发明的目的在于提供一类尿嘧啶类衍生物的制备方法。本申请采用多组分中的ugi反应,得到的ugi产物在不需要提纯的基础上就可以在碱性条件下关环反应,由微波辅助,一锅法就可以合成得到尿嘧啶类衍生物,产率较高,适合大量化合物的合成。
本发明的目的是通过以下技术方案实现的:
一种尿嘧啶类衍生物,其特征在于:衍生物的结构通式如下:
其中所述的r1为芳基和杂芳基,r2为烷基、芳基和杂芳基。
而且,所述化合物为2-苄基-4-(对甲苯基)嘧啶并[1,6-a]吲哚-1,3,5(2h)-三酮。
而且,所述化合物为2-苯乙基-4-苯基嘧啶并[1,6-a]吲哚-1,3,5(2h)-三酮。
而且,所述化合物为2-苄基-4-(4-溴苯基)嘧啶并[1,6-a]吲哚-1,3,5(2h)-三酮。
而且,所述化合物为2-苄基-4-(4-甲氧基苯基)嘧啶并[1,6-a]吲哚-1,3,5(2h)-三酮。
而且,所述化合物为2-环己基-4-苯基嘧啶并[1,6-a]吲哚-1,3,5(2h)-三酮。
而且,所述化合物为2-苄基-4-苯基嘧啶并[1,6-a]吲哚-1,3,5(2h)-三酮。
而且,所述化合物为2-(环己基-4-(4-甲氧基苯基)嘧啶并[1,6-a]吲哚-1,3,5(2h)-三酮
所述的尿嘧啶类衍生物,其特征在于:合成路线如下
其中r1为芳基和杂芳基,r2为烷基、芳基和杂芳基。
而且,尿嘧啶类衍生物在制备抗肿瘤药物中的应用。所述化合物具有潜在的抗肿瘤作用,可用作抗肿瘤药物。
本发明的优点和积极效果:
(1)本发明以2-氨基苯甲酸甲酯为其中一种原料,经过ugi反应和碱性条件下的关环得到尿嘧啶类结构。所合成的尿嘧啶类化合物具有潜在抗肿瘤活性,可用作制备抗肿瘤药物。
(2)本发明合成路线具有操作工艺简单、合成路线短,成本低等优点。该合成方法中使用的原料易得,合成时间较短,合成中间体无需提纯就可以进行下一步操作,适合大量化合物的合成。
附图说明
图1为结构通式,其中所述的r1为烷基、芳基和杂芳基,r2为氢原子、卤素、甲基。
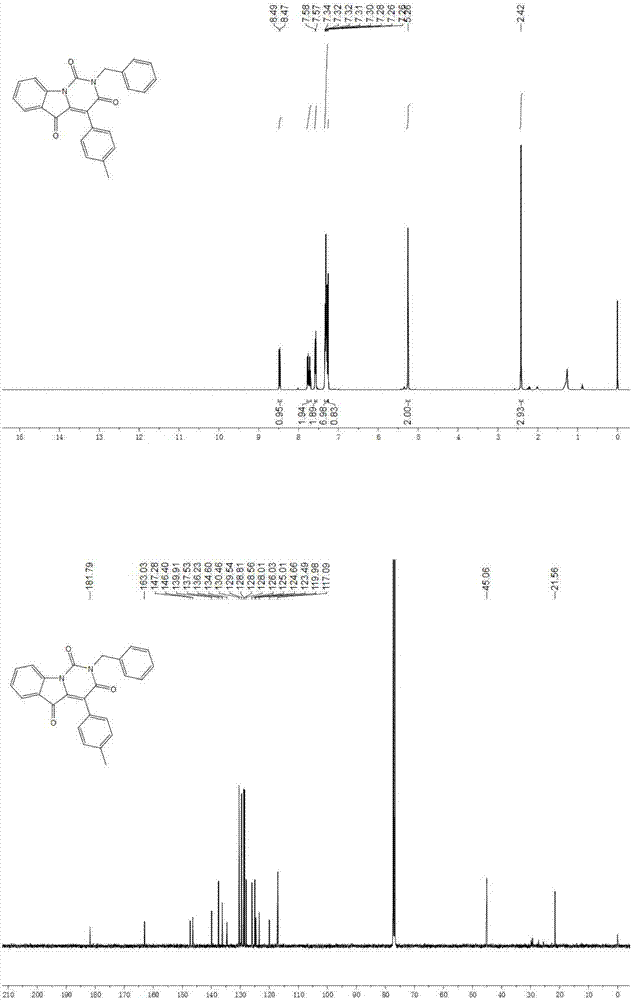
图2为2-苄基-4-(对甲苯基)嘧啶并[1,6-a]吲哚-1,3,5(2h)-三酮的核磁谱图。
图3为2-苯乙基-4-苯基嘧啶并[1,6-a]吲哚-1,3,5(2h)-三酮的核磁谱图。
图4为2-苄基-4-(4-溴苯基)嘧啶并[1,6-a]吲哚-1,3,5(2h)-三酮的核磁谱图。
图5为2-苄基-4-(4-甲氧基苯基)嘧啶并[1,6-a]吲哚-1,3,5(2h)-三酮的核磁谱图。
图6为2-环己基-4-苯基嘧啶并[1,6-a]吲哚-1,3,5(2h)-三酮的核磁谱图。
图7为2-苄基-4-苯基嘧啶并[1,6-a]吲哚-1,3,5(2h)-三酮的核磁谱图。
图8为2-(环己基-4-(4-甲氧基苯基)嘧啶并[1,6-a]吲哚-1,3,5(2h)-三酮的核磁谱图。
具体实施方式
为了理解本发明,下面结合实施例子对本发明作进一步说明:下述实施例子是说明性的,不是限定性的,不能以下述实施例来限定本发明的保护范围。
本发明所述的尿嘧啶类衍生物的结构通式如下:
其中所述的r1为芳基和杂芳基,r2为烷基、芳基和杂芳基。
所述的尿嘧啶类衍生物具体合成路线如下:
其中所述的r1为芳基和杂芳基,r2为烷基、芳基和杂芳基。
下面通过实施例子具体说明合成过程。
实施例1
其中r1为芳基,r2为烷基,即2-苄基-4-(对甲苯基)嘧啶并[1,6-a]吲哚-1,3,5(2h)-三酮的合成,具体步骤如下:
在10毫升大小的微波炉反应管中,先将乙醛酸乙酯(1.5毫摩尔)和2-氨基苯甲酸甲酯(1.0毫摩尔)溶解在2.0毫升的甲醇溶液中,然后再将对甲基苯甲酰甲酸(1.0毫摩尔)和苄基异氰(1.0毫摩尔)依次加入该溶液中,反应液常温下搅拌一晚上,然后使用薄层色谱检测异氰化合物,如果没有剩余的异氰原料,溶液使用氮气吹干,然后再用5.0毫升的二甲基甲酰胺(dmf)溶解,再加入1,8-二氮杂二环十一碳-7-烯(dbu)(2.0毫摩尔),在微波炉中100oc反应10分钟。该溶液使用乙酸乙酯(15毫升)稀释,然后用饱和食盐水洗涤3次,每次20毫升。有机相使用硫酸镁干燥后,采用硅胶柱进行分离,得到目标化合物2-苄基-4-(对甲苯基)嘧啶并[1,6-a]吲哚-1,3,5(2h)-三酮,产率73%。
1hnmr(400mhz,cdcl3)δ8.48(d,j=8.2hz,1h),7.79-7.68(m,2h),7.60-7.54(m,2h),7.35-7.27(m,7h),7.26(s,1h),5.26(s,2h),2.42(s,3h).13cnmr(100mhz,cdcl3)δ181.79,163.03,147.28,146.40,139.91,137.53,136.23,134.60,130.46,129.54,128.81,128.56,128.01,126.03,125.01,124.66,123.49,119.98,117.09,45.06,21.56.hrms(esi)m/zcalcdforc25h19n2o3+(m+h)+395.13902,found395.13901。
实施例2
其中r1为芳基,r2为烷基,即2-苯乙基-4-苯基嘧啶并[1,6-a]吲哚-1,3,5(2h)-三酮的合成,具体步骤如下:
在10毫升大小的微波炉反应管中,先将乙醛酸乙酯(1.5毫摩尔)和2-氨基苯甲酸甲酯(1.0毫摩尔)溶解在2.0毫升的甲醇溶液中,然后再将苯甲酰甲酸(1.0毫摩尔)和苯乙基异氰(1.0毫摩尔)依次加入该溶液中,反应液常温下搅拌一晚上,然后使用薄层色谱检测异氰化合物,如果没有剩余的异氰原料,溶液使用氮气吹干,然后再用5.0毫升的二甲基甲酰胺(dmf)溶解,再加入1,8-二氮杂二环十一碳-7-烯(dbu)(2.0毫摩尔),在微波炉中100oc反应10分钟。该溶液使用乙酸乙酯(15毫升)稀释,然后用饱和食盐水洗涤3次,每次20毫升。有机相使用硫酸镁干燥后,采用硅胶柱进行分离,得到目标化合物2-苯乙基-4-苯基嘧啶并[1,6-a]吲哚-1,3,5(2h)-三酮,产率64%。
1hnmr(400mhz,cdcl3)δ8.48(d,j=8.2hz,1h),7.85-7.69(m,2h),7.48(dd,j=4.2,2.3hz,3h),7.44-7.39(m,2h),7.37-7.29(m,5h),7.25-7.21(m,1h),4.35-4.24(m,2h),3.09-2.94(m,2h).13cnmr(100mhz,cdcl3)δ181.81,162.78,147.09,146.50,138.10,137.65,134.79,130.47,129.68,129.02,128.62,128.05,127.70,126.69,126.09,125.09,123.42,119.69,117.04,43.33,33.82.hrms(esi)m/zcalcdforc25h19n2o3+(m+h)+395.13902,found395.13901。
实施例3
其中r1为芳基,r2为烷基,即2-苄基-4-(对甲苯基)嘧啶并[1,6-a]吲哚-1,3,5(2h)-三酮的合成,具体步骤如下:
在10毫升大小的微波炉反应管中,先将乙醛酸乙酯(1.5毫摩尔)和2-氨基苯甲酸甲酯(1.0毫摩尔)溶解在2.0毫升的甲醇溶液中,然后再将对溴苯甲酰甲酸(1.0毫摩尔)和苄基异氰(1.0毫摩尔)依次加入该溶液中,反应液常温下搅拌一晚上,然后使用薄层色谱检测异氰化合物,如果没有剩余的异氰原料,溶液使用氮气吹干,然后再用5.0毫升的二甲基甲酰胺(dmf)溶解,再加入1,8-二氮杂二环十一碳-7-烯(dbu)(2.0毫摩尔),在微波炉中100oc反应10分钟。该溶液使用乙酸乙酯(15毫升)稀释,然后用饱和食盐水洗涤3次,每次20毫升。有机相使用硫酸镁干燥后,采用硅胶柱进行分离,得到目标化合物2-苄基-4-(对甲苯基)嘧啶并[1,6-a]吲哚-1,3,5(2h)-三酮,产率61%。
1hnmr(400mhz,cdcl3)δ8.47(d,j=8.2hz,1h),7.81-7.69(m,2h),7.62-7.53(m,4h),7.36-7.27(m,6h),5.25(s,2h).13cnmr(100mhz,cdcl3)δ181.71,162.62,147.12,146.47,137.79,136.03,134.89,132.26,131.30,129.52,128.60,128.10,126.51,126.23,125.16,124.27,123.23,118.45,117.13,45.13.hrms(esi)m/zcalcdforc24h16brn2o3+(m+h)+459.03388,found459.03345。
实施例4
其中r1为芳基,r2为烷基,即2-苄基-4-(4-甲氧基苯基)嘧啶并[1,6-a]吲哚-1,3,5(2h)-三酮的合成,具体步骤如下:
在10毫升大小的微波炉反应管中,先将乙醛酸乙酯(1.5毫摩尔)和2-氨基苯甲酸甲酯(1.0毫摩尔)溶解在2.0毫升的甲醇溶液中,然后再将4-甲氧基苯甲酰甲酸(1.0毫摩尔)和苄基异氰(1.0毫摩尔)依次加入该溶液中,反应液常温下搅拌一晚上,然后使用薄层色谱检测异氰化合物,如果没有剩余的异氰原料,溶液使用氮气吹干,然后再用5.0毫升的二甲基甲酰胺(dmf)溶解,再加入1,8-二氮杂二环十一碳-7-烯(dbu)(2.0毫摩尔),在微波炉中100oc反应10分钟。该溶液使用乙酸乙酯(15毫升)稀释,然后用饱和食盐水洗涤3次,每次20毫升。有机相使用硫酸镁干燥后,采用硅胶柱进行分离,得到目标化合物2-苄基-4-(4-甲氧基苯基)嘧啶并[1,6-a]吲哚-1,3,5(2h)-三酮,产率75%。
1hnmr(400mhz,cdcl3)δ8.48(d,j=8.2hz,1h),7.78(d,j=7.1hz,1h),7.75-7.69(m,1h),7.60-7.55(m,2h),7.41(d,j=8.8hz,2h),7.32(qd,j=8.6,3.9hz,4h),6.99(d,j=8.8hz,2h),5.26(s,2h),3.87(s,3h).13cnmr(100mhz,cdcl3)δ181.82,163.14,160.89,147.25,146.30,137.48,136.22,134.27,132.29,129.51,128.56,128.01,126.01,124.98,123.56,119.82,119.64,117.09,113.53,55.32,45.08.hrms(esi)m/zcalcdforc25h19n2o4+(m+h)+411.13393,found411.13391。
实施例5
其中r1为芳基,r2为烷基,即2-环己基-4-苯基嘧啶并[1,6-a]吲哚-1,3,5(2h)-三酮的合成,具体步骤如下:
在10毫升大小的微波炉反应管中,先将乙醛酸乙酯(1.5毫摩尔)和2-氨基苯甲酸甲酯(1.0毫摩尔)溶解在2.0毫升的甲醇溶液中,然后再将苯甲酰甲酸(1.0毫摩尔)和环己基异氰(1.0毫摩尔)依次加入该溶液中,反应液常温下搅拌一晚上,然后使用薄层色谱检测异氰化合物,如果没有剩余的异氰原料,溶液使用氮气吹干,然后再用5.0毫升的二甲基甲酰胺(dmf)溶解,再加入1,8-二氮杂二环十一碳-7-烯(dbu)(2.0毫摩尔),在微波炉中100oc反应10分钟。该溶液使用乙酸乙酯(15毫升)稀释,然后用饱和食盐水洗涤3次,每次20毫升。有机相使用硫酸镁干燥后,采用硅胶柱进行分离,得到目标化合物2-环己基-4-苯基嘧啶并[1,6-a]吲哚-1,3,5(2h)-三酮,产率68%。
1hnmr(400mhz,cdcl3)δ8.47(d,j=8.2hz,1h),7.81-7.68(m,2h),7.44(m,5h),7.32(t,j=7.3hz,1h),4.93-4.86(m,1h),2.49(qd,j=12.4,3.3hz,2h),1.88(d,j=13.2hz,2h),1.78-1.70(m,2h),1.47-1.34(m,2h),1.33-1.18(m,2h).13cnmr(100mhz,cdcl3)δ182.03,163.37,147.42,146.75,137.55,134.64,130.53,129.53,128.08,127.97,125.89,124.96,123.47,119.86,117.17,55.47,28.67,26.40,25.27.hrms(esi)m/zcalcdforc23h21n2o3+(m+h)+373.15467,found373.15466。
实施例6
其中r1为芳基,r2为烷基,即2-苄基-4-苯基嘧啶并[1,6-a]吲哚-1,3,5(2h)-三酮的合成,具体步骤如下:
在10毫升大小的微波炉反应管中,先将乙醛酸乙酯(1.5毫摩尔)和2-氨基苯甲酸甲酯(1.0毫摩尔)溶解在2.0毫升的甲醇溶液中,然后再将苯甲酰甲酸(1.0毫摩尔)和苄基异氰(1.0毫摩尔)依次加入该溶液中,反应液常温下搅拌一晚上,然后使用薄层色谱检测异氰化合物,如果没有剩余的异氰原料,溶液使用氮气吹干,然后再用5.0毫升的二甲基甲酰胺(dmf)溶解,再加入1,8-二氮杂二环十一碳-7-烯(dbu)(2.0毫摩尔),在微波炉中100oc反应10分钟。该溶液使用乙酸乙酯(15毫升)稀释,然后用饱和食盐水洗涤3次,每次20毫升。有机相使用硫酸镁干燥后,采用硅胶柱进行分离,得到目标化合物2-苄基-4-苯基嘧啶并[1,6-a]吲哚-1,3,5(2h)-三酮,产率69%。
1hnmr(400mhz,dmso-d6)δ8.36(d,j=8.2hz,1h),7.88-7.82(m,1h),7.78(d,j=7.5hz,1h),7.46-7.39(m,8h),7.34(t,j=7.4hz,2h),7.29(d,j=7.1hz,1h),5.15(s,2h).13cnmr(100mhz,dmso-d6)δ182.35,163.25,147.57,146.58,137.98,136.98,136.09,131.21,129.29,129.13,128.85,128.26,127.96,127.83,126.40,125.11,123.80,118.11,116.74,44.71.hrms(esi)m/zcalcdforc24h17n2o3+(m+h)+381.12337,found381.12338。
实施例7
其中r1为芳基,r2为烷基,即2-(环己基-4-(4-甲氧基苯基)嘧啶并[1,6-a]吲哚-1,3,5(2h)-三酮的合成,具体步骤如下:
在10毫升大小的微波炉反应管中,先将乙醛酸乙酯(1.5毫摩尔)和2-氨基苯甲酸甲酯(1.0毫摩尔)溶解在2.0毫升的甲醇溶液中,然后再将4-甲氧基苯甲酰甲酸(1.0毫摩尔)和环己基异氰(1.0毫摩尔)依次加入该溶液中,反应液常温下搅拌一晚上,然后使用薄层色谱检测异氰化合物,如果没有剩余的异氰原料,溶液使用氮气吹干,然后再用5.0毫升的二甲基甲酰胺(dmf)溶解,再加入1,8-二氮杂二环十一碳-7-烯(dbu)(2.0毫摩尔),在微波炉中100oc反应10分钟。该溶液使用乙酸乙酯(15毫升)稀释,然后用饱和食盐水洗涤3次,每次20毫升。有机相使用硫酸镁干燥后,采用硅胶柱进行分离,得到目标化合物2-(环己基-4-(4-甲氧基苯基)嘧啶并[1,6-a]吲哚-1,3,5(2h)-三酮,产率71%。
1hnmr(400mhz,cdcl3)δ8.37(t,j=8.9hz,1h),8.32(d,j=8.7hz,1h),7.69(d,j=7.5hz,1h),7.63(t,j=7.7hz,1h),7.33(d,j=8.7hz,2h),6.91(d,j=8.7hz,2h),3.80(s,1h),3.78(s,3h),1.89(dd,j=12.3,3.0hz,1h),1.80(d,j=10.1hz,2h),1.69-1.63(m,3h),1.40-1.24(m,4h).13cnmr(100mhz,cdcl3)δ185.06,162.53,159.74,146.35,145.53,136.37,132.89,131.27,124.76,123.84,122.58,118.95,116.11,112.78,112.42,54.28,47.37,31.70,27.64,25.37,24.26,23.74.hrms(esi)m/zcalcdforc24h23n2o4+(m+h)+403.16523,found403.16522。
- 还没有人留言评论。精彩留言会获得点赞!