报告基因法测定重组人角质细胞生长因子的生物学活性的制作方法
本发明涉及重组药物活性检测领域,针对重组人角质细胞生长因子(keratinocytegrowthfactor,kgf)1和2(kgf-1和kgf-2)的生物学活性测定建立了一种快速、敏感、准确的报告基因活性测定方法。
背景技术:
kgf属于成纤维细胞因子家族,其中kgf-1(fgf-7)是1989年发现的能够刺激上皮细胞增殖的生长因子;kgf-2(fgf-10)于1996年发现,结构和促有丝分裂活性与kgf-1相似。kgf与其受体结合后,能够促进上皮细胞的增殖、分化和迁移。2004年12月15日,美国fda批准kepivance(palifermin)用于治疗接受高剂量化疗药物的骨髓移植患者的口腔黏膜炎。kepivance是一种重组人角质细胞生长因子,能够保护口腔表皮细胞并刺激新的表皮细胞生长。从2004年批准上市至今,有关kepivance的临床研究从未间断,适应症范围逐渐从口腔黏膜炎扩展到移植后加快异体干细胞的免疫恢复和多重联合用药治疗难治性疾病。
自从kepivance批准上市,我国多家企业对重组人kgf进行了研究和生产,并已经获得cfda批准的重组人kgf-1和kgf-2的临床批件,并开展相关的临床研究。除了重组人kgf-1与kepivance适应症一致外,重组人kgf-2主要促进创面愈合,用于烧伤创面(包括浅ii度、深ii度)和治疗皮肤局部ii度灼伤创面。
目前,中国和美国药典中尚无收录重组人kgf活性的测定方法。在我国申报企业中,重组人kgf-1和kgf-2活性测定方法均采用细胞增殖法。申报企业采用细胞增殖法具有一定局限性,例如,活性测定用细胞为非kgf依赖细胞株,分别来源于恒河猴和小鼠;药物的初始浓度较高(其中kgf-2>3000ng/ml),试验周期长(3d-6d)、信噪比较低和结果变异性大。
本发明采用报告基因活性测定方法,利用kgf与其受体结合后激活mapk信号途径,进而激活elk-1/srf转录因子,结合sre反应元件(serumresponseelement,sre),并激活其下游荧光素酶基因的转录,根据荧光素酶基因表达的变化来反应kgf的活性。该方法易于操作,实验周期短,初始药物浓度低和变异系数低,明显克服了细胞增殖法的局限性。
技术实现要素:
本发明是建立一种快速、简便的kgf-1和kgf-2活性的测定方法。该方法包括构建表达kgfr2iiib(genbankno:nm_022970)和sre反应元件的稳定细胞株,重组人kgf-1和kgf-2刺激后能够激活sre下游荧光素酶报告基因的表达,根据化学发光的信号值拟合四参数曲线,确定重组人kgf-1和kgf-2的生物学活性。
本发明的目的在于提供一种快速测定kgf-1和kgf-2生物学活性测定方法,所述方法包括:
(1)分别将sre反应元件和kgfr2iiib受体基因慢病毒感染细胞,加压筛选单克隆细胞株,获得稳定表达sre和kgfr2iiib的单克隆细胞株;
(2)将重组kgf-1和kgf-2药物稀释至适当浓度后进行倍比稀释,再依次加入至(1)细胞中,37℃刺激4-5h;
(3)弃去上述(2)中的培养液,加入荧光素酶底物,充分裂解细胞后测定信号值,根据拟合的四参数曲线确定重组人kgf-1和kgf-2生物学活性。
hek293细胞是人胚胎肾细胞,其转染效率高、表达蛋白结构接近人体内源性蛋白构象和生长较快,已被广泛应用到重组蛋白、病毒包装和药物的研发和生产中。hek293细胞表面表达少量的kgfr受体,与kgf结合后可以激活mapk等信号通路,从而促进细胞的增殖等。为提高其对kgf的反应性,在hek293细胞中同时转入sre和kgfr2iiib,kgf与kgfr2iiib结合后刺激mapk信号通路,从而激活sre下游的荧光素酶基因表达,根据荧光素酶基因表达的强弱与结合至靶细胞膜上kgf受体的kgf含量呈正相关,确定kgf的活性。稳定表达sre和kgfr2iiib的细胞株命名为hek293-luc。
hacat细胞是人永生化表皮细胞,其表面表达kgfr,但表达量受细胞密度的影响。导入外源性kgfr受体的hacat细胞,kgf刺激后增殖反应明显增强。本发明中构建稳定表达sre和kgfr2iiib的hacat细胞株的策略与hek293细胞相同。稳定表达sre和kgfr2iiib的细胞株命名为hacat-luc。
在本发明的实施方案中,稳定表达sre和kgfr2iiib的细胞株选择hek293细胞、hacat细胞和hela细胞,优选为稳定表达sre和kgfr2iiib的hek293细胞和hacat细胞。
在本发明的实施方案中,报告基因为荧光素酶报告基因。
在本发明的实施方案中,稳定表达sre和kgfr2iiib的hek293-luc和hacat-luc细胞,优选含sre反应元件的载体为市售的pgl4.33[luc2p/sre/hygro]质粒;优选kgfr2iiib受体基因的过表达慢病毒。
在本发明的实施方案中,重悬细胞时采用含0-40μg/ml肝素钠-0.5%fbs的dmem,优先2μg/ml肝素钠-0.5%fbs的dmem。
在本发明的实施方案中,铺板细胞数量为1.0-6.0×104/孔,优先4.0×104/孔。
在本发明的实施方案中,重组kgf-1/kgf-2及参比品的稀释液为含2μg/ml肝素钠-0.5%fbs的dmem。
在本发明的实施方案中,用稳定表达sre和kgfr2iiib受体的hek293细胞检测时,重组kgf-1预稀释浓度为150ng/ml,重组kgf-2的预稀释浓度为300ng/ml,3倍比稀释。
在本发明的实施方案中,用稳定表达sre和kgfr2iiib受体的hacat细胞检测时,重组kgf-1预稀释浓度为400ng/ml,重组kgf-2的预稀释浓度为600ng/ml,3倍比稀释。
在本发明的实施方案中,加入kgf-1/kgf-2后,与细胞作用时间为2-8h,优先4-5h。
在本发明的实施方案中,检测的是kgf与转基因细胞作用后荧光素酶基因表达的变化。
在本发明的实施方案中,荧光素酶底物试剂盒有perkinelmer的briteliteplus和promega的bright-glo,优先perkinelmer的briteliteplus试剂盒。
在spectramaxm5酶标仪读取化学发光值,通过拟合四参数曲线确定kgf和参比品的ec50值,以相对生物学活性(相对生物学活性=参比品ec50/样品ec50)反应kgf的生物学活性。
该发明方法操作简单,实验时间短,准确度高,变异小,在kgf-1和kgf-2重组药物的研发和质量控制中具有较高的应用价值。
附图说明
现结合附图和实施例对本发明的内容作进一步说明。
图1是hek293-luc和hacat-luc混克隆细胞株反应液的优化;
图2是不同单克隆hek293-luc和hacat-luc细胞株的反应曲线;
图3是hek293-luc和hacat-luc细胞株不同预稀释浓度的反应曲线;
图4是hek293-luc和hacat-luc细胞株不同肝素浓度的反应曲线;
图5是hek293-luc和hacat-luc细胞株不同细胞数量的反应曲线;
图6是hek293-luc和hacat-luc细胞株不同作用时间的反应曲线;
图7是hek293-luc和hacat-luc细胞株的破坏性试验;
图8是hek293-luc和hacat-luc细胞株对kgf-2的反应曲线;
图9是hek293-luc细胞株的线性回归曲线;
图10是hacat-luc细胞株的线性回归曲线。
具体实施方式
通过下面的具体实施例对本发明作进一步解释和说明,仅用于解释本说明,并不能理解为对本发明的限制。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照厂商建议的条件实施检测。以下实施例中采用试剂的配制方法如下:
实施例1筛选表达sre和kgfr2iiib受体的hek293和hacat稳定细胞株
1.材料与方法
1.1细胞
hek293细胞来源于atcc;hacat细胞来源于中国科学院细胞库。
1.2试剂及材料
pgl4.33[luc2p/sre/hygro]质粒和viafecttm转染试剂购于promega;kgfr2iiib基因过表达慢病毒由上海吉凯基因科技有限公司构建及包装;dmem和胎牛血清(fbs)购于gibco;嘌呤霉素购于invitrogen;潮霉素b购于索莱宝生物科技有限公司;briteliteplus荧光素酶底物购于perkinelmer;白色底部透光96孔板购于corning;重组kgf-1和kgf-2为中国食品药品检定研究院重组药物室留存。
1.3仪器
酶标仪购自moleculardevices,型号为spectramaxm5;softmaxpro及graphpadprism7.0用于四参数数据分析。
2.试验操作
2.1质粒转染
用含10%fbs的dmem调整hek293和hacat细胞浓度至3×105/ml,取5ml至25cm2细胞瓶。37℃培养24h后根据说明书转染pgl4.33[luc2p/sre/hygro]质粒,48h后加入300μg/ml的潮霉素b进行加压筛选,每隔5d更换新的含潮霉素b的培养液,连续培养约14-21d。
2.2感染kgfr2iiib基因过表达慢病毒
用含10%fbs的dmem调整2.1中混克隆细胞密度至5×105/ml,取5ml至25cm2细胞瓶。37℃培养24h弃去培养液,加入无血清dmem稀释的kgfr2iiib基因过表达慢病毒,混匀,继续培养12-24h后更换含嘌呤霉素和潮霉素b的完全培养液。每隔3d更换新的培养液,连续培养约7d。
2.3反应液的优化
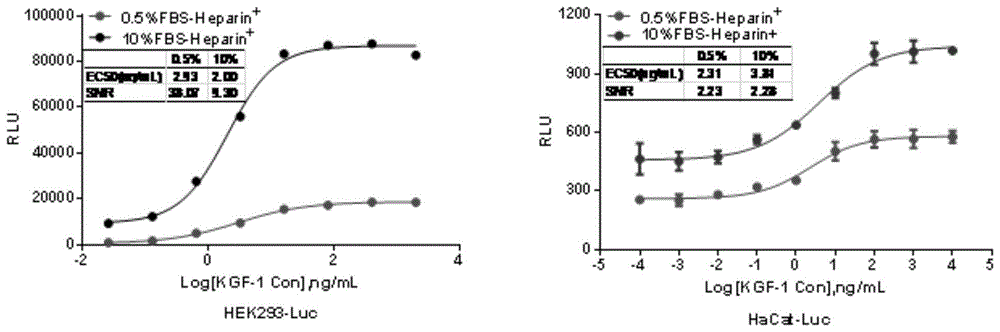
将转入pgl4.33[luc2p/sre/hygro]质粒和kgfr2iiib基因过表达慢病毒的hek293和hacat细胞分别命名为hek293-luc和hacat-luc。分别用含肝素钠的0.5%fbs和10%fbs的dmem调整细胞浓度,按照3×104/孔细胞加入96孔板,37℃,5%co2培养12-18h,加入等体积倍比稀释的重组kgf-1进行刺激,继续培养4-6h后弃去反应液,加入60μlbriteliteplus荧光素酶底物,充分震荡5min后检测荧光素酶的荧光值,拟合四参数曲线(图1)。根据ec50和信噪比(snr)选择含肝素钠的0.5%fbs的dmem作为活性检测反应液。
2.4hek293-luc和hacat-luc单克隆细胞株制备
消化并重悬细胞,按照0.8个/孔的密度铺96孔板。定期观察细胞生长情况,挑选圆的单克隆细胞孔,依次在24孔板和6孔板进行扩大培养。
2.5单克隆细胞株筛选
分离挑选9和6个hek293-luc和hacat-luc单克隆细胞株,检测对重组kgf-1的反应性。用含肝素钠的0.5%fbs的dmem调整细胞浓度,按照3×104/孔细胞加入96孔板,37℃,5%co2培养12-18h。
重组kgf-1预稀释浓度为10000ng/ml,10倍比系列稀释8个梯度,各设2个复孔。加入等体积不同浓度的重组kgf-1,作用4-6h检测荧光信号值并拟合四参数曲线(图2)。根据ec50和信噪比(snr)选择1cl和1a6单克隆作为检测用细胞株(表1和表2)。
表1hek293-luc单克隆细胞株的ec50和snr结果
表2hacat-luc单克隆细胞株的ec50和snr结果
实施例2kgf活性测定的方法学优化
1.kgf-1浓度优化
根据实施例1中2.5的单克隆细胞株筛选条件,kgf-1预稀释浓度100000ng/ml,3倍比系列稀释20个梯度,各设2个复孔。加入等体积的不同浓度的重组kgf-1,作用4-6h检测荧光信号值并拟合四参数曲线(图3)。
结果显示hek293-luc和hacat-luc细胞株的预稀释浓度约在137ng/ml和411ng/ml,3倍比连续稀释8个浓度时在曲线的下平台,因此,选择150ng/ml和400ng/ml重组kgf-1浓度作为hek293-luc和hacat-luc细胞株的预稀释浓度,3倍比进行稀释。
2.肝素钠浓度优化
根据实施例2中1和实施例1中2.5的单克隆细胞株筛选条件,采用含不同浓度肝素钠(0-40μg/ml)的0.5%fbsdmem反应液重悬细胞,按照3×104/孔细胞加入96孔板,37℃,5%co2培养12-18h。
用含不同浓度肝素钠(0-40μg/ml)的0.5%fbsdmem反应液稀释重组kgf-1。kgf-1预稀释浓度分别为150ng/ml和400ng/ml,3倍比系列稀释,各设2个复孔。稀释后加入细胞中,作用4-6h检测荧光信号值并拟合四参数曲线(图4)。
结果显示(表3),hek293-luc细胞株在不加入肝素钠时,snr较低;1ug/ml和2ug/ml肝素钠时ec50基本一致,后者的snr高于前者;5ug/ml肝素钠ec50和snr与2ug/ml无明显差异;20ug/ml和40ug/ml肝素钠时ec50和snr变化无规律。考虑到成本和试验稳定性,检测反应液中的肝素钠选择2ug/ml。
表3hek293-luc细胞株的肝素钠浓度优化结果
同理,hacat-luc细胞株检测反应液中的肝素钠选择2ug/ml(表4)。
表4hacat-luc细胞株的肝素钠浓度优化结果
3.细胞密度优化
用含2μg/ml肝素钠-0.5%fbs的dmem调整细胞浓度,分别按照1.0×104/孔、2.0×104/孔、2.0×104/孔、4.0×104/孔、5.0×104/孔和6.0×104/孔细胞加入至96孔板中,37℃,5%co2培养12-18h。分别加入150ng/ml和400ng/ml预稀释,3倍比稀释的重组kgf-1,4-6h后检测荧光信号值并拟合四参数曲线(图5)。
结合ec50和snr结果(表5),选择3.0-4.0×104/孔细胞密度进行后续实验。
表5hek293-luc和hacat-luc细胞株的细胞密度优化结果
4.作用时间优化
用含2μg/ml肝素钠-0.5%fbs的dmem调整细胞浓度,按照4.0×104/孔细胞加入至96孔板中,37℃,5%co2培养12-18h。分别加入150ng/ml和400ng/ml预稀释,3倍比稀释的重组kgf-1,分别于2h、3h、4h、5h、6h、7h和8h后检测荧光信号值并拟合四参数曲线(图6)。结合ec50和snr结果(表6),选择4-5h做为重组kgf-1作用时间。
表6hek293-luc和hacat-luc细胞株的作用时间优化结果
5.破坏性试验
按照实施例2中1-5确定的试验条件,对37℃处理不同天数(0d、1d、3d和5d)的重组kgf-1样品进行活性检测。在活性测定中,将重组kgf-1样品和参比品进行相同操作,以相对生物学活性为最终的结果分析(相对生物学活性=参比品ec50/样品ec50)。
用含2μg/ml肝素钠-0.5%fbs的dmem调整细胞浓度,按照4.0×104/孔细胞加入至96孔板中,37℃,5%co2培养12-18h。分别加入150ng/ml和400ng/ml预稀释,3倍比稀释的重组kgf-1,作用5h后检测荧光信号值并拟合四参数曲线(图7)。
从结果可以看出,在37℃处理条件下,kgf-1有一定的降解,37℃未处理的正常样品的相对生物学活性最高,随着在37℃放置时间的延长,重组kgf-1的相对生物学活性逐渐降低,处理5d时基本没有活性。说明hek293-luc和hacat-luc细胞株可以测定不同生物学活性的kgf-1样品,方法的适用性较好。
6.hek293-luc和hacat-luc细胞对kgf-2的反应性
按照实施例2中1-5确定的试验条件,检测hek293-luc和hacat-luc对重组kgf-2的反应性(图8),结果表明,两株细胞均对重组kgf-2有反应性,可以用来检测kgf-2的生物学活性,当预稀释浓度分别为300ng/ml和600ng/ml时获得较好的四参数曲线。
实施例3kgf活性测定的方法学验证
1.精密度
用实施例2确定的实验条件评价该方法的精密度。取1批重组kgf-1样品进行活性测定,每天测定不同3次,连续测定4d,每个稀释度3个复孔。
表7结果表明,连续测定4d,hek293-luc细胞株的日内变异系数(cv)为1.49-3.75%,日内cv值为2.82%;hacat-luc细胞株的日内变异系数(cv)为0.52-5.78%,日内cv值为5.57%。两株细胞株的日内和日间的cv值均小于6%,说明该方法的精密度较好,可以用来测定重组kgf-1的生物学活性。
表7hek293-luc和hacat-luc细胞株测定重组kgf-1生物学活性的精密度
2.准确性
用实施例2确定的实验条件评价该方法的准确性。取1批重组kgf-1样品,分别制备预稀释浓度为确定预稀释浓度(150ng/ml和400ng/ml)的50%、75%、100%、125%和150%,3倍比稀释,连续8个稀释度,上述5个不同预稀释浓度的样品和参比品进行相同操作。每天测定不同3次,连续测定3d,每个稀释度3个复孔。
表8结果表明,连续测定3d,hek293-luc细胞株的cv值均小于5.00%。将5组样品的实际测量相对生物学活性的平均值与理论值进行线性拟合,r2为0.9995,线性拟合较好(图9),表明该方法的准确性较好。
表8hek293-luc细胞株测定重组kgf-1生物学活性的准确性
同理,hacat-luc细胞株连续测定3d,cv值均小于7.00%。线性拟合的r2为0.9955(图10和表9),该方法的准确性较好。
表9hacat-luc细胞株测定重组kgf-1生物学活性的准确性
- 还没有人留言评论。精彩留言会获得点赞!