一种细胞分选系统的制作方法
本发明属于微流控和细胞检测交叉技术领域,具体涉及一种细胞分选系统。
背景技术:
拉曼光谱(ramanspectra),是一种散射光谱。拉曼光谱分析法是基于印度科学家c.v.拉曼(raman)所发现的拉曼散射效应,对与入射光频率不同的散射光谱进行分析以得到分子振动、转动方面信息,并应用于分子结构研究的一种分析方法。
目前通过拉曼光谱进行细胞动力学研究和拉曼光谱分选辨别细胞,如区分肿瘤和正常、白血病细胞、变异红细胞等是单细胞拉曼光谱研究两个研究热点。但是,现有拉曼光谱技术中缺乏实用的细胞分选装置,常常采用光镊子人工操控费时费力,而且拉曼光谱中缺乏系统图像采集和分析装置。
技术实现要素:
有鉴于此,本发明提出的分选系统基于细胞的拉曼光谱,采用微流控芯片技术实现细胞的自动引导、检测与分选,提升了现有细胞分选的效率和准确性,设计的微流控芯片具有多个分选通道,能够同时分选多种细胞,该系统可以高效、自动、无损的纯化原代胰岛细胞、鼻咽癌细胞、组织细胞等,推进单细胞水平上的科学研究。
为了实现本发明的目的,本发明的细胞分选系统采用如下技术方案:
一种细胞分选系统,其特征在于,包括微流控芯片和拉曼光谱检测系统,其中:
所述微流控芯片包括从上向下依次堆叠的气路控制层、pdms薄膜层、流体通道层和石英玻璃基底:所述气路控制层内设置有多个用于开、闭流体通道的微阀门,所述流体通道层内设置有连通细胞样品池的主通道、用于控制细胞运动的多个鞘流组、以及多个连通细胞收集池和废液池的分选通道;
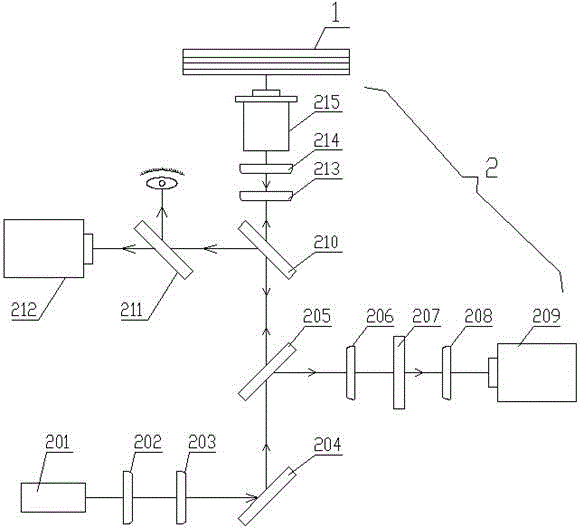
所述拉曼光谱检测系统用于激发和检测细胞的拉曼光谱、包括激光单元、ccd单元、摄像机单元和观察单元:所述激光单元用于提供激光源、且包括同轴布置的激光器、光频隔离器、干扰滤波器和反射镜,所述反射镜成45°倾斜布置用于将激光引导至细胞分选系统中的检测细胞;所述ccd单元用于采集检测细胞的图像信息、且包括同轴布置的第一全息干涉陷波滤波器、第一透镜、第二全息干涉陷波滤波器、第二透镜和ccd,所述第一全息干涉陷波滤波器成45°倾斜布置用于将检测细胞的图像信息引导至ccd;所述摄像机单元用于实时采集检测细胞的视频信息、且包括同轴布置的光束分离器、分光镜和摄像机,所述光束分离器成45°倾斜布置用于将检测细胞的图像信息引导至摄像机;所述观察单元包括同轴布置的第二透镜、第二透镜和油镜,所述油镜紧邻微流控芯片;所述反射镜、第一全息干涉陷波滤波器、光束分离器、第二透镜、第二透镜和油镜的中心均在同一直线上。
优选的,所述流体通道层的主通道上间隔设置有两个鞘流组,两个鞘流组之间形成拉曼检测区,所述两个鞘流组用于控制细胞单行排列和运动,两个鞘流组包括对称布置的第一鞘流通道和第二鞘流通道以及第三鞘流通道和第四鞘流通,所述主通道的出口处连通有第一分选通道和第二分选通道,其中:所述第一分选通道上设置有对称布置的第五鞘流通道和第六鞘流通道,第一分选通道的出口处连通有第三分选通道和第四分选通道;所述第二分选通道上设置有对称布置的第七鞘流通道和第八鞘流通道,第二分选通道的出口处连通有第五分选通道和第六分选通道。
优选的,所述气路控制层内设置有第一微阀门、第二微阀门、第三微阀门、第四微阀门、第五微阀门和第六微阀门,其中:所述第一微阀门布置在第一分选通道的上方,所述第一分选通道的导通或关闭由第一微阀门的排气或充气驱动pdms薄膜层形变实现;所述第二微阀门布置在第二分选通道的上方,所述第二分选通道的导通或关闭由第二微阀门的排气或充气驱动pdms薄膜层形变实现;所述第三微阀门布置在第三分选通道的上方,所述第三分选通道的导通或关闭由第三微阀门的排气或充气驱动pdms薄膜层形变实现;所述第四微阀门布置在第四分选通道的上方,所述第四分选通道的导通或关闭由第四微阀门的排气或充气驱动pdms薄膜层形变实现;所述第五微阀门布置在第五分选通道的上方,所述第五分选通道的导通或关闭由第五微阀门的排气或充气驱动pdms薄膜层形变实现;所述第六微阀门布置在第六分选通道的上方,所述第六分选通道的导通或关闭由第六微阀门的排气或充气驱动pdms薄膜层形变实现。
优选的,所述第一微阀门、第二微阀门、第三微阀门、第四微阀门、第五微阀门和第六微阀门的控制由气路、进气电磁阀、排气电磁阀、气源和排气口完成,所述气源和排气口分别通过三通阀接入微阀门的气路,进气电磁阀设置在气源的出口处,排气电磁阀设置在排气口处。
优选的,还包括控制鞘流组工作的多个微流泵,所述多个微流泵接收计算机的控制信号、且能独立工作,每个鞘流通道连通单独的微流泵。
本发明的一种细胞分选系统具有以下有益效果:
(1)该细胞分选系统具有多个鞘液组,能够将检测细胞聚焦成单行排列并驱动其依次进入拉曼检测区,多个鞘液组通道分别连接驱动鞘流液的微流泵,并由计算机控制其开闭和流量。
(2)该细胞分选系统的气路控制层内设置多个微阀门,多个微阀门可以独立控制,实现不同微流通道的关闭和导通,以引导细胞进入不同的细胞收集池或废液池。
(3)该细胞分选系统的透明的四层结构,能够与图像采集分析系统、自动控制技术相结合,基于检测细胞的图像和视频,可以由计算机自动进行拉曼检测、信号收集、数据处理。当分析结果判定该细胞为某类细胞时,计算机控制微阀门开闭,从而使其进入相应管道,实现细胞的分选。
附图说明
图1为本发明中细胞分选系统的结构示意图;
图2为本发明中微流控芯片的分层结构示意图;
图3为本发明中微流控芯片的工作原理示意图;
图4为本发明中pdms微阀的导通状态示意图;
图5为本发明中pdms微阀的关闭结构示意图;
图6为本发明中细胞分选技术路线图。
图中,1-微流控芯片、101-气路控制层、1011-第一微阀门、1012-第二微阀门、1013-第三微阀门、1014-第四微阀门、1015-第五微阀门、1016-第六微阀门、102-pdms薄膜层、103-流体通道层、1031-主通道、1032-第一鞘流通道、1033-第二鞘流通道、1034-第三鞘流通道、1035-第四鞘流通道、1036-第一分选通道、1037-第二分选通道、1038-第五鞘流通道、1039-第六鞘流通道、1040-第三分选通道、1041-第四分选通道、1042-第七鞘流通道、1043-第八鞘流通道、1044-第五分选通道、1045-第六分选通道、104-石英玻璃基底、2-拉曼光谱检测系统、201-激光器、202-光频隔离器、203-干扰滤波器、204-反射镜、205-第一全息干涉陷波滤波器、206-第一透镜、207-第二全息干涉陷波滤波器、208-第二透镜、209-ccd、210-光束分离器、211-分光镜、212-摄像机、213-第二透镜、214-第二透镜、215-油镜、3-气路、4-进气电磁阀、5-排气电磁阀6-气源、7-排气口。
具体实施方式
在本发明的描述中,需要理解的是,术语“中心”、“上”、“下”、“前”、“后”、“左”、“右”、“竖直”、“水平”、“顶”、“底”、“内”、“外”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。在本发明的描述中,除非另有说明,“多个”的含义是两个或两个以上。
如图1和图2所示,一种细胞分选系统包括微流控芯片1和拉曼光谱检测系统2,其中,微流控芯片1在计算机的控制下能够实现细胞的自动检测、聚焦、前进、静止、分选等功能,拉曼光谱检测系统2系统能够激发、检测细胞的拉曼光谱,同时采用图像分析、对比进行细胞类型确定。
具体的,微流控芯片1包括从上向下依次堆叠的气路控制层101、pdms薄膜层102、流体通道层103和石英玻璃基底104:气路控制层101内设置有多个用于开、闭流体通道的微阀门,流体通道层103内设置有连通细胞样品池的主通道1031、用于控制细胞运动的多个鞘流组、以及多个连通细胞收集池和废液池的分选通道。其中,pdms为polydimethylsiloxane的缩写,中文为聚二甲基硅氧烷,该材料是有机硅的一种,因其成本低,使用简单,同硅片之间具有良好的粘附性,而且具有良好的化学惰性等特点,成为一种广泛应用于微流控等领域的聚合物材料。
图1中,拉曼光谱检测系统2中一束波长为785nm的半导体激光由激光器201,激光器201采用hitachi的hl-7851g型号,发出780nm、15mw的激光,经过滤波后被导入一台尼康倒置生物显微镜(nikonte2000-u),本实施例中显微镜物镜是数值孔径为1.30,放大倍数为100倍的油镜2015。激光束到达物镜前的光斑直径大约6mm,发散角是2mrad。半导体激光器201通过恒温电路控制以避免波长漂移,样品池由石英材质的微流控芯片构成。培养液缓里的单个细胞可以被聚焦的激光束产生的辐射压力固定在焦点附近,同时这束激光也用来激发被囚禁细胞的拉曼散射。在收集光路里,物镜也作为收集透镜收集来自细胞的背向散射光,一个200μm的针孔用来去除离轴的散射光。光谱仪耦合到电荷耦合器件ccd209上,为了获得极低的暗电流,ccd209被冷却到-120℃。
需要说明的是,激光单元用于提供激光源、且包括同轴布置的激光器201、光频隔离器202、干扰滤波器203和反射镜204,反射镜204成45°倾斜布置用于将激光引导至细胞分选系统中的检测细胞;激光器201发射的激光经过光频隔离器202、干扰滤波器203滤波后通过反射镜204被导入倒置生物显微镜,激光束经第二透镜2013和第二透镜2014聚焦后在焦点附近形成了光束光势陷阱,细胞被固定于焦点当中。ccd单元包括同轴布置的第一全息干涉陷波滤波器205、第一透镜206、第二全息干涉陷波滤波器207、第二透镜208和ccd209,第一全息干涉陷波滤波器205成45°倾斜布置用于将检测细胞的图像信息引导至ccd209,两个全息干涉陷波滤波器被用来滤除波长与激发波长相同的弹性散射光,而细胞的拉曼散射光聚焦到被冷却到-120℃的电荷耦合器件ccd上。摄像机单元用于实时采集检测细胞的视频信息、且包括同轴布置的光束分离器2010、分光镜2011和摄像机2012,光束分离器2010成45°倾斜布置用于将检测细胞的图像信息引导至摄像机2012;光束分离器2010可以提供目镜下观察显微视野,同时可以通过一个摄像机2012进行连续监视。细胞被检测时浸泡在培养基中,整个实验过程在自动加温台中进行,全程保持37℃。
需要进一步说明的是,观察单元包括同轴布置的第二透镜2013、第二透镜2014和油镜2015,油镜2015紧邻细胞分选系统;反射镜204、第一全息干涉陷波滤波器205、光束分离器2010、第二透镜2013、第二透镜2014和油镜2015的中心均在同一直线上。
如图3所示,流体通道层103的主通道301上间隔设置有两个鞘流组,两个鞘流组之间形成拉曼检测区,两个鞘流组用于控制细胞单行排列和运动,两个鞘流组包括对称布置的第一鞘流通道1032和第二鞘流通道1033以及第三鞘流通道1034和第四鞘流通1035,主通道301的出口处连通有第一分选通道1036和第二分选通道1037,其中:
第一分选通道1036上设置有对称布置的第五鞘流通道1038和第六鞘流通道1039,第一分选通道1036的出口处连通有第三分选通道1040和第四分选通道1041;
第二分选通道1037上设置有对称布置的第七鞘流通道1042和第八鞘流通道1043,第二分选通道1037的出口处连通有第五分选通道1044和第六分选通道1045。
流体通道层103的具体工作过程如下:
本实施例中的细胞图像识别使用图像采集卡获取数字化视频图像信息。当细胞流过拉曼检测区时,图像中的像素点被累加,通过计算可设定相应的阈值来判断。此时程序输出断流信号,所有鞘流均停止,使细胞停留。本实施例中的细胞直径约5-10μm,在焦点附近的细胞会被光镊的光势陷阱力捕获并停留在焦点上。程序会驱动winspec32软件对光谱进行收集和保存,拉曼光谱积分时间15秒。光谱收集完成后,测得的每个细胞光谱减去来自鞘流液、毛细管和光学部件的背景光谱,并对光谱进行基线矫正、归一化处理后与原有的光谱细胞库进行对比和判别分析。
图3中,气路控制层101内设置有第一微阀门1011、第二微阀门1012、第三微阀门1013、第四微阀门1014、第五微阀门1015和第六微阀门1016,其中:第一微阀门1011布置在第一分选通道1036的上方,第一分选通道1036的导通或关闭由第一微阀门1011的排气或充气驱动pdms薄膜层102形变实现;第二微阀门1012布置在第二分选通道1037的上方,第二分选通道1037的导通或关闭由第二微阀门1012的排气或充气驱动pdms薄膜层102形变实现;第三微阀门1013布置在第三分选通道1040的上方,第三分选通道1040的导通或关闭由第三微阀门1013的排气或充气驱动pdms薄膜层102形变实现;第四微阀门1014布置在第四分选通道1041的上方,第四分选通道1041的导通或关闭由第四微阀门1014的排气或充气驱动pdms薄膜层102形变实现;第五微阀门1015布置在第五分选通道1044的上方,第五分选通道1044的导通或关闭由第五微阀门1015的排气或充气驱动pdms薄膜层102形变实现;第六微阀门1016布置在第六分选通道1045的上方,第六分选通道1045的导通或关闭由第六微阀门1016的排气或充气驱动pdms薄膜层102形变实现。
气路控制层101的具体工作过程如下:
当细胞经过拉曼检测去后,计算机判断出具体的细胞类型后,开始向微流泵发出工作信号,此时,多个鞘流组开始工作驱动细胞前进。计算机根据不同的细胞类型,控制相应的电磁阀实现不同微阀门的关闭和开启,例如:开启第一微阀门1011和第三微阀门1013,其余微阀门关闭,细胞则进入第三分选通道1040落入相应的细胞收集池。以上自动化控制都是用visualbasic和visualc++软件编程通过计算机来实现。
其中,第一微阀门1011、第二微阀门1012、第三微阀门1013、第四微阀门1014、第五微阀门1015和第六微阀门1016的控制由气路3、进气电磁阀4、排气电磁阀5、气源6和排气口7完成,气源6和排气口7分别通过三通阀接入微阀门的气路3,进气电磁阀4设置在气源6的出口处,排气电磁阀5设置在排气口7处。需要说明的是,如图4和图5所示,薄膜微阀结构是一种常用的微阀门,其采用聚二甲基硅氧烷制作,具体分上中下三层结构:上层为气路控制层101,中层为pdms薄膜层102,下层为流体流动通道,图4中的微阀门未充气,此时,聚合物膜未发生形变,流动通道未被阻隔,图5中的微阀门充气,此时,聚合物膜发生形变,流动通道被阻隔。具体的,多个微流泵接收计算机的控制信号、且能独立工作,每个鞘流通道连通单独的微流泵。
如图6所示,该系统具体包括如下操作步骤:
步骤1)获得细胞光谱数据:
将待检测细胞贴壁生长于细胞定位格子培养皿中,收集所有生长于坐标系内细胞的拉曼光谱数据并记录所收集细胞在培养皿中的空间坐标,将该培养皿中的所有细胞进行免疫荧光染色,通过格子的空间位置确定某个细胞的空间坐标,挑选出免疫荧光染色阳性细胞的拉曼光谱数据从而获得单一种类的细胞光谱数据集;
具体的,还包括对未知的待测细胞,将其拉曼光谱与已知的细胞数据共计算,根据判别分析结果判定未知细胞的细胞类型。目前该数据库已建立,不同细胞分选效率和结果可以参考公开的现有学术论文发表,该数据库在持续扩充中。
步骤2)建立分选模型:
根据光谱的统计特性,利用主成分分析方法-线性判别分析(pca-lda)法进行正交变换,获得对应特征值依次递减的特征向量,将光谱数据降维至多个综合指标,基于所述综合指标进行fisher判别分析,并采用pca-lda法建立判别函数;
需要说明的是,主成分分析方法-线性判别分析法(pca-lda),是处理多元光谱数据,区分判别细胞类型的有力方法。本实施例中采用pca-lda法建立判别函数。对未知的待测细胞,将其拉曼光谱与已知的细胞数据共计算,根据其判别分析结果判定未知细胞的细胞类型。
步骤3)微流检测:
从样品池中流出的检测细胞进入微流控芯片1,在多个鞘流组的作用下,检测细胞成单细胞排列依次通过拉曼检测区,当检测细胞通过拉曼焦点时鞘流停止,检测细胞在拉曼检测区静止15秒以通过拉曼光谱检测系统获取拉曼光谱;
根据不同细胞,在微流检测程序还可以设置异常图像识别与处理步骤:
3.1)检测细胞在拉曼检测区静止15秒以通过摄像机2012或ccd209获取细胞形态;
3.2)系统判断细胞形态是否完好,细胞边缘是否光滑;
3.3)当检测细胞的细胞形态完好且细胞边缘光滑,检测细胞允许通过第三分选通道1040、第四分选通道1041或第五分选通道1044进入收集池;
3.4)当检测细胞的细胞形态不完好或细胞边缘不光滑,检测细胞被放,通过第六分选通道1045进入废液池。
需要说明的是,在实际操作中,胰蛋白酶消化时间过长会使细胞活性下降,而胰酶消化时间过短则细胞会发生粘连。因此,在图像识别中通过调节阈值和机器学习算法,仅当细胞形态完好,边缘光滑的细胞才被允许进入收集池,其余不符合要求的细胞会被放弃。正常形态的细胞,其边缘光滑,细胞核细胞质清晰可见。非正常形态的细胞包括粘连细胞、凋亡细胞,其中,粘连细胞为两个细胞相互粘连,影响拉曼信号的准确性,凋亡细胞的细胞边缘不整,细胞皱缩,上述细胞均不能进入收集池,以保证收集池中细胞状态良好,有利于无损分选的实现。
步骤4)微流分选:
检测完毕后,检测细胞进入分选区域,基于检测结果,在多个鞘流组的推动下以及多个微阀门的选择下细胞进入不同的分选通道,落入相应的细胞收集池中。
最后需要说明的是,该系统中的活细胞所处的细胞培养液对可见光吸收很弱,以可见光为激发源的拉曼光谱技术适合生长于培养液中活细胞的研究,该系统中的低能量的近红外波长的激光对于细胞几乎没有损伤,细胞能够耐受较长时间的拉曼检测。该系统中的拉曼光谱基于细胞的物理性质拉曼散射,检测细胞无需染色和固定,不引人新混杂因素。
最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
- 还没有人留言评论。精彩留言会获得点赞!