一种转氨酶-辅酶共固定化工程菌细胞及应用的制作方法
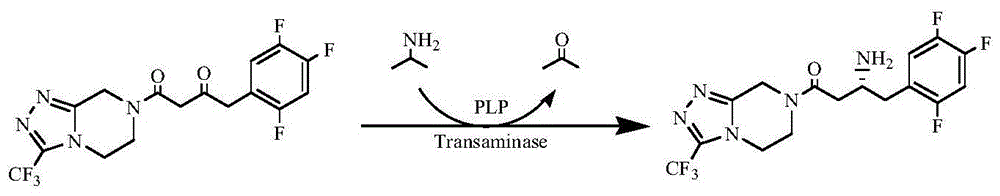
本发明属于生物工程技术领域,具体涉及一种转氨酶-辅酶共固定化微生物细胞的方法及以共固定化细胞为催化剂,合成西他列汀药物中间体(3r)-3-氨基-1-[3-(三氟甲基)-5,6,7,8-四氢-1,2,4-三唑并[4,3-a]吡嗪-7-基]-4-(2,4,5-三氟苯基)丁-1-酮的方法。
(二)
背景技术:
糖尿病是一种因胰岛素分泌缺陷或胰岛素作用障碍所致的以高血糖为主要特征的慢性代谢疾病。糖尿病可分为胰岛素依赖型糖尿病(insulin-dependentdiabetesmellitus,iddm,又称ⅰ型糖尿病)和非胰岛素依赖型糖尿病(non-insulindependentdiabetesmellitus,niddm,又称ⅱ型糖尿病)。其中ⅱ型糖尿病占总发病率的90%。糖尿病还会引起多种并发症,包括:视网膜病变引起的视力障碍和失明、终末期肾病、增加心血管患病率和死亡率、下肢血管病变引起的截肢等疾病,是严重威胁人类健康的一种多发病。因此,如何有效地防控和治疗糖尿病成为了医药和生物等领域的研究热点。西他列汀(sitagliptin),是一种二肽基肽酶-iv(dpp-4)抑制剂,可有效降低并稳定ⅱ型糖尿病患者血糖水平,且无体重增加及引起水肿等常见副作用是近年来国内外临床首选的ⅱ型糖尿病治疗药物之一,市场价值巨大。
西他列汀的合成关键在于手性胺基团的构建。转氨酶(aminotransferase,transaminase,ats)(ec2.6.1.x)不对称催化西他列汀前体酮3-酮基-1-[3-(三氟甲基)-5,6,7,8-四氢-1,2,4-三唑并[4,3-a]吡嗪-7-基]-4-(2,4,5-三氟苯基)丁-1-酮制备西他列汀中间体(3r)-3-氨基-1-[3-(三氟甲基)-5,6,7,8-四氢-1,2,4-三唑并[4,3-a]吡嗪-7-基]-4-(2,4,5-三氟苯基)丁-1-酮具有产物光学纯度高、反应条件温和、生产成本低廉等优势。2010年codexis公司选育一种r-转氨酶,并用于西他列汀中间体的合成,产物产率达92%,e.e.值>99%(2010,savileck,science)。2017年何人宝等人筛选、改造得到一株新型ω-转氨酶bgta,可西他列汀前体酮不对称转氨制备西他列汀中间体,转化率可以达到91%,e.e.>99%(cn201710543569.6)。但目前的转氨酶不对称合成西他列汀中间体技术中仍存在一些不足,游离转氨酶稳定性低,储运操作环境要求高,且难以用于长时间反应;酶制剂无法回收,酶制剂成本高;反应液中存在大量游离蛋白,影响产物的收率与纯度。
利用固定化及共固定化技术对细胞处理,可增强酶和细胞的稳定性,提高细胞对有机溶剂、机械剪切力耐受,避免细胞破裂后内容物释放至反应体系,降低对产物纯化工艺造成的影响,达到生物催化剂循环利用,简化后处理工艺,降低“三废”排放等目标。
2013年rehn等人将转氨酶细胞分别固定在海藻酸钙、三氧化钛、壳聚糖等载体材料上,虽然连续8次反应后其固定化酶活性仍大于90%,但反应规模较小,批次循环少,反应需要添加额外的辅酶,转化率也相对较低(2013,rehng,etal.,journalbiotechnology)。2014年andrade等人将转氨酶大肠杆菌与辅酶共固定化在甲基丙烯酸颗粒上,e.e.>99%,并且不必额外添加辅酶,能够在有机相中反应,其反应可长达10天,但该方法转化率较低,批次反应后酶活下降明显(2014andradelh,etal.,organicletters)。
目前国内外在固定化细胞催化西他列汀药物手性中间体合成领域研究较少,相关研究存在着总酶活回收率低、固定化酶制备成本高、催化活力不理想、稳定性差、底物浓度不高、有机溶剂耐受性差等问题,严重限制了固定化生物催化剂在他汀药物关键中间体的生产中的应用。
(三)
技术实现要素:
本发明目的是提供一种转氨酶-plp共固定化基因工程菌细胞技术,即以活性炭为吸附载体,以聚乙烯亚胺、戊二醛为交联剂对含转氨酶基因大肠杆菌细胞与辅酶plp进行共固定化的方法,以及该固定化细胞在制备西他列汀药物手性中间体中的应用。本发明方法联合使用吸附与共价交联技术,可实现共固定化转氨酶细胞与辅酶的高效制备,所得共固定化细胞酶活回收率高,稳定性好,有机溶剂耐受性强,成本低廉。将所得共固定化细胞应用于催化西他列汀前体酮反应体系中,生物酶法手性合成西他列汀药物中间体,并提高底物浓度、批次稳定性等主要指标。
本发明采用的技术方案是:
本发明提供一种转氨酶-辅酶磷酸吡哆醛(plp)共固定化基因工程菌细胞,所述共固定化基因工程菌细胞按如下方法制备:将转氨酶基因工程菌经发酵培养获得的湿菌体用ph9.0、100mm甘氨酸缓冲液悬浮,获得菌悬液;向菌悬液中加入辅酶plp在室温(20-30℃),500rpm条件下水浴搅拌30min;再加入活性炭,500rpm条件下水浴搅拌30min;再加入质量浓度5%聚乙烯亚胺水溶液,在室温,500rpm条件下水浴搅拌交联1-2h;然后加入质量浓度50%戊二醛水溶液,在室温,500rpm条件下水浴搅拌交联1-2h,抽滤,滤饼用ph9.0、100mm甘氨酸缓冲液清洗两次,抽滤去除缓冲液,即获得转氨酶-plp共固定化细胞;所述菌悬液中湿菌体含量为25-150g/l(优选50g/l);所述辅酶plp加入量以固定化反应液体积计为0.1-2g/l(优选0.5g/l);所述活性炭加入量以固定化反应液体积计为5-20g/l(优选10g/l);所述50%聚乙烯亚胺水溶液体积用量以固定化反应液体积计为2-6%(优选4%);所述戊二醛水溶液体积用量以固定化反应液体积计为0.4-2%(优选1%)。
所述转氨酶基因工程菌由seqidno.1所示核苷酸序列(编码蛋白氨基酸序列为seqidno.2所示)导入宿主菌大肠杆菌获得。
所述活性炭为分析级颗粒活性炭,在加入前先进行预处理,所述预处理方法为:将活性炭过40目筛,再加入1m盐酸中,50℃搅拌1h,抽滤,用蒸馏水清洗滤液至中性(ph值为6.9-7.1),滤饼烘干,即为预处理后的活性炭。
进一步,本发明所述酶制剂按如下方法制备:将转氨酶基因工程菌接种至含有终浓度50μg/ml卡那霉素抗性的lb液体培养基,37℃,200rpm下培养8h,再以体积浓度10%接种量接种至新鲜的含有终浓度50μg/ml卡那霉素抗性的发酵培养基中,于37℃,500rpm下培养至菌体od600达6~8,加入终浓度为0.1mm的iptg,28℃下诱导培养11h,发酵液4℃、8000rpm离心10min,弃去上清液,收集湿菌体,-20℃保存。
本发明涉及所述转氨酶-plp共固定化细胞在不对称合成制备(3r)-3-氨基-1-[3-(三氟甲基)-5,6,7,8-四氢-1,2,4-三唑并[4,3-a]吡嗪-7-基]-4-(2,4,5-三氟苯基)丁-1-酮中的应用,反应式如附图1所示。
本发明还涉及利用所述转氨酶-plp共固定化基因工程菌细胞不对称还原制备西他列汀中间体中的方法,所述方法包括:
(1)将转氨酶基因工程菌经发酵培养获得的湿菌体用ph9.0、100mm甘氨酸缓冲液悬浮,获得菌悬液;向菌悬液中加入辅酶plp,在20-30℃,500rpm条件下水浴搅拌30min;再向菌悬液中加入活性炭,在20-30℃,500rpm条件下水浴搅拌30min;然后加入质量浓度5%聚乙烯亚胺水溶液,在20-30℃,500rpm条件下水浴搅拌交联1h;最后加入质量浓度50%戊二醛水溶液,在20-30℃,500rpm条件下水浴搅拌交联1h,抽滤,滤饼用ph9.0、100mm甘氨酸缓冲液清洗两次,抽滤去除缓冲液,获得转氨酶-plp共固定化细胞;所述菌悬液中湿菌体含量为25-150g/l(优选50g/l);所述辅酶plp加入量以固定化反应液体积计为0.1-2g/l(优选0.5g/l);所述活性炭加入量以固定化反应液体积计为5-20g/l(优选10g/l);所述50%聚乙烯亚胺水溶液体积用量以固定化反应液体积计为2-6%(优选4%);所述戊二醛水溶液体积用量以固定化反应液体积计为0.4-2%(优选1%)
(2)以转氨酶-plp共固定化细胞为催化剂,加入以3-酮基-1-[3-(三氟甲基)-5,6,7,8-四氢-1,2,4-三唑并[4,3-a]吡嗪-7-基]-4-(2,4,5-三氟苯基)丁-1-酮为底物,以二甲基亚砜(dmso)为助溶剂,于ph8.0-10.0的缓冲液(优选ph9.5、100mm三乙醇胺缓冲液),以异丙胺为反应氨基供体,在20-40℃、400-700rpm(优选45℃、500rpm)条件下反应12-36h,于反应液中获得西他列汀中间体——(3r)-3-氨基-1-[3-(三氟甲基)-5,6,7,8-四氢-1,2,4-三唑并[4,3-a]吡嗪-7-基]-4-(2,4,5-三氟苯基)丁-1-酮。反应液经后处理(分离纯化)获得西他列汀中间体。
进一步,所述催化剂用量为25-150g/l反应体系,底物终浓度25-150g/l反应体系,二甲基亚砜体积用量为30-70%,异丙胺添加量为0.5-3mm。
所述转氨酶-plp共固定化细胞不对称合成制备西他列汀中间体的后处理方法为:转氨酶-plp共固定化细胞催化合成西他列汀后,获得底物、产物和共固定化细胞的混合液;将混合液抽滤得到滤饼a和滤液a,再用乙酸乙酯清洗滤饼a得到滤饼b和滤液b,最后用蒸馏水清洗滤饼b得到滤饼c和滤液c。
用浓盐酸将滤液cph调至1.5,与滤液b混合搅拌20min,得到有机相a和水相a;用0.1m的盐酸再次反萃取滤液b,混合搅拌20min,得到有机相b和水相b;合并滤液a、水相a和水相b,用浓盐酸将反应液ph调至1.5,用二氯甲烷萃取一次,获得有机相c和水相c;水相c用氢氧化钠调节ph至12,再用二氯甲烷萃取,获得有机相d和水相d,水相d中再加入二氯甲烷萃取,获得有机相e和水相e,合并有机相d和有机相e并用饱和氯化钠水洗二次,加入无水硫酸钠干燥,抽滤去除硫酸钠,45℃下旋转蒸发,得到西他列汀手性中间体;本发明所述滤液a-滤液c,滤饼a-滤饼c,有机相a-有机相e,水相a-水相e中的字母均无含义,为了便于表述而命名。
固定化酶酶活的定义:
在45℃,500rpm反应条件下,每小时催化底物生成1μmol产物所需要的酶量即为1个酶活力单位,用u表示。
本发明中产物的检测方法:液相色谱柱:zorbaxeclipsexdb-c18(4.6*150mm,5-micron),流动相:10mm乙酸铵:乙腈(50:50),流速:1.0ml/min,柱温:40℃,保留时间:产物:2.2min;西他列汀前体酮底物:3.2min,检测波长:205nm。
与现有技术相比,本发明的有益效果主要体现在:本发明提供了一种转氨酶-plp共固定化细胞的方法,所得固定化细胞总酶活回收>80%。以固定化的大肠杆菌e.coli细胞做为生物催化剂进行西他列汀的生物催化制备,底物浓150g/l,反应24h,底物转化率在95%以上,e.e.>99%。将共固定化细胞回收利用,底物浓100g/l,重复反应15批次,酶活无明显下降,各批次底物转化率均大于99%,e.e.>99%。本发明催化西他列汀中间体合成无需额外辅酶添加,产品产率与纯度高,并且可简化工艺步骤,减少“三废”排放,能够降低生产成本的20%,且具备大规模应用的潜力,在西他列汀手性中间体的工业化生产中具有极高应用价值。
(四)附图说明
图1为转氨酶不对称合成西他列汀反应式;
图2为pmd18-t-bgta重组质粒物理图谱;
图3为pet28b-bgta重组质粒物理图谱。
(五)具体实施方式
下面结合具体实施例对本发明进行进一步的描述,但本发明的保护范围并不仅限于此:
实施例1:活性炭预处理
活性炭(购自上海凌峰化学试剂有限公司,分析级)经40目筛子过筛处理。称取100g过筛后的活性炭加入1000ml、1m盐酸中,50℃搅拌1h。抽滤,用蒸馏水清洗活性炭并冲洗至滤液接近中性(ph值为6.9-7.1),滤饼60℃烘干,即为预处理后的活性炭100g,室温保存待用。
实施例2:转氨酶基因工程菌细胞的培养
(1)转氨酶基因工程菌的构建:
根据基因序列seqidno.1设计引物1(ccgcatatggctatcatccaggttcagc)、引物2(ttgctcgagtcaagccggaacagaagag),并分别在引物1和引物2中引入了ndei和xhoi限制性酶切位点(下划线标记)。在引物1和引物2的引发下,利用高保真pfudna聚合酶进行扩增,以重组质粒pmd18-t-bgta(图2)为模板,获转氨酶bgta基因序列,测序后利用ndei和xhoi限制性内切酶(takara)对扩增片段进行处理,并利用t4dna连接酶(takara)将该片段同用相同的限制性内切酶处理的商业化载体pet28b(invitrogen)进行连接,构建表达载体pet28b-bgta(图3)。将构建的表达载体pet28b-bgta转化至大肠杆菌bl21(de3)(invitrogen)中(42℃,90s),涂布于含有50μg/ml卡那霉素抗性的lb平板,37℃下培养8-12h,随机挑取克隆抽提质粒进行测序鉴定,筛选获得含有表达重组质粒pet28b-bgta的重组大肠杆菌bl21(de3)/pet28b-bgta。
(2)将转氨酶基因工程菌bl21(de3)/pet28b-bgta接种至含有终浓度50μg/ml卡那霉素抗性的lb液体培养基,37℃,200rpm下培养8h,再以体积浓度10%接种量接种至新鲜的含有终浓度50μg/ml卡那霉素抗性的发酵培养基中,于37℃,500rpm下培养至菌体od600达6~8,加入终浓度为0.1mm的iptg,28℃下诱导培养11h,发酵液4℃、8000rpm离心10min,弃去上清液,收集沉淀,即获得转氨酶基因工程菌湿菌体。该菌体可直接作为生物催化剂或者用于固定化。
发酵培养基配方(g/l):蛋白胨20,酵母粉15,nacl10,(nh4)2so43,甘油20,kh2po41.36,k2hpo4·3h2o2.28,mgso4·7h2o0.7,ph7.0。
实施例3:转氨酶-plp共固定化工程菌细胞制备
用蒸馏水配制ph9.0的甘氨酸缓冲液(摩尔浓度为100mm),称取50g实施例2方法制备的转氨酶基因工程菌湿菌体加入到1l、ph9.0、100mm甘氨酸缓冲液中,得到菌悬液1l。准确称取0.5g的plp,添加到1l菌悬液进行混合,在室温(20-30℃),500rpm条件下,水浴搅拌浆搅拌吸附30min;称取10g(干重)实施例1预处理后的活性炭(按10g/l的比例)添加到1l菌悬液进行混合,500rpm水浴搅拌浆搅拌吸附30min;再加入40ml质量浓度5%聚乙烯亚胺水溶液(按体系总体积1l的4%添加),在室温,500rpm条件下,水浴搅拌浆搅拌交联1h;然后加入10ml质量浓度50%戊二醛水溶液(按体系总体积1l的1%添加),在室温,500rpm条件下,水浴搅拌浆搅拌交联1h,固定化结束;抽滤除去上清液,所得滤饼用甘氨酸缓冲液(ph9.0、100mm)清洗两次,抽滤除去多余水份后,获得转氨酶-plp共固定化细胞,置4℃冰箱保存备用。
实施例4:转氨酶-plp共固定化细胞酶活检测
以实施例3方法得到的转氨酶基因工程菌固定化细胞用于催化西他列汀前体酮,催化体系(10ml)组成及催化条件如下:ph9.0的0.2m三乙醇胺含浓度1m氨基供体异丙胺为缓冲液,底物的浓度为25g/l,助溶剂dmso的添加量为50%(v/v),加入0.3g的共固定化细胞,在500rpm,45℃下反应2小时,取1ml反应液,盐酸调ph1-2终止反应,稀释、过滤后进行hplc检测。同样条件下,以转氨酶基因工程菌湿菌体细胞作为对照。
在上述反应条件下,每小时催化底物生成1μmol产物所需要的酶量即为1个酶活力单位,用u表示。
实施例5:西他列汀前体酮、西他列汀以及西他列汀的(s)型对映体的液相检测方法。
高效液相色谱仪器:shimadzulc-16系统-spd-16紫外检测器和hitachi8dd-0801系统-1410紫外检测器。
检测转化率是:液相色谱柱:zorbaxeclipsexdb-c18(4.6*150mm,5-micron),流动相:10mm乙酸铵:乙腈(50:50),流速:1.0ml/min,柱温:40℃,保留时间:产物:2.2min;西他列汀前体酮底物:3.2min,检测波长:205nm。
检测产物e.e.值:手性色谱柱为chiralpakad-h(150×4.6mm,5μm),流动相为乙醇/正庚烷/二乙胺=60:40:0.1,流速0.8ml/min,柱温35℃,检测波长:268nm。西他列汀前体酮和西他列汀的保留时间为10.1min(检测时间是12min)和5.9min。西他列汀的(s)型对映体的保留时间为8.4min。(液相是shimadzulc-20ad系统-spd20a检测器)
产物e.e.p计算公式:
e.e.p=(cr-cs)/(cr+cs)×100%
cr为西他列汀的峰面积,cs为s-对映体的峰面积。
实施例6:转氨酶基因工程菌固定化细胞的活性炭优化
取5g实施例2方法制备的转氨酶基因工程菌湿菌体加入到100ml甘氨酸缓冲液(100mm、ph9.0)中,再分别加入0.5g,1.0g,1.5g,2.0g(干重)实施例1预处理后的活性炭,混合,在室温,500rpm条件下,水浴搅拌浆搅拌吸附30min;再加入4ml质量浓度5%聚乙烯亚胺水溶液(按体系的4%添加),在室温,500rpm条件下,水浴搅拌浆搅拌交联1h;然后加入1ml质量浓度50%戊二醛水溶液(按体系的1%添加),在室温,500rpm条件下,水浴搅拌浆搅拌交联1h,固定化结束;抽滤除去上清液,滤饼用100mm、ph9.0甘氨酸缓冲溶液清洗两次,抽滤除去多余水份后,获得固定化细胞,置4℃冰箱保存备用。采用实施例4方法测定相对酶活(以游离工程菌细胞活性为100%)结果见表1所示,所得优选活性炭添加量为10g/l。
表1不同活性炭添加量对固定化细胞相对酶活的影响
实施例7:转氨酶基因工程菌固定化细胞的聚乙烯亚胺优化
取5g实施例2方法制备的转氨酶基因工程菌湿菌体加到100ml甘氨酸缓冲液(100mm、ph9.0)中,再加入1.0g(干重)实施例1预处理后的活性炭混合,在室温,500rpm条件下,水浴搅拌浆搅拌吸附30min;分别加入2ml,3ml,4ml,5ml,6ml质量浓度5%聚乙烯亚胺水溶液(分别按体系的2%,3%,4%,5%,6%(v/v)添加),在室温,500rpm条件下,水浴搅拌浆搅拌交联1h;再加入1ml质量浓度50%戊二醛水溶液(按体系的1%添加),在室温,500rpm条件下,水浴搅拌浆搅拌交联1h,固定化结束;抽滤除去上清液,滤饼用100mm、ph9.0甘氨酸缓冲溶液清洗两次,抽滤除去多余水份后,获得固定化细胞,置4℃冰箱保存备用。取样采用实施例4方法液相检测相对酶活,结果见表2所示,所得优选5%聚乙烯亚胺水溶液添加量为4%(v/v)。
表2:不同聚乙烯亚胺添加量对固定化细胞酶活影响
实施例8:转氨酶基因工程菌固定化细胞的戊二醛优化
取10g实施例2方法制备的转氨酶基因工程菌湿菌体溶解到100ml(100mm、ph9.0)甘氨酸缓冲液中,再加入1g(干重)实施例1预处理后的活性炭,混合,在室温,500rpm条件下,水浴搅拌浆搅拌吸附30min;再加入4ml质量浓度5%聚乙烯亚胺水溶液(按体系的4%(v/v)添加),在室温,500rpm条件下,水浴搅拌浆搅拌交联1h;分别加入0.4ml,0.8ml,1.0ml,1.6ml,2ml质量浓度50%戊二醛水溶液(分别按体系的0.4%,0.8%,1%,1.6%,2%(v/v)添加),在室温,500rpm条件下,水浴搅拌浆搅拌交联1h,固定化结束;抽滤除去上清液,滤饼用100mm、ph9.0甘氨酸缓冲溶液清洗两次,抽滤除去多余水份后,获得固定化细胞,置4℃冰箱保存备用。采用实施例4方法测定上述固定化细胞相对酶活,结果见表3所示,所得优选50%戊二醛水溶液添加量为1%(v/v)。
表3:不同戊二醛添加量对固定化细胞酶活影响
实施例9:转氨酶基-plp共固定化细胞的辅酶plp优化
取10g实施例2方法制备的转氨酶基因工程菌湿菌体溶解到100ml(100mm、ph9.0)甘氨酸缓冲液中,分别加入(0mm,0.5mm,1mm,2mm,4mm)的plp,混合,在室温,500rpm条件下,水浴搅拌浆搅拌吸附30min;再加入1g(干重)实施例1预处理后的活性炭,混合,在室温,500rpm条件下,水浴搅拌浆搅拌吸附30min;再加入4ml质量浓度5%聚乙烯亚胺水溶液(按体系的4%(v/v)添加),在室温,500rpm条件下,水浴搅拌浆搅拌交联1h;加入1.0ml质量浓度50%戊二醛水溶液(按体系的1%添加),在室温,500rpm条件下,水浴搅拌浆搅拌交联1h,固定化结束;抽滤除去上清液,滤饼用100mm、ph9.0甘氨酸缓冲溶液清洗两次,抽滤除去多余水份后,获得共固定化细胞,置4℃冰箱保存备用。
采用实施例4方法测定上述共固定化细胞相对酶活,结果见表4所示,相比2mm的辅酶plp添加量,3、4mm的添加量其酶活并未有显著的提高,考虑到辅酶成本较高,所得优选辅酶plp添加量为2mm。
表4:不同磷酸吡哆醛添加量对固定化细胞酶活影响
实施例10:转氨酶-plp共固定化细胞的催化体系中dmso添加量优化
50ml反应体积,取实施例3中的3.0g转氨酶-plp共固定化细胞用于催化反应,底物的浓度为50g/l,底物溶解于助溶剂dmso中,添加量分别为总体积的30%,40%,50%(v/v),缓冲体系为100mm,ph9.0三乙醇胺-盐酸的缓冲液,异丙胺添加量为底物浓度(mol/l)的8倍,在500rpm,45℃条件下反应12h,取1ml反应液,盐酸调ph1-2终止反应,稀释、过滤后进行hplc检测,其结果见表5。dmso具有一定的毒害作用,因此随着添加量的增加而转化率降低,但考虑底物的难溶性和底物浓度的增加,所得优选dmso添加量为50%。
表5:不同dmso添加量对共固定化细胞转化率的影响
实施例11:转氨酶-plp共固定化细胞的催化体系中异丙胺添加量优化
50ml反应体积,取实施例3中3.0g的转氨酶-plp共固定化细胞用于催化反应,底物的浓度为50g/l,底物溶解于助溶剂dmso中,添加量为总体积的50%(v/v),缓冲体系为100mm,ph9.0三乙醇胺-盐酸的缓冲液,异丙胺添加量分别为底物浓度(mol/l)的4,6,8,10,12倍,在500rpm,45℃条件下反应12h,取1ml反应液,盐酸调ph1-2终止反应,稀释、过滤后进行hplc检测,其结果见表6,随着氨基供体的增加转化率也随之提高,但高浓度的异丙胺并未获得显著的效果,且需要大量的酸液调整ph,增加了生产成本,所以综合考虑后优选异丙胺添加量为8倍底物浓度。
表6:不同异丙胺添加量对共固定化细胞转化率的影响
实施例12:转氨酶共固定化细胞的催化体系中温度优化
50ml反应体积,取实施例3中3.0g的转氨酶-plp共固定化细胞用于催化反应,底物的浓度为50g/l,底物溶解于助溶剂dmso中,添加量为总体积的50%(v/v),缓冲体系为100mm,ph9.0三乙醇胺-盐酸的缓冲液,异丙胺添加量为底物浓度(mol/l)的8倍,分别在25℃,35℃,45℃,55℃,500rpm的条件下反应12h,取1ml反应液,盐酸调ph1-2终止反应,稀释、过滤后进行hplc检测,其结果见表7。转氨反应是吸热反应,因此温度的升高有利于反应速率的加快,但高于50℃时底物产物会变性生成副产物,所以优选反应温度为45℃。
表7:不同反应温度对共固定化细胞转化率的影响
实施例13:转氨酶-plp共固定化细胞的催化体系中共固定化菌体量优化
50ml反应体积,分别取实施例3中的转氨酶-plp共固定化细胞用于催化反应(分别为底物浓度的0.5,1.0,1.5,2.0倍),底物的浓度为50g/l,底物溶解于助溶剂dmso中,添加量为总体积的50%(v/v),缓冲体系为100mm,ph9.0三乙醇胺-盐酸的缓冲液,异丙胺添加量为底物浓度(mol/l)的8倍,在45℃,500rpm的条件下反应12h,取1ml反应液,盐酸调ph-2终止反应,稀释、过滤后进行hplc检测,其结果见表8。共固定化细胞添加量增加能够显著提高反应速率,但过量的细胞大量吸附产物底物,不利于后处理的进行,所以优选共固定化菌体添加量为1倍。
表8:不同共固定化细胞添加量对共固定化细胞转化率的影响
实施例14:转氨酶共固定化细胞的催化体系中ph优化
50ml反应体积,取实施例3中的3.0g转氨酶-plp共固定化细胞用于催化反应,底物的浓度为50g/l,底物溶解于助溶剂dmso中,添加量为总体积的50%(v/v),缓冲体系为100mm三乙醇胺-盐酸的缓冲液,整个反应过程ph分别稳定控制为8.0,8.5,9.0,9.5,10.0,异丙胺添加量为底物浓度(mol/l)的8倍,在500rpm,45℃条件下反应12h,取1ml反应液,盐酸调ph1-2终止反应,稀释、过滤后进行hplc检测,其结果见表9。所得优选反应体系ph为9.5。
表9:不同ph对共固定化细胞转化率的影响
实施例15:转氨酶共固定化细胞的催化体系中共固定化底物浓度优化
50ml反应体积,分别取实施例3中的转氨酶-plp共固定化细胞用于催化反应,底物的浓度分别为25,50,75,100,125g/l,底物溶解于助溶剂dmso中,添加量为总体积的50%(v/v),缓冲体系为100mm,ph9.0三乙醇胺-盐酸的缓冲液,异丙胺添加量为底物浓度(mol/l)的8倍,在45℃,500rpm的条件下反应12h,取1ml反应液,盐酸调ph1-2终止反应,稀释、过滤后进行hplc检测,其结果见表10。可见当底物浓度在25-100g/l时,底物转化率均>98%所得优选底物浓度为100g/l。
表10:不同底物浓度对共固定化细胞转化率的影响
实施例16:转氨酶共固定化细胞的催化反应批次实验
100ml反应体积,分别取实施例3中的12g转氨酶-plp共固定化细胞用于催化反应,底物的浓度为100g/l,底物溶解于助溶剂dmso中,添加量为总体积的50%(v/v),缓冲体系为100mm,ph9.0三乙醇胺-盐酸的缓冲液,异丙胺添加量为底物浓度(mol/l)的8倍,在45℃,500rpm的条件下反应24h,取1ml反应液,盐酸调ph1-2终止反应直接用流动相稀释,过滤后进行hplc检测,其结果见表11。底物的浓度为100g/l,连续反应15个批次,转化率均大于99%,e.e.大于99%,具有工业化生产的潜力。
表11:批次反应结果
实施例17:批次反应液后处理
转氨酶共固定化细胞催化合成西他列汀后,获得底物、产物和共固定化细胞的混合液;将100ml混合液抽滤得到滤饼a和滤液a,再用30ml乙酸乙酯清洗滤饼a得到滤饼b和滤液b,最后用40ml蒸馏水清洗滤饼b得到滤饼c和滤液c。
用浓盐酸将滤液cph调至1.5,与滤液b混合搅拌20min,得到有机相a和水相a;用30ml0.1m的盐酸再次反萃取滤液b,混合搅拌20min,得到有机相b和水相b;合并滤液a、水相a和水相b,用浓盐酸将反应液ph调至1.5,用200ml二氯甲烷萃取一次,获得有机相c和水相c;水相c用4m氢氧化钠调节ph至12,再用200ml二氯甲烷萃取,获得有机相d和水相d,水相d中再加入200ml二氯甲烷萃取,获得有机相e和水相e,合并有机相d和有机相e并用50ml饱和氯化钠水洗二次,加入无水硫酸钠干燥,抽滤去除硫酸钠,45℃下旋转蒸发,得到西他列汀手性中间体,收率为85.4%,e.e.大于99%;本发明所述滤液a-滤液c,滤饼a-滤饼c,有机相a-有机相e,水相a-水相e中的字母均无含义,为了便于表述而命名。
实施例18:羰基还原酶与辅酶nad的共固定化细胞
用蒸馏水配制ph7.0的磷酸钾盐(k2hpo4-kh2po4)缓冲液(摩尔浓度为100mm),称取10g羰基还原酶基因工程菌湿菌体加入到100ml、ph7.0、100mm磷酸钾盐缓冲液中,得到菌悬液100ml。称取nadph浓度0.5mm,加入到菌悬液中,在室温(20-30℃),500rpm条件下,水浴搅拌浆搅拌吸附30min;准确称取18g(干重)实施例1预处理后的活性炭(按18g/l的比例)添加到100ml菌悬液进行混合,在室温(20-30℃),500rpm条件下,水浴搅拌浆搅拌吸附30min;再加入4ml质量浓度5%聚乙烯亚胺水溶液(按体系总体积100ml的4%添加),在室温,500rpm条件下,水浴搅拌浆搅拌交联1h;然后加入3ml质量浓度50%戊二醛水溶液(按体系总体积100ml的3%添加),在室温,500rpm条件下,水浴搅拌浆搅拌交联1h,固定化结束;抽滤除去上清液,所得滤饼用磷酸钾盐缓冲液(ph7.0、100mm)清洗两次,抽滤除去多余水份后,获得羰基还原酶基因工程菌固定化细胞,置4℃冰箱保存备用。
催化体系(100ml)组成及催化条件如下:60ml磷酸钾缓冲液(ph7.0、100mm)中加入40ml异丙醇和(s)-6-氯-5-羟基-3-羰基己酸叔丁酯20g(终浓度为100g/l),16g共固定化细胞。30℃,转速150r/min条件下反应16h,取样检测转化率为50%。结果表明羰基还原酶与辅酶nad的共固定化细胞效率低下,说明转氨酶-plp共固定化细胞具有独特性。
应理解,在阅读了本发明的上述内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
序列表
<110>浙江工业大学
<120>一种转氨酶-辅酶共固定化工程菌细胞及应用
<160>4
<170>siposequencelisting1.0
<210>1
<211>978
<212>dna
<213>未知(unknown)
<400>1
atggctatcctccaggttcagcagatcatgcacgaaaacccgctgcacgctaaggctccg60
cacgaaccgcgttacgaagacggctcggcgttctgcgacggtaattacgttccgatcacc120
gaagctaccgttccgctggttgacgctggtttctataccgctgacgctgcttacgacgtt180
gttaccgtttctcgtggtaacttcttccgtctgggcgaccacctggcccgtatggaagaa240
tcttctgctaaaattttcctggaaaacccgttcaaccgtgaccaggttaaagaaatcctg300
cacaacctggttcgtaacgctggtctgaaagacgctatggttacctggaccgttacccgt360
ggtccgctgactgttgactttcgtgaccgtggtgctatgaaaaacgctatgttcgctagc420
gcttgcccgttcttcttccaggctgacgacgaagttcgtacccgtggttctcatctgctg480
atctctagactgtacaaccgtatctctgctaaagctgttgacccgaccgctaaaaacttc540
cactggatggacatgaaactggctattttcgaagctatgacccaggaaaaagacctggct600
gttctggttgactgctctaataacctgaccgaagctgatggttttaacgttttcttcgct660
aaaaacggtgaactgtacaccccggctgaaggttgcctgctgggtatcacacgtcagtct720
gtattcgacgtcgcggctgaactgggtatcaaagttaacatcggtaaatacaccccgacc780
cagctgtatgaagctgacgaggcgttcacctcttcttcgggcggtggcataatgccggta840
agcgctatcgacgaccagagcctgggtaaccgtaacggtccgggtccgctctctgaaaaa900
atccacaacctgtactgggaaaaacgttgggctggttggcacgctcagccggctgaatac960
ttctcttctcttccggct978
<210>3
<211>326
<212>prt
<213>未知(unknown)
<400>3
metalaileleuglnvalglnglnilemethisgluasnproleuhis
151015
alalysalaprohisgluproargtyrgluaspglyseralaphecys
202530
aspglyasntyrvalproilethrglualathrvalproleuvalasp
354045
alaglyphetyrthralaaspalaalatyraspvalvalthrvalser
505560
argglyasnphepheargleuglyasphisleualaargmetgluglu
65707580
serseralalysilepheleugluasnpropheasnargaspglnval
859095
lysgluileleuhisasnleuvalargasnalaglyleulysaspala
100105110
metvalthrtrpthrvalthrargglyproleuthrvalaspphearg
115120125
aspargglyalametlysasnalametphealaseralacysprophe
130135140
phepheglnalaaspaspgluvalargthrargglyserhisleuleu
145150155160
ileserargleutyrasnargileseralalysalavalaspprothr
165170175
alalysasnphehistrpmetaspmetlysleualailephegluala
180185190
metthrglnglulysaspleualavalleuvalaspcysserasnasn
195200205
leuthrglualaaspglypheasnvalphephealalysasnglyglu
210215220
leutyrthrproalagluglycysleuleuglyilethrargglnser
225230235240
valpheaspvalalaalagluleuglyilelysvalasnileglylys
245250255
tyrthrprothrglnleutyrglualaaspglualaphethrserser
260265270
serglyglyglyilemetprovalseralaileaspaspglnserleu
275280285
glyasnargasnglyproglyproleuserglulysilehisasnleu
290295300
tyrtrpglulysargtrpalaglytrphisalaglnproalaglutyr
305310315320
pheserserleuproala
325
<210>3
<211>28
<212>dna
<213>未知(unknown)
<400>3
ccgcatatggctatcatccaggttcagc28
<210>4
<211>28
<212>dna
<213>未知(unknown)
<400>4
ccgcatatggctatcatccaggttcagc28
- 还没有人留言评论。精彩留言会获得点赞!