谷氨酸脱氢酶基因受抑制的类球红细菌及其制备方法和法尼醇的生产方法与流程
本发明涉及生物技术领域,具体地涉及一种谷氨酸脱氢酶(gdha)基因受抑制的类球红细菌、其制备方法以及利用该类球红细菌生产法尼醇的方法。
背景技术:
foh(1-羟基-3,7,11-三甲基-2,6,10-十二碳三烯;c15h26o)是一种无环倍半萜,广泛分布在多种植物精油中,例如寻常椴、加南芥、茉莉、玫瑰和柠檬草等。foh具有独特的甜香味,常被用来作为化妆品、香皂、芳香油和香水的香料。它还具有信号转导、群体感应、细胞增殖等多种生物学功能。foh还被用作胃溃疡和维生素合成药物的原料,因为其能诱导多种肿瘤细胞系的凋亡。因此,其衍生物已成为候选的抗癌药物。此外,由于其在水中的溶解性较低并具有高能量也可以作为生物燃料的替代品。随着人们对foh的需求日益增长,且从自然资源中提取的产量极低,化学合成的纯度低,用微生物代谢工程生产foh变得十分必要。
目前,foh的生物合成途径在植物和微生物中都已基本阐明。植物中foh合成酶或微生物中混杂的磷酸酶可以通过法尼酰基焦磷酸盐(fpp)的去磷酸化作用生成foh。fpp是由fpp合成酶通过一个二甲基丙烯焦磷酸盐(dmapp)和两个异戊基焦磷酸盐(ipp)的头尾缩合形成的。这两种物质的合成有两种途径:一条是2-c-甲基-d-赤藓醇-4-磷酸(2-c-methyl-d-erythritol4-phosphatesmep)途径;另一条是甲羟戊酸(mevalonatemva)途径。实验表明,fpp的可用性对foh的合成具有重要意义,增加fpp池的大小可以促进微生物高水平的生产foh。而参与fpp的生物合成酶经常参与生成与还原的盐酸酰胺腺嘌呤二核苷酸(nadph)相当的代谢物,并在其中发挥着主导作用。类球红细菌作为辅酶q10的生产菌株,拥有完整的mep途径。但是,想要提高生物体内foh的产量,生物体内的还原辅因子nadph量是远远不够的。而在工业应用中,需要还原辅因子如nadh和nadph的生物合成过程,如果以等摩尔的量投入,将会非常昂贵。
目前已公开了使用类球红细菌培养进行法尼醇发酵生产的方法,例如,cn107119001a公开了一种基因工程化类球红细菌及其制备方法和法尼醇的生产方法。其通过将来自于鼠疫耶尔辛杆菌yersiniapestisco92的磷酸酶pgpb基因转化到类球红细菌能够在胞内表达,并产生具有活性的磷酸酶pgpb,从而直接催化类球红细菌mep途径积累的焦磷酸法尼酯生成法尼醇。但是目前国内外利用微生物生产法尼醇的报道仍然很少。本领域内仍然需要微生物合成法尼醇的新方法。
技术实现要素:
本发明以类球红细菌为出发菌株,利用生物工程手段,增加nadph在全细胞系统中的可用性,从而提高foh的产量。至少部分地基于此完成了本发明。具体地,本发明包括以下内容。
本发明的第一方面,提供一种谷氨酸脱氢酶基因受抑制的类球红细菌,其包含能够干扰谷氨酸脱氢酶基因mrna的至少一个片段的至少一种干扰核酸,从而降低胞内nadph的消耗,并由此强化类球红细菌产生foh的能力。干扰核酸的数量不特别限定,优选包括第一干扰核酸和第二干扰核酸两种类型,更优选地,两种干扰核酸干扰谷氨酸脱氢酶基因mrna的两个不同片段。进一步优选地,第一干扰核酸的结合序列与第二干扰核酸的结合序列之间不存在重叠。
在某些实施方案中,本发明的谷氨酸脱氢酶基因受抑制的类球红细菌中的所述干扰核酸包含seqidno:5所示的序列和/或seqidno:6所示的序列。优选地,干扰核酸为两种,且其中之一的序列如seqidno:5所示,和另一种核酸的序列如seqidno:6所示。更优选地,两种核酸之间通过化学键连接。
在某些实施方案中,本发明的谷氨酸脱氢酶基因受抑制的类球红细菌中所述干扰核酸包含于质粒载体内。质粒载体的类型不特别限定,可使用任意类型,只要能够在供体菌或受体菌内表达即可。其实例包括但不限于pbbr1mcs2等。
本发明的第二方面,提供一种谷氨酸脱氢酶基因受抑制的类球红细菌的制备方法,其包括:
(1)构建重组质粒并转化至供体菌得到阳性供体菌的步骤;和
(2)使所述阳性供体菌与类球红细菌受体菌进行细菌结合,从而将所述重组质粒转移至所述类球红细菌的步骤;
其中,所述重组质粒包含能够干扰谷氨酸脱氢酶基因mrna的至少一个片段的至少一种干扰核酸,或者所述重组质粒能够产生干扰谷氨酸脱氢酶基因mrna的至少一种干扰核酸。
在某些实施方案中,本发明的谷氨酸脱氢酶基因受抑制的类球红细菌的制备方法中,所述步骤(1)包括:
使用第一引物对从类球红细菌的基因组中克隆第一片段,和使用第二引物对从类球红细菌的基因组中克隆第二片段;
利用连接酶将所述第一片段和所述第二片段分别插入质粒pbbr1mcs2得到pbbr1mcs2-gdhai,其中,所述第一片段具有能够形成发夹结构的片段;和
将所述pbbr1mcs2-gdhai转化至供体菌,并筛选阳性供体菌。
在某些实施方案中,本发明的谷氨酸脱氢酶基因受抑制的类球红细菌的制备方法中,所述第一引物对中各引物的序列分别如seqidno:1和seqidno:2所示;和所述第二引物对中各引物的序列分别如seqidno:3和seqidno:4所示。
在某些实施方案中,本发明的谷氨酸脱氢酶基因受抑制的类球红细菌的制备方法中所述第一片段的序列如seqidno:5所示,所述第二片段的序列如seqidno:6所示。
在某些实施方案中,本发明的谷氨酸脱氢酶基因受抑制的类球红细菌的制备方法中,步骤(2)包括:将所述阳性供体菌和所述类球红细菌受体菌各自分别用培养基稀释重悬,将稀释重悬后的阳性供体菌和类球红细菌受体菌按比例混合,涂布到无抗固体平板进行预结合,之后收集并重悬细菌涂布到含亚碲酸钾和卡那霉素的抗性固体平板培养,挑取黑色结合子,并进行菌落验证。亚碲酸钾和卡那霉素的浓度在本领域内是已知的。例如,亚碲酸钾的浓度可为100~200mg/l,优选120~160mg/l。
在某一示例性实施方案中,本发明的谷氨酸脱氢酶基因受抑制的类球红细菌的制备方法包括以类球红细菌的基因组作为模板,用含有相应的限制性酶切位点的两对引物对扩增出gdha基因相对应的两段反向重复序列。然后用限制性酶消化两段片段。然后将限制性内切酶消化的两个产物与用相应酶消化后的载体用连接酶连接,形成质粒。
在某些实施方案中,本发明的谷氨酸脱氢酶基因受抑制的类球红细菌的制备方法还包括重组菌株的构建和验证。示例性重组菌株的构建和验证包括以下步骤:
将含有相应质粒的供体菌s17-1接种在含有卡那霉素抗性的液体lb中37℃过夜培养,第二天以10%的接种量转接到含有相应抗性的新鲜lb中,37℃继续培养至对数生长期;受体菌r.sphaeroides接种在无抗的液体lb中于30℃培养24h后转接到新鲜的lb培养基中,继续培养至对数生长期,将受体菌和供体菌转移到1.5ml的离心管中,7000rpm离心3min,用新鲜的lb洗两次,然后分别用300μl和200μl重悬受体菌和供体菌,将受体菌和供体菌按4~10:1,优选6:1的体积比混匀后点在无抗的lb平板,于30℃恒温培养箱中培养大约20h,最后用1ml预冷的1×sistrom’s培养基洗脱到预冷的1.5ml的离心管中,4℃,5000rpm离心2min后去上清,用约1ml的预冷的1×sistrom’s洗涤两次后用100μl预冷的1×sistrom’s的培养基重悬后,涂布在含有卡那霉素抗性和终浓度为150mg/lk2teo3的平板上,30℃恒温培养3~5d直至长出黑色的接合子。用验证引物或单酶切验证黑色的接合子,根据条带大小验证质粒是否有转入成功。
本发明的第三方面,提供一种法尼醇的生产方法,其包括培养根据上述谷氨酸脱氢酶基因受抑制的类球红细菌的步骤。
在某些实施方案中,本发明的法尼醇的生产方法包括以下步骤:
(1’)挑取活化后的谷氨酸脱氢酶基因受抑制的类球红细菌单菌落,以斜面的形式接种到含有固体培养基的试管斜面中,放入恒温培养箱中培养;和
(2’)挑取试管斜面中的谷氨酸脱氢酶基因受抑制的类球红细菌,转接至装有种子培养基的容器中,摇床培养,按照15~25体积%的接种量转接到发酵培养基中培养,得到发酵液;和
(3’)取所述发酵液离心,并经癸烷萃取后,即得法尼醇。
本发明中,谷氨酸脱氢酶(gdha)是一个依赖nadph的脱氢酶,本发明通过弱化这个基因的表达,减少nadph辅因子的消耗,从而提高类球红细菌胞内nadph的水平,达到强化mep途径,增加fpp前提供应的目的,从而提高foh的产量。
附图说明
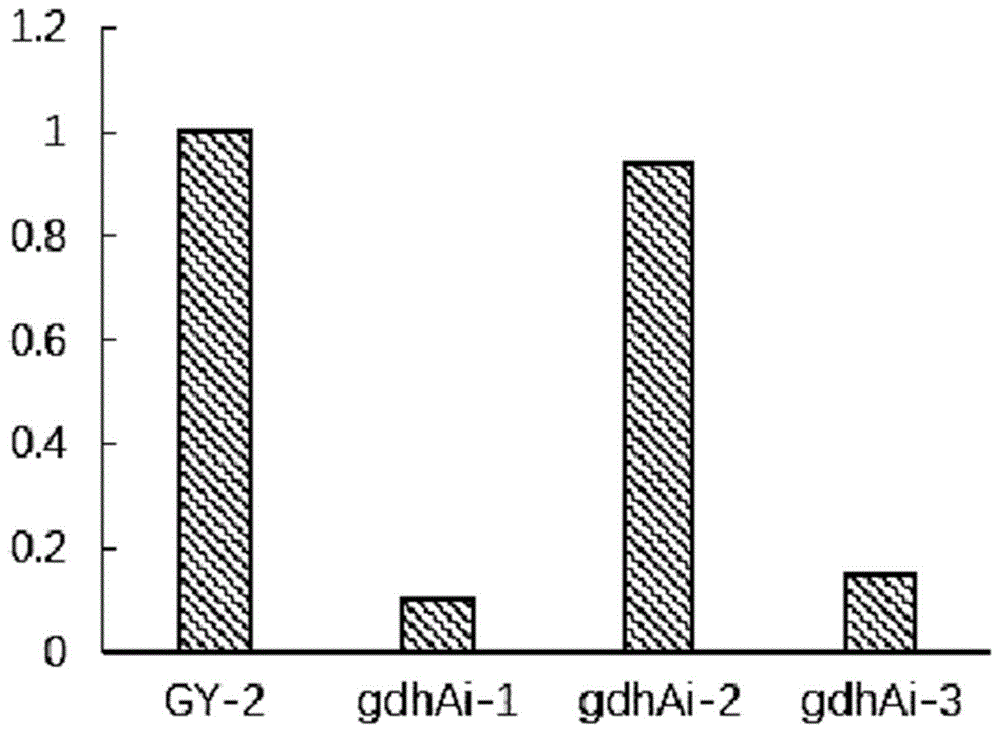
图1为干扰后gdha基因的转录水平。
图2为各干扰菌株foh的产量和生物量。
具体实施方式
现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为具体公开了该范围的上限和下限以及它们之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
本发明的菌株为类球红细菌。优选地,类球红细菌为基因工程化菌株,其为通过rna干扰技术改造的菌株。本发明优选使用类球红细菌r.sphaeroidesgy-2作为出发菌株或受体菌株,其是一株辅酶q10高产菌株,其具有很强的mep途径,能产生大量的前体物质fpp。
本发明中所述的具体方法、步骤以及其中所使用的试剂、材料等,除非另作说明,否则均为本领域内通常已知的,并且也容易地通过公开出版物获知或通过购买获得。具体出版物可参见,例如冷泉港的《分子克隆实验指南》第四版等公开出版物等。
实施例1
本实施例通过rna干扰技术抑制类球红细菌中谷氨酸脱氢酶基因(gdha)的表达,减少类球红细菌中nadph的消耗,提高胞内nadph的水平,进而强化mep途径,增加foh前体物fpp的合成浓度,从而提高foh的产量。具体包括以下步骤:
1.构建pbbr1mcs2-gdhai重组质粒
以类球红细菌的基因组作为模板,用含有相应的限制性酶切位点的第一引物对gdhail-f(seqidno:1)和gdhail-r(seqidno:2)和第二引物对gdhais-f(seqidno:3)和gdhais-r(seqidno:4)扩增出gdha基因相对应的两段反向重复序列,较长的片段包含548bp(seqidno:5),较短的片段包含498bp(seqidno:6),较长的片段中多出的50bp形成发夹结构。然后用bamhⅰ和ecorⅰ消化较长的片段,ecorⅰ和salⅰ消化较短的片段。然后将限制性内切酶消化的两个产物与用bamhⅰ和salⅰ消化后的载体用t4连接酶连接,形成一个称为pbbr1mcs2-gdhai的质粒。
2.重组菌株的构建和验证
将含有相应质粒的供体菌s17-1接种在含有卡那霉素抗性的液体lb中37℃过夜培养,第二天以10%的接种量转接到含有相应抗性的新鲜lb中,37℃继续培养至对数生长期;受体菌r.sphaeroides接种在无抗的液体lb中于30℃培养24h后转接到新鲜的lb培养基中,继续培养至对数生长期,将受体菌和供体菌转移到1.5ml的离心管中,7000rpm离心3min,用新鲜的lb洗两次,然后分别用300μl和200μl重悬受体菌和供体菌,将受体菌和供体菌按6:1的体积比混匀后点在无抗的lb平板,于30℃恒温培养箱中培养大约20h,最后用1ml预冷的1×sistrom’s培养基洗脱到预冷的1.5ml的离心管中,4℃5000rpm离心2min后去上清,用约1ml的预冷的1×sistrom’s洗涤两次后用100μl预冷的1×sistrom’s的培养基重悬后,涂布在含有卡那霉素抗性和终浓度为150mg/lk2teo3的平板上,30℃恒温培养3-5d直至长出黑色的接合子。用验证引物或单酶切验证黑色的接合子,根据条带大小验证质粒是否有转入成功。
3.干扰后gdha基因的转录组水平分析
为了评价gdha基因干扰后的转录水平,采用实时荧光定量pcr对两株干扰株进行分析。首先提取所有干扰菌株中总的rna,然后用dna酶消化所提取rna中的dna,用逆转录试剂盒将去除dna后的rna反转录成cdna,最后用powersybrgreenpcr试剂进行qpcr。以ω亚基的编码基因(rpoz基因)作为参照,对转录组水平进行分析。每个反应混合物包括rt反应液2μl(模板·浓度为50ng/μl),引物分别1μl,sybrpremixextaqⅱ12.5μl,用水补足到25μl。每个反应做三组平行,采用下式相对法对基因进行定量分析:
分别挑取三个验证正确的接合子接种在含有卡那霉素抗性的液体lb中,30℃220rpm培养:24h后分别提取其总rna,反转录等一系列操作之后,采用了q-pcr的方法,分别测定了干扰菌株中gdha基因的转录水平,以出发菌株gy2中相对应的基因为1,来计算改造以后基因的相对转录水平。结果如图1所示。
4.nadph的测定
收集发酵48h后菌液1ml(约1×105个细胞)用预冷的pbs清洗两遍之后,2000rpm离心5min,去除上清。加入300μldanp/nadph缓冲液,于-80℃条件下反复冻融两次,每次冻20min,然后涡旋震荡10s,13000rpm离心10min后,将上清转移到干净的离心管中,取50μl转移到96孔板中,然后再加入100μl反应混合液,混匀后在室温下反应5min,最后加入10μl显色剂,在室温的条件下反应约4h后,测其在450nm处的吸光值,得到nadp总量;取200μl上清液到干净的离心管中,在60℃的水浴锅中加热30min,立刻将样品放在冰上冷却,快速离心,然后取50μl的样品于96孔板中,加入100μl反应混合液,混匀后在室温下反应5min,最后加入10μl显色剂,在室温的条件下反应约4h后,测其在450nm处的吸光值,即得nadph的量,如表1。
表1:各干扰菌株胞内nadph的浓度与nadph/nadp+的比例
5.法尼醇产量的测定
由于foh具有挥发性,为了减少foh的挥发我们在发酵培养液里加入体积比为15%癸烷。发酵48小时后,收集癸烷相,以8000rpm离心10min,去除细胞碎片,取1ml的上清,过滤膜,采用配备火焰离子化检测器(fid)的安捷伦技术7890a气相色谱仪对foh的产率进行了定量。样品以1:10的比例注入,在19091jhp-5柱(30m,长;0.32mm,内径);以流速为1.0ml/min的氮气为载气,入口压力为39psi。喷油器初始温度为250℃,柱式烘箱设置为80℃。然后以10℃/min的速度增加到250℃,并保持1分钟。结果如图2所示。
由图2可知,干扰类球红细菌中gdha的表达可以提高法尼醇的产量,产量最高为42.02mg/l,而出发菌株gy-2法尼醇的产量为27.77mg/l,重组菌株的产量是出发菌株的1.51倍。本发明利用rna干扰技术,成功干扰了类球红细菌gdha基因的表达,增加了类球红细菌合成法尼醇的能力。
序列表
<110>福建师范大学
<120>谷氨酸脱氢酶基因受抑制的类球红细菌及其制备方法和法尼醇的生产方法
<130>yc12019050019-b
<160>6
<170>siposequencelisting1.0
<210>2
<211>29
<212>dna
<213>人工序列
<400>2
ccggaattcgaggagctgcgccactggat29
<210>2
<211>29
<212>dna
<213>人工序列
<400>2
cgcggatcccaccttccgccccgtgccag29
<210>3
<211>29
<212>dna
<213>人工序列
<400>3
ccggaattcgcaggccgactttgtcgagg29
<210>4
<211>48
<212>dna
<213>人工序列
<400>4
ttccgcggccgctatggccgacgtcgaccaccttccgccccgtgccag48
<210>5
<211>547
<212>dna
<213>rhodobactersphaeroides
<400>5
gaggagctgcgccactggatgatgaagacgggctcgatccgcggcttctcgcaggccgac60
tttgtcgaggacgggagcaagctgctcgaagaggagtgcgacattctcatccccgccgcg120
atggagggcgtcatcacccgggagaatgcggcgcggatcaaggcgccgctcatcatcgag180
gcggcgaacggcccgatcaccttcggcgcggacgagatcctgcgccagaaggggacggtc240
atcgtgcccgatctctatgccaatgcgggcggcgtcacggtctcctatttcgaatgggtg300
aagaacctcagccacatccgcttcggccggatgcagcggcgggccgaggaggcgcgctcg360
cgcgcgctggtcgaggagctggagcggctttcggcggatcaggggctgggctggcagctc420
gcgcccgatttcaagcagaagttcatgcaagggtcggacgagctggcgctggtgcgctcg480
ggtctcgatgacacgatgcgcatcgcctatcagtcgatgcgcgaagtctggcacggggcg540
gaaggtg547
<210>6
<211>497
<212>dna
<213>rhodobactersphaeroides
<400>6
gcaggccgactttgtcgaggacgggagcaagctgctcgaagaggagtgcgacattctcat60
ccccgccgcgatggagggcgtcatcacccgggagaatgcggcgcggatcaaggcgccgct120
catcatcgaggcggcgaacggcccgatcaccttcggcgcggacgagatcctgcgccagaa180
ggggacggtcatcgtgcccgatctctatgccaatgcgggcggcgtcacggtctcctattt240
cgaatgggtgaagaacctcagccacatccgcttcggccggatgcagcggcgggccgagga300
ggcgcgctcgcgcgcgctggtcgaggagctggagcggctttcggcggatcaggggctggg360
ctggcagctcgcgcccgatttcaagcagaagttcatgcaagggtcggacgagctggcgct420
ggtgcgctcgggtctcgatgacacgatgcgcatcgcctatcagtcgatgcgcgaagtctg480
gcacggggcggaaggtg497
- 还没有人留言评论。精彩留言会获得点赞!