一种利用佐夫色绿藻生产虾青素的方法与流程
本发明涉及一种高效生产虾青素的方法,属于生物工程发酵
技术领域:
,特别是涉及一种利用佐夫色绿藻生产虾青素的方法。
背景技术:
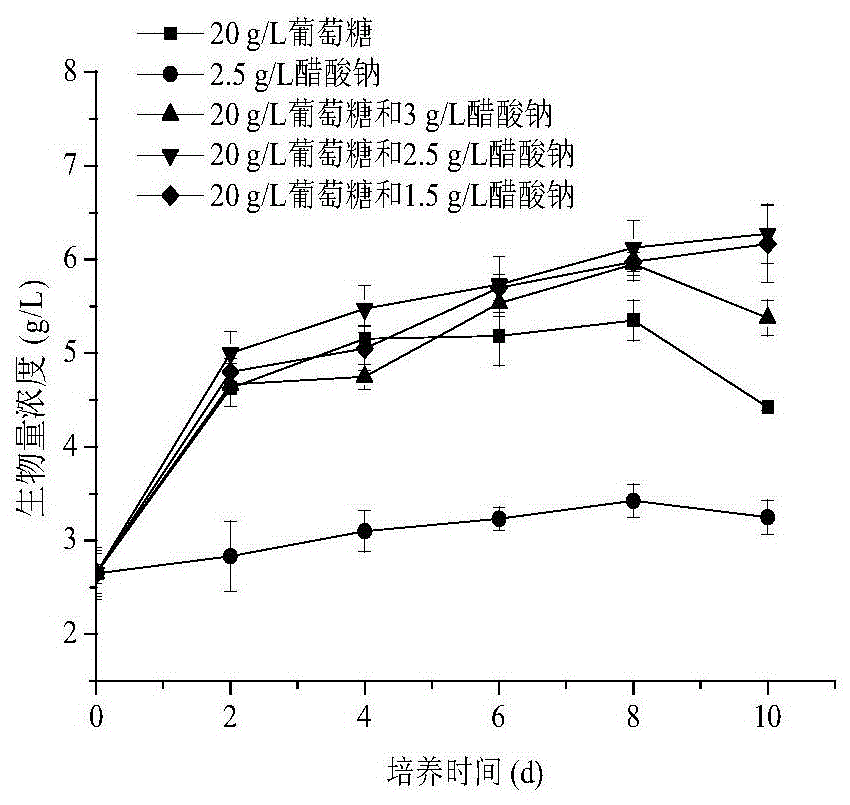
:虾青素(astaxanthin)是一种脂溶性紫红色的类胡萝卜素,普遍存在于多种微生物和海洋生物中,一些甲壳类动物如虾、蟹及鲑科鱼类等呈现的颜色均是由于存在虾青素所致。虾青素具有较强的着色功能,抗氧化、抗癌等生理活性,在饲料、食品、营养品和制药行业具有广泛的应用。虾青素的来源分为天然提取和人工合成。天然提取的虾青素主要源于藻类、酵母、一些鱼虾类等,相较于合成虾青素,天然虾青素具有更好的稳定性。尽管目前市场上虾青素主要是合成虾青素,然而消费者对于天然产品日益增长的需求,促进天然虾青素产业的发展。天然虾青素的来源主要分为三种:1)从甲壳类副产品中获取。甲壳类副产品内含有类胡萝卜素,然而其虾青素含量很低,而灰分和几丁质含量较高,导致消化率较低,不利于在饵料中的应用。2)从真菌或细菌中获取。红发夫酵母可以快速生长并实现高细胞密度,但是虾青素含量较低且细胞壁比较厚,阻碍了鱼类对于虾青素的利用,因此需要破壁。一些细菌如海洋细菌也可以产生虾青素,但是成本高,虾青素含量少。3)从微藻中获取。微藻是生产天然虾青素最具潜力的来源。目前利用雨生红球藻生产虾青素的含量最高,并且已经应到了虾青素的工业生产中,但是它的细胞密度低,培养时间长且易污染,此外,虾青素的诱导和积累需要极高的光照强度,这些问题阻碍了虾青素的进一步商业化的应用。佐夫色绿藻是一种淡水绿藻,能够利用光能和二氧化碳进行光合自养,也能够利用多种有机碳源异养生长,同时又能够利用光照与有机碳源混养生长。由于其高生长率,高细胞密度,不易污染且能快速产生虾青素而被认为生产虾青素的潜在替代者。相较于雨生红球藻,除了生长速度快外,在胁迫条件下(如高光、缺氮等)能够提高细胞内虾青素含量,生产效率较高,具有较好的发展前景。因此,针对佐夫色绿藻的生长以及虾青素积累的特性进行研发,如何提高佐夫色绿藻的虾青素产量以及工业化应用是当前所属领域技术人员急需解决的技术难题。技术实现要素:为了克服现有技术的不足,本发明的目的是提供一种利用佐夫色绿藻生产虾青素的方法,对于提高佐夫色绿藻的虾青素产量以及工业化应用具有重要的意义。为了达到上述目的,本发明采用以下的技术方案。一种利用佐夫色绿藻生产虾青素的方法,包括如下步骤:s1,摇瓶两阶段培养诱导:快速扩种和虾青素的诱导;具体的,第一阶段:低光强提高细胞密度作为种子液;第二阶段:虾青素的诱导:将第一阶段种子液接入进行虾青素的诱导,具体如下:混合碳源浓度中醋酸钠浓度为0-3.0g/l,接种密度为0.24×108~1.22×108cfu/ml,光照强度80-320μmol.s-1.m-2,过氧化氢诱导剂浓度0-137.5mg/l;s2,光发酵诱导验证:将步骤s1所述条件在光发酵罐进行效果验证,并在不同操作方式:恒定高光强、低光强-高光强、低光强-高光强-补加诱导剂进行佐夫色绿藻诱导。优选的,步骤s1中,培养基中碳源:20g/l的葡萄糖和2.5g/l的醋酸钠的混合碳源。优选的,步骤s1中,佐夫色绿藻的诱导阶段接种密度为1.22×108cfu/ml。优选的,步骤s1中,佐夫色绿藻的诱导阶段光照强度为240μmols-1.m-2。优选的,步骤s1中,佐夫色绿藻的诱导阶段过氧化氢的添加范围为107.5-137.5mg/l。优选的,所述光发酵诱导验证是在恒定高光强条件下进行操作的具体步骤为:5l的发酵罐装置采用外置光源,通过调节电流控制光照强度,调节电流至最大(光照强度为653μmol.m-2.s-1)并维持恒定培养佐夫色绿藻。优选的,步骤s2中,采用低光强-高光强的光照方式(312-653μmol.m-2.s-1),并培养至72h进行过氧化氢诱导剂补料,补料浓度为107.5mg/l过氧化氢。优选的,步骤s1和s2中,均采用完全无氮的bristol培养基。接种密度为2.30g/l,其中培养基中葡萄糖浓度为30g/l、硝酸钠为碳源、碳氮比为34;在光照为10μmol.m-2.s-1、温度为26℃、转速为150r/min的恒温培养箱中培养。其中,快速扩种bristol培养组成为:nano3750mg/l;fecl3·6h2o5.0mg/l;kh2po4175mg/l;znso4·7h2o0.287mg/l;k2hpo475mg/l;mnso4·h2o0.169mg/l;mgso4·7h2o75mg/l;h3bo30.061mg/l;cacl2·2h2o25mg/l;cuso4·5h2o0.0025mg/l;nacl25mg/l;(nh4)6mo7·h2o0.00124mg/l。诱导虾青素合成bristol培养组成为:fecl3·6h2o5.0mg/l;kh2po4175mg/l;znso4·7h2o0.287mg/l;k2hpo475mg/l;mnso4·h2o0.169mg/l;mgso4·7h2o75mg/l;h3bo30.061mg/l;cacl2·2h2o25mg/l;cuso4·5h2o0.0025mg/l;nacl25mg/l;(nh4)6mo7·h2o0.00124mg/l。进一步而言,通过上述利用佐夫色绿藻生产虾青素的方法制得虾青素。借由上述技术方案,本发明具有如下优点和有益技术效果:1)本发明提供的利用佐夫色绿藻生产虾青素的方法,能够提高佐夫色绿藻生产虾青素的产量和产率,大大缩短了培养时间、成本,提高生产效率,在利用佐夫色绿藻生产虾青素方面具有重要的意义;2)本发明除了提供利用佐夫色绿藻积累虾青素方法外,还采用光发酵罐系统此方法进行放大以及效果验证;此外,本发明还探索了利用佐夫色绿藻规模化生产虾青素的方式,对于佐夫色绿藻未来的商业化应用具有重要的价值。附图说明图1a和图1b分别为混合碳源下佐夫色绿藻生物量浓度的变化曲线及虾青素积累的影响图;图2a和图2b分别为不同接种密度下佐夫色绿藻生物量浓度的变化曲线及虾青素积累的影响图;图3a和图3b分别为不同光照强度下佐夫色绿藻生物量浓度的变化曲线及虾青素积累的影响图;图4a和图4b分别为不同光氧化氢添加量下佐夫色绿藻生物量浓度的变化曲线及虾青素积累的影响图;图5a和图5b分别为恒定高光强光发酵罐下佐夫色绿藻光照强度、生物量浓度及虾青素含量和产量随培养时间的变化曲线图;图6a和图6b分别为低光强-高光强光发酵罐下佐夫色绿藻光照强度、生物量浓度及虾青素含量和产量随培养时间的变化曲线图;图7a和图7b分别为低光强-高光强-补加诱导剂光发酵罐下佐夫色绿藻光照强度、生物量浓度及虾青素含量和产量随培养时间的变化曲线图。具体实施方式下面通过具体较佳实施例例结合附图,对本发明作进一步详细的说明,但本发明的实施方式不限于此。本发明公开了一种利用佐夫色绿藻生产虾青素的方法,包括步骤:s1,对佐夫色绿藻进行快速扩种提高细胞密度,并将其接种至摇瓶培养基中进行胁迫诱导;混合碳源浓度中醋酸钠浓度为0~3.0g/l,接种密度为0.24×108~1.22×108cfu/ml,光照强度80~320μmols-1.m-2,过氧化氢诱导剂浓度0~137.5mg/l;s2,将步骤s1摇瓶获得实验条件在5l光发酵罐中不同操作方式下进行效果验证。本发明提供的利用佐夫色绿藻生产虾青素的方法,能够提高佐夫色绿藻生产虾青素的产量和产率,大大缩短了培养时间、成本,提高生产效率,在利用佐夫色绿藻生产虾青素方面具有重要的意义。实施例11、混合碳源对佐夫色绿藻积累虾青素的影响1.1藻种活化及种子液的快速制备从培养基平板上挑取一个单藻落,接种至含有10g/l葡萄糖的bristol’smedium的250ml三角瓶中(装液量为100ml),在光照为10μmol.m-2.s-1、温度为26℃、转速为150r/min的恒温培养箱中连续培养4-5天。将上述活化好的种子液接入bristol培养基中(接种密度为2.30g/l),其中培养基中葡萄糖浓度为30g/l、硝酸钠为碳源、碳氮比为34。在光照为10μmol.m-2.s-1、温度为26℃、转速为150r/min的恒温培养箱中培养。1.2混合碳源对佐夫色绿藻积累虾青素的影响以无氮的bristol培养基为基本培养基,设置五组实验:只加20g/l的葡萄糖;只加2.5g/l的醋酸钠(naac);同时加20g/l的葡萄糖和3.0g/l的醋酸钠;同时加20g/l的葡萄糖和2.5g/l的醋酸钠;同时加20g/l的葡萄糖和1.5g/l的醋酸钠。调节培养基的ph为6.5,并分装至250ml三角瓶中(装液量100ml),然后于121℃、15min条件下高压蒸汽灭菌。培养基冷却至室温后接种,在温度为26℃,转速为150r/min,光照为130μmol.m-2.s-1的恒温培养箱中培养。培养结束后,测定佐夫色绿藻细胞的生物量浓度;离心收集,去除上清,收集藻泥并冻干,分析藻细胞内的色素组成。1.3实验结果从图1a-1b和表1可知,混合碳源浓度对佐夫色绿藻虾青素的积累有很大的影响。其中当采用20g/l的葡萄糖和2.5g/l的醋酸钠的混合碳源时,佐夫色绿藻的虾青素的产量和生物量浓度最高,分别为16.98mg/l和6.5g/l。表1混合碳源浓度对佐夫色绿藻虾青素的积累注:采用t检验分析成对数据的显著性,用*标注显著性(p<0.05)。实施例22、接种密度对佐夫色绿藻积累虾青素的影响2.1藻种活化及种子液快速制备佐夫色绿藻的活化以及种子液的快速制备如1.1所述。2.2接种密度对佐夫色绿藻积累虾青素的影响以无氮的britol培养基为基本培养基,初始葡萄糖浓度为20g/l,接种密度设为:1.22×108、0.61×108、0.32×108和0.24×108cfu/ml。其他培养条件同1.2所述。培养结束后,测定佐夫色绿藻细胞的生物量浓度;离心收集,去除上清,收集藻泥并冻干,分析藻细胞内的色素组成。2.3实验结果从图2a-2b和表2可知,当接种密度为1.22×108cfu/ml,佐夫色绿藻的虾青素的产量和生物量浓度最高,分别为60.28mg/l和16.96mg/l。表2接种密度对佐夫色绿藻积累虾青素的影响注:采用t检验分析成对数据的显著性,用*标注显著性(p<0.05)。实施例33、光照强度对佐夫色绿藻积累虾青素的影响3.1藻种活化及种子液快速制备佐夫色绿藻的活化以及种子液的快速制备如1.1所述。3.2光照强度对佐夫色绿藻积累虾青素的影响以无氮的britol培养基为基本培养基,初始葡萄糖20g/l,光照梯度设为:88±8、160±5、240±6和320±5μmol.m-2.s-1其他培养条件同1.2所述。培养结束后,测定佐夫色绿藻细胞的生物量浓度;离心收集,去除上清,收集藻泥并冻干,分析藻细胞内的色素组成。3.3实验结果从图3a-3b和表3可知,当光照强度为240μmol.m-2.s-1,佐夫色绿藻的虾青素含量和产量最高,分别为2.85mg/g和32.20mg/l。表3光照强度对佐夫色绿藻积累虾青素的影响注:采用t检验分析成对数据的显著性,用*标注显著性(p<0.05)。实施例44、过氧化氢添加量对佐夫色绿藻积累虾青素的影响4.1藻种活化及种子液快速制备佐夫色绿藻的活化以及种子液的快速制备如1.1所述。4.2过氧化氢添加量对佐夫色绿藻积累虾青素的影响以无氮的britol培养基为基本培养基,过氧化氢浓度添加量:0、77.5、107.5、137.5mg/l,并加入18μmol/l硫酸亚铁,初始葡萄糖浓度为20g/l,培养过程中监测葡萄糖浓度变化,降至0-5g/l时进行补料,补至20g/l。其他培养条件同1.2所述。培养结束后,测定佐夫色绿藻细胞的生物量浓度;离心收集,去除上清,收集藻泥并冻干,分析藻细胞内的色素组成。4.3实验结果从图4a-4b和表4可知,当过氧化氢添加量范围为107.5~137.5mg/l,佐夫色绿藻的最高虾青素产量和生物量浓度,分别为73.45mg/l和22.55g/l。表4过氧化氢添加量对佐夫色绿藻积累虾青素的影响注:采用t检验分析成对数据的显著性,用*标注显著性(p<0.05)。效果试验例11、光发酵罐恒定光强下佐夫色绿藻积累虾青素的效果1.1藻种活化及种子液快速制备佐夫色绿藻的活化以及种子液的快速制备如1.1所述。1.2光发酵罐恒定光强下对佐夫色绿藻积累虾青素的影响以无氮的bristol培养基为基本培养基,初始葡萄糖浓度为20g/l,醋酸钠浓度为2.5g/l,加入107.5mg/l的过氧化氢和18μmol/l的硫酸亚铁。ph设置范围6.5-8.5,温度设置范围为26℃-28℃,通气量为3.33l/min,转速为150r/min,培养期间采用0.1mol/l盐酸和氢氧化钠调节ph,温度通过冷却循环泵控制。5l的发酵罐装置采用外置光源,通过调节电流控制光照强度,调节电流至最大(光照强度为653μmol.m-2.s-1)并维持恒定培养佐夫色绿藻。培养结束后,测定佐夫色绿藻细胞的生物量浓度;离心收集,去除上清,收集藻泥并冻干,分析藻细胞内的色素组成。1.3实验结果从图5a-5b和表5可知,恒定高光强下,佐夫色绿藻的最高虾青素产量和生产率,分别为21.46mg/l和2.76mg/l/d。效果试验例22、光发酵罐低光强-高光强下佐夫色绿藻积累虾青素的效果2.1藻种活化及种子液快速制备佐夫色绿藻的活化以及种子液的快速制备如1.1所述。2.2低光强-高光强下对佐夫色绿藻积累虾青素的影响以无氮的bm培养基为基本培养基,初始葡萄糖浓度为20g/l,醋酸钠浓度为2.5g/l,加入107.5mg/l的过氧化氢和18μmol/l的硫酸亚铁。在发酵罐中,采用无氮的bm培养基,发酵罐装置采用外置光源,光照强度采用逐渐提高光强的方式,调节范围为169-653μmol.m-2.s-1。其他培养条件同5.1所述。培养结束后,测定佐夫色绿藻细胞的生物量浓度;离心收集,去除上清,收集藻泥并冻干,分析藻细胞内的色素组成。2.3实验结果从图6a-6b和表5可知,在低光强-高光强培养条件下更有利于提高佐夫色绿藻虾青素的产量,虾青素产量和产率最高可达38.38mg/l和6.25mg/l/d,相较于恒定高光强,分别提高了78.84%、126%。效果试验例33、光发酵罐低光强-高光强—诱导剂下佐夫色绿藻积累虾青素的效果3.1藻种活化及种子液快速制备佐夫色绿藻的活化以及种子液的快速制备如1.1所述。3.2光发酵罐低光强-高光强—诱导剂对佐夫色绿藻积累虾青素的效果以无氮的bm培养基为基本培养基,初始葡萄糖浓度为20g/l,醋酸钠浓度为2.5g/l,加入107.5mg/l的过氧化氢和18μmol/l的硫酸亚铁。在光照强度采用低光强-高光照(312-653μmolm-2s-1)的方式,培养至72h进行过氧化氢诱导剂补料,补料浓度为107.5mg/l过氧化氢和18μmol/l的硫酸亚铁。其他培养条件同5.1所述。培养结束后,测定佐夫色绿藻细胞的生物量浓度;离心收集,去除上清,收集藻泥并冻干,分析藻细胞内的色素组成。7.3实验结果从图7a-7b和表5可知,低光强-高光强-补加诱导剂操作方式下,利用低光强-高光强-补加过氧化氢诱导剂进行培养,细胞的虾青素产量和产率分别41.41mg/l和6.77mg/l/d,相较于恒定高光强,佐夫色绿藻的虾青素产量和产率分别提高了92.96%和163%。表5光发酵罐恒定光强下对佐夫色绿藻积累虾青素的影响实验条件恒定高光低光强-高光强低光强-高光强-补加诱导剂平均比生长速率(d-1)0.07±0.010.13±0.02*0.10±0.02最大生物量浓度(g/l)8.15±0.5116.50±0.99*11.08±0.20*生物量产率(g/l/d)0.39±0.021.39±0.03*0.83±0.02*虾青素含量(mg/g)2.80±0.102.66±0.143.82±0.12*虾青素产量(mg/l)21.46±0.5238.38±0.52*41.41±0.93*虾青素产率(mg/l/d)2.76±0.076.25±0.15*6.77±0.11*注:采用t检验分析成对数据的显著性,用*标注显著性(p<0.05)。8测定方法:8.1生物量浓度生物量浓度采取干重法进行测定。吸取2ml佐夫色绿藻培养液于烘干称重的2ml离心管中,在3800×g的离心力下离心3min、并用蒸馏水进行洗涤。将离心得到的藻泥置于60℃恒温干燥箱中烘干至恒重,置于分析天平准确称量,计算样品干重。8.2葡萄糖浓度利用sba生物传感分析仪测定培养基内葡萄糖浓度。取待测样品上清液过滤并稀释至量程范围内(0.5~1.0g/l),测定前先用1.0g/l的葡萄糖标准品定标,定标通过后,吸取25μl样品进行测定。8.3细胞中的色素组成分析细胞内色素提取方法、成分及测定参考相关文献。离心收集的藻泥冷冻后置于冷冻干燥机冻干成藻粉,准确称量10mg藻粉于装有陶瓷珠的振荡管中,加入1ml甲醇/二氯甲烷的提取液(体积比为3:1,含有0.1%的2,6-二叔丁基-4-甲基苯酚)。振荡30s后,迅速置于液氮中冷却,离心收集上清液,如此反复操作直至藻细胞变成无色。合并收集的所有上清液并在通风橱中利用氮气吹干。然后用甲醇/mtbe混合溶剂(1:1,v/v)进行定容,最后过滤并转移至棕色瓶中保存,用于高效液相分析。以上操作均需避光。色素的hplc的测定如下:采用ymccarotenoidcolumnc30色谱柱和pda检测器,柱温为30℃,进样量为20μl,流速为0.8ml/min。流动相分别为甲醇(a)及mtbe(b)。具体洗脱条件如下:0-2min,90%-80%a、10%-20%b;2-6min,80%-60%a、20%-40%b;6-18min,60%-50%a、40%-50%b;18-21min,50%-90%a、50%-10%b;21-24min,90%a、10%b。检测波长为480nm、645nm和665nm,并在300-800nm下进行全波长扫描以测定光谱。以上所述,仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制,故凡是未脱离本发明技术方案内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属于本发明技术方案的范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1