一种透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂及其制备方法与流程
本发明涉及医疗药物领域,具体涉及一种透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂及其制备方法。
背景技术:
靶向给药系统是药剂学研究领域中的热点之一。靶向给药能够选择性的将药物输送至靶标位置,增加疗效的同时减少药物对正常组织的毒副作用。透明质酸(ha)是一种由n-乙酰-d-葡萄糖胺和d-葡萄糖醛酸经β-1,4糖苷键连接而成的线性高分子氨基葡聚糖。目前研究采用高分子量透明质酸作为主动靶向因子,与肿瘤细胞表面的cd44受体特异性结合,介导药物进入细胞,在细胞内释放药物。ha具有很多优势:水溶性好,生物可降解,生物相容性好,无毒,无免疫原性,容易进行化学修饰等。
在传统的临床实践中,疾病的诊断和治疗是两个相对独立的过程。然而,诊断用造影剂和治疗用药的分别使用会带来用药的副作用叠加,贻误治疗时期以及增加患者用药痛苦等缺点。为此,在临床医生和科研工作者的共同努力下,治疗诊断学(theranostics)作为一种新理念逐渐发展起来。治疗诊断学是一种将药物治疗与诊断相结合的手段,个性化地对病人同时实现治疗和诊断,可以提高诊断效率,减少对人体的毒副作用,以达到事半功倍的效果。同时应用于诊断和治疗的试剂称为治疗诊断一体化试剂(theranosticagent),该类试剂能够实时诊断病情并同步进行治疗的独特优势使其成为治疗癌症的新策略。
微泡具有良好的回声效果,被应用为超声造影剂,但是微泡的粒径过大和不稳定性限制了它在超声造影方面的应用。近年来,为了解决超声微泡粒径过大和不稳定问题,出现了一种相变液态氟碳纳米球。相变液态氟碳纳米球粒径小,可穿过血管内皮细胞到达血管外靶标;与微泡相比,稳定性较好,在聚焦超声,激光以及加热条件下可以发生液-气转变而进行超声成像。尽管具有很多优点,相变液态氟碳纳米球仍然存在稳定性不高的问题,据文献报道,相变液态氟碳纳米球在储存过程中会出现液-气相变;在进入体循环后,在到达靶部位之前,出现过早的相变。因此,需要制备一种更为稳定,粒径在纳米级的相变超声造影剂。
无机硅材料具有良好的生物相容性,稳定性。有文献报道,中空微球具有超声成像效果而作为超声造影剂,但粒径在微米级,不能通过epr效应到达肿瘤部位。近年来,硅包裹的液态氟碳相变纳米球被报道用做超声造影剂,该造影剂可通过epr效应到达肿瘤部位,然后在聚焦超声的作用下发生液-气转变,产生造影效果,但是制备该造影剂的工艺复杂,并且会加入有毒的表面活性剂。
在本发明中采用硅沉积法所制备的一种透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂粒径较小,可通过肿瘤部位epr效应实现被动靶向。同时,修饰的透明质酸又可以实现对肿瘤细胞的主动靶向,从而可降低该制剂的毒副作用,并增强药物的疗效。另一方面,与磷脂液态氟碳纳米球相比,本发明制备的一种透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球具有良好的稳定性和持久的超声造影效果。采用温和的硅沉积法制备一种透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂,工艺简单方便,所用的材料经济且生物相容性好,无有毒的表面活性剂的加入,具有广阔的临床应用前景。
技术实现要素:
本发明的目的在于针对磷脂液态氟碳纳米球作为超声造影剂稳定性不好,现有硅包裹液态氟碳纳米球工艺复杂的问题,以多西他赛为模型药物,提供一种新的透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂及其制备方法。该新型载药液——气相变纳米球粒径较小,可通过肿瘤部位epr效应实现被动靶向。同时,修饰透明质酸又可以实现对肿瘤细胞的主动靶向,可降低该制剂的毒副作用,并增强药物的治疗作用。另一方面,与磷脂液态氟碳纳米球相比,本发明制备的透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球具有良好的稳定性和持久的超声造影加效果。采用硅沉积法制备一种透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂,工艺简单方便,所用的材料经济且生物相容性好,无有毒的表面活性剂的加入,具有广阔的临床应用前景。
本发明的目的可以通过以下技术方案实现:
步骤1:称取适量的大豆卵磷脂和药物溶解于二氯甲烷,在减压旋转蒸发除去二氯甲烷,得到均匀的脂膜,然后加入一定量的水,震荡或超声使薄膜脱落,得到脂质混悬液。
步骤2:将步骤1得到的脂质混悬液用超声波细胞破碎仪超声10min,得到脂质体,将该脂质体于4℃冷却。
步骤3:向步骤2得到的脂质体加入一定量液态氟碳,冰浴条件下,用超声波细胞破碎仪进行超声,即得到载药磷脂液态氟碳纳米球。
步骤4:将步骤3得到的载药磷脂液态氟碳纳米球分散在一定量的水中,用稀氨水调ph呈弱碱性,然后加入少量的硅酸四乙酯(teos),冰浴搅拌反应24小时,离心,除去未包载的药物以及硅酸四乙酯的水解产物,将沉淀用水洗,再分散于水中,得到硅包裹载药磷脂液态氟碳纳米球混悬液。
步骤5:向步骤4制备的硅包裹载药磷脂液态氟碳纳米球混悬液中加入3-氨丙基-三乙氧基硅烷(aptes),并用稀氨水调ph呈弱碱性,搅拌反应一段时间,得到氨基化的硅包裹载药磷脂液态氟碳纳米球。
步骤6:取一定量的透明质酸,溶解于水中。然后向透明质酸的水溶液中加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺(nhs)的水溶液,反应一段时间,得到活化的透明质酸。
步骤7:向步骤5得到的氨基化的硅包裹磷脂液态氟碳纳米球混悬液和步骤6得到的活化透明质酸溶液混合,反应过夜,离心,沉淀用水洗3次,再分散于水中,得到透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂。
本发明应用乳化法和硅沉积法成功制备了透明质酸修饰的硅包裹磷脂液态氟碳纳米球超声造影剂,具有合成工艺简单、耗时少、生物相容性好、高度特异性结合的优点。
附图说明
图1为本发明实例1中透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂电镜图。
图2为本发明实施例1中透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂粒径分布图。
图3为本发明实例1透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂红外图。
图4为本发明实例2透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂体外加热致相变显微镜观察图。
图5为本发明实例2透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂体外累积释放图。
图6为本发明实例2透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂mtt实验细胞活力图。
图7为本发明实例2透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂体外显影图。
图8为本发明实例2透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂体内显影图。
具体实施方式
以下结合附图实施例对本发明进行详细描述,但本发明并不仅限于下述实施例。
实施例1
1.磷脂液态氟碳纳米球的制备
将30mg大豆卵磷脂(spc)和3mg药物溶于2ml二氯甲烷中。通过减压蒸发快速除去二氯甲烷,形成脂膜。加入8ml磷酸盐缓冲液(ph7.4)后,将脂质膜在超声波水浴中水合5分钟,得到粗乳。将粗乳用超声波细胞破碎仪超声10min,并在4℃的冰箱中冷却得到脂质体。将0.06ml的pfp加入到脂质体混悬液中,然后用超声波细胞破碎器在冰浴条件下超声5分钟,得到载药磷脂液态氟碳纳米球。
2.氨基化的硅包裹载药磷脂液态氟碳纳米球的制备
将8ml磷脂液态氟碳纳米球混悬液稀释至24ml,用稀氨水调ph8.5,然后加入0.162ml硅酸四乙酯,冰浴搅拌反应24小时,离心,用高效液相色谱法测量上清液药物含量,测得药物包封率86.70%±1.42%。沉淀再分散于24ml水中,用水调ph8.5,加入0.012ml3-氨丙基-三乙氧基硅烷(aptes),搅拌反应4小时,得到氨基化的硅包裹载药磷脂液态氟碳纳米球。
3.透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂的制备
精密称量11.3mg的透明质酸溶解于6ml水中得到透明质酸溶液。精密称量37mg的nhs和20mgedc并溶解于2ml水中。将两份溶液混合,搅拌反应2小时得到活化的透明质酸溶液。将活化的透明质酸溶液与氨基化的硅包裹磷脂液态氟碳纳米球混悬液混合,搅拌反应过夜,离心,沉淀用水洗3次,得到透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂。
将制备成的透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂混悬液稀释一定的倍数,用透射电镜观察其形态,如图1所示,透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂为球体结构。采用马尔文激光粒度分析仪测量其粒径,粒径分布结果见图2,透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂的平均粒径为274.5±3.25nm。傅里叶红外分析验证透明质酸的成功修饰,如图3所示,(a)表示硅包裹载药磷脂液态氟碳纳米球,在修饰氨基后,在1560cm-1出现氨基的弯曲振动峰,得到氨基化的硅包裹载药磷脂液态氟碳纳米球(b)。将氨基化的硅包裹载药磷脂液态氟碳纳米球透明质酸修饰后得到透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂(c),在(c)的红外图谱上出现透明质酸的羟基峰3600cm-1,以及形成的酰胺键的羰基峰1730cm-1。
实施例2
1.透明质酸修饰的硅包裹磷脂液态氟碳纳米球超声造影剂体外加热致相变显微镜观察
将制备成的透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂混悬液加入到离心管中,然后将离心管进入到水浴中,用温度计监测温度,于不同温度(25,35,45,55,65,70℃)下加热5min,然后再光学显微镜下观察形态。结果见图4,结果表明,当温度低于55℃,几乎没有气泡产生。当温度升高至65℃,可观察到少量气泡,当温度升至70℃时,可观察到大量气泡。粒径分析结果显示,当温度从25加热到55℃时,粒径从280nm缓慢增加到526nm,当温度升高到65和75℃时,粒径呈现不均匀分布,并且出现多峰,表明过度膨胀和破碎的透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂共存。
2.透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂体外药物释放实验
以多西他赛为模型药物,将透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球,透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球+聚焦超声,载药磷脂液态氟碳纳米球,多西他赛原料药进行体外药物释放考察,如图5所示,多西他赛原料药由于其难水溶性,体外释药速度缓慢,在36小时其累积释药率仅为36%。载药磷脂液态氟碳纳米球具有较快的累积释药速度和较高的累积实药率,在24小时累积释药率达到94%。透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球由于硅壳的包裹,药物释放与载药磷脂液态氟碳纳米球相对缓慢,在36小时的累积释药率约为60%,然而透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球+聚焦超声具有相对较快的实验速度和比较高的累积实验率,累积释药率可以达到85%。表明透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂具有超声介导的释药行为。
3.透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂细胞毒性研究
以a549细胞为研究对象,以细胞活力为考察指标,对透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂空白载体的毒性进行评价。并且考察了超声对细胞以及对载体毒性的影响。如图6所示,透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂空白载体具有较高的生物相容性。超声并不会增加载体的毒性,并且单独的超声也不会对细胞产生伤害。
4.透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂体外显影实验
将制备成的透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂,硅包裹载药磷脂液态氟碳纳米球超声造影剂,载药磷脂液态氟碳纳米球超声造影剂混悬液取0.2ml于琼脂模型中,给予低强度聚焦超声(lifu)照射,进行超声显影。结果如图7所示,透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂和硅包裹载药磷脂液态氟碳纳米球超声造影剂比载药磷脂液态氟碳纳米球超声造影剂具有更强和更持久的超声显影效果.表明包裹的硅壳可以增强造影效果。
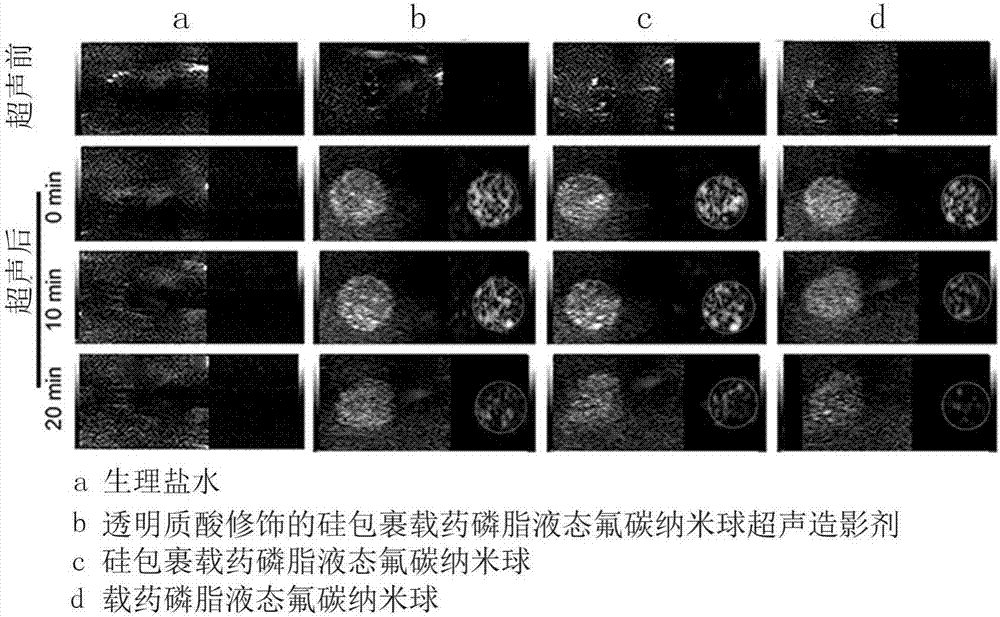
5.透明质酸修饰的硅包裹磷脂液态氟碳纳米球超声造影剂体内显影实验
将制备成的透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂混悬液尾静脉注射给入h22荷瘤小鼠,然后用lifu照射肿瘤部位,再进行超声成像。如图8所示,透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂具有较好的体内显影效果。由于透明质酸介导的肿瘤靶向,透明质酸修饰的硅包裹载药磷脂液态氟碳纳米球超声造影剂比硅包裹载药磷脂液态氟碳纳米球超声造影剂具有更强的造影效果。
- 还没有人留言评论。精彩留言会获得点赞!