一类吡啶/联吡啶共轭微孔聚合物及其制备方法和应用与流程
本发明属于微孔聚合物技术领域,特别涉及一类吡啶/联吡啶共轭微孔聚合物及其制备方法和应用。
背景技术:
温室效应及全球变暖是目前全世界人类共同面临的一大环境难题。因此,科学家们致力于开发二氧化碳吸附及分离系统实现捕获大气中二氧化碳的目的。共轭微孔聚合物是一类以π-共轭结构连接结构单元的无定形多孔有机聚合物,具有高比表面积、多级孔、合成方法多样、结构可设计性等特性,在二氧化碳吸附及分离方面具有良好的应用前景。
然而,现有的co2捕集剂在高压下才表现出一定的吸附效果,但选择性差。大量研究表明,在共轭微孔聚合物中引入氮原子可以有效提高二氧化碳吸附量及co2/n2选择性。而吡啶氮,由于其在引入氮的同时依然保留共轭结构的优良特点,被广泛应用于含氮的共轭微孔聚合物的制备过程中。然而,现有技术中大部分联吡啶共轭微孔聚合物的合成条件相当严苛,往往需要昂贵的重金属催化剂或是高温缩聚条件等。此外,常规合成方法无法直接形成吡啶氮,合成过程中无法保证氮的有效引入。
技术实现要素:
本发明所要解决的技术问题是提供一类吡啶/联吡啶共轭微孔聚合物及其制备方法和应用,克服了现有共轭微孔聚合物合成条件严苛,需重金属催化,引入的吡啶氮含量具有不确定性、co2/n2选择性差等缺陷。
本发明提供了一类吡啶/联吡啶共轭微孔聚合物,所述聚合物结构式如下:
本发明还提供了一类吡啶/联吡啶共轭微孔聚合物的制备方法,包括:
将2,2’-联吡啶-5,5’-二甲醛和芳香酮化合物混合,加入醋酸铵和溶剂,110~120℃下油浴加热搅拌反应12~24h,然后过滤、洗涤、干燥,即得。
所述芳香酮化合物为1,4-二乙酰基苯、1,3-二乙酰基苯或2,6-二乙酰基吡啶,与2,2’-联吡啶-5,5’-二甲醛的摩尔比为1:2。
所述醋酸铵和反应原料的摩尔比为5:1~20:1;其中,反应原料是指2,2’-联吡啶-5,5’-二甲醛和芳香酮化合物之和。
所述溶剂为吡啶;溶剂与2,2’-联吡啶-5,5’-二甲醛的比例为50~100ml:1mmol。
所述洗涤的工艺条件为:依次采用去离子水和有机溶剂在60℃下洗涤,洗涤时间均为24h。
所述有机溶剂为氯仿。
所述干燥为真空干燥,温度为60~100℃,时间为20~24h。
本发明还提供了一类吡啶/联吡啶共轭微孔聚合物的应用,应用于二氧化碳吸附及分离。
有益效果
(1)本发明基于chichibabin小分子合成反应,合成吡啶/联吡啶共轭微孔聚合物;该方法在原有合成思路基础上,改变反应溶剂,利用2,2’-联吡啶-5,5’-二甲醛、芳香酮化合物和醋酸铵在吡啶反应介质中,构造共轭微孔网络结构,生成具有一定比表面积的吡啶/联吡啶共轭微孔聚合物。
(2)本发明在co2吸附及分离方面具有良好的应用价值,通过吡啶氮的有效引入大大提高了聚合物的氮含量,从而明显提升了所得聚合物的co2吸附量及co2/n2选择性,且均具有良好的可逆吸附-脱附性能。
附图说明
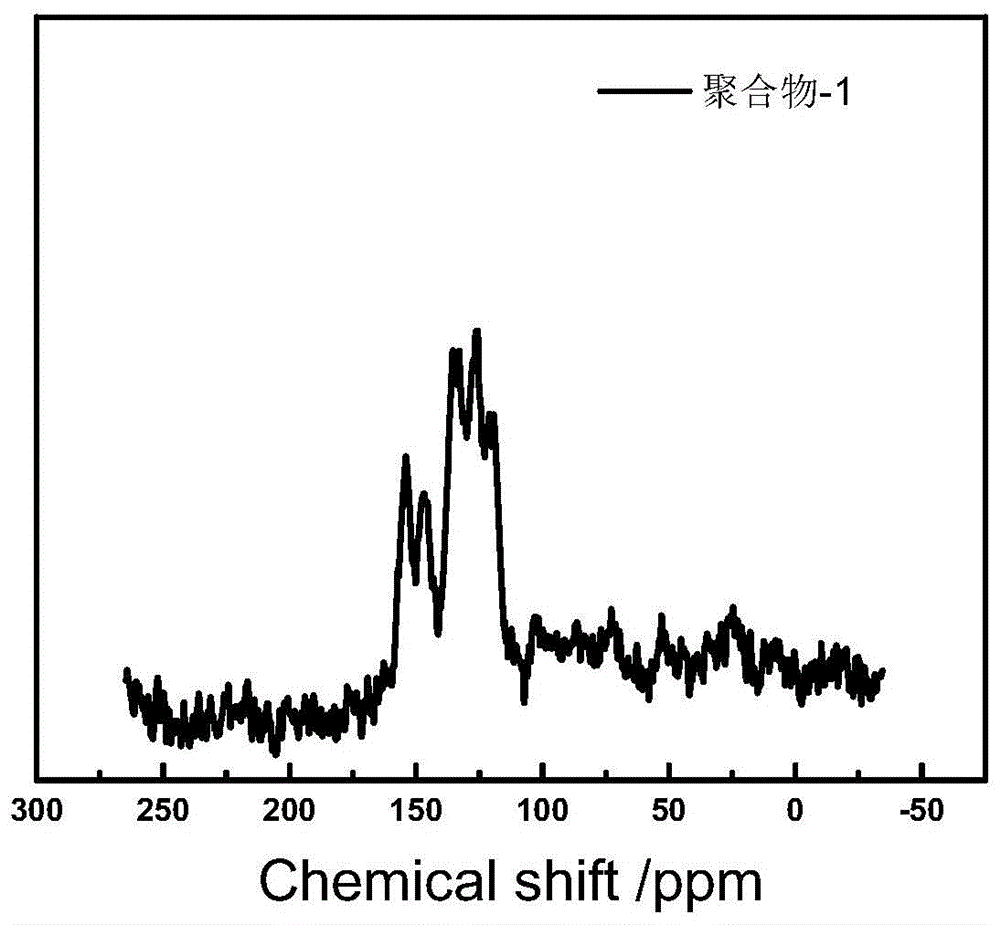
图1为实施例1合成产物的13c-nmr图;
图2为实施例1合成产物在77.4k下的n2吸附-脱附曲线;
图3为实施例1合成产物在273k下的co2吸附-脱附曲线;
图4为实施例1合成产物在298k下的co2吸附-脱附曲线;
图5为实施例1合成产物在273k下的co2及n2的初始吸附斜率曲线;
图6为实施例1合成产物在298k下的co2及n2的初始吸附斜率曲线
图7为实施例2合成产物的13c-nmr图;
图8为实施例2合成产物在77.4k下的n2吸附-脱附曲线;
图9为实施例2合成产物在273k下的co2吸附-脱附曲线;
图10为实施例2合成产物在298k下的co2吸附-脱附曲线;
图11为实施例2合成产物在273k下的co2及n2的初始吸附斜率曲线;
图12为实施例2合成产物在298k下的co2及n2的初始吸附斜率曲线;
图13为实施例3合成产物的13c-nmr图;
图14为实施例3合成产物在77.4k下的n2吸附-脱附曲线;
图15为实施例3合成产物在273k下的co2吸附-脱附曲线;
图16为实施例3合成产物在298k下的co2吸附-脱附曲线;
图17为实施例3合成产物在273k下的co2及n2的初始吸附斜率曲线;
图18为实施例3合成产物在298k下的co2及n2的初始吸附斜率曲线。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
实施例1
将2,2’-联吡啶-5,5’-二甲醛(212.2mg,1mmol)和1,4-二乙酰基苯(324.4mg,2mmol)混合置于100ml圆底烧瓶中,加入醋酸铵(2.31g,30mmol),然后加入50ml吡啶,将混合液置于115℃油浴下搅拌反应12h。反应结束后抽滤,分别使用去离子水和氯仿在60℃下洗涤24h,抽滤后置于100℃真空烘箱中烘干24h,即得到吡啶/联吡啶共轭微孔聚合物,记为聚合物-1,其bet比表面积为347m2/g。
本实施例得到的聚合物-1的13c-nmr测试结果如图1所示,可知在153.8和146.1ppm化学位移处的峰分别为处于吡啶基化学环境下的邻位和对位c的峰,证明吡啶氮的存在;在134.6、126.1及120.3ppm化学位移处的峰为处于苯环化学环境的c的峰,分别为连接吡啶氮环的原芳香酮苯环位置上的c、原酮苯环的其余四个位置的c以及吡啶氮间位的c,受到吡啶氮影响依次减弱,表现为苯环化学环境的峰,证明共轭结构的存在。该结果证实了聚合物-1的成功合成。
本实施例得到的聚合物-1在77.4k下的n2吸脱附曲线如图2所示,可知吸附等温线在低压区(p/p0<0.1)时有一段快速增长的区域,说明材料与氮有较强的作用,这种作用来源于微孔内强吸附势,证明聚合物-1中存在大量微孔;在高压区域(p/p0=0.9~1.0)时,吸附曲线的明显上升形为表明聚合物-1中有大孔的存在。此外,脱附曲线与吸附曲线未完全闭合,脱附曲线在吸附曲线之上,说明材料种存在一定的介孔。
本实施例得到的聚合物-1在273k下的co2吸脱附曲线如图3所示,可知吸附曲线在低压区域即有快速的上升,表明微孔结构对于吸附有一定的作用效果。在273k,1bar下聚合物-1的co2吸附量达到6.66wt%。此外,此温度下的co2脱附曲线与吸附曲线完全重合,说明所得聚合物-1对于co2的捕集为一种优异的可逆的物理吸附。
本实施例得到的聚合物-1在298k下的co2吸脱附曲线如图4所示,可知吸附曲线在低压区域即有快速的上升,表明微孔结构对于吸附有一定的作用效果。在298k,1bar下聚合物-1的co2吸附量达到4.90wt%。此外,此温度下的co2脱附曲线与吸附曲线未完全重合,存在滞后行为,说明此温度下脱附时仍有部分气体残留在孔隙中。
本实施例得到的聚合物-1在273k下的co2及n2的初始吸附斜率曲线如图5所示,通过计算拟合出的co2及n2初始吸附曲线斜率之比,可知co2/n2吸附选择性为42.34,具有良好的吸附选择性,明显优于大部分聚合物网络和多孔炭材料。
本实施例得到的聚合物-1在298k下的co2及n2的初始吸附斜率曲线如图6所示,通过计算拟合出的co2及n2初始吸附曲线斜率之比,可知co2/n2吸附选择性为41.06,具有良好的吸附选择性,明显优于大部分聚合物网络和多孔炭材料。
实施例2
将2,2’-联吡啶-5,5’-二甲醛(212.2mg,1mmol)和1,3-二乙酰基苯(324.4mg,2mmol)混合置于100ml圆底烧瓶中,加入醋酸铵(2.31g,30mmol),然后加入25ml醋酸使上述混合粉末全部溶解,最后将混合液置于115℃油浴下搅拌反应12h。反应结束后抽滤,分别使用去离子水和氯仿在60℃下洗涤24h,抽滤后置于100℃真空烘箱中烘干24h,即得到吡啶/联吡啶共轭微孔聚合物,记为聚合物-2,其bet比表面积为418m2/g。
本实施例得到的聚合物-2的13c-nmr测试结果如图7所示,可知在155.6和148.5ppm化学位移处的峰分别为处于吡啶基化学环境下的邻位和对位c的峰,证明吡啶氮的存在;在135.6、126.5及119.3ppm化学位移处的峰为处于苯环化学环境的c的峰,分别为连接吡啶氮环的原芳香酮苯环位置上的c、原酮苯环的其余四个位置的c以及吡啶氮间位的c,受到吡啶氮影响较小,表现为苯环化学环境的峰,证明共轭结构的存在。该结果证实了聚合物-2的成功合成。
本实施例得到的聚合物-2在77.4k下的n吸脱附曲线如图8所示,可知吸附等温线在低压区(p/p0<0.1)时有一段快速增长的区域,说明材料与氮有较强的作用,这种作用来源于微孔内强吸附势,证明聚合物-2中存在大量微孔,为明显的typei型n2吸附曲线,证明聚合物-2为微孔型材料。脱附曲线在吸附曲线之上,未完全闭合,这是由于部分n2残留在样品聚合物-2的孔隙中未能被彻底脱附造成的。
本实施例得到的聚合物-2在273k下的co2吸脱附曲线如图9所示,可知吸附曲线在低压区域即有快速的上升,表明微孔结构对于吸附有一定的作用效果。在273k,1bar下聚合物-2的co2吸附量达到7.18wt%。此外,此温度下的co2脱附曲线与吸附曲线基本重合,说明所得聚合物-2对于co2的捕集为一种优异的可逆的物理吸附。
本实施例得到的聚合物-2在298k下的co2吸脱附曲线如图10所示,可知吸附曲线在低压区域即有快速的上升,表明微孔结构对于吸附有一定的作用效果。在298k,1bar下聚合物-1的co2吸附量达到4.52wt%。此外,此温度下的co2脱附曲线与吸附曲线未完全重合,存在滞后行为,说明此温度下脱附时仍有部分气体残留在孔隙中。
本实施例得到的聚合物-2在273k下的co2及n2的初始吸附斜率曲线如图11所示,通过计算拟合出的co2及n2初始吸附曲线斜率之比,可知co2/n2吸附选择性为29.47,具有良好的吸附选择性,明显优于大部分聚合物网络和多孔炭材料。
本实施例得到的聚合物-2在298k下的co2及n2的初始吸附斜率曲线如图12所示,通过计算拟合出的co2及n2初始吸附曲线斜率之比,可知co2/n2吸附选择性为34.19,具有良好的吸附选择性,明显优于大部分聚合物网络和多孔炭材料。
实施例3
将2,2’-联吡啶-5,5’-二甲醛(212.2mg,1mmol)和2,6-二乙酰基吡啶(326.3mg,2mmol)混合置于100ml圆底烧瓶中,加入醋酸铵(2.31g,30mmol),然后加入50ml吡啶,最后将混合液置于120℃油浴下搅拌反应12h。反应结束后抽滤,分别使用去离子水和氯仿在60℃下洗涤24h,抽滤后置于60℃真空烘箱中烘干24h,即得到吡啶/联吡啶共轭微孔聚合物,记为聚合物-3,其bet比表面积为400m2/g。
本实施例得到的聚合物-3的13c-nmr测试结果如图13所示,可知在154.5和148.2ppm化学位移处的峰分别为处于吡啶基化学环境下的邻位和对位c的峰,证明吡啶氮的存在;在135.3及120.0ppm化学位移处的峰为处于苯环化学环境的c的峰,分别为原单体结构单元联吡啶环及酰基吡啶环相应位置吡啶氮间位的c,受到吡啶氮的影响最小,表现为苯环化学环境的峰,证明共轭结构的存在。该结果证实了聚合物-3的成功合成。
本实施例得到的聚合物-3在77.4k下的n2吸脱附曲线如图14所示,可知吸附等温线在低压区(p/p0<0.1)时有一段快速增长的区域,说明材料与氮有较强的作用,这种作用来源于微孔内强吸附势,证明聚合物-3中存在大量微孔;在高压区域(p/p0=0.9~1.0)时,吸附曲线的明显上升形为表明聚合物-3中有大孔的存在。此外,脱附曲线与吸附曲线未完全闭合,这是由于部分n2残留在样品聚合物-3的孔隙中未能被彻底脱附造成的。
本实施例得到的聚合物-3在273k下的co2吸脱附曲线如图15所示,可知吸附曲线在低压区域即有快速的上升,表明微孔结构对于吸附有一定的作用效果。在273k,1bar下聚合物-1的co2吸附量达到3.85wt%。此外,此温度下的co2脱附曲线与吸附曲线基本重合,说明所得聚合物-3对于co2的捕集行为表现为一种优异的可逆的物理吸附。
本实施例得到的聚合物-3在298k下的co2吸脱附曲线如图16所示,可知吸附曲线在低压区域即有快速的上升,表明微孔结构对于吸附有一定的作用效果。在298k,1bar下聚合物-1的co2吸附量达到4.90wt%。此外,此温度下的co2脱附曲线与吸附曲线未完全重合,存在滞后行为,说明此温度下脱附时仍有部分气体残留在孔隙中。
本实施例得到的聚合物-3在273k下的co2及n2的初始吸附斜率曲线如图17所示,通过计算拟合出的co2及n2初始吸附曲线斜率之比,可知co2/n2吸附选择性为36.98,具有良好的吸附选择性,明显优于大部分聚合物网络和多孔炭材料。
本实施例得到的聚合物-3在298k下的co2及n2的初始吸附斜率曲线如图18所示,通过计算拟合出的co2及n2初始吸附曲线斜率之比,可知co2/n2吸附选择性为37.84,具有良好的吸附选择性,明显优于大部分聚合物网络和多孔炭材料。
- 还没有人留言评论。精彩留言会获得点赞!
- 改性的基于共轭二烯的聚合物、包含其的改性橡胶组合物和制备改性的基于共轭二烯的 ...的制作方法
- 改性的共轭二烯聚合物、包含该聚合物的改性的橡胶组合物、以及用于制备改性的共轭二 ...的制作方法
- 能增强芴类共轭聚合物发射强度衬底及其制备方法及应用
- 基于荧光共轭聚合物与上转换纳米材料的复合抗菌剂及其使用方法
- 基于可分散超支化共轭聚合物纳米粒子的Fe<sup>3+</sup>荧光薄膜传感器件制备方法
- 一种基于萘并茚芴单元的共轭聚合物及其制备方法与应用
- 基于三苯胺共轭聚合物电致变色材料及其制备方法和应用
- 一种富含氮硫有机共轭小分子的制备方法与应用
- 共轭二烯系聚合物及共轭二烯系聚合物的制造方法
- 末端官能化的基于共轭二烯的聚合物及制备该聚合物的方法