PQBP1在卵巢癌诊治中的应用的制作方法
本发明属于生物医药和分子生物学技术领域,具体涉及pqbp1在卵巢癌诊治中的应用。
背景技术:
公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
卵巢癌是女性生殖器官常见的恶性肿瘤,病死率一直位居妇科恶性肿瘤之首。高级别浆液性卵巢癌(high-gradeserousovariancancer,hgsoc)是恶性程度最高的亚型,占卵巢癌的70%~80%,且具有发病隐匿、侵袭能力强、预后差等特点。大多数卵巢癌患者由于缺乏特异性症状和早期筛查方法,发现时多已确诊为晚期,常死于肿瘤复发和耐药,晚期患者的5年生存率仅为20%~30%。因此,阐明卵巢癌发生发展的分子机制,筛选有效的分子靶点,对于卵巢癌的早期诊断和治疗具有重要意义。
异常的选择性剪接在恶性肿瘤发生发展中起到重要作用,肿瘤细胞通过异常的选择性剪接产生有利于肿瘤增殖、凋亡、缺氧、血管生成、免疫逃逸和转移等行为的剪接异构体,进而促进肿瘤的发生发展。卵巢癌中异常剪接的分子机制与癌症进展密切相关。课题组通过转录组及蛋白质组学分析发现。与卵巢癌发生发展相关的信号通路中,剪接体通路排在首位,进一步分析134个主控剪接因子,发现有33个在卵巢癌中上调,提示异常的选择性剪接在卵巢癌中发挥关键作用。
卵巢癌中存在许多基因转录本的差异剪接,在卵巢癌细胞中cd44s高表达,cd44v低表达,cd44s通过下调剪接因子esrp1介导tgfβ1诱导的emt通路,从而诱导卵巢癌细胞侵袭迁移,随后获得干细胞样特征和耐药;骨桥蛋白(opn)转录本opnc在卵巢癌中特异性表达,而不是opna或opnb,促进卵巢癌细胞增殖、迁移、侵袭、体内肿瘤形成等恶性行为;bcl-x是凋亡基因bcl-2家族的一员,bcl-x基因的pre-mrna选择性剪接产生bcl-xs和bcl-xl,这两种亚型分别与促进和抑制凋亡有关,bcl-xl的过表达抑制肿瘤细胞凋亡、促进转移和化疗耐药并与不良临床预后有关,而bcl-xs可诱导细胞凋亡,使细胞对化疗药物敏感。
多聚谷氨酰胺结合蛋白1,即pqbp1(polyglutaminebindingprotein1,pqbp1)是课题组发现的在卵巢癌中表达上调的剪接因子之一,是一个进化上高度保守的智力发育相关蛋白,其突变会导致x染色体相关的“renpenning综合征”。pqbp1与rna聚合酶ii等转录因子相互作用参与转录调控。除此之外,pqbp1与多个剪接因子相互作用,参与人类细胞中许多基因mrna的选择性剪接。功能缺失的pqbp1降低了sf3b1与底物mrna的关联,导致选择性剪接模式发生显著变化。pqbp1在卵巢癌中表达水平上调,但是在卵巢癌发生发展中发挥怎样的作用,具体参与了哪些异常剪接事件,还有待进一步研究。
技术实现要素:
针对上述现有技术的不足,本发明提供pqbp1在卵巢癌诊治中的应用。经研究发现,pqbp1在卵巢癌患者中高表达,且通过体内和体外功能试验明确pqbp1促进卵巢癌细胞的增殖和侵袭迁移。此外,研究发现pqbp1能够影响内源性bcl-x的选择性剪接,具体表现在促进抑凋亡转录本bcl-xl的表达,抑制促凋亡转录本bcl-xs的表达,从而最终抑制卵巢癌细胞的凋亡。表明pqbp1是一种参与卵巢癌发生发展的剪接因子,可作为卵巢癌的生物标记物和治疗靶点。
本发明是通过如下技术方案实现的:
本发明的第一个方面,提供pqbp1在制备卵巢癌分子标志物中的应用。
进一步的,所述分子标志物用于检测、诊断或预测卵巢癌的进展。
所述卵巢癌的进展包括卵巢癌细胞的增殖、侵袭迁移和/或卵巢癌细胞的凋亡。
本发明的第二个方面,提供一种用于检测、诊断或预测卵巢癌的进展的组合物,其包含基于高通量测序方法和/或基于定量pcr方法和/或基于探针杂交方法检测卵巢癌样品中pqbp1的物质;或基于免疫检测方法检测卵巢癌样品中pqbp1蛋白的物质。
更进一步的,本发明提供一种试剂盒,所述试剂盒包括用于检测、诊断或预测卵巢癌的进展的组合物;
本发明的第三个方面,提供能够抑制pqbp1表达和/或活性降低的物质在如下(a)-(c)至少一种中的应用:
(a)抑制卵巢癌细胞的增殖,或制备用于抑制卵巢癌细胞增殖的产品;
(b)抑制卵巢癌细胞的侵袭迁移,或者制备用于抑制卵巢癌细胞侵袭迁移的产品;
(c)促进卵巢癌细胞的凋亡,或者制备用于促进卵巢癌细胞凋亡的产品。
进一步的,所述pqbp1通过调控bcl-x凋亡基因选择性剪接信号通路抑制卵巢癌细胞的凋亡;具体的,所述pqbp1能够促进抑凋亡转录本bcl-xl的表达,抑制促凋亡转录本bcl-xs的表达,从而抑制卵巢癌细胞的凋亡。
本发明的第四个方面,提供一种用于预防或治疗卵巢癌的药物组合物,其包含抑制pqbp1表达和/或活性降低的物质;
所述抑制pqbp1表达和/或活性降低的物质,包括采用基于rna的microrna功能性获得技术、和/或慢病毒shrna干扰技术下调pqbp1表达和/或抑制其活性;优选为pqbp1拮抗剂或抑制剂;其中,所述pqbp1拮抗剂包括根据pqbp1人工合成的shrna;
在本发明中,“治疗或预防”指的是能够抑制卵巢癌细胞的增殖、侵袭迁移和/或促进卵巢癌细胞凋亡。
本发明有益效果:
1.本发明为卵巢癌的诊断、病情评估和预后判断提供有效的分子标记物:本发明通过大量临床样本的验证,采用qpcr、westernblot以及免疫组织化学染色等方法证明了pqbp1在卵巢癌患者中高表达,具有卵巢癌分子标记物的潜力。
2.本发明为卵巢癌的诊断和治疗提供新的靶点:本发明通过体内和体外功能试验明确pqbp1促进卵巢癌细胞的增殖和侵袭迁移,并且抑制了细胞的凋亡。以上数据证明,降低内源性的pqbp1可以抑制肿瘤的生长、侵袭等恶性生物学行为。基于此,可以设计特异性的pqbp1抑制剂,从而达到治疗卵巢癌的目的。
3.本发明首次公布了pqbp1的靶点bcl-x关键凋亡基因,bcl-x作为凋亡关键基因在卵巢癌的发生发展中具有重要意义。本发明为凋亡信号通路的靶向调控找到了新的有效地方法,即通过pqbp1mimics/inhibitor实现凋亡通路的激活和抑制;相比较于铂类药物抑制凋亡通路,此方法靶向性更强。
附图说明
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
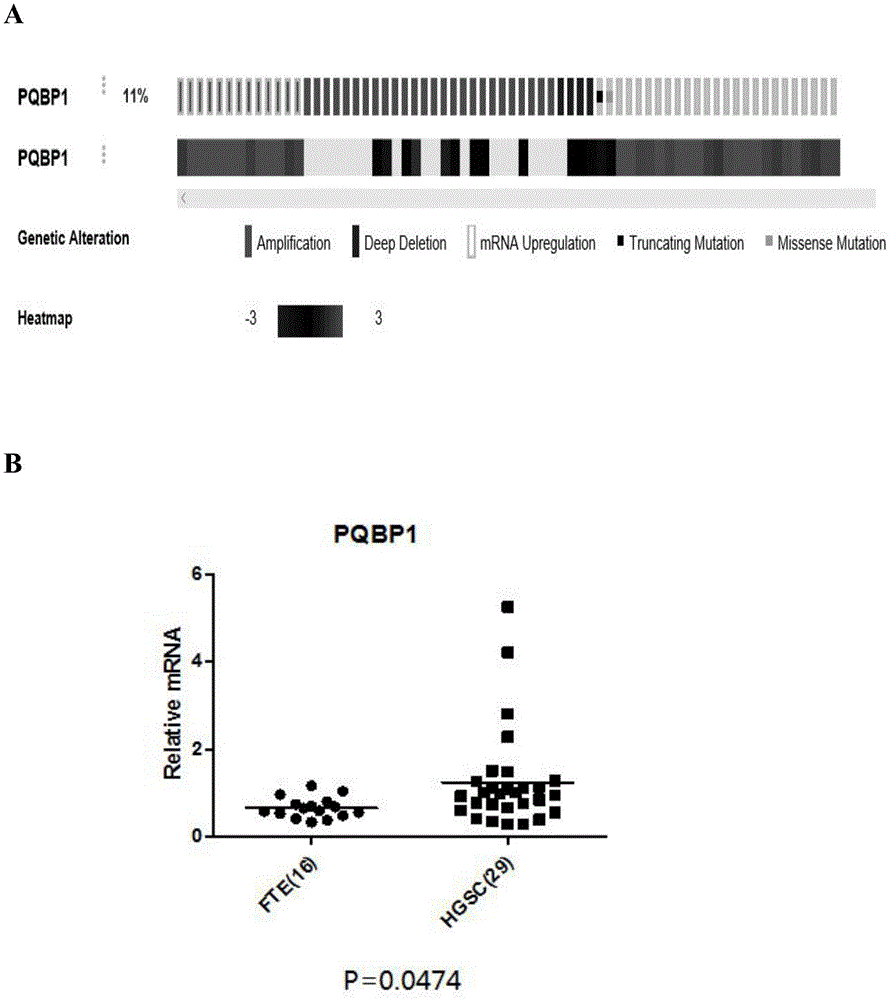
图1为实施例1中pqbp1在hgsoc中的表达及临床意义图;其中,图1a为数据库分析pqbp1在卵巢癌中的遗传改变;图1b为高级别浆液性卵巢癌组织与正常输卵管伞组织中pqbp1mrna含量比较图;图1c为tcga数据库分析pqbp1与卵巢癌预后关系图。
图2为慢病毒表达系统构建pqbp1稳转过表达和敲低三种细胞系相关图,图2a为qpcr、westernblotting检测敲低效率图;图2b为qpcr、westernblotting检测过表达效率图。
图3为实施例3中pqbp1促进卵巢癌细胞增殖图;其中,图3a为pqbp1促进了卵巢癌细胞增殖图,平板克隆实验证明pqbp1能够促进卵巢癌细胞克隆形成能力,增强癌细胞的恶性程度;图3b为pqbp1促进卵巢癌细胞增殖速率图,mtt实验证明过表达pqbp1和对照组相比,卵巢癌细胞的增殖速率明显增强,敲低pqbp1和对照组相比,卵巢癌细胞的增值速率显著降低;图3c显示pqbp1对周期信号通路蛋白的影响图;图3d显示pqbp1对裸鼠皮下成瘤能力的影响图。
图4为实施例3中pqbp1促进卵巢细胞侵袭迁移图;其中,图4a为pqbp1能够促进卵巢癌细胞侵袭迁移能力图,transwell实验证明过表达pqbp1能够显著增强癌细胞的恶性程度,敲低pqbp1能够降低卵巢癌细胞的恶性程度;图4b为pqbp1能够影响emt通路相关蛋白的表达图,过表达pqbp1能够促进snail、slug、vimentin等蛋白的表达,敲低pqbp1能够降低emt相关通路蛋白的表达进而促进卵巢癌细胞的侵袭迁移能力。
图5为实施例3中pqbp1抑制卵巢癌细胞凋亡相关图;流式细胞术证明过表达pqbp1的卵巢癌细胞系细胞凋亡数明显低于对照组,敲低pqbp1的卵巢癌细胞系细胞凋亡数明显高于对照组;westernblot实验表明过表达pqbp1能够降低bax蛋白的表达,促进bcl-2蛋白的表达;敲低pqbp1能够促进bax蛋白的表达,降低bcl-2蛋白的表达进而抑制卵巢癌细胞发生凋亡。
图6为实施例5中pqbp1调控bcl-x的选择性剪接相关图;图6a为pqbp1可以影响一系列凋亡因子相关的选择性剪接,其中包括bcl-x;图6b可以看出pqbp1可以促进抑凋亡转录本bcl-xl的表达,抑制促凋亡转录本bcl-xs的表达。图6c表明pqbp1调控外源性bcl-x的选择性剪接相关图;梯度过表达pqbp1促进抑凋亡转录本bcl-xl的梯度过表达,促进促凋亡转录本bcl-xs的梯度降低,在293t和hela细胞中分别验证。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本申请的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。下列具体实施方式中如果未注明具体条件的实验方法,通常按照本领域技术内的分子生物学的常规方法和条件,这种技术和条件在文献中有完整解释。参见例如sambrook等人,《分子克隆:实验手册》中所述的技术和条件,或按照制造厂商所建议的条件。
本发明的一个具体实施方式中,提供pqbp1在制备卵巢癌分子标志物中的应用。
本发明的又一具体实施方式中,所述pqbp1在制备卵巢癌分子标志物中的应用,所述标志物用于检测、诊断或预测卵巢癌的进展。
所述卵巢癌的进展包括卵巢癌细胞的增殖、侵袭迁移和/或卵巢癌细胞的凋亡;
本发明的又一具体实施方式中,所述卵巢癌为高级别浆液性卵巢癌(hgsoc)。
本发明的又一具体实施方式中,提供一种用于检测、诊断或预测卵巢癌的进展的组合物,其包含基于高通量测序方法和/或基于定量pcr方法和/或基于探针杂交方法检测卵巢癌样品中pqbp1的物质;或基于免疫检测方法检测卵巢癌样品中pqbp1蛋白的物质。
本发明的又一具体实施方式中,采用液相杂交、northern杂交、rna芯片、原位杂交检测卵巢癌样品中pqbp1;采用酶联免疫吸附测定、胶体金检测、蛋白质免疫印迹、蛋白质芯片检测卵巢癌样品中pqbp1蛋白;
本发明的又一具体实施方式中,本发明提供一种试剂盒,所述试剂盒包括用于检测、诊断或预测卵巢癌的进展的组合物;
本发明的又一具体实施方式中,所述组合物中含有检测pqbp1的引物,所述引物包括:
pqbp1上游引物:5’-accctagctcatactcagacg-3’(seqidno.1);
pqbp1下游引物:5’-tcttggcctcattccgcttg-3’(seqidno.2)。
本发明的又一具体实施方式中,提供能够抑制pqbp1表达和/或活性降低的物质在如下(a)-(c)至少一种中的应用:
(a)抑制卵巢癌细胞的增殖,或制备用于抑制卵巢癌细胞增殖的产品;
(b)抑制卵巢癌细胞的侵袭迁移,或者制备用于抑制卵巢癌细胞侵袭迁移的产品;
(c)促进卵巢癌细胞的凋亡,或者制备用于促进卵巢癌细胞凋亡的产品。
本发明的又一具体实施方式中,所述pqbp1通过调控bcl-x凋亡基因选择性剪接信号通路抑制卵巢癌细胞的凋亡;具体的,所述pqbp1能够促进抑凋亡转录本bcl-xl的表达,抑制促凋亡转录本bcl-xs的表达,从而抑制卵巢癌细胞的凋亡。
本发明的又一具体实施方式中,提供一种用于预防或治疗卵巢癌的药物组合物,其包含抑制pqbp1表达和/或活性降低的物质;
所述抑制pqbp1表达和/或活性降低的物质,包括采用基于rna的microrna功能性获得技术、和/或慢病毒shrna干扰技术下调pqbp1表达和/或抑制其活性;优选为pqbp1拮抗剂或抑制剂;其中,所述pqbp1拮抗剂包括根据pqbp1人工合成的shrna;
本发明的又一具体实施方式中,所述shrna序列合成时包含序列如下:
正向寡核苷酸(forwardoligo):5’-ccggcccttactactggaatgcagactcgagtctgcattccagtagtaagggtttttg-3’(seqidno.3);
反向寡核苷酸(reverseoligo):5’-aattcaaaaacccttactactggaatgcagactcgagtctgcattccagtagtaaggg-3’(seqidno.4)。
本发明的又一具体实施方式中,“治疗或预防”指的是能够抑制卵巢癌细胞的增殖、侵袭迁移和/或促进卵巢癌细胞凋亡。
本发明的又一具体实施方式中,所述药物组合物为固体口服制剂、液体口服制剂或注射剂。
本发明的又一具体实施方式中,药物剂型为可注射埋植剂、乳剂、脂质体、微囊剂、微球剂、纳米粒等。药物组合物施用的剂量可根据患者体重、年龄和性别、健康状况、饮食、施用时间、施用途径、排泄率和疾病严重性而变化。
以下通过实施例对本发明做进一步解释说明,但不构成对本发明的限制。应理解这些实施例仅用于说明本发明而不用于限制本发明的范围。另外,实施例中未详细说明的分子生物学方法均为本领域常规的方法,具体操作可参看分子生物指南或产品说明书。
实施例1明确卵巢癌中pqbp1所扮演的角色
课题组前期通过转录组及蛋白质组学分析发现pqbp1在hgsoc中高表达,我们进一步扩大样本进行验证,利用收集的卵巢正常输卵管伞组织16例,高级别浆液性卵巢癌组织共29例,提取组织rna,qpcr检测pqbp1mrna的相对表达量,发现pqbp1在高级别浆液性卵巢组织中mrna表达量明显高于正常输卵管伞组织(p<0.05)(图1b)。tcga数据库分析发现pqbp1在hgsoc中存在基因扩增和mrna高表达(11%),进一步分析发现pqbp1高表达的患者预后差,pqbp1低表达的患者预后好(图1aand1c)。综上所述,pqbp1在高级别浆液性卵巢癌中高表达,并且和患者预后密切相关,pqbp1在卵巢癌中出现部分扩增、上调及点突变等遗传改变。以上结果提示pqbp1可能在卵巢癌的发生和发展过程中发挥重要作用。
实施例2pqbp1过表达和敲低质粒构建
1.过表达质粒构建:
从addgene官网购买pqbp1过表达质粒。首先将pqbp1目的基因序列构建到中间载体pcdna3.1载体上,然后通过bamhⅰ酶切位点和xhoⅰ酶切位点连接到慢病毒载体pcmv上。
2.敲低质粒构建:
从sigma官网检索pqbp1对应的shrna序列如下:
forwardoligo:
5’ccggcccttactactggaatgcagactcgagtctgcattccagtagtaagggtttttg3’;
reverseoligo:
5’aattcaaaaacccttactactggaatgcagactcgagtctgcattccagtagtaaggg3’;
然后将该序列通过酶切位点ageⅰ和ecorⅰ构建到plko.1载体上。将过表达和敲低质粒瞬时转染功能细胞293t,48h之后收rna,72h之后收蛋白,分别检测rna和蛋白水平pqbp1的过表达和敲低情况。
实施例3pqbp1在卵巢癌细胞中发挥的生物学功能
将pqbp1的序列连接到pcmv质粒(origene官网购买得到)上,慢病毒包装后转染a2780和skov3细胞,利用嘌呤霉素进行筛选。筛选后用westernblot和qpcr检测pqbp1的含量。细胞系构建成功后用平板克隆实验形成实验检测细胞的增殖能力,以及transwell实验检测细胞的侵袭能力。
1、稳转细胞系构建:
(1)病毒颗粒的产生
配制转染复合物:用1.6ml无血清的opti-mem培养基分别稀释10μg的质粒dna和36μl的脂质体,吹匀后室温孵育5min;
将两者混合,吹匀并避免产生气泡,室温孵育20min左右以形成dna-脂质体混合物;
将上述dna-脂质体复合物加入到铺好细胞的培养皿中置于培养箱中;
培养3h后取出,往培养皿中补加5mlopti-mem培养基,继续培养6h左右之后换以6ml新鲜的无抗生素的dmem完全培养基,放回培养箱中继续培养;
培养24h后收集含有病毒颗粒的上清液,暂存于4℃,并向皿中加入6ml新鲜完全培养基;
培养48h后再次收集上清并将两次收集的上清液混合,20000rpm,4℃离心2h,获得病毒颗粒沉淀;
用500μl培养基重悬病毒沉淀,进行下一步实验或储存于-80℃。
(2)感染宿主细胞
将待感染细胞按照3×104个细胞/ml的密度接种到6孔板中,培养过夜;
铺板第二天,每孔加入含8μg/mlpolybreen(及50μl浓缩的病毒颗粒进行感染。晃动培养板(十字晃)使其混匀。放入培养箱中继续培养;
感染48h后,吸弃上清,更换含有2μg/ml嘌呤霉素的培养基进行筛选,每隔2天观察细胞生长状态,每3-4天更换一次含有嘌呤霉素的培养液,持续筛选2周后即可得到稳定转染目的质粒的细胞。
2、平板克隆:选取对数生长期细胞,膜蛋白酶消化,细胞计数,400个细胞每孔,接种于6孔板中,培养约10-14天,甲醇固定15min,结晶紫染色30min。镜下观察并进行计数。
3、mtt生长曲线:选取对数生长期细胞,胰蛋白酶消化,细胞计数,1000个细胞每空,接种于96孔板中,连续检测5天,mtt处理,dmso溶解,测细胞的od值。绘制细胞生长速率曲线。
4、裸鼠皮下成瘤明确pqbp1在卵巢癌中作用:4周龄balb/cnude雌鼠对照和实验组各6只。对照组注射hey-pcmv-nc细胞,实验组注射hey-pcmv-pqbp1细胞,每只注射500万细胞,细胞稀释于200μlpbs中,于皮下进行注射。2周后麻醉处死老鼠,取肿瘤组织浸泡于10%福尔马林溶液中,后石蜡包埋,然后进行切片,he染色和免疫组织化学染色以观察肿瘤组织细胞的形态和数目。
1、he染色步骤
烤片:60度烤片30min。
脱蜡:二甲苯i15min——二甲苯15min——100%酒精5min——100%酒精5min——95%酒精5min——80%酒精5min——75%酒精5min,自来水中涮洗2-3次。
苏木素染色10min,用小水流轻轻冲洗玻片,注意:水流过大可将组织冲走。
盐酸酒精1-2秒,氨水5-10秒,自来水中涮洗2-3次。
伊红染色20min,自来水中涮洗2-3次。
脱水:75%酒精10s——80%酒精10s——95%酒精10s——100%酒精10s——100%酒精10s——二甲苯i3min——二甲苯3min。
2、免疫组织化学染色
脱蜡步骤同上。
抗原修复:加入修复液(柠檬酸钠)附有组织的一面朝上,置于洗涤盒中,微波高火加热40s,待出现沸腾,暂停30秒。此时进入15个循环的蒸煮。12秒open+48秒close,冷却至室温(30min-60min);湿盒中3%过氧化氢37度孵育15-20min,pbs摇床洗3次*3min;血清封闭:滴加试剂a(蓝色液体)37度孵育25-30min;加一抗:室温2小时,加试剂b:37度孵育15-20min,pbs摇床洗3次*3min;加试剂b:37度孵育10-15min,pbs摇床洗3次*3min。
加显色液dab,苏木素染色,盐酸酒精中浸泡2秒---氨水中7-10秒;进行脱水(步骤同上)。
和对照组相比,实验组过表达pqbp1能够明显增强裸鼠的成瘤能力,无论在成瘤速率和成瘤大小上,都明显高于对照组,实验结果具有统计学意义。pqbp1是一个癌基因,能够促进卵巢癌细胞的增殖、侵袭迁移,抑制卵巢癌细胞凋亡,能够明显促进裸鼠的成瘤能力。
4、transwell:matrigel:dmem=10:1,该混合液每孔加入50μl,待胶凝固后,上室加入200μl细胞与无血清dmem混悬液(a278020万/孔,skov310万/孔),下室加入含有10%fbs的dmem,培养48小时后,甲醇固定,结晶紫染色后镜下观察计数。
5、流式细胞仪检测凋亡:提前一天将生长状态良好的稳转细胞系接种于6cm皿中,用30%过氧化氢处理1h,收细胞,用1×pbs洗一遍,用100μl1×annexinvbindingsolution重悬细胞,加入5μlpi和fitc染料,15分钟后,流式细胞仪检测凋亡细胞数。
为深入研究pqbp1在卵巢癌发生发展过程中的作用,我们利用慢病毒表达系统构建了pqbp1过表达和低表达稳转细胞系。qpcr验证及westernblotting检测pqbp1表达水平,细胞系构建成功(图2aand2b)。平板克隆实验证明pqbp1能够促进卵巢癌细胞克隆形成能力,促进卵巢癌细胞增殖,增强癌细胞的恶性程度,如图3a。mtt实验证明pqbp1促进卵巢癌细胞的增殖速率,过表达pqbp1和对照组相比,卵巢癌细胞的增殖速率明显增强,敲低pqbp1和对照组相比,卵巢癌细胞增殖速率明显降低,如图3b。westernblotting实验显示pqbp1影响g1期停滞相关蛋白的表达,过表达pqbp1能够促进cyclind1、cycline蛋白的表达,降低p53、p27、p21蛋白的表达进而抑制卵巢癌细胞增殖,降低pqbp1能够降低cyclind1、cycline等蛋白的表达,增加p53、p21等蛋白的表达,如图3c。我们将构建好的卵巢癌过表达pqbp1稳转hey细胞系(每组5×106个细胞)皮下接种裸鼠上肢腋窝处,一周裸鼠成瘤。发现过表达pqbp1能够明显增强裸鼠皮下成瘤能力,成瘤速度快,瘤体的体积和重量明显高于对照组(***p<0.001),两组数据具有统计学意义,如图3d。
transwell实验证明过表达pqbp1实验组细胞穿过matrigel胶的细胞数明显多于了对照组(p<0.001),敲低pqbp1实验组细胞穿过matrigel胶的细胞数明显低于对照组(p<0.001),表明pqbp1能够促进卵巢癌细胞的侵袭迁移,显著增强癌细胞的恶性程度,如图4a。westernblotting实验检测了emt通路相关蛋白marker的表达,结果显示,过表达pqbp1能够促进间质表达相关标记物n-cadherin、β-catenin、vimentin、claudin-1等蛋白的表达,同时也降低了上皮表达相关的标记物e-cadherin、zo-1等蛋白的表达,敲低pqbp1反之,如图4b。
我们采用一定浓度的过氧化氢作为凋亡诱导剂处理卵巢癌细胞,利用流式细胞术检测了凋亡细胞的比例。skov3、a2780细胞中敲低pqbp1早期凋亡和晚期凋亡的细胞总比例相比较对照组均明显升高(p<0.001)。hey细胞系中过表达pqbp1实验组早期凋亡和晚期凋亡细胞总比例明显低于对照组(p<0.001),如图5a。westernblotting实验检测凋亡相关蛋白的表达,敲低pqbp1促进bax、降低bcl-2蛋白的表达,与流式细胞术结果一致,见图5b。
实施例4bcl-xminigene质粒构建
构建的bcl-xminigene序列第一部分序列是外显子1和内含子2的前半部分;bcl-xminigene第二部分序列是内含子2后半部分和外显子3。将bcl-xminigene序列构建到了pcdna3.1载体上。bcl-xminigene质粒涉及的引物设计如下表:
实施例5明确pqbp1对bcl-x的调控关系
设计内源性bcl-xl和bcl-xs转录本的引物,检测过表达或敲低pqbp1对内源性bcl-x选择性剪接的影响。在稳转过表达或敲低pqbp1细胞系中检测内源性bcl-x表达的情况。发现pqbp1能够影响内源性bcl-x的选择性剪接,能够促进抑凋亡转录本bcl-xl的表达,抑制促凋亡转录本bcl-xs的表达。
于是进一步检测pqbp1对外源性bcl-xminigene选择性剪接的影响,瞬时转染293t、hela细胞,梯度过表达pqbp1,发现bcl-xl抑凋亡转录本的表达随之梯度升高,bcl-xs促凋亡转录本的表达梯度降低,如图6c。
瞬时转染步骤:
1.细胞铺板:一般取传代两次,状态良好的细胞进铺板转染。胰酶消化-培养基重悬细胞-细胞计数,根据细胞的大小,以及转染目的的不同,接种不同的细胞密度。转染质粒时,细胞密度最好控制在60%-80%。
2.配制转染复合物:以六孔板为例
dna转染方法:将2μgdna,4μljet
3.将上述转染混合液加入到已经接种合适密度细胞的6孔板中,每孔培养基2m1,加入200μ1的上述混合液,轻轻十字混匀后放入细胞培养箱中。兙俥
4.根据细胞状态以及后续实验需要(是否需要加药)决定是否去掉含有转染剂的培养基。一般情况下,转染后48h收细胞提取rna,72h收取细胞提取protein。
琼脂糖凝胶电泳步骤:
(1)配制1%的琼脂糖溶液(100m1tae+1g琼脂糖粉),微波加热融化后,混匀。
(2)倒入灌胶板内,插入齿子,冷却凝固后方可使用。兙俥
(3)pcr产物与核酸上样缓冲液混合,并加入胶孔中,注意在上样缓冲液及dnamarker中加入eb替代物。兙俥
(4)140v,30min进行琼脂糖电泳。兙俥
(5)紫外线下观测目的片段,是否有杂带,并拍照获取图像。
图6a显示pqbp1能够影响多个凋亡因子的选择性剪接,从中筛选到bcl-x基因。可以看出pqbp1可以促进抑凋亡转录本bcl-xl的表达,抑制促凋亡转录本bcl-xs的表达。图6b显示pqbp1能够影响卵巢癌细胞系内源性bcl-x的选择性剪接,敲低pqbp1能够抑制抑凋亡转录本bcl-xl的表达,促进促凋亡转录本bcl-xs的表达。通过westernblot实验证明pqbp1也能够影响bcl-xl蛋白的表达。图6c显示pqbp1能够影响外源性bcl-x的选择性剪接,梯度过表达pqbp1,能够梯度增强bcl-xl的表达,梯度降低bcl-xs的表达,在293t细胞和hela细胞系中分别验证。
应注意的是,以上实例仅用于说明本发明的技术方案而非对其进行限制。尽管参照所给出的实例对本发明进行了详细说明,但是本领域的普通技术人员可根据需要对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围。
sequencelisting
<110>山东大学
<120>pqbp1在卵巢癌诊治中的应用
<130>
<160>8
<170>patentinversion3.3
<210>1
<211>21
<212>dna
<213>人工合成
<400>1
accctagctcatactcagacg21
<210>2
<211>20
<212>dna
<213>人工合成
<400>2
tcttggcctcattccgcttg20
<210>3
<211>58
<212>dna
<213>人工合成
<400>3
ccggcccttactactggaatgcagactcgagtctgcattccagtagtaagggtttttg58
<210>4
<211>58
<212>dna
<213>人工合成
<400>4
aattcaaaaacccttactactggaatgcagactcgagtctgcattccagtagtaaggg58
<210>5
<211>30
<212>dna
<213>人工合成
<400>5
accagaattcggaggaggaagcaagcgagg30
<210>6
<211>32
<212>dna
<213>人工合成
<400>6
attactcgaggtaacccagcctgtccaaggtc32
<210>7
<211>31
<212>dna
<213>人工合成
<400>7
attactcgaggaccctcagaggcacagcttc31
<210>8
<211>34
<212>dna
<213>人工合成
<400>8
accatctagatttccgactgaagagtgagcccag34
- 还没有人留言评论。精彩留言会获得点赞!