他克林-吡啶并噻吩类化合物及其制备方法与用途与流程
本发明属于医药领域,涉及他克林-吡啶并噻吩类化合物及其制备方法,以及该类化合物在制备治疗阿尔茨海默症药物中应用。
背景技术:
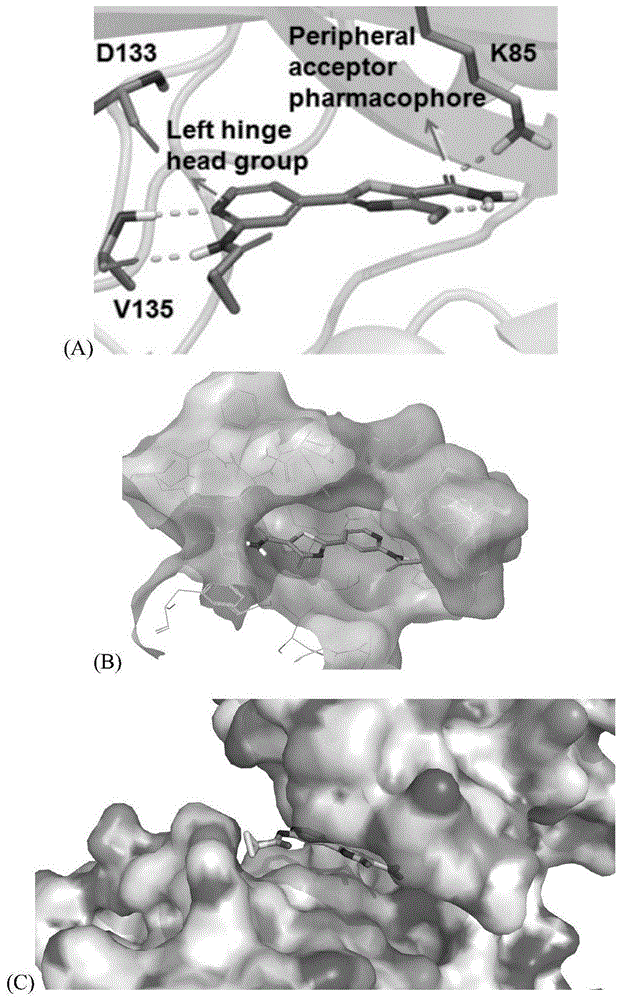
:阿尔茨海默症(alzheimer'sdisease,ad)是一种极为复杂的大脑神经退行性综合症,迄今为止人们对其确切病因尚无结论。目前认为ad是多种病因综合作用的结果,并且从发病机理角度提出了十几种ad学说,如胆碱能学说、淀粉样蛋白(β-amyloid,aβ)级联学说、tau蛋白学说、金属离子学说、氧化应激学说、免疫炎症学说、神经细胞凋亡学说、谷氨酸功能学说等。胆碱能损伤学说认为ad患者脑内基底层和大脑皮层中大量的胆碱能神经元遭到破坏,导致胆碱能神经元突触间隙ach含量大幅度减少,从而影响大脑信号的传导,导致学习记忆和认知功能下降,甚至智力丧失。淀粉样蛋白级联学说认为产生aβ的主要原因是膜内淀粉样前体蛋白(amyloidprecursorprotein,app)的异常水解和错误折叠。正常条件下app由α-分泌酶和γ-分泌酶切割;在ad患者中app则由β-分泌酶和γ-分泌酶切割产生p7和aβ40及aβ42,其中aβ40是主要形式,而aβ42则是致病形式,能导致app沉淀,形成老年斑,而且aβ的可溶性二聚体和聚集形成的原纤维都会对神经元产生毒性。神经纤维缠结(neurofibrillarytangles,nfts)是阿尔茨海默病的另一标志特征,主要包括以成对螺旋丝(pairedhelicalfilament,phf)形式出现的过度磷酸化的tau蛋白。tau属于微管相关蛋白(microtubule-associatedproteins,maps),与微管蛋白相连并使微管蛋白的稳定地聚合。而过度磷酸化tau蛋白(phf-tau)与微管蛋白的结合作用降低到正常水平的十分之一,从而丧失了促进微管装配的功能,而且其还可与微管蛋白竞争性的结合正常tau蛋白以及其他大分子微管相关蛋白,并夺取这些蛋白,导致正常的微管解聚,异常过度磷酸化的tau蛋白则自身聚集并且形成phf/nfts结构,从而导致老年痴呆。ad患者表现出来的认知障碍与记忆衰退是由于体内,尤其是脑内的乙酰胆碱(acetylcholine,ach)水平降低所引起的。而在正常人中乙酰胆碱大多数通过乙酰胆碱酯酶(acetylcholineesterase,ache)水解,丁酰胆碱酯酶(butyrylcholineesterase,buche)则水解剩余部分。ache除了传递胆碱能的功能之外也参与了神经细胞的生长、分化和粘附。研究证明ache在体外促进aβ纤维的形成以及在ad转基因鼠中促进了淀粉样斑块在脑内的沉积。故抑制患者乙酰胆碱酯酶的含量可以有效提高脑内乙酰胆碱水平,从而达到缓解病情的目的。神经纤维缠结的主要成分是过度磷酸化的tau蛋白(phf-tau),phf-tau是一种在树突中聚集的错误折叠的不可溶沉淀。在神经纤维缠结出现前,在ad患者的脑部检测到thr-231被磷酸化的tau蛋白。这个位点的磷酸化使tau蛋白与微管的结合能力下降,而thr-231的磷酸化需要cdk-5和gsk-3β的共同作用。抑制tau蛋白磷酸化的限速酶gsk-3β可以有效的减少tau蛋白的过度磷酸化,从而减轻脑部的nfts。目前,单靶点药物在治疗多因素疾病如神经退行性疾病、肿瘤、心血管系统疾病时,往往难以达到预期效果,还可能引发毒性。而多靶点药物可以通过调控疾病的多个环节,提高疗效,减少不良反应,并改善耐药性,呈现出良好的应用前景。目前,多靶点药物治疗方式可以分为三类:药物联合应用,多组分药物治疗和真正意义上的多靶点药物治疗(单一成分药物)。多靶点药物是指可以同时选择性地作用于两个或多个分子靶点的单一组分的药物。相比于联合用药和多组分药物,多靶点药物有着明显的优势:由于是单一组分,在药物代谢上其优于联合用药和多组分药物;克服了各组分之间因相互作用导致的不良反应;用药方便,不存在组合用药的剂量或比例问题;具有可预测的药效学(pharmacodynamics,pd)和药物代谢动力学(pharmacokinetics,pk)性质;在相同疗效的前提下,由于协同作用可使药物给药剂量降低,从而改善高选择性单靶点药物的不良反应;减缓耐药性的发生【proschak,e.;stark,h.;merk,d.polypharmacologybydesign:amedicinalchemist'sperspectiveonmultitargetingcompounds.j.med,chem.2018,doi:10.1021/acs.jmedchem.8b00760】。目前,多靶点药物治疗多因素疾病已有成功的临床案例。例如,伊马替尼是一种可以阻断多种酪氨酸激酶的小分子抑制剂,临床上用于治疗慢性髓性白血病和恶性胃肠道间质肿瘤【renaud,c.;elisabeth,b.;juerg,z.;alex,m.glivec(sti571,imatinib),arationallydeveloped,targetedanticancerdrug.nat.rev.drugdiscov.2002,1(7),493.】。对于ad,临床上还没有真正有效的治疗药物。而脑内胆碱水平下降和tau蛋白磷酸化是ad患者的两种重要的病理特征,针对这两个靶点开发双靶点抗ad药物,将可能极大发挥协同作用,对ad的治疗产生较好的疗效。他克林(1)是一种在1993年经美国fda批准的乙酰胆碱酯酶抑制剂(式1),用于治疗ad。其脂溶性高,易透过血脑屏障,为第一代可逆性抗胆碱酯酶抑制剂,可以通过抑制ache而增加ach的含量,还可以激动m受体和n受体,促进ach释放。但由于其严重的肝毒性,临床上现已停用。目前,针对改善他克林肝毒性,并基于他克林母核设计开发双靶点抗ad研究十分热门【lu,c.;zhou,q.;yan,j.;du,z.;huang,l.;li,x.anovelseriesoftacrine–selegilinehybridswithcholinesteraseandmonoamineoxidaseinhibitionactivitiesforthetreatmentofalzheimer'sdisease.eur.j.med.chem.2013,62,745-753.】。糖原合成酶激酶-3(gsk-3)是一种在进化上非常保守的丝氨酸/苏氨酸激酶,普遍存在于哺乳动物真核细胞中,除去最早发现的调控糖原合成酶(gs)的活性外,gsk-3β还能作用于众多信号蛋白结构蛋白和转录因子,调节细胞的分化、增殖、存活和凋亡。在癌症神经退行性疾病神经精神类疾病等多种重大疾病的研究中,选择其作为治疗靶点,受到越来越多研究者的重视。gsk-3β的生物学特性:gsk-3最早在兔骨骼肌的分次提取物中被分离出来,主要有两种亚型,即gsk-3α和gsk-3β,二者在催化区域具有98%的同源性,于n-和c-末端略有不同。gsk-3β是参与肝糖代谢的关键酶,通过磷酸化gs抑制其活性,降低肝糖的合成,使体内血糖浓度升高,在胰岛素信号通路中受控于胰岛素,参与肝糖的合成代谢。同时,gsk-3β通过影响血液中葡萄糖的浓度,还可调控bax/hkii的比例,进而影响线粒体渗透性及细胞色素c的释放,参与细胞凋亡的调控。此外,由于神经纤维缠结(nfts)是ad的一种重要的病理假说,而nfts的主要成分是过度磷酸化的tau蛋白,而gsk-3β是tau蛋白磷酸化的限速酶,抑制其活性可以有效减少tau蛋白的过度磷酸化,从而减轻脑部的nfts。gsk-3β(糖原合成酶激酶-3)中k85(lys85)的ε-氨基基团,在大部分结构中与配体氢键受体的n和o原子形成关键的氢键。sivaprakasam等【sivaprakasamp,hanx,civiellorl,etal.discoveryofnewacylaminopyridinesasgsk-3inhibitorsbyastructureguidedin-depthexplorationofchemicalspacearoundapyrrolopyridinonecore[j].bioorganic&medicinalchemistryletters,2015,25(9):1856-1863.】利用这个关键氢键设计了一系列吡啶并噻唑类化合物,并设想吡啶并噻唑核心提供三个关键片段结合gsk-3β活性位点:(1)铰链结合头部,即吡啶甲酰胺中吡啶结合于gsk-3β的铰链区;(2)间隔基团(吡啶并噻唑核心);(3)k85氢键受体原子,即双环中的羰基o与k85形成氢键。优选化合物2表现出良好的gsk-3β抑制活性,其ic50为1.1nm。但是,设计开发gsk-3β/che双靶点化合物存在着种种问题和挑战:(1)为了满足双靶点对于药效团的要求,双靶点药物分子通常在分子尺寸和相对分子质量上比单靶点药物分子更大,结构上更复杂,由于空间位阻的存在,多靶点药物分子的合成难度往往较大;(2)双靶点药物需要平衡对于不同靶点的活性,使其合理和平衡,如果其对于不同靶点的活性差异较大,则无法确定合适的给药剂量,难以达到预期效果。技术实现要素:本发明的目的在于制备同时具有胆碱酯酶和糖原合成酶3β的他克林-吡啶并噻吩类化合物,以期提供一类具有双靶点抗阿尔茨海默症作用的他克林-吡啶并噻吩化合物。本发明的目的可以通过以下技术方案实现:一种如式i所示的他克林-吡啶并噻吩类化合物:其中:r1为乙氧基、取代氨基或含有他克林片段的基团;r2为甲基、取代烷基或含有他克林片段的基团;r3为甲基、取代烷基或含有他克林片段的基团;所述的他克林-吡啶并噻吩类化合物,其特征在于r1为乙氧基、氨基、甲氨基、乙胺基、丙氨基;所述的他克林-吡啶并噻吩类化合物,其特征在于r2为甲基、环丙甲基、环丁甲基、异丙甲基、异丙基、二甲基丁基或含有他克林的基团;所述的他克林-吡啶并噻吩类化合物,其特征在于r3为甲基、环丙基、环丁基或含有他克林的基团;所述的他克林-吡啶并噻吩类化合物,其特征在于所述的含他克林片段的基团为以下基团:其中n为0~8整数,x为ch2、nh、氧原子、硫原子;r4选自甲氧基、氯。所述的他克林-吡啶并噻吩类化合物,其特征在于n为0~8整数,x为ch2、nh、氧原子、硫原子,r4为甲氧基、氯;一种所述的他克林-吡啶并噻吩类化合物,其特征在所述的他克林-吡啶并噻唑类化合物为如下结构中任意一种:2-(2-(环丙烷甲酰氨基)吡啶)-4-甲氧基-n-(2-((1,2,3,4-四氢吖啶)氨基)乙基)噻唑-5-甲酰胺;2-(2-(环丙烷甲酰氨基)吡啶)-4-甲氧基-n-(2-((1,2,3,4-四氢吖啶)氨基)丙基)噻唑-5-甲酰胺;2-(2-(环丙烷甲酰氨基)吡啶)-4-甲氧基-n-(2-((1,2,3,4-四氢吖啶)氨基)己基)噻唑-5-甲酰胺;4-(环丙基甲氧基)-n-甲基-2-(2-(2-((2-((1,2,3,4--1,2,3,4-四氢吖啶)氨基)乙基)氨基)乙酰氨基)吡啶-4-基)噻唑-5-甲酰胺;2-(2-(环丙烷甲酰氨基)吡啶)-4-(2-((1,2,3,4-四氢吖啶)氨基)乙氧基)噻唑-5-羧酸乙酯;2-(2-(环丙烷甲酰氨基)吡啶)-4-(2-((1,2,3,4-四氢吖啶)氨基)乙氧基)噻唑-5-羧酸;2-(2-(环丙烷甲酰氨基)吡啶)-4-(2-((1,2,3,4-四氢吖啶)氨基)乙氧基)噻唑-5-甲酰胺;2-(2-(环丙烷甲酰氨基)吡啶)-4-(2-((1,2,3,4-四氢吖啶)氨基)乙氧基)噻唑-5-羧酸甲酯;4-(环丙基甲氧基)-n-甲基-2-(2-(2-((2-((1,2,3,4-四氢吖啶)氨基)乙基)氨基)乙酰氨基)吡啶-4-基)噻唑-5-甲酰胺;2-(2-(2-((2-((6-氯-1,2,3,4-四氢吖啶)氨基)乙基)氨基)乙酰氨基)吡啶-4-基)-4-(环丙基甲氧基)-n-甲基噻唑-5-甲酰胺;4-(环丙基甲氧基)-2-(2-(2-((2-((7-甲氧基-1,2,3,4-四氢吖啶)氨基)乙基)氨基)乙酰氨基)吡啶-4-基)-n-甲基噻唑-5-甲酰胺;4-(环丙基甲氧基)-n-乙基-2-(2-(2-((2-((1,2,3,4-四氢吖啶)氨基)乙基)氨基)乙酰氨基)吡啶-4-基)噻唑-5-甲酰胺;4-(环丙基甲氧基)-n-丙基-2-(2-(2-((2-((-1,2,3,4-四氢吖啶)氨基)乙基)氨基)乙酰氨基)吡啶-4-基)噻唑-5-甲酰胺;4-(环丙基甲氧基)-n-甲基-2-(2-(2-((4-((1,2,3,4-四氢吖啶)氨基)丁基)氨基)乙酰氨基)吡啶-4-基)噻唑-5-甲酰胺;4-(环丙基甲氧基)-n-甲基-2-(2-(2-((6-((1,2,3,4-四氢吖啶)氨基)己基)氨基)乙酰氨基)吡啶-4-基)噻唑-5-甲酰胺;4-(环丙基甲氧基)-n-甲基-2-(2-(2-((8-((1,2,3,4-四氢吖啶)氨基)辛基)氨基)乙酰氨基)吡啶-4-基)噻唑-5-甲酰胺;4-(环丙基甲氧基)-n-甲基-2-(2-(2-((8-((1,2,3,4-四氢吖啶)氨基)辛基)氨基)乙酰氨基)吡啶-4-基)噻唑-5-甲酰胺;4-(环丁基甲氧基)-n-甲基-2-(2-(2-((2-((1,2,3,4-四氢吖啶)氨基)乙基)氨基)乙酰氨基)吡啶-4-基)噻唑-5-甲酰胺;n-甲基-4-(新戊氧基)-2-(2-(2-((2-((1,2,3,4-四氢吖啶)氨基)乙基)氨基)乙酰氨基)吡啶-4-基)噻唑-5-甲酰胺;4-异丙氧基-n-甲基-2-(2-(2-((2-((1,2,3,4-四氢吖-9-基)氨基)乙基)氨基)乙酰氨基)吡啶-4-基)噻唑-5-甲酰胺;4-异丁氧基-n-甲基-2-(2-(2-((2-((1,2,3,4-四氢吖啶)氨基)乙基)氨基)乙酰氨基)吡啶-4-基)噻唑-5-甲酰胺。所述的他克林-吡啶并噻吩类化合物在制备治疗阿尔茨海默症药物中应用。本发明的另一目的在于提供一种他克林-吡啶并噻唑类化合物的制备方法。本发明结构式ⅰ所示的他克林-吡啶并噻唑衍生物的制备方法,包括:首先,他克林部分合成方法为:以邻氨基苯甲酸甲酯为原料,经碱水解得到邻氨基苯甲酸,邻氨基苯甲酸与环己酮成环反应得到9-氯-1,2,3,4四氢吖啶,进一步和乙二胺反应得到9-(β-氨基乙二胺)-1,2,3,4-四氢吖啶;其次,吡啶并噻吩部分合成方法为:以2-氨基-4-腈基吡啶为原料与环丙基酰氯进行酰化反应得到n-(4-氰基吡啶)环丙烷甲酰胺,再与硫化铵反应将腈基水解为硫代酰胺,之后与溴代丙二酸二乙酯进行缩合环化反应生成噻唑环得到吡啶并噻唑中间体,再通过光延反应将其羟基进行烷基化。后续制备分为两种:(1)用弱碱将乙酯碱水解再酸化得到羧基产物,以及通过取代反应得到烷基酯,通过与氨基缩合反应得到酰胺化合物;最后,将他克林部分与吡啶并噻唑部分通过缩合成酰胺键或者成醚键反应制备得到如式(i)所示的他克林-吡啶并噻唑类化合物。(2)用强碱将乙酯和酰胺同时水解,通过与氨基缩合反应得到酰胺化合物;之后,氨基与氯乙酰氯发生消除反应;最后,将他克林部分与吡啶并噻唑部分通过取代反应制备得到如式(i)所示的他克林-吡啶并噻唑类化合物。具体包括如下步骤:步骤1、将邻氨基苯甲酸与环己酮加入到二颈瓶中,冰浴中滴加三氯氧磷,冰浴中搅拌5~10分钟后,105~115℃回流3~5小时,冷却至室温。用6~10倍反应液体积的冰dcm稀释,冰浴中加入与dcm体积相等的水,调ph值到9~10。分离有机层,dcm萃取三次,卤水洗三次,有机层用无水硫酸钠干燥。旋干,柱层析分离(pe/ea=8/1,v/v)最终得到棕黄色固体9-氯-1,2,3,4四氢吖啶。硅胶柱层析的洗脱剂为石油醚:乙酸乙酯(pe/ea)=8:1v/v;所述的邻氨基苯甲酸与环己酮的摩尔比为1:1~1:2;步骤2、将不同碳链长度的烷基二胺与催化量的nai溶于正戊醇中,n2保护下,边搅拌边滴加9-氯-1,2,3,4四氢吖啶的正戊醇溶液,滴毕,回流反应,反应结束后,冷却至室温,用hcl溶液萃取反应液,水层用naoh固体调碱,接着用二氯甲烷萃取,饱和食盐水洗,合并有机层,干燥,旋干,硅胶柱层析分离,得到不同碳链取代的他克林衍生物;洗脱剂为dcm:meoh=30:1,v/v,每1000ml洗脱剂中加入1ml三乙胺;所述的碳链长度的烷基二胺与9-氯-1,2,3,4四氢吖啶的摩尔比为1:1~2:1;步骤3、将2-氨基-4-腈基吡啶溶于干燥的dcm中,向其中加入少量的三乙胺助溶,再加入碳酸钾,冰浴搅拌5~10分钟。将环丙基甲酰氯溶于dcm中,用分液漏斗逐滴加入反应液中,最后加入催化量的dmap,冰浴10分钟后室温反应15~20小时。tlc监测反应完成,用滤纸加上硅藻土抽滤出去碳酸钾,dcm洗涤滤饼,滤饼用甲醇重结晶得到n-(4-氰基吡啶)环丙烷甲酰胺。所述的2-氨基-4-腈基吡啶与环丙基甲酰氯的摩尔比为1:2~1:4;步骤4、将n-(4-氰基吡啶)环丙烷甲酰胺溶于无水乙醇中,向其中滴加硫化铵,80~90℃回流反应2.5~4小时。将反应液旋干,加入适量的热乙醇,超声之后抽滤,用冷乙醇洗涤滤饼,剩下的滤液再次旋干重复上述操作,得到产物(4-碳硫基吡啶)氨基甲酰。所述的n-(4-氰基吡啶)环丙烷甲酰胺与硫化铵的摩尔比为1:5~1:10;步骤5、将(4-碳硫基吡啶)氨基甲酰溶于无水乙醇中,向其中加入溴代丙二酸二乙酯和吡啶,80~90℃反应16~20小时。用旋蒸装置蒸出五分之一的乙醇,冷却至室温后冰浴,析出大量黄色针状固体,得到2-(2-(环丙烷甲酰氨基)吡啶)-4-羟基噻唑-5-羧酸乙酯。所述的(4-碳硫基吡啶)氨基甲酰与溴代丙二酸二乙酯的摩尔比为1:1~1:2;步骤6、在二颈瓶中加入2-(2-(环丙烷甲酰氨基)吡啶)-4-羟基噻唑-5-羧酸乙酯,用干燥thf溶解,加入无水甲醇和三苯基膦,氩气保护冰浴条件下用分液漏斗缓慢滴加偶氮二甲酸二异丙酯,撤去冰浴后室温反应16~23小时。向反应液中加入适量的水,用乙酸乙酯萃取三次,无水硫酸钠干燥,滤液浓缩后柱层析得到2-(2-(环丙烷甲酰氨基)吡啶)-4-甲氧基噻唑-5-羧酸乙酯。洗脱剂为dcm:meoh=50:1,v/v,每1000ml洗脱剂中加入1ml三乙胺;所述的2-(2-(环丙烷甲酰氨基)吡啶)-4-羟基噻唑-5-羧酸乙酯与无水甲醇、三苯基膦、偶氮二甲酸二异丙酯的摩尔比为1:2:3:3~1:3:4:4;步骤7、将2-(2-(环丙烷甲酰氨基)吡啶)-4-甲氧基噻唑-5-羧酸乙酯溶于thf/meoh混合液中,在冰浴下缓慢滴加lioh溶液,10分钟后撤去冰浴,室温反应6~9小时。低温旋蒸去除反应液里的thf,将反应液中加入5倍量的水,反应液混浊,抽滤除去不溶于水的固体,将滤液ph调至2~4,用乙酸乙酯萃取3次,无水硫酸钠干燥,旋干得到2-(2-(环丙烷甲酰氨基)吡啶)-4-甲氧基噻唑-5-羧酸。所述的2-(2-(环丙烷甲酰氨基)吡啶)-4-甲氧基噻唑-5-羧酸乙酯与lioh的摩尔比为1:3~1:6;所述的氢氧化锂水溶液浓度为1~3n;步骤8、将2-(2-(环丙烷甲酰氨基)吡啶)-4-甲氧基噻唑-5-羧酸溶于dmf中,先后加入n,n-二异丙基乙胺和六氟磷酸苯并三唑-1-基-氧基三吡咯烷基磷,反应10分钟。将氨基他克林中间体加入反应液中,氩气保护下反应10~19小时。将反应液旋干,柱层析分离得到通式(i)结构的化合物。其中,2-(2-(环丙烷甲酰氨基)吡啶)-4-甲氧基噻唑-5-羧酸、六氟磷酸苯并三唑-1-基-氧基三吡咯烷基磷和n,n-二异丙基乙胺的摩尔比为1:1.2~1.5:1.3~1.5:0.8~11;洗脱剂为dcm:meoh=30:1,v/v,每1000ml洗脱剂中加入1ml三乙胺;步骤9、将2-(2-(环丙烷甲酰氨基)吡啶)-4-甲氧基噻唑-5-羧酸乙酯溶于thf/meoh混合液中,冰浴下逐滴滴加10nnaoh(20eq)水溶液,滴加完毕后,65℃回流10~24小时。反应结束后,加入与反应液体积相同的水,低温减压旋蒸除去thf/meoh,此过程有淡黄色不溶物析出,超声,抽滤除去不溶物,滤液在冰浴条件下用3nhcl调节ph至2~3,大量沉淀析出。静置1小时后,抽滤得2-(2-氨基吡啶-4-基)-4-(环丙基甲氧基)噻唑-5-羧酸;步骤10、将2-(2-氨基吡啶-4-基)-4-(环丙基甲氧基)噻唑-5-羧酸溶于dmf中,先后加入n,n-二异丙基乙胺和六氟磷酸苯并三唑-1-基-氧基三吡咯烷基磷,反应30分钟。将甲胺盐酸盐(3eq)加入反应液中,室温反应10~24小时。反应结束后,将反应液旋干,加入5ml适量水,抽滤,得2-(2-氨基吡啶-4-基)-4-(环丙基甲氧基)-n-甲基噻唑-5-甲酰胺;步骤11、将2-(2-氨基吡啶-4-基)-4-(环丙基甲氧基)-n-甲基噻唑-5-甲酰胺溶于干燥的dcm中,向其中加入少量的三乙胺,再加入nah(5eq)和催化量的dmap,冰浴搅拌10分钟。将氯乙酰氯(5eq)溶于5mldcm中,用分液漏斗逐滴加入反应液中,50℃回流反应16小时。tlc监测反应完成,在冰浴条件下,向反应液中逐滴滴加甲醇,旋干,加冰甲醇重结晶,抽滤,得2-(2-(2-氯乙酰氨基)吡啶-4-基)-4-(环丙基甲氧基)-n-甲基噻唑-5-甲酰胺;步骤12、将2-(2-(2-氯乙酰氨基)吡啶-4-基)-4-(环丙基甲氧基)-n-甲基噻唑-5-甲酰胺溶于mecn中,加入k2co3(2mmol),冰浴10分钟后加入氨基他克林中间体,82℃回流4~10小时。反应结束后,抽滤除去不溶物,将反应液旋干,柱层析分离得到通式(i)结构的化合物(dcm/meoh=10/1,v/v)。所述的药物组合物的剂型为胶囊剂、丸剂、片剂、颗粒剂或注射剂。一种组合物,以本发明所述的他克林-阿魏酸类化合物为有效成分或主要有效成分,与药学上可接受的载体。本发明的设计原理:经过分析gsk-3β抑制剂2与gsk-3β蛋白的作用方式,我们优选化合物2作为杂交体与gsk蛋白结合的配体(gsk-3β:ic50=1.1nm)。通过分析2与gsk蛋白共晶结构的分子对接示意图(图2):与吡啶环相连的酰胺键与氨基酸残基v135形成氢键,噻唑环5位酰胺键上的羰基氧原子与k85形成关键氢键,而酰胺键上的氨基则与噻唑环4位甲氧基上的氧原子形成分子内氢键帮助稳定氧原子和k85形成的氢键,中间的杂环骨架结构为左侧铰链区和右侧受体药效团提供了正确的集合框架(图1a)。另外,由分子对接结构也可以看出,噻唑环上酰胺键和甲氧基(图1b)、吡啶环上的环丙甲酰胺基团(图1c)处于溶剂暴露区,为引入linker提供了接入位点,从这些位点用linker连入他克林片段,将最小程度影响化合物与gsk-3β的结合。结合多靶点他克林杂交体的设计方法,我们将他克林和化合物2结合到一起设计一系列新的多靶点、双作用位点抑制剂。首先,我们先将linker与化合物2噻唑环上的酰胺键和他克林上的氨基通过不同长度的linker相连。其次,根据gsk-3β抑制剂2的x射线晶体衍射结果,噻唑环5位的羰基氧原子作为氢键受体与gsk-3β的k85氨基酸残基形成氢键,为了更加稳定这种作用力,我们将linker的接入位点改到噻唑环的4位甲氧基上。第三,为了丰富化合物的种类,帮助发现活性更好的杂交体,我们尝试从吡啶环上环丙甲酰胺部位连入linker。由此,我们设计并合成了多系列的双靶点抑制剂。有益效果发明人以糖原合成激酶-3β、乙酰胆碱酯酶及丁酰胆碱酯酶抑制活性的筛选为载体来评价他克林-吡啶并噻吩化合物治疗阿尔茨海默症活性的,发现具有良好的体外活性,同时降低了肝毒性通过了初步肝毒性评价,可作为进一步开发为通过抑制胆碱酯酶活性来发挥抗阿尔茨海默症作用的前体物质。morris水迷宫研究小鼠行为学,试验结果显示结果分析:显示了所有组小鼠到达平台所需平均时间,搜索距离。与空白对照组相比,东莨菪碱模型组小鼠到达平台的平均时间和距离高出很多,表明东莨菪碱会导致小鼠记忆缺陷,同时表明造模成功。相对于模型组,他克林组所耗时间和距离都显著降低,表明他克林对于小鼠的记忆和认知功能有显著性的改善。而化合物2g、化合物2f和化合物2d组,小鼠到达平台的平均时间和距离都低于他克林组,表明该系列对小鼠记忆和认知功能的改善效果超过他克林。附图说明图1为化合物2与gsk-3β的分子对接示意图,其中中间的杂环骨架结构为左侧铰链区和右侧受体药效团提供了正确的集合框架(图1a);噻唑环上酰胺键和甲氧基(图1b);吡啶环上的环丙甲酰胺基团(图1c)处于溶剂暴露区;图2为水迷宫研究小鼠行为学结果,其中所有组小鼠到达平台所需平均时间(a),搜索距离(b);图3为肝毒性组织病理学照片,其中对照组(a)、化合物2f(b)、化合物2d(c)、tacrine(d)。具体实施方式以下通过实施例形式对本发明的技术方案作进一步补充说明,但不应该理解为本发明范围仅限于以下实例。根据本发明技术方案,按照本领域的普通技术知识和惯用手段,在不脱离本发明技术思想的前提下,还可以做出其他多种形式的修改,替换和变更,凡基于本发明技术方案所实现的技术均属于本发明的范围。本发明所用溶剂均为市售化学纯或分析纯。通过核磁共振(nmr)确定化合物的结构。nmr的测定是使用brukeravance-300核磁共振仪,测定溶剂是cdcl3,内标为tms。实施例1n-(4-氰基吡啶)环丙烷甲酰胺(7)将2-氨基-4-腈基吡啶(6)(2.48g,20mmol)溶于干燥的dcm中(240ml),向其中加入少量的三乙胺助溶,再加入碳酸钾(14g,5eq),室温搅拌10分钟,冰浴搅拌10分钟。将环丙基甲酰氯(5.6ml,3eq)溶于15mldcm中,用分液漏斗逐滴加入反应液中,最后加入dmap(200mg,0.1eq),冰浴10分钟后室温反应16小时。tlc监测反应完成,用滤纸加上硅藻土抽滤出去碳酸钾,dcm洗涤滤饼,将滤液直接旋干用于下步反应。纯品2为白色粉末,产率为92%。(4-碳硫基吡啶)氨基甲酰氯(8)将化合物7(3.7g,20mmol)溶于无水乙醇(90ml),为白色混浊液体,向其中滴加硫化铵(35ml,5eq),溶液立即澄清,90℃回流反应3小时。tlc监测反应完成,将反应液旋干,加入适量的热乙醇,超声之后抽滤,用冷乙醇洗涤滤饼,得到黄色固体,剩下的滤液再次旋干重复上述操作。产物为黄色固体,产率为74%。2-(2-(环丙烷甲酰氨基)吡啶)-4-羟基噻唑-5-羧酸乙酯(9)将8(4.4g,20mmol)溶于无水乙醇中(120ml),向其中加入溴代丙二酸二乙酯(3.73ml,1.1eq)和吡啶(6.4ml,4eq),80℃搅拌,反应20小时。tlc监测反应完成,用旋蒸装置蒸出五分之一的乙醇,冷却至室温后冰浴,析出大量黄色针状固体,抽滤,滤饼用冰乙醇洗涤;将滤液再次浓缩至三分之一,重复上述操作。产物为黄色针状固体,产率为70%。1hnmr(300mhz,dmso-d6,δppm):11.03(s,1h,nh-),8.60(s,1h,-oh-),8.70(d,j=1.0hz,1h,ar-h),8.70(d,j=3.2hz,1h,ar-h),7.56(dd,j=3.2hz,1.0hz,1h,ar-h),4.27(q,j=3.1hz,2h,-ch2),2.08(m,1h,-ch-),1.31(t,3h,-ch3),0.88(m,4h,-ch2*2);esi/ms(m/z):334.3([m+h]+).2-(2-(环丙烷甲酰氨基)吡啶)-4-甲氧基噻唑-5-羧酸乙酯(10)在二颈瓶中加入9(3.33g,10mmol),用干燥thf溶解(120ml),加入无水甲醇(607μl,1.5eq)和三苯基膦(5.3g,2eq),氩气保护冰浴条件下用分液漏斗缓慢滴加由10ml四氢呋喃稀释过的diad(3.6ml,1.8eq),持续滴加10分钟,撤去冰浴后室温反应18小时。tlc检测反应完成,向反应液中加入150ml水,用75ml乙酸乙酯萃取,水层再用35ml乙酸乙酯萃取三次,无水硫酸钠干燥,浓缩有固体析出,抽滤滤饼为10。滤液浓缩后柱层析(dcm/meoh=50/1,v/v)得到淡黄色体,产率69%。1hnmr(300mhz,cdcl3,δppm):8.77(s,1h,-nh-),8.60(s,1h,ar-h),8.38(d,j=6.2hz,1h,ar-h),7.60(d,j=6.2hz,1h,ar-h),4.34(q,j=6.2hz,2h,-och2-),4.25(s,3h,-och3),1.71(m,1h,-ch-),1.37(t,j=6.2hz,3h,-ch2ch3),1.17(d,j=6.1hz,2h,-ch2-),0.95(d,j=6.1hz,2h,-ch2-);esi/ms(m/z):348.3([m+h]+).2-(2-(环丙烷甲酰氨基)吡啶)-4-甲氧基噻唑-5-羧酸(11)将10(1.7g,4.9mmol)溶于60mlthf/meoh混合液中(thf/meoh=3/1,v/v),在冰浴下缓慢滴加lioh溶液(11ml,1mmol/ml),10分钟后撤去冰浴,室温反应9小时。tlc检测反应完成,低温旋蒸去除反应液里的thf,将反应液中加入5倍量的水,反应液混浊,抽滤除去不溶于水的固体,将滤液ph调至2,用乙酸乙酯萃取3次,无水硫酸钠干燥,旋干得到淡黄色粉末,产率为80%。1hnmr(300mhz,dmso-d6,δppm):13.08(brs,1h,-cooh),11.06(s,1h,-nh-),8.64(s,1h,ar-h),8.43(d,j=6.1hz,1h,ar-h),7.54(d,j=6.1hz,1h,ar-h),4.09(s,3h,-och3),2.03(m,1h,-ch-),0.83(m,4h,-ch2*2);esi/ms(m/z):320.3([m+h]+).9-氯-1,2,3,4-四氢吖啶(4)将邻氨基苯甲酸(3)(5g,36.2mmol)与环己酮(3.6g,36.2mmol)加入到二颈瓶中,冰浴中滴加三氯氧磷(15ml),冰浴中搅拌5分钟后,115℃反应。反应液回流约5小时,tlc检测反应完成,冷却至室温。用80ml冰dcm稀释,冰浴中加入40ml水,调ph到9。分离有机层,dcm萃取三次,卤水洗三次,有机层用无水硫酸钠干燥。旋干,柱层析分离(pe/ea=8/1,v/v)。最终得到棕黄色固体5.99g,产率为76%。esi/ms(m/z):218.6([m+h]+).2-(1,2,3,4-四氢吖啶)-氨基乙醇(5)将化合物4a(1.09g,5mmol)溶于14ml异戊醇中,加入催化量的ki和2-氨基乙醇(3.7g,60mmol),135℃回流反应18小时。tlc检测反应完成,将反应液旋干出现棕色固体,用dcm溶解出现大量不溶物,抽滤,滤饼为黄色粉末状产物。将滤液通过柱层析得到余下产物(dcm/meoh=10/1,v/v),产率为64%。1hnmr(300mhz,dmso-d6,δppm):8.10(d,j=8.2hz,1h,ar-h),7.71(d,j=8.2hz,1h,ar-h),7.52(t,j=8.2hz,1h,ar-h),7.33(t,j=8.2hz,1h,ar-h),5.28(t,j=6.1hz,1h,-ch2nh-),4.84(brs,1h,-ch2oh),3.55(m,2h,-ch2oh),3.48(m,2h,-ch2nh-),2.89(t,j=6.1hz,2h,ar-ch2),2.72(t,j=6.1hz,2h,ar-ch2),1.83-1.76(m,4h,-ch2*2);esi/ms(m/z):243.1([m+h]+).9-(β-氨基乙二胺)-1,2,3,4-四氢吖啶(12a)将化合物4a(781mg,3.6mmol)溶于10ml异戊醇中,加入催化量的ki和乙二胺(1.3g,21.6mmol),135℃加热回流24小时。tlc检测反应完成,将反应液旋干,制沙,柱层析分离(dcm/meoh=10/1,v/v)得到黄色油状液体产物,产率为62%。1hnmr(cd3od,δppm):8.12(m,1h,ar-h),7.76(m,1h,ar-h),7.60(m,1h,ar-h),7.42(m,1h,ar-h),3.61(t,j=7.5hz,2h,-ch2),2.96(m,2h,-ch2),2.90(m,2h,-ch2),2.76(m,2h,-ch2),1.88-1.91(m,4h,-ch2*2);hrms(m/z):calcdforc15h20n3[m+h]+,242.1652;found,242.16499-(γ-氨基丙二胺)-1,2,3,4-四氢吖啶(12b)将化合物4a(781mg,3.6mmol)溶于10ml异戊醇中,加入催化量的ki和丙二胺(1.6g,21.6mmol),135℃加热回流24小时。tlc检测反应完成,将反应液旋干,制沙,柱层析分离(dcm/meoh=10/1,v/v)得到黄色油状液体产物,产率为65%。1hnmr(cd3od,δppm):8.04(m,1h,ar-h),7.78(m,1h,ar-h),7.67(m,1h,ar-h),7.31(m,1h,ar-h),3.24(t,j=7.5hz,2h,-ch2),2.98(m,2h,-ch2),2.86(t,j=7.5hz,2h,-ch2),2.69(m,2h,-ch2),1.87(m,4h,-ch2*2),1.83(m,2h,-ch2);hrms(m/z):calcdforc16h22n3[m+h]+,256.1808;found,256.1812.9-(γ-氨基丁二胺)-1,2,3,4-四氢吖啶(12c)将化合物4a(781mg,3.6mmol)溶于10ml异戊醇中,加入催化量的ki和丁二胺(1.9g,21.6mmol),135℃加热回流24小时。tlc检测反应完成,将反应液旋干,制沙,柱层析分离(dcm/meoh=10/1,v/v)得到黄色油状液体产物,产率为65%。1hnmr(cdcl3,,δppm):7.96(m,1h,ar-h),7.91(m,1h,ar-h),7.57(m,1h,ar-h),7.36(m,1h,ar-h),3.52(m,2h,-nhch2-),3.08(m,2h,ar-ch2-),2.75(m,2h,ar-ch2-),2.68(m,2h,nh2ch2-),1.93(m,4h,m,4h,-ch2*2),1.73(m,2h,nh2ch2ch2-),1.56(m,2h,-nhch2ch2-);hrms(m/z):calcdforc17h23n3[m+h]+,270.1970;found,270.1959.9-(1-氨基己二胺)-1,2,3,4-四氢吖啶(12d)将化合物4a(781mg,3.6mmol)溶于10ml异戊醇中,加入催化量的ki和己二胺(2.5g,21.6mmol),135℃加热回流24小时。tlc检测反应完成,将反应液旋干,制沙,柱层析分离(dcm/meoh=10/1,v/v)得到黄色油状液体产物,产率为62%。1hnmr(cd3od,δppm):8.04(m,1h,ar-h),7.75(m,1h,ar-h),7.59(m,1h,ar-h),7.26(m,1h,ar-h),3.19(t,j=7.5hz,2h,-ch2),3.04(m,2h,-ch2),2.79(t,j=7.5hz,2h,-ch2),2.63(m,2h,-ch2),1.82-1.89(m,4h,-ch2*2),1.57(m,4h,-ch2*2),1.25(m,4h,-ch2*2);hrms(m/z):calcdforc19h28n3[m+h]+,298.2278;found,298.2275.9-(1-氨基辛二胺)-1,2,3,4-四氢吖啶(12e)将化合物4a(781mg,3.6mmol)溶于10ml异戊醇中,加入催化量的ki和辛二胺(3.2g,21.6mmol),135℃加热回流24小时。tlc检测反应完成,将反应液旋干,制沙,柱层析分离(dcm/meoh=10/1,v/v)得到黄色油状液体产物,产率为62%。1hnmr(cdcl3,,δppm):7.96(m,1h,ar-h),7.93(m,1h,ar-h),7.56(m,1h,ar-h),7.35(m,1h,ar-h),3.50(t,j=7.5hz,2h,-ch2),3.08(m,2h,-ch2),2.71(t,j=7.5hz,2h,-ch2),2.67(m,2h,-ch2),1.93(m,4h,-ch2*2),1.66(m,2h,-ch2-),1.31~1.46(m,6h,-ch2*3);hrms(m/z):calcdforc21h31n3[m+h]+,326.2596;found,326.2585.6-氯-9-(β-氨基乙二胺)-1,2,3,4-四氢吖啶(12f)将化合物4b(1.17g,5mmol)溶于14ml异戊醇中,加入催化量的ki和乙二胺(3.6g,60mmol),135℃回流反应18小时。tlc检测反应完成,将反应液旋干出现棕色固体,用dcm溶解出现大量不溶物,抽滤,滤饼为黄色粉末状产物。将滤液通过柱层析得到余下产物(dcm/meoh=10/1,v/v),产率为64%。1hnmr(300mhz,cdcl3,δppm):7.97(s,1h,-ch2nh-),6.91-7.24(m,3h,ar-h),3.58(t,j=9.0hz,2h,-nhch2-),3.09(t,j=6.0hz,2h,-nh2ch2-),3.02(t,j=6.0hz,2h,ar-ch2-),2.75(m,2h,ar-ch2-),1.92(m,4h,-(ch2)ch-);hrms(m/z):calcdforc15h19cln3[m+h]+,276.1262;found,276.1251.6-氯-9-(γ-氨基丙二胺)-1,2,3,4-四氢吖啶(12g)将化合物4b(1.17g,5mmol)溶于14ml异戊醇中,加入催化量的ki和丙二胺(4.4g,60mmol),135℃回流反应18小时。tlc检测反应完成,将反应液旋干出现棕色固体,用dcm溶解出现大量不溶物,抽滤,滤饼为黄色粉末状产物。将滤液通过柱层析得到余下产物(dcm/meoh=10/1,v/v),产率为64%。1hnmr(300mhz,dmso-d6,δppm):7.97(s,1h,-ch2nh-),7.93(d,j=6.0hz,1h,ar-h),7.26(m,1h,ar-h),3.65(t,j=6.0hz,2h,-nhch2-),3.05(t,j=6.0hz,2h,-nh2ch2-),2.95(t,j=6.0hz,2h,ar-ch2-),2.69(m,2h,-ch2ch2ch2-),1.82(m,2h,ar-ch2-),1.81(m,4h,-(ch2)ch-);hrms(m/z):calcdforc16h21cln3[m+h]+,290.1419;found,290.1425.7-甲氧基-9-(β-氨基乙二胺)-1,2,3,4-四氢吖啶(12h)将化合物4c(1.14g,5mmol)溶于14ml异戊醇中,加入催化量的ki和乙二胺(3.6g,60mmol),135℃回流反应18小时。tlc检测反应完成,将反应液旋干出现棕色固体,用dcm溶解出现大量不溶物,抽滤,滤饼为黄色粉末状产物。将滤液通过柱层析得到余下产物(dcm/meoh=10/1,v/v),产率为64%。1hnmr(300mhz,cdcl3,δppm):7.90(d,j=9.0hz,1h,ar-h),7.25-7.36(m,2h,ar-h),3.94(s,3h,-och3),3.47(m,2h,-nhch2-),3.09(d,2h,-nh2ch2-),3.01(m,2h,ar-ch2-),2.82(m,2h,ar-ch2-),1.94(m,4h,-(ch2)ch-);hrms(m/z):calcdforc16h22n3o[m+h]+,272.1757;found,272.1752.7-甲氧基-9-(γ-氨基丙二胺)-1,2,3,4-四氢吖啶(12i)将化合物4c(1.14g,5mmol)溶于14ml异戊醇中,加入催化量的ki和丙二胺(4.4g,60mmol),135℃回流反应18小时。tlc检测反应完成,将反应液旋干出现棕色固体,用dcm溶解出现大量不溶物,抽滤,滤饼为黄色粉末状产物。将滤液通过柱层析得到余下产物(dcm/meoh=10/1,v/v),产率为64%。1hnmr(cdcl3,δppm):7.89(m,1h,ar-h),7.29(m,1h,ar-h),7.22(m,1h,ar-h),3.91(s,3h,-och3),3.56(m,2h,ar-ch2-),3.06(m,2h,ar-ch2-),2.93(m,2h,-nh2ch2-),2.75(m,2h,-nhch2-),1.91(m,2h,-ch2ch2ch2-),1.82(m,2h,-ch2ch2ch2-),1.26(m,2h,-nhch2ch2ch2-),0.84(m,2h,-nh2);hrms(m/z):calcdforc17h24n3o[m+h]+,286.1914;found,286.1920.2-(2-(环丙烷甲酰氨基)吡啶)-4-甲氧基-n-(2-((1,2,3,4-四氢吖啶)氨基)乙基)噻唑-5-甲酰胺(2a)将化合物11(96mg,0.3mmol)溶于5mldmf中,先后加入dipea(149μl,3eq)和hatu(160mg,1.4eq),氩气保护下活化3小时。将化合物12a(107mg,1.4eq)用3mldmf溶解,待活化结束后加入到反应液中,氩气保护下反应24小时。tlc检测反应完成,将反应液旋干,柱层析分离得到产物(dcm/meoh=20/1,v/v)。产物为黄色固体,产率为48%。1hnmr(300mhz,dmso-d6,δppm):13.31(brs,1h,-conh-),11.02(s,1h,-conh-),8.62(t,j=6.1hz,1h,-nhch2-),8.42(t,j=6.1hz,2h,ar-h),7.85(t,j=6.1hz,2h,ar-h),7.70(m,1h,ar-h),7.54(q,j=8.2hz,2h,ar-h),4.05(s,3h,-och3),4.03(m,2h,-ch2nh-),3.66(d,j=6.1hz,2h,-ch2nh-),2.90(d,j=6.1hz,2h,ar-ch2-),2.65(s,2h,-ch2-,ar-ch2-),2.04(d,j=6.1hz,1h,-chco-),1.80(m,2h,-ch2-),1.23(m,2h,-ch2-),0.84(d,j=8.2hz,4h,-(ch2)ch-);13cnmr(75mhz,dmso-d6,δppm):173.6,163.6,161.2,157.2,153.6,151.0,149.8,140.9,138.2,133.2,125.6,119.4,116.2,115.5,112.3,109.3,58.7,54.1,42.3,28.4,21.9,20.8,18.6,17.2,14.7,12.9,8.3;hrms(m/z):calcdforc29h31n6o3s[m+h]+,543.2173;found,543.2175;实施例2:2-(2-(环丙烷甲酰氨基)吡啶)-4-甲氧基-n-(2-((1,2,3,4-四氢吖啶)氨基)丙基)噻唑-5-甲酰胺(2b)参照实施例1的合成方法,以12b替代实施例1中的12a,得黄色固体化合物,产率为43%。1hnmr(300mhz,dmso-d6,δppm):11.03(s,1h,-conh-),8.62(s,1h,-conh-),8.45(d,j=5.1hz,1h-nhch2-),8.35(d,j=8.6hz,1h,ar-h),7.74-7.82(m,4h,ar-h),7.49-7.56(m,2h,ar-h),4.08(s,3h,-och3),3.92(d,j=5.7hz,2h,-ch2nh-),3.39(d,j=5.7hz,2h,-ch2nh-),2.89(t,j=9.1hz,2h,ar-ch2-),2.64(t,j=9.1hz,2h,ar-ch2-),2.03(m,1h,-chco-),2.01(m,2h,-ch2-),1.79(m,4h,-(ch2)2-),0.85(m,4h,-(ch2)ch-);13cnmr(75mhz,dmso-d6,δppm):173.6,163.2,161.1,160.3,156.36,153.6,149.8,141.0,138.3,133.2,129.3,125.6,125.4,121.2,119.5,115.9,115.5,111.7,110.1,109.2,58.7,54.1,45.6,40.5,40.5,40.4,40.3,40.2,40.0,39.9,39.7,39.5,37.1,30.3,28.4,24.3,21.9,20.7,14.8,8.4;hrms(m/z):calcdforc30h33n6o3s[m+h]+,557.2335;found,557.2333;实施例3:2-(2-(环丙烷甲酰氨基)吡啶)-4-甲氧基-n-(2-((1,2,3,4-四氢吖啶)氨基)己基)噻唑-5-甲酰胺(2c)参照实施例1的合成方法,以12d替代实施例1中的12a,得黄色固体化合物,产率为36%。1hnmr(300mhz,dmso-d6,δppm):11.02(s,1h,-conh-),8.60(s,1h,-conh-),8.45(dd,j=8.5,2.6hz,1h,ar-h),8.31(dd,j=8.5,2.6hz,1h,ar-h),7.86(d,j=8.2hz,1h,ar-h),7.78(t,j=8.2hz,1h,ar-h),7.58(m,1h,ar-h),7.51(m,2h,ar-h),4.11(s,3h,-och3),3.78(t,j=6.1hz,2h,-ch2nh-),3.23(d,j=6.1hz,2h,-ch2nh-),2.95(m,2h,ar-ch2-),2.62(m,2h,ar-ch2-),2.03(m,1h,-chco-),1.79(m,2h,-ch2-),1.70(m,2h,-ch2-),1.48(m,2h,-ch2-),1.31(m,2h,-ch2-),1.29(m,4h,-(ch2)2-),0.83(t,j=6.1hz,4h,-(ch2)ch-);13cnmr(75mhz,dmso-d6,δppm):173.6,162.9,161.0,159.9,158.6,158.3,155.7,153.6,151.7,149.8,149.0,141.0,139.9,139.1,135.0,132.6,128.2,125.3,120.4,119.9,118.9,116.5,116.4,115.4,112.0,110.5,109.2,58.7,53.7,47.8,46.6,42.1,40.5,40.3,40.2,40.1,40.0,39.8,39.7,39.5,30.3,29.6,28.8,26.4,26.2,24.4,22.0,20.9,19.1,17.8,14.7,12.7,8.3;hrms(m/z):calcdforc33h39n6o3s[m+h]+,599.2804;found,599.2809;实施例4:2-(2-(环丙烷甲酰氨基)吡啶)-4-甲氧基-n-(2-((6-氯-(1,2,3,4-四氢吖啶)))氨基)丙基)噻唑-5-甲酰胺(2d)参照实施例1的合成方法,以12f替代实施例1中的12a,得黄色固体化合物,产率为43%。1hnmr(300mhz,dmso-d6,δppm):11.02(s,1h,-conh-),8.65(s,1h,-conh-),8.43-8.49(m,j=6.0hz,2h,ar-h),7.55-7.74(m,4h,ar-h),7.83(t,j=6.0hz,1h,-nhch2-),4.07(s,3h,-och3),4.03(s,2h,-ch2nh-),3.64(dd,j=6.0hz,2h,-ch2nh-),2.92(d,j=6.0hz,2h,ar-ch2-),2.67(s,2h,ar-ch2-),2.06(m,j=6.0hz,1h,-chco-),1.82(m,4h,-(ch2)2-),0.86(m,4h,-(ch2)ch-);13cnmr(75mhz,dmso-d6,δppm):175.05,173.61,165.02,163.53,161.23,160.96,156.38,153.63,149.83,140.91,137.14,128.01,125.53,119.14,115.51,115.21,113.23,109.45,109.12,58.64,48.29,29.01,24.38,21.88,20.92,14.75,8.40;hrms(m/z):calcdforc29h30cln6o3s[m+h]+,577.1783;found,577.1793.实施例5:2-(2-(环丙烷甲酰氨基)吡啶)-4-甲氧基-n-(2-((6-氯-(1,2,3,4-四氢吖啶))氨基)丙基)噻唑-5-甲酰胺(2e)参照实施例1的合成方法,以12g替代实施例1中的12a,得黄色固体化合物,产率为49%。1hnmr(300mhz,dmso-d6,δppm):11.01(s,1h,-conh-),8.64(s,1h,-conh-),8.47(d,j=6.0hz,1h,-nhch2-),8.37(d,j=9.0hz,1h,ar-h),7.80(s,1h,ar-h),7.51-7.72(m,4h,ar-h),4.11(s,3h,-och3),3.93(m,j=6.0hz,2h,-ch2nh-),3.40(dd,j=6.0hz,2h,-ch2nh-),2.91(t,j=3.0hz,2h,ar-ch2-),2.65(s,2h,ar-ch2-),2.09(m,4h,-(ch2)2-),2.04(m,2h,--ch2ch2ch2-),1.97(m,4h,-(ch2)2-),0.86(m,4h,-(ch2)ch-);13cnmr(75mhz,dmso-d6,δppm):173.0,162.6,160.4,159.6,155.6,153.1,150.9,149.2,140.4,138.7,136.9,127.4,124.9,117.9,114.9,114.1,111.8,109.4,108.6,58.1,45.1,36.5,29.5,28.0,23.7,21.2,20.2,14.2,7.8;hrms(m/z):calcdforc30h31cln6o3s[m+h]+,591.1940;found,591.1952.实施例6:2-(2-(环丙烷甲酰氨基)吡啶)-4-甲氧基-n-(2-((7-甲氧基(1,2,3,4-四氢吖啶))氨基)丙基)噻唑-5-甲酰胺(2f)参照实施例1的合成方法,以12h替代实施例1中的12a,得黄色固体化合物,产率为43%。1hnmr(300mhz,dmso-d6,δppm):11.00(s,1h,-conh-),8.63(m,1h,-conh-),7.45-7.65(m,4h,ar-h),7.19(m,1h,ar-h),5.51(m,1h,-ch2nh-),4.01(s,1h,-och3),3.85(s,1h,-och3),3.54(m,4h,-nhch2ch2nh-),2.86(t,2h,j=5.79hz,ar-ch2-),2.74(m,2h,ar-ch2-),2.04(m,1h,-chco-),1.81(m,4h,-(ch2)2-),0.86(m,4h,-(ch2)ch-);13cnmr(75mhz,dmso-d6,δppm):173.0,162.6,160.5,160.0,155.5,155.3,149.4,149.2,142.1,140.5,129.3,121.0,119.9,117.1,114.9,109.5,108.6,101.5,58.0,55.3,48.5,47.1,32.9,25.2,22.6,22.3,14.2,7.7;hrms(m/z):calcdforc29h30cln6o3s[m+h]+,573.2279;found,573.2273.实施例7:2-(2-(环丙烷甲酰氨基)吡啶)-4-甲氧基-n-(2-((7-甲氧基(1,2,3,4-四氢吖啶))氨基)丙基)噻唑-5-甲酰胺(2g)参照实施例1的合成方法,以12i替代实施例1中的12a,得黄色固体化合物,产率为43%。1hnmr(300mhz,cdcl3,δppm):8.76(m,1h,-conh-),8.62(m,1h,-ch2nh-),8.36(d,1h,j=5.88hz,ar-h),7.86(d,j=8.91hz,1h,ar-h),7.51(d,1h,j=6.12hz,ar-h),7.41(s,1h,j=6.13hz,ar-h),7.26(m,1h,ar-h),4.19(s,1h,-och3),3.95(s,1h,-och3),3.61(t,2h,j=5.66hz,-nhch2-),3.50(m,2h,-nhch2-),3.06(m,2h,ar-ch2-),2.81(m,2h,ar-ch2-),1.90(m,6h,-(ch2)2-,-ch2ch2ch2-),1.09(m,1h,-chco-),1.17(m,2h,-(ch2)ch-),0.83(m,2h,-(ch2)ch-);13cnmr(75mhz,cdcl3,δppm):172.6,163.3,161.4,161.0,156.2,156.1,152.6,149.7,148.5,142.8,141.8,129.8,121.3,120.5,117.6,115.6,110.0,109.9,101.1,58.4,55.6,44.9,36.8,33.4,31.5,25.3,23.1,22.8,15.7,8.4;hrms(m/z):calcdforc30h31cln6o3s[m+h]+,587.2435;found,587.2435.实施例8:4-(环丙基甲氧基)-n-甲基-2-(2-(2-((2-((1,2,3,4--1,2,3,4-四氢吖啶)氨基)乙基)氨基)乙酰氨基)吡啶-4-基)噻唑-5-甲酰胺(2h)参照实施例1的合成方法,以环丙甲醇替代实施例1中的甲醇,得黄色固体化合物,产率为43%。1hnmr(300mhz,cdcl3,δppm):11.05(s,1h,-conh-),8.76(m,1h,-conh-),8.61(s,1h,ar-h),8.52(d,1h,j=5.88hz,ar-h),8.45(d,j=8.91hz,1h,ar-h),7.79(d,1h,j=6.12hz,ar-h),7.72(s,1h,j=6.13hz,ar-h),7.53(m,1h,ar-h),7.50(m,1h,ar-h),4.32(d,2h,-och2-),3.94(m,2h,-nhch2-),3.18(m,2h,-nhch2-),2.92(m,2h,ar-ch2-),2.64(m,2h,ar-ch2-),2.03(m,2h,-ch2ch2ch2-),2.02(m,1h,-chco-),1.80(m,4h,-(ch2)2-),1.29(m,1h,-ch2ch(ch2)2),0.86(m,2h,-(ch2)ch-),0.85(m,2h,-(ch2)ch-),0.52(m,2h,-(ch2)ch-),0.39(m,2h,-(ch2)ch-);13cnmr(75mhz,dmso-d6,δppm):171.65,160.64,160.55,156.92,152.75,151.80,149.94,145.63,141.24,129.16,126.96,123.93,123.84,119.77,115.90,115.32,110.90,108.72,76.13,52.83,49.43,48.25,32.89,30.87,29.09,26.74,25.28,22.95,22.49,10.79,3.77;hrms(m/z):calcdforc33h36n6o3s[m+h]+,597.2648;found,587.640.实施例9:2-(2-(环丙烷甲酰氨基)吡啶)-4-(2-((1,2,3,4-四氢吖啶)氨基)乙氧基)噻唑-5-羧酸乙酯(2i)将化合物9(666mg,2mmol)和5(727mg,3mmol)溶于55mlthf中,加入三苯基磷(1.57g,6mmol),冰浴条件下氩气保护下缓慢滴加diad(1.2ml,6mmol),加毕撤去冰浴后室温反应24小时。将反应液旋干,dcm溶解通过柱层析分离得到产物(dcm/meoh=30/1,v/v)。产物为淡黄色固体,产率为52%。1hnmr(300mhz,dmso-d6,δppm):11.04(s,1h,-conh-),8.51(m,1h,-nhch2-),8.42(m,2h,ar-h),7.41-7.77(m,3h,ar-h),7.41-7.49(m,2h,ar-h),4.16(m,2h,-och2ch3),4.18(t,j=9.1hz,2h,-ch2nh-),3.29(m,2h,-ch2nh-),2.99(m,2h,ar-ch2-),2.60(m,2h,ar-ch2-),2.07(m,1h,-chco-),1.76(m,4h,-(ch2)2-),1.19(t,j=6.1hz,3h,-och2ch3),0.84(d,j=6.1hz,4h,-(ch2)ch-);13cnmr(75mhz,dmso-d6,δppm):175.7,173.6,164.90,164.6,160.1,155.8,153.6,149.8,140.4,135.1,133.2,133.1,132.0,130.4,130.2,125.4,125.3,124.7,124.1,123.8,123.3,115.5,109.4,102.8,70.5,61.2,55.4,47.4,40.5,40.5,40.4,40.3,40.2,40.1,40.0,39.9,39.7,39.5,25.0,22.5,22.1,21.1,14.8,14.6,8.4;hrms(m/z):calcdforc30h32n5o4s[m+h]+,558.2175;found,558.2181;实施例10:2-(2-(环丙烷甲酰氨基)吡啶)-4-(2-((1,2,3,4-四氢吖啶)氨基)乙氧基)噻唑-5-羧酸(2j)将2i(55.7mg,0.1mmol)溶于3mlthf/meoh混合溶液中(thf/meoh=2/1,v/v),冰浴下滴加lioh溶液(400μl,1.5mmol/ml),撤去冰浴后室温反应7小时。tlc检测反应完成,低温旋蒸除去反应液中的thf,加2倍量水,调酸析出固体抽滤得到淡黄色结晶产物(60.1mg),产率为87%。1hnmr(300mhz,dmso-d6,δppm):10.94(s,1h,-conh-),8.45(m,1h,-nhch2-),8.39(m,1h,ar-h),7.89(m,1h,ar-h),7.78(m,1h,ar-h),7.69(t,j=8.2hz,1h,ar-h),7.57(m,1h,ar-h),7.38(t,j=8.2hz,2h,ar-h),4.83(t,j=8.2hz,2h,-nhch2-),4.29(m,2h,-nhch2-),2.95(t,j=8.2hz,2h,ar-ch2-),2.66(t,j=8.2hz,2h,ar-ch2-),2.07(m,1h,-chco-),1.76(m,4h,-(ch2)2-),0.85(t,j=8.2hz,4h,-(ch2)ch-);13cnmr(75mhz,dmso-d6,δppm):173.6,164.2,163.9,161.8,157.0,153.5,151.7,149.7,140.5,137.9,133.6,132.8,132.5,132.0,131.9,129.3,129.2,125.6,125.0,119.5,116.5,115.5,112.5,109.3,104.7,70.1,55.4,47.3,40.5,40.4,40.3,40.3,40.2,40.0,39.8,39.7,39.5,28.4,24.9,21.9,20.6,14.8,8.4;hrms(m/z):calcdforc28h28n5o4s[m+h]+,530.1862;found,530.1874;实施例11:2-(2-(环丙烷甲酰氨基)吡啶)-4-(2-((1,2,3,4-四氢吖啶)氨基)乙氧基)噻唑-5-甲酰胺(2k)将2j(55.7mg,0.1mmol)溶于8mldmf中,加入dipea(49.5μl,0.3mmol)和hatu(53.2mg,0.14mmol),氩气保护下室温活化3小时之后加入nh4cl(31.8mg,0.6mmol),氩气保护下室温反应18小时。tlc检测反应完成,将反应液旋干,制沙,通过柱层析分离得到黄色固体产物(dcm/meoh=10/1,v/v),产率为38%。1hnmr(300mhz,dmso-d6,δppm):11.00(s,1h,-conh-),8.44(m,1h,-nhch2-),8.31-8.42(m,3h,ar-h),7.81(d,j=6.1hz,1h,ar-h),7.68(m,2h,-conh2),7.30-7.40(m,2h,ar-h),6.97(s,1h,ar-h),4.81(t,j=8.2hz,2h,-nhch2-),4.28(d,j=6.1hz,2h,-nhch2-),2.91(t,j=8.2hz,2h,ar-ch2-),2.65(d,j=8.2hz,2h,ar-ch2-),2.03(m,1h,-chco-),1.73(d,j=8.2hz,4h,-(ch2)2-),0.84(d,j=8.2hz,4h,-(ch2)ch-);13cnmr(75mhz,dmso-d6,δppm):173.5,163.0,161.3,160.1,155.7,152.8,149.8,149.6,140.7,140.0,135.0,132.1,128.5,125.4,124.6,121.0,120.3,117.3,115.4,113.2,111.0,109.1,79.8,79.5,79.2,70.4,55.4,49.1,47.0,40.5,40.5,40.4,40.3,40.2,40.0,39.9,39.7,39.5,29.2,25.2,22.1,20.9,14.8,8.4;hrms(m/z):calcdforc28h29n6o3s[m+h]+,529.2022;found,529.2025;实施例12:2-(2-(环丙烷甲酰氨基)吡啶)-4-(2-((1,2,3,4-四氢吖啶)氨基)乙氧基)噻唑-5-羧酸甲酯(2l)将2i(55.7mg,0.1mmol)溶于1.5mldmf中,加入k2co3(13.8mg,1eq),冰浴10分钟后加入碘甲烷(14μl,2eq),冰浴30分钟后常温反应3小时。tlc检测反应,在通风橱中加水淬灭,用乙酸乙酯萃取三次,用无水硫酸钠干燥,旋干后用dcm溶解,柱层析分离得到黄色粉末状产物(dcm/meoh=20/1,v/v),产率为43%。1hnmr(300mhz,dmso-d6,δppm):11.02(s,1h,-conh-),8.57(s,1h,ar-h),8.43(d,j=6.1hz,1h,ar-h),8.14(d,j=8.2hz,1h,ar-h),7.67(t,j=8.2hz,1h,ar-h),7.51(m,1h,ar-h),7.27(t,j=8.2hz,1h,ar-h),5.73(m,1h,-nhch2-),4.70(t,j=6.1hz,2h,-nhch2-),3.88(q,j=6.1hz,2h,-nhch2-),3.67(s,3h,-cooch3),2.85(t,j=6.3hz,2h,ar-ch2-),2.70(t,j=8.1hz,2h,ar-ch2-),2.04(t,j=8.2hz,1h,-chco-),1.74(q,j=7.4hz,4h,-(ch2)2-),0.84(d,j=8.2hz,4h,-(ch2)ch-);hrms(m/z):calcdforc29h30n5o4s[m+h]+,544.2019;found,544.2029;实施例13:2-(2-氨基吡啶-4-基)-4-(环丙基甲氧基)噻唑-5-羧酸(11b)将10b(368mg,1mmol)溶于thf/meoh混合溶剂中,冰浴下逐滴滴加10nnaoh水溶液(2ml,20eq),滴加完毕后,65℃回流10~24小时。反应结束后,加入与反应液体积相同的水,低温减压旋蒸除去thf/meoh,此过程有淡黄色不溶物析出,超声,抽滤除去不溶物,滤液在冰浴条件下用3nhcl调节ph至2~3,大量沉淀析出。静置1小时后,抽滤得淡黄色粉末状固体,产率87%。1hnmr(300mhz,dmso-d6,δppm):11.04(s,1h,-cooh),8.76(s,1h,-conh-),8.13(s,1h,ar-h),7.60(d,j=6.1hz,1h,ar-h),7.51(d,j=6.1hz,1h,ar-h),7.21(s,2h,ar-nh2),4.33(d,j=6.2hz,2h,-och2-),1.39(m,1h,-ch2ch-),0.59(m,2h,-ch2ch2ch-),0.42(m,2h,-ch2ch2ch-);hrms(m/z):calcdforc13h13n3o3s[m+h]+,292.0756;found,292.0760;2-(2-氨基吡啶-4-基)-4-(环丙基甲氧基)-n-甲基噻唑-5-甲酰胺(13b)将11b(291mg,1mmol)溶于5mldmf中,先后加入n,n-二异丙基乙胺和六氟磷酸苯并三唑-1-基-氧基三吡咯烷基磷,反应30分钟。将甲胺盐酸盐(101mg,1.5mmol)加入反应液中,室温反应10~24小时。反应结束后,将反应液旋干,加入5ml水,抽滤,得黄色固体粉末,产率92%。1hnmr(300mhz,dmso-d6,δppm):8.77(s,1h,-conh-),8.03(s,1h,ar-h),7.61(d,j=6.1hz,1h,ar-h),7.53(d,j=8.2hz,1h,ar-h),7.11(q,j=6.2hz,1h,ar-h),4.37(d,j=6.2hz,2h,-och2-),2.84(d,3h,-nhch3),1.39(m,1h,-ch2ch-),0.59(m,2h,-ch2ch2ch-),0.42(m,2h,-ch2ch2ch-);hrms(m/z):calcdforc31h35n7o3s[m+h]+,305.1072;found,305.1062;2-(2-(2-氯乙酰氨基)吡啶-4-基)-4-(环丙基甲氧基)-n-甲基噻唑-5-甲酰胺(14b)将13b(304mg,1mmol)溶于干燥的dcm中(20ml),向其中加入少量的三乙胺,再加入nah(120mg,5eq)和催化量的dmap,冰浴搅拌10分钟。将氯乙酰氯(398μl,5eq)溶于5mldcm中,用分液漏斗逐滴加入反应液中,50℃回流反应16小时。tlc监测反应完成,在冰浴条件下,向反应液中逐滴滴加甲醇,旋干,加10ml冰甲醇重结晶,抽滤,得棕色固体粉末,产率80%。1hnmr(300mhz,dmso-d6,δppm):8.97(s,1h,-conh-),8.72(s,1h,ar-h),8.40(d,j=6.1hz,1h,ar-h),7.57(d,j=8.2hz,1h,ar-h),7.18(q,j=6.2hz,1h,ar-h),4.43(d,j=6.2hz,2h,-och2-),4.25(s,2h,-coch2-),3.03(d,3h,-nhch3),1.38(m,1h,-ch2ch-),0.70(m,2h,-ch2ch2ch-),0.46(m,2h,-ch2ch2ch-);hrms(m/z):calcdforc16h17cln4o3s[m+h]+,381.0788;found,381.1;4-(环丙基甲氧基)-n-甲基-2-(2-(2-((2-((1,2,3,4-四氢吖啶)氨基)乙基)氨基)乙酰氨基)吡啶-4-基)噻唑-5-甲酰胺(2m)将14b(381mg,1mmol)溶于10mlmecn中,加入k2co3(276mg,2mmol),冰浴10分钟后加入12a(241μl,1mmol),82℃回流4~10小时。反应结束后,抽滤除去不溶物,将反应液旋干,柱层析分离得到黄色粉末状产物(dcm/meoh=10/1,v/v),产率为20%。1hnmr(300mhz,dmso-d6,δppm):10.45(s,1h,-conh-),8.65(s,1h,ar-h),8.40(d,j=6.1hz,1h,ar-h),8.26(d,j=8.2hz,1h,ar-h),7.75(t,j=8.2hz,1h,ar-h),7.58(m,2h,ar-h),7.40(t,j=8.2hz,1h,ar-h),7.37(m,1h,-conh-),4.36(d,j=8.2hz,2h,-och2-),3.69(d,j=8.3hz,2h,-coch2-),3.45(m,2h,-nhch2-),2.88(m,2h,-nhch2-),2.89(t,j=7.8hz,2h,ar-ch2-),2.84(t,j=6.3hz,3h,-nhch3),2.72(t,j=7.9hz,2h,ar-ch2-),1.79(m,4h,-ch2ch2-),1.39(m,1h,-ch2ch-),0.57(m,2h,-ch2ch2ch-),0.43(m,2h,-ch2ch2ch-);13cnmr(75mhz,dmso-d6,δppm):171.88,162.64,160.66,160.59,152.92,149.54,141.18,131.11,125.11,124.88,124.68,121.18,115.85,113.51,110.92,108.86,76.15,52.49,49.17,47.74,30.73,30.60,26.77,24.86,24.54,22.42,21.62,10.82,3.80;hrms(m/z):calcdforc31h35n7o3s[m+h]+,586.2600;found,586.2587;实施例14:2-(2-(2-((2-((6-氯-1,2,3,4-四氢吖啶)氨基)乙基)氨基)乙酰氨基)吡啶-4-基)-4-(环丙基甲氧基)-n-甲基噻唑-5-甲酰胺(2n)参照实施例13的合成方法,以12f替代实施例13中的12a,得黄色固体化合物,产率为21%。1hnmr(300mhz,dmso-d6,δppm):10.43(s,1h,-conh-),8.64(s,1h,ar-h),8.43(d,j=6.1hz,1h,ar-h),8.17(d,j=8.2hz,1h,ar-h),7.70(s,1h,ar-h),7.61(m,1h,-conh-),7.60(m,1h,ar-h),7.30(t,j=8.2hz,1h,ar-h),4.39(d,j=8.4hz,2h,-och2-),3.54(d,j=8.2hz,2h,-coch2-),3.42(m,2h,-nhch2-),2.85(t,j=7.8hz,2h,ar-ch2-),2.81(t,j=6.3hz,3h,-nhch3),2.73(t,j=7.9hz,2h,ar-ch2-),2.51(m,2h,-nhch2-),1.80(m,4h,-(ch2)2-),1.39(m,1h,-ch2ch-),0.58(m,2h,-ch2ch2ch-),0.44(m,2h,-ch2ch2ch-);13cnmr(75mhz,dmso-d6,δppm):172.00,162.63,160.52,159.57,152.93,151.06,149.85,147.99,127.03,126.03,123.80,118.83,116.25,115.83,108.83,106.26,76.10,52.62,49.66,48.16,33.93,30.45,26.75,25.13,23.00,22.68,19.11,10.79,3.78;hrms(m/z):calcdforc31h34cln7o3s[m+h]+,620.2211;found,620.2190;实施例15:4-(环丙基甲氧基)-2-(2-(2-((2-((7-甲氧基-1,2,3,4-四氢吖啶)氨基)乙基)氨基)乙酰氨基)吡啶-4-基)-n-甲基噻唑-5-甲酰胺(2o)参照实施例13的合成方法,以12h替代实施例13中的12a,得棕色固体化合物,产率为19%。1hnmr(300mhz,dmso-d6,δppm):10.48(s,1h,-conh-),8.63(s,1h,ar-h),8.43(d,j=8.2hz,1h,ar-h),7.67(d,j=8.2hz,1h,ar-h),7.58(d,j=8.2hz,2h,ar-h),7.49(s,1h,ar-h),7.23(m,j=8.2hz,1h,-conh-),,4.39(d,j=8.4hz,2h,-och2-),3.54(d,j=8.2hz,2h,-coch2-),3.42(m,2h,-nhch2-),2.85(t,j=7.8hz,2h,ar-ch2-),2.81(t,j=6.3hz,3h,-nhch3),2.73(t,j=7.9hz,2h,ar-ch2-),2.51(m,2h,-nhch2-),1.80(m,4h,-(ch2)2-),1.39(m,1h,-ch2ch-),0.58(m,2h,-ch2ch2ch-),0.44(m,2h,-ch2ch2ch-);13cnmr(75mhz,dmso-d6,δppm):171.52,162.14,160.07,155.50,154.59,152.46,150.30,149.40,141.21,140.67,128.47,120.52,116.34,115.34,108.36,101.79,75.62,55.36,52.19,49.23,47.27,32.39,27.14,26.25,24.86,22.57,22.16,20.92,10.29,3.28;hrms(m/z):calcdforc32h37n7o4s[m+h]+,616.2706;found,616.2691;实施例16:4-(环丙基甲氧基)-n-乙基-2-(2-(2-((2-((1,2,3,4-四氢吖啶)氨基)乙基)氨基)乙酰氨基)吡啶-4-基)噻唑-5-甲酰胺(2p)参照实施例13的合成方法,以14g替代实施例13中的14b,得棕色固体化合物,产率为20%。1hnmr(300mhz,dmso-d6,δppm):10.48(s,1h,-conh-),8.63(s,1h,ar-h),8.43(d,j=8.2hz,1h,ar-h),8.27(d,j=8.2hz,1h,ar-h),7.77(d,j=8.2hz,1h,ar-h),7.66(s,1h,ar-h),7.61(s,1h,ar-h),7.43(m,j=8.2hz,1h,-conh-),7.40(m,1h,ar-h),4.40(d,j=8.4hz,2h,-och2-),3.71(d,j=8.2hz,2h,-coch2-),3.45(m,2h,-nhch2-),3.35(m,2h,-nhch2-),2.90(t,j=7.8hz,2h,ar-ch2-),2.89(m,2h,-conhch2-),2.74(t,j=7.9hz,2h,ar-ch2-),1.81(m,4h,-(ch2)2-),1.39(m,1h,-ch2ch-),1.14(t,j=6.3hz,3h,-ch2ch3),0.58(m,2h,-ch2ch2ch-),0.44(m,2h,-ch2ch2ch-);13cnmr(75mhz,dmso-d6,δppm):171.97,162.74,160.68,159.90,152.95,149.93,141.20,130.42,124.70,124.59,124.45,115.90,114.29,111.10,108.88,76.18,52.56,49.34,47.92,34.46,31.63,30.32,29.47,24.73,22.63,21.96,15.37,10.79,3.72;hrms(m/z):calcdforc32h37n7o3s[m+h]+,600.2757;found,600.2749;实施例17:4-(环丙基甲氧基)-n-丙基-2-(2-(2-((2-((-1,2,3,4-四氢吖啶)氨基)乙基)氨基)乙酰氨基)吡啶-4-基)噻唑-5-甲酰胺(2q)参照实施例13的合成方法,以14h替代实施例13中的14b,得棕色固体化合物,产率为18%。1hnmr(300mhz,dmso-d6,δppm):10.46(s,1h,-conh-),8.61(s,1h,ar-h),8.42(d,j=8.2hz,1h,ar-h),8.28(d,j=8.2hz,1h,ar-h),7.75(d,j=8.2hz,1h,ar-h),7.66(s,1h,ar-h),7.60(s,1h,ar-h),7.58(m,j=8.2hz,1h,-conh-),7.43(m,1h,ar-h),4.39(d,j=8.4hz,2h,-och2-),3.73(d,j=8.2hz,2h,-coch2-),3.46(m,2h,-nhch2-),3.28(m,2h,-nhch2-),2.90(t,j=7.8hz,2h,ar-ch2-),2.89(m,2h,-conhch2-),2.73(t,j=7.9hz,2h,ar-ch2-),1.81(m,4h,-(ch2)2-),1.55(m,2h,-ch2ch2-),1.39(m,1h,-ch2ch-),0.92(t,j=6.3hz,3h,-ch2ch3),0.58(m,2h,-ch2ch2ch-),0.44(m,2h,-ch2ch2ch-);13cnmr(75mhz,dmso-d6,δppm):171.98,162.75,160.68,160.00,154.80,153.35,152.92,149.91,143.32,141.15,130.51,124.61,124.46,121.89,118.42,115.88,114.15,110.92,108.84,76.20,52.51,49.29,47.87,31.38,29.47,24.68,22.89,22.58,21.90,11.69,10.75,3.66;hrms(m/z):calcdforc33h39n7o3s[m+h]+,614.2913;found,614.2910;实施例18:4-(环丙基甲氧基)-n-甲基-2-(2-(2-((4-((1,2,3,4-四氢吖啶)氨基)丁基)氨基)乙酰氨基)吡啶-4-基)噻唑-5-甲酰胺(2r)参照实施例13的合成方法,以12c替代实施例13中的12a,得黄色固体化合物,产率为19%。1hnmr(300mhz,dmso-d6,δppm):8.63(s,1h,ar-h),8.41(d,j=8.2hz,1h,ar-h),8.17(d,j=8.2hz,1h,ar-h),7.72(d,j=8.2hz,1h,ar-h),7.58(s,1h,ar-h),7.55(s,1h,ar-h),7.37(m,1h,ar-h),4.38(d,j=8.4hz,2h,-och2-),3.60(d,j=8.2hz,2h,-coch2-),3.37(m,2h,-nhch2-),2.90(t,j=7.8hz,2h,ar-ch2-),2.84(t,j=6.3hz,3h,-nhch3),2.69(t,j=7.9hz,2h,ar-ch2-),2.57(m,2h,-nhch2-),1.79(m,4h,-(ch2)2-),1.65(m,2h,-ch2ch2-),1.50(m,2h,-ch2ch2-),1.39(m,1h,-ch2ch-),0.58(m,2h,-ch2ch2ch-),0.44(m,2h,-ch2ch2ch-);13cnmr(75mhz,dmso-d6,δppm):172.80,171.69,162.62,160.68,160.60,156.69,152.00,150.06,149.97,145.31,141.23,129.47,129.39,124.08,123.97,119.60,115.19,108.74,76.14,52.73,49.08,48.16,32.69,29.47,28.62,26.77,25.26,22.91,22.40,10.80,3.80;hrms(m/z):calcdforc33h39n7o3s[m+h]+,614.2910;found,614.2911;实施例19:4-(环丙基甲氧基)-n-甲基-2-(2-(2-((6-((1,2,3,4-四氢吖啶)氨基)己基)氨基)乙酰氨基)吡啶-4-基)噻唑-5-甲酰胺(2s)参照实施例13的合成方法,以12d替代实施例13中的12a,得黄色固体化合物,产率为19%。1hnmr(300mhz,dmso-d6,δppm):8.62(s,1h,ar-h),8.41(d,j=8.2hz,1h,ar-h),8.15(d,j=8.2hz,1h,ar-h),7.75(d,j=8.2hz,1h,ar-h),7.58(s,1h,ar-h),7.54(s,1h,ar-h),7.36(m,1h,ar-h),4.37(d,j=8.4hz,2h,-och2-),3.60(d,j=8.2hz,2h,-coch2-),3.38(d,j=8.2hz,2h,-coch2-),2.90(t,j=7.8hz,2h,ar-ch2-),2.84(t,j=6.3hz,3h,-nhch3),2.67(t,j=7.9hz,2h,ar-ch2-),2.55(m,2h,-nhch2-),1.78(m,4h,-(ch2)2-),1.58(m,2h,-ch2ch2ch2-),1.41(m,2h,-ch2ch2ch2-),1.39(m,1h,-ch2ch-),1.29(m,2h,-ch2ch2ch2-),1.22(m,2h,-ch2ch2ch2-),0.58(m,2h,-ch2ch2ch-),0.43(m,2h,-ch2ch2ch-);13cnmr(75mhz,dmso-d6,δppm):171.48,162.58,160.66,160.57,156.78,156.67,152.00,149.98,145.29,141.22,129.35,127.14,126.62,124.03,123.95,119.61,115.93,115.14,108.70,76.13,52.68,49.26,48.17,32.68,30.87,29.55,29.45,26.77,26.59,25.30,22.91,22.41,10.80,3.80;hrms(m/z):calcdforc35h44n7o3s[m+h]+,642.3226;found,642.3221;实施例20:4-(环丙基甲氧基)-n-甲基-2-(2-(2-((8-((1,2,3,4-四氢吖啶)氨基)辛基)氨基)乙酰氨基)吡啶-4-基)噻唑-5-甲酰胺(2t)参照实施例13的合成方法,以12e替代实施例13中的12a,得黄色固体化合物,产率为25%。1hnmr(300mhz,dmso-d6,δppm):8.64(s,1h,ar-h),8.42(d,j=8.2hz,1h,ar-h),8.14(d,j=8.2hz,1h,ar-h),7.72(d,j=8.2hz,1h,ar-h),7.57(s,1h,ar-h),7.54(s,1h,ar-h),7.36(m,1h,ar-h),4.37(d,j=8.4hz,2h,-och2-),3.60(d,j=8.2hz,2h,-coch2-),3.38(d,j=8.2hz,2h,-nhch2-),2.90(t,j=7.8hz,2h,ar-ch2-),2.85(t,j=6.3hz,3h,-nhch3),2.67(t,j=7.9hz,2h,ar-ch2-),2.55(m,2h,-nhch2-),1.79(m,4h,-(ch2)2-),1.55(m,4h,-ch2ch2ch2-),1.39(m,1h,-ch2ch-),1.33(m,4h,-ch2ch2ch2-),1.22(m,4h,-ch2ch2ch2-),0.58(m,2h,-ch2ch2ch-),0.43(m,2h,-ch2ch2ch-);13cnmr(75mhz,dmso-d6,δppm):171.63,162.56,162.55,160.54,156.83,152.74,151.79,149.92,147.80,147.28,141.23,129.15,126.94,123.91,123.83,115.89,115.87,115.30,108.69,76.12,52.80,49.41,49.36,48.23,32.88,30.85,30.82,29.20,29.08,26.91,26.73,26.61,25.27,22.93,22.48,10.78,3.77;hrms(m/z):calcdforc35h44n7o3s[m+h]+,670.3539;found,670.3536;实施例21:4-(环丙基甲氧基)-n-甲基-2-(2-(2-((8-((1,2,3,4-四氢吖啶)氨基)辛基)氨基)乙酰氨基)吡啶-4-基)噻唑-5-甲酰胺(2u)参照实施例13的合成方法,以14a替代实施例13中的14b,得黄色固体化合物,产率为17%。1hnmr(300mhz,dmso-d6,δppm):10.49(s,1h,-conh-),8.63(s,1h,ar-h),8.44(d,j=8.2hz,1h,ar-h),8.29(d,j=8.2hz,1h,ar-h),7.82(d,j=8.2hz,1h,ar-h),7.67(s,1h,ar-h),7.62(s,1h,ar-h),7.42(m,1h,ar-h),4.16(s,3h,-och3),3.73(d,j=8.2hz,2h,-coch2-),3.48(d,j=8.2hz,2h,-nhch2-),3.17(d,j=8.2hz,2h,-nhch2-),2.92(t,j=7.8hz,2h,ar-ch2-),2.81(t,j=6.3hz,3h,-nhch3),2.74(t,j=7.9hz,2h,ar-ch2-),1.81(m,4h,ar-ch2(ch2)2-);13cnmr(75mhz,dmso-d6,δppm):171.90,162.63,161.04,160.44,157.92,149.95,141.19,130.66,129.90,124.81,124.66,124.62,117.08,115.89,114.86,111.18,110.60,108.85,58.67,49.21,47.75,31.64,30.31,26.78,22.57,14.44;hrms(m/z):calcdforc28h32n7o3s[m+h]+,546.2287;found,546.2280;实施例22:4-(环丁基甲氧基)-n-甲基-2-(2-(2-((2-((1,2,3,4-四氢吖啶)氨基)乙基)氨基)乙酰氨基)吡啶-4-基)噻唑-5-甲酰胺(2v)参照实施例13的合成方法,以14c替代实施例13中的14b,得黄色固体化合物,产率为24%。1hnmr(300mhz,dmso-d6,δppm):10.46(s,1h,-conh-),8.62(s,1h,ar-h),8.44(d,j=8.2hz,1h,ar-h),8.28(d,j=8.2hz,1h,ar-h),7.76(d,j=8.2hz,1h,ar-h),7.63(s,1h,ar-h),7.63(m,1h,-conhch3),7.43(m,2h,ar-h),4.53(d,j=8.4hz,2h,-och2-),3.73(d,j=8.2hz,2h,-coch2-),3.45(d,j=8.2hz,2h,-nhch2-),3.27(m,1h,-ch2nhch2-),2.92(t,j=7.8hz,2h,ar-ch2-),2.91(d,j=7.8hz,2h,-nhch2-),2.84(t,j=6.3hz,3h,-nhch3),2.74(t,j=7.9hz,2h,ar-ch2-),2.70(m,1h,-ch2ch-),2.08(m,2h,-chch2ch2-),1.88(m,4h,-ch(ch2)2-),1.81(m,4h,-(ch2)2-);13cnmr(75mhz,dmso-d6,δppm):171.96,162.68,160.76,160.55,157.67,152.96,149.95,141.18,130.99,130.54,124.64,124.60,118.59,115.91,114.46,110.86,108.85,75.32,52.50,51.94,49.20,48.24,41.37,24.51,29.49,26.78,24.78,22.61,21.96,18.53;hrms(m/z):calcdforc32h38n7o3s[m+h]+,600.2757;found,600.2760;实施例23:n-甲基-4-(新戊氧基)-2-(2-(2-((2-((1,2,3,4-四氢吖啶)氨基)乙基)氨基)乙酰氨基)吡啶-4-基)噻唑-5-甲酰胺(2w)参照实施例13的合成方法,以14d替代实施例13中的14b,得黄色固体化合物,产率为22%。1hnmr(300mhz,dmso-d6,δppm):8.60(s,1h,ar-h),8.44(d,j=8.2hz,1h,ar-h),8.33(d,j=8.2hz,1h,ar-h),7.83(d,j=8.2hz,1h,ar-h),7.71(s,1h,ar-h),7.47(m,1h,-conhch3),7.30(m,2h,ar-h),4.28(d,j=8.4hz,2h,-och2-),3.71(d,j=8.2hz,2h,-coch2-),3.48(d,j=8.2hz,2h,-nhch2-),2.94(t,j=7.8hz,2h,ar-ch2-),2.91(t,j=7.8hz,2h,-nhch2-),2.87(t,j=6.3hz,3h,-nhch3),2.69(t,j=7.9hz,2h,ar-ch2-),1.88(m,4h,-ch(ch2)2-),1.04(m,9h,-c(ch3)3);13cnmr(75mhz,dmso-d6,δppm):171.16,162.67,161.10,160.68,160.63,157.72,152.94,149.96,141.14,131.62,131.41,125.17,124.92,124.74,118.93,115.95,109.28,108.85,80.97,51.96,48.14,41.26,32.38,30.31,29.48,26.80,24.72,22.39,21.57;hrms(m/z):calcdforc32h40n7o3s[m+h]+,602.2913;found,602.2883;实施例24:4-异丙氧基-n-甲基-2-(2-(2-((2-((1,2,3,4-四氢吖-9-基)氨基)乙基)氨基)乙酰氨基)吡啶-4-基)噻唑-5-甲酰胺(2x)参照实施例13的合成方法,以14e替代实施例13中的14b,得黄色固体化合物,产率为21%。1hnmr(300mhz,dmso-d6,δppm):10.50(s,1h,-conh-),8.64(s,1h,ar-h),8.44(d,j=8.2hz,1h,ar-h),8.24(d,j=8.2hz,1h,ar-h),7.78(d,j=8.2hz,1h,ar-h),7.61(s,1h,ar-h),7.59(m,1h,-conhch3),7.42(m,2h,ar-h),5.30(m,1h,-och(ch3)2),3.67(d,j=8.2hz,2h,-coch2-),3.47(d,j=8.2hz,2h,-nhch2-),2.92(t,j=7.8hz,2h,ar-ch2-),2.87(t,j=7.8hz,2h,-nhch2-),2.75(t,j=6.3hz,3h,-nhch3),2.53(t,j=7.9hz,2h,ar-ch2-),1.81(m,4h,-ch(ch2)2-),1.43(m,6h,-ch(ch3)2);13cnmr(75mhz,dmso-d6,δppm):171.96,162.77,160.62,160.05,152.95,149.89,141.21,130.09,129.73,125.17,124.45,124.31,124.12,118.78,115.86,114.45,111.24,109.04,108.88,75.52,52.55,49.39,47.90,31.79,26.82,24.81,22.70,22.38,22,07;hrms(m/z):calcdforc30h36n7o3s[m+h]+,574.2600;found,574.2593;实施例25:4-异丁氧基-n-甲基-2-(2-(2-((2-((1,2,3,4-四氢吖啶)氨基)乙基)氨基)乙酰氨基)吡啶-4-基)噻唑-5-甲酰胺(2y)参照实施例13的合成方法,以14f替代实施例13中的14b,得黄色固体化合物,产率为17%。1hnmr(300mhz,dmso-d6,δppm):10.48(s,1h,-conh-),8.63(s,1h,ar-h),8.45(d,j=8.2hz,1h,ar-h),8.25(d,j=8.2hz,1h,ar-h),7.78(d,j=8.2hz,1h,ar-h),7.61(s,1h,ar-h),7.46(m,1h,-conhch3),7.41(m,2h,ar-h),4.33(d,1h,j=8.4hz,2h,-och2-),3.68(d,j=8.2hz,2h,-coch2-),3.45(d,j=8.2hz,2h,-nhch2-),2.92(t,j=7.8hz,2h,ar-ch2-),2.91(t,j=7.8hz,2h,-nhch2-),2.86(t,j=6.3hz,3h,-nhch3),2.74(t,j=7.9hz,2h,ar-ch2-),2.19(m,1h,-ch2ch(ch3)2),1.81(m,4h,-ch(ch2)2-),1.00(m,6h,-ch(ch3)2);13cnmr(75mhz,dmso-d6,δppm):171.97,162.68,160.76,160.57,152.96,149.95,141.18,130.39,130.13,125.47,124.61,124.59,124.44,124.40,118.94,115.90,114.56,111.15,110.64,108.85,77.61,52.54,49.33,47.89,31.63,30.31,29.51,28.18,26.81,24.76,19.40;hrms(m/z):calcdforc31h38n7o3s[m+h]+,588.2757;found,588.2745;实施例26:酶抑制活性的测定实验测定仪器:thermovarioskanflash全波长多功能酶标仪。以实施例1方法所得的化合物以以下方法测酶抑制活性:药品与试剂:实施例1-25制得的化合物、ache(e.c.3.1.1.7,typevi-s,选自电鳗)、buche(e.c.3.1.1.8,选自马血清)、gsk-3β选自人源,5,5’-二硫双(2-硝基苯甲酸)(5,5’-dithiobis(2-nitrobenzoicacid),dtnb)、乙酰硫代胆碱(atc)碘化物以及丁酰硫代胆碱(btc)碘化物均购于sigma(steinheim,germany)公司;他克林盐酸盐(9-amino-1,2,3,4-tetrahydroacridinehydrochloridehydrate)购自biotrend(wangen,switerland)公司。实验操作(1)配制缓冲溶液。13.6g磷酸二氢钾溶于1l水中,以氢氧化钾调节ph=8±0.1。溶液保存于4℃温度下以备用。(2)配制0.01mdtnb溶液。将0.396gdtnb及0.15g碳酸氢钠溶于100ml水中制得0.01mdtnb溶液,将之保存于-30℃温度下以备用。(3)配制0.075matc/btc溶液。将0.217gatc/0.237gbtc溶于10ml水中制得0.075matc/btc溶液,将之保存于-30℃温度下以备用。(4)配制ache/buche溶液。将500单位的ache/buche溶于1ml1%的凝胶溶液中,然后用水稀释至100ml制得浓度为5单位/ml的ache/buche溶液,将之保存于-30℃温度下以备用。(5)配制受试物溶液。将受试物溶于乙醇中以制得浓度为10-3m的溶液(乙醇不影响测试结果),然后用水稀释分别制得浓度为10-4、10-5、10-6、10-7、10-8、10-9、10-10m的溶液。实验开始前,将所用溶液均加温至室温,并将ache/buche溶液用水稀释一倍制成浓度为2.5单位/ml的酶溶液。用空白缓冲液(3ml)测得背景紫外吸收。受试物的测量操作为先将100μl受试物溶液、100μldtnb溶液、100μl酶溶液加至3ml缓冲溶液中,待加入20μlatc或btc溶液触发反应后立即计时并同时快速混匀测试溶液,2min后于412nm波长下测量紫外吸收度。对照组可用等容积的水代替受试物溶液测得。所有测试均平行操作三次。以对照组的紫外吸收值作为100%,计算受试化合物在各个浓度下的抑制率,所得结果用graphpadprismtm(graphpadsoftware,sandiego,ca,usa)软件以非线性衰退分析模式(non-linearregressionanalysismodel)计算得相应的ic50值,如下表1所示:表1各化合物对电鳗ache、马源buche、人源gsk-3β的抑制活性注:(a)表格中化合物1和2分别代表上文所提到的tacrine(1)和gsk-3β(2)抑制剂实施例27对sh-sy5y细胞株的细胞毒活性测试(1)细胞株及试剂人神经母细胞瘤细胞sh-sy5y购自中国科学院上海生命科学研究院细胞库;高糖dmem培养液购自美国gibco公司;胎牛血清购自美国gibco公司;胰酶细胞消化液购自上海碧云天生物技术有限公司;噻唑蓝(mtt)购自sigma公司。pbs缓冲盐溶液:磷酸二氢钾(kh2po4)0.27g,磷酸氢二钠(na2hpo4)1.42g,氯化钠(nacl)8g,氯化钾(kcl)0.2g,加去离子水约800ml充分搅拌溶解,然后加入浓盐酸调ph至7.4,最后定容到1l,高温高压灭菌后置于4℃冰箱保存待用。(2)受试药品溶液化合物2a-2y用dmso溶解配制成30mm的溶液,用高糖dmem培养液稀释为300μm的母液,在此基础上依次用高糖dmem培养液稀释得75,50,25,12.5,3.125μm的受试药品溶液,4℃保存备用。(3)细胞培养及mtt实验人神经母细胞瘤细胞sh-sy5y在含10%胎牛血清的dmem培养液中,37℃、5%co2保持饱和湿度培养,2-3天传代一次。分别取对数生长期细胞一瓶,加入胰酶细胞消化液消化,使贴壁细胞脱落,配制成浓度为5×104个/ml的细胞悬液,96孔细胞培养板中每孔加入100μl细胞悬液(每孔5×103个细胞),板置于37℃,5%co2培养箱中培养24小时。弃去培养液,pbs缓冲盐溶液清洗2次,每孔加入100μl相应的含不同浓度受试药品溶液的高糖dmem培养液;同时设立阴性对照组(只加高糖dmem培养液)。96孔板置于37℃,5%co2培养箱中培养24小时,每孔加入10μlmtt溶液(5mg/ml),在培养箱继续培养4小时。弃去培养基,每孔加入150μldmso溶解,摇床10分钟轻轻混匀;每孔的吸光度(od值)用1500酶标仪在490nm波长下进行检测,计算抑制率和ic50值。抑制率(%)=(阴性对照组od值—实验组)/(阴性对照组od值)×100%应用graphpadprism5软件计算ic50。表2各化合物对sh-sy5y细胞株的细胞毒活性cpdsh-sy5y(ic50μm)2a7.1±0.62b21±1.82c19±2.52d13±0.92e6.3±0.52f18±1.22g30±2.82h45±4.92i2.3±0.32j3.1±0.22k8.9±0.92l2.9±0.22m33.7±0.12n32.9±7.22o99.4±2.22p53.4±4.92q14.3±1.02r28.6±2.32s30.3±5.72t60.7±5.42u35.6±1.72v32.7±2.62w22.2±0.32x30.5±6.62y12.9±1.1128±2.4244±5.2本实验目的在于检测该类型化合物对于sh-sy5y细胞的毒性,以初步评价其安全性。结果显示,该类型的化合物具有一定的毒性,对sh-sy5y细胞株的ic50在2.3~99.4μm之间。实施例28morris水迷宫研究小鼠行为学。测定仪器为panlabsmart3.0我们优选化合物2g、2f和2d为代表性化合物,选择以上三个化合物作为优选化合物的原因是,其分别具有最优的gsk-3β、ache和buche酶活抑制活性。将上述三个化合物用以下方法进行小鼠行为学研究:动物与试剂:成年雄性icr小鼠(8-10周,体重20-25克)购自扬州大学医学中心,氢溴酸东莨菪碱购自阿拉丁试剂公司(s107418,上海),他克林由申请人合成(纯度>95%)。实验操作:将30只小鼠随机分为5组(每组6只小鼠):(1)空白对照组,(2)东莨菪碱模型组,(3)化合物2g,(4)化合物2f,(5)化合物2d,(5)他克林组。(3)、(4)、(5)组小鼠分别口服给药化合物2g,化合物2f,化合物2d、他克林组。30min后,(2)、(3)、(4)、(5)组小鼠腹腔注射东莨菪碱(1mg/kg),(1)组小鼠腹腔注射生理盐水。接下来通过水迷宫测试小鼠的认知功能和记忆能力。在一个圆形水池(直径120cm,高60cm)中固定一个逃生平台(直径10cm),平台上固定一个5cm高的小旗子,水池中填充高度为40cm的水,并且保持温度在25℃组成水迷宫。第1-2天将小鼠放在逃生平台进行训练,第3-5天将平台放置到水下1cm,对小鼠进行训练,最后一天(第6天)将平台移走,对小鼠进行评估,记录小鼠到达平台所在位置的时间,轨迹及速度。实验结果如下图2所示:结果分析:图2显示了所有组小鼠到达平台所需平均时间(a),搜索距离(b)。与空白对照组相比,东莨菪碱模型组小鼠到达平台的平均时间和距离高出很多,表明东莨菪碱会导致小鼠记忆缺陷,同时表明造模成功。相对于模型组,他克林组所耗时间和距离都显著降低,表明他克林对于小鼠的记忆和认知功能有显著性的改善。而化合物2g、化合物2f和化合物2d组,小鼠到达平台的平均时间和距离都低于他克林组,表明该系列对小鼠记忆和认知功能的改善效果超过他克林。实施例28急性肝毒性研究。实验操作:将他克林,化合物2f和化合物2d所得化合物溶于cmc-na溶液(0.5gcmc-na,100ml蒸馏水),配置成3mg/100mg体重浓度,进行灌胃给药。在给药8小时,22小时和36小时后分别从球后神经丛中获得肝素化血清。通过市售测定试剂盒(ef551,ef550)测定丙氨酸转氨酶(alt),试剂盒(eh027,ef548)测定天冬氨酸转氨酶两种肝损伤指标。数据由生化分析仪(hitachi7020,日本)进行分析。在收集球后血液1小时后处死小鼠,取出肝脏,通过免疫组织化学的方法进行形态学研究。使用超薄半自动切片机(leicarm2245,德国)分离肝脏门部至左侧外叶边缘的两个3mm切片,立即置于10%甲醛缓冲液中,固定两天,用石蜡进行包埋,制备成5μm石蜡切片,去石蜡,用苏木精和伊红染色进行组织病理学检查。实验结果如表3所示:表3:三个时间点小鼠丙氨酸转氨酶及天冬氨酸转氨酶水平结果分析:化合物2f和化合物2d所得化合物在三个时间点的alt,ast水平与对照组和模型组相当,不存在显著性差异,说明化合物具有初步的安全性。另外,组织病理学图片表明,与对照组(a)、他克林组(b)相比,化合物2f(c)和化合物2d(d)所得化合物的治疗没有引起肝脏的不良形态变化,这些结果都表明了化合物的安全性,预示出这类化合物具有良好的临床应用前景。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种环吡酮胺的药物组合物及其医药用图
- 一种吡噻菌胺残留量的gc-ei-ms测定方法
- 一种检测噻吩并吡啶类抗血小板药物疗效的试剂卡及其使用方法和应用
- 一种环吡酮胺的药物组合物及其医药用图
- 一种吡噻菌胺残留量的gc-ei-ms测定方法
- 一种吡噻菌胺残留量的gc-ei-ms快速测定方法
- 四氢糠醇气固相催化合成吡啶的负载型催化剂及其制备方法
- 一种合成n-取代-1,2,5,6-四氢吡啶-4-硼酸酯的方法
- (5-(2-腈基苄基)-4,5,6,7-四氢噻吩并[3,2-c]吡啶-2-基)乙酸酯的晶型Ⅰ及其制备方 ...的制作方法
- (5-(2-腈基苄基)-4,5,6,7-四氢噻吩并[3,2-c]吡啶-2-基)乙酸酯的晶型Ⅲ及其制备方 ...的制作方法