在E.coli中实现rhTβ4完全乙酰化修饰表达的中试生产发酵方法与流程
本发明属于药物技术领域,涉及蛋白质完全n-乙酰化的发酵方法。
背景技术:
人胸腺素beta4(tβ4)是一个n末端ser被乙酰化修饰的含有43个氨基酸残基的小分子多肽,平均分子量为4964.5da,等电点为4.6。tβ4广泛存在于哺乳动物及其他脊椎动物的组织、器官和细胞中。人脾脏、胸腺、肺和腹膜巨噬细胞中的tβ4含量最高,其次是脑、肝、肾脏、睾丸和心脏。在血小板和白细胞中高度表达,但红细胞中不含有tβ4。tβ4在哺乳动物中高度保守。研究表明tβ4具有抗炎、抑制细胞凋亡、促进细胞迁移等功能,可应用于皮肤创伤愈合、眼角膜损伤修复、干眼症治疗、心肌损伤修复、神经损伤修复以及化妆品领域。以regenex公司为代表,目前正在开展的tβ4临床试验适应症包括干眼症、神经营养性角膜炎、急性心肌梗死、大疱性表皮松解症、静脉淤滞性溃疡等,该公司的tβ4为化学合成的多肽,化学合成需要大量使用有毒试剂,特别是乙酰化修饰试剂,而且其生产成本高,生产规模难以放大。
由本申请人持有的中国发明授权专利“n-末端乙酰化蛋白或多肽的制备方法及其专用工程菌”(cn201010521842.3)公开了一种解决了生物合成胸腺素两大难题的方法:实现n-末端乙酰化修饰和高表达。简单来说,首先应用整合技术将特异的n-乙酰转移酶基因(nat)插入到大肠杆菌染色体上,获得稳定表达nat的宿主。采用突变后具有n-末端切割功能的spldnaxintein,tβ4和his标签分别融合在其n-末端和c-末端,构建了融合蛋白表达载体,将融合蛋白表达质粒转至稳定表达大肠杆菌乙酰化酶的宿主中,发酵培养表达融合蛋白,经切割、纯化等步骤,生物制备重组人胸腺素beta4(rhtβ4)。应用此方法,在大肠杆菌培养体积为小试规模(1l)时可实现tβ4的n端完全乙酰化。
然而,在该方法中,尽管在大肠杆菌培养规模为1l时可获得n端100%乙酰化的tβ4蛋白,当放大培养至中试规模(≥50l)时,纯化获得的tβ4蛋白并未实现100%乙酰化,乙酰化程度仅在40%-60%不等。
乙酰化是一种广泛存在的蛋白质修饰,乙酰化修饰对一些蛋白的活性和稳定性具有重要影响,在某些情况下,缺少乙酰化会导致蛋白质热稳定性的下降或其他动力参数的改变,或者复合体组装效率下降。对肽类药物而言,乙酰化修饰可以提高多肽在体内的半衰期,尽管体外研究表明非乙酰化修饰的tβ4也具有生物活性,但是乙酰化修饰会增加tβ4的体内外稳定性。prospec公司的tβ4(cataloguenumber:hor-003)产品,即为未乙酰化修饰的大肠杆菌重组表达产物,其说明书明确说明了溶解后的tβ4在4℃只能保存2-7天(uponreconstitutionthymosinb4humanshouldbestoredat4°conlybetween2-7days)。缺少乙酰化修饰的tβ4产品只能制成干粉形式保存,而这种保存方式不适用于滴眼液或者凝胶制剂。因此,如果要开发tβ4滴眼液或者凝胶制剂用于治疗干眼症或皮肤疾病,迫切需要解决中试或生产规模下,tβ4的部分乙酰化问题。本发明的目的就是提供一种中试或生产规模下(发酵体积≥50l),能够对tβ4完全乙酰化的生成制备方法。
技术实现要素:
基于上述目的,本发明提供了一种人胸腺素beta4在大肠杆菌中完全被乙酰化修饰的发酵方法,所述方法包括以下步骤:
(1)菌种活化:取表达rhtβ4的冻存工程菌,以1:30~1:50(v/v)的比例接种于ampr/kanrlb液体培养基中,培养12h获得活化菌液;
(2)种子液制备:将步骤(1)所得的活化菌液以1:30~1:50(v/v)的比例接种于ampr/kanrfmg培养基中,培养12h获得种子液;
(3)发酵:将步骤(2)所得的种子液以1:30~1:50(v/v)的比例接种于50lfml培养基中,发酵培养24h下罐,其中,将fml培养基中的葡萄糖含量控制为4g/l以上,并且发酵过程中控制发酵液ph在6.0~7.0。
在一个优选的实施方案中,在所述步骤(3)中,控制发酵液的ph在6.0~6.5。
在一个更为优选的实施方案中,采用50%乙酸替代磷酸控制发酵液的ph。
在一个优选的实施方案中,所述步骤(1)中培养温度为28~37℃,培养转速为200~250rpm/min。
更为优选地,所述步骤(1)中培养温度为30~32℃,
在另一个优选的实施方案中,所述步骤(2)中培养温度为28~37℃,培养转速为200~250rpm/min。
更为优选地,所述步骤(2)中培养温度为30~32℃。
在又一个优选的实施方案中,所述步骤(3)中培养温度为28~37℃,培养转速为200~250rpm/min。
更为优选地,所述步骤(3)中培养温度为30~32℃。
尤为优选地,所述步骤(3)中通气量4~8l/min,溶氧为20%~80%,消泡剂1:5000~1:10000(v/v)。
本发明的发酵方法包含了菌种活化,种子液制备以及发酵三个步骤,之所以需要菌种活化,是因为在研究过程中发现增加菌种活化的步骤可有效地提高工程菌的表达量。本发明提供的发酵方法通过对乙酰化修饰代谢通路的研究,对发酵工艺进行合理规划,并对发酵培养基进行优化配制,将发酵液中葡萄糖的含量由常规的2g/l提高到4g/l以上,可以增加培养液中的碳源,促进葡萄糖→丙酮酸→乙酸→乙酰辅酶a代谢通路中乙酰基的产生,发酵过程中采用乙酸代替磷酸控制ph在7.0以下,可有效地减少发酵过程中乙酸的消耗,促进乙酰辅酶a的生成,增加乙酰基的含量,最终不仅可以促进rhtβ4的乙酰化,更可以大幅提高rhtβ4的产量,得到拥有与天然tβ4具有完全一致的序列以及修饰的的人tβ4,扩大了rhtβ4的应用领域和范围。发明人对发酵过程中的设计的各种技术参数进行了摸索和优化,经过了大量实践,将各个参数均调整到适宜的范围内,能够在中试和生产规模生产出具有100%乙酰化的rhtβ4。
本发明提供的人胸腺素beta4在大肠杆菌中完全乙酰化修饰的发酵方法取得了优异的技术效果:
(1)可实现中试或生产规模(发酵体积≥50l)rhtβ4的完全乙酰化修饰。
(2)可比常规发酵增加3倍以上的rhtβ4产量。
本发明所使用的发酵工艺简单,且成本较低,50l发酵规模即可获得10g以上的rhtβ4纯品,对于rhtβ4的工业化大规模生产具有重要应用价值。
附图说明
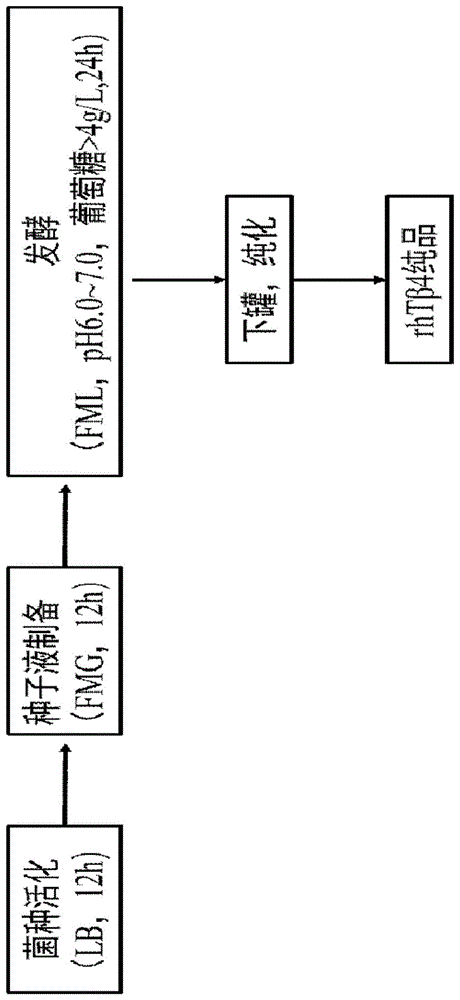
图1.完全n-乙酰化rhtβ4的发酵流程图;
图2.不同培养条件下碎菌上清sds-page电泳图;
图3.采用四联罐平行培养系统进行发酵条件优化;
图4.不同乙酰化率的tβ4在2~8℃放置不同时间的sds-page电泳图。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
实施例
附图1给出了本发明的人胸腺素beta4在大肠杆菌中完全被乙酰化修饰的发酵方法的流程图。本实施例按照该流程图对各种步骤中的技术参数在实验设计的基础上进行了各种优化方案的处理,以期达到中试和生产规模以上的优异的乙酰化效果和更高的目的蛋白产量。
1.菌种是否活化对rhtβ4表达量的影响
rhtβ4的发酵表达过程分为lb培养基活化、fmg培养基扩增和fml培养基诱导表达3个步骤,首先我们研究了菌种的活化、扩增温度对融合蛋白表达量的影响,方法如下:
一级种子活化:取按照中国发明专利cn101979505b(cn201010521842.3)制备的rhtβ4甘油菌种1ml接种至30mlampr/kanr(amp:100μg/ml,kan:25μg/ml)lb液体培养基(酵母粉5g/l,蛋白胨10g/l,氯化钠10g/l,ph7.0,121℃灭菌20min)中,30℃,220rpm,培养12h。
二级种子扩增:一级种子30ml接种至1lamp/kanfmg培养基(k2hpo4.3h2o(7g/l),nah2po4.2h2o(3g/l),nacl(2.5g/l),酵母粉(12g/l),蛋白胨(15g/l),mgso4.7h2o(0.5g/l),葡萄糖(2g/l))中,30℃或37℃,220rpm,培养12h。
未活化的甘油菌30ml直接接种至1lampr/kanrfmg培养基中,30℃或37℃,220rpm,培养12h。
诱导表达:1l种子液转接至50lfml培养基(k2hpo4.3h2o(7g/l),nah2po4.2h2o(3g/l),nacl(2.5g/l),酵母粉(12g/l),蛋白胨(15g/l),mgso4.7h2o(0.5g/l),葡萄糖(2g/l),乳糖(2mm)),30℃或37℃,220rpm诱导培养,24h,每两小时取样测od600值并收集菌沉淀超声碎菌后取上清进行蛋白电泳检测目的蛋白表达量。
实验结果:不同培养条件下sds-page电泳结果如图2所示,结果显示采用lb培养基进行工程菌活化后表达量要高于未活化,采用fmg培养基30℃扩增,fml培养基30℃诱导表达的菌浓度和融合蛋白量最高。
2.不同的发酵条件对rhtβ4乙酰化和产量的影响
在实际生产过程中,我们发现50l规模发酵产物的乙酰化程度远低于1l小试表达产物的100%,只有40%~60%。为了促进目的蛋白的乙酰化反应,我们采用四联罐平行培养系统(常州生德生物科技有限公司,型号cuber1500),模拟实际发酵条件,在发酵过程中增加葡萄糖含量或者添加乙酸,通过检测目的蛋白的产量及乙酰化程度来获得最优的发酵条件。四联罐平行培养系统可同时进行4个1l体积的发酵罐发酵,四个发酵罐f1、f2、f3、f4的发酵条件如图3所示,取工作种子150μl接种于5mlampr/kanrlb培养基中,30℃,220rpm,活化12h,将5ml上述菌液接种于150mlampr/kanrfmg培养基中,30℃,220rpm,扩增12h,每个发酵罐中含1lfml培养基,每罐接种20mlfmg种子液,30℃,220rpm,发酵过程中通气量均为4-8l/min,溶氧控制在20%-80%,发酵24h下罐,离心后收集菌沉淀,超声碎菌,按照常规方法纯化,采用串联质谱(thermofisherorbitrapfusionlumos)对纯化后的目的蛋白进行精确分子量检测。实验结果如图3所示,f1、f2发酵条件均能实现目的蛋白100%乙酰化,但f1条件下,目的蛋白产量更高,因此最终选取f1的发酵条件为最优的方法,即:将fml培养基中的葡萄糖含量由2g/l增加为4g/l,并且发酵过程中采用乙酸替代磷酸控制ph≤6.5。
在获得f1的发酵条件后,我们又进行了连续多批次50l发酵,进行条件验证。采用上述发酵条件,在50l发酵体积的中试发酵罐中,每50l发酵液中加入8ml泡敌(江苏长丰有机硅有限公司,高温硅聚醚、聚醚多元醇的共聚物)作为消泡剂,进行了验证。从实验结果(表1,表2)可以看出,采用优化前原工艺发酵纯化产物的乙酰化率约为60%,而采用优化后的工艺进行的5批次发酵产物的乙酰化率均能达到100%,且获得的纯品量由3g左右增加至10g左右,产量提高了3倍以上。
表1.采用优化前工艺3批发酵产物情况总结
表2.采用优化后工艺5批发酵产物情况总结
3.不同乙酰化程度对rhtβ4蛋白溶液稳定性的影响
将具有不同乙酰化修饰程度的tβ4样品分别放置在2~8℃不同时间,通过在不同时间取样,检测其电泳条带变化和蛋白浓度变化,评估乙酰化对tβ4蛋白溶液稳定性的影响。
其中样品1为prospec公司的tβ4产品(cataloguenumber:hor-003),为未乙酰化修饰的大肠杆菌重组表达产物,粉末状,用pbs缓冲液重选制成浓度为1mg/ml的蛋白溶液;
样品2为采用普通发酵工艺生产制备的rhtβ4蛋白溶液,缓冲液为pbs,浓度为1mg/ml,乙酰化率为60%;
样品3为采用本发明的发酵工艺制备的rhtβ4蛋白溶液,缓冲液为pbs,浓度为1mg/ml,乙酰化率为100%。
实验结果如图4和表3所示,图4中,m:蛋白分子量标准。条带由上而下分别为120、100、80、60、50、40、30、20、12kd;泳道(样品)1:乙酰化率为0的tβ4蛋白溶液;泳道(样品)2:乙酰化率为60%的tβ4蛋白溶液;泳道(样品)3:乙酰化率为100%的tβ4蛋白溶液。2~8℃放置7天后,样品1,即乙酰化率为0的tβ4蛋白溶液,蛋白条带明显减弱,蛋白浓度降低,说明蛋白发生了降解;样品2,即乙酰化率为60%的tβ4蛋白溶液,蛋白条带稍有减弱,蛋白浓度稍有降低,说明蛋白发生了部分降解;而样品3,即乙酰化率为100%的tβ4蛋白溶液,蛋白条带和蛋白浓度均未见明显变化。2~8℃放置24个月后,样品1中的蛋白基本全部降解,未见明显条带,样品2条带稍有减弱,样品3蛋白条带和浓度均未见明显变化。从以上结果可以看出,采用本发明发酵工艺制备的100%乙酰化tβ4在2~8℃可以放置24个月以上,未见蛋白降解和浓度改变,说明n乙酰化对tβ4的稳定性具有重要影响,而这一点对于其成药性极其关键。
表3不同乙酰化率的tβ4在2~8℃放置不同时间的蛋白浓度
- 还没有人留言评论。精彩留言会获得点赞!