一种长效化合物的制备方法与流程
本申请涉及药物领域,具体涉及一种治疗抑郁症、神经性和慢性疼痛,包括复杂性区域疼痛综合症(crps)的化合物的制备方法。
背景技术:
氯胺酮(ketamine)是临床常用的苯环己哌啶类静脉麻醉药物的代表,是近年来临床与基础研究发展较快的麻醉剂之一。在临床实践中,因为其具有诱导迅速、作用时间较短、苏醒较快、对呼吸和循环系统影响较轻等特点,常用于满足儿科、产科、围手术期及特殊疾病患者的麻醉需求。
氯胺酮最早于1962年合成,1965年用于人体,1970年被fda正式批准用于临床。其典型的“分离麻醉”及短效确切的镇痛使得它曾红极一时,但是随后被发现精神方面的副作用及其他静脉麻醉药物的迅速发展使得氯胺酮的临床使用大大减少。近10年来,随着对氯胺酮用法用量的研究,及其抗炎,抗抑郁,神经保护、镇痛等的作用被发现,医学界对氯胺酮的兴趣重新高涨。
一直以来,氯胺酮具有的强力镇痛,遗忘,同时能保留自主呼吸和气道保护性反射,保持血流动力学稳定等作用使得氯胺酮在院前麻醉镇痛中的作用不容忽视。氯胺酮同时具有神经毒性和神经保护作用,巨大的手术刺激理论上可能平衡麻醉的伤害,而氯胺酮能够减轻手术伤害刺激引起的神经认知功能损害,氯胺酮到底引起神经保护还是神经损害与使用氯胺酮的剂量有直接相关性。
氯胺酮对术后认知功能具有影响。有研究者对50例接受氯胺酮麻醉的患儿进行测试后发现,氯胺酮全麻可以降低患儿术后6h的认知功能,但对术后24h的认知功能无影响。hudetz等发现在全麻诱导时给予0.5mg/kg氯胺酮,能够降低心脏手术术后1周的术后认知功能障碍发生率,而这一作用可能与氯胺酮的抗炎作用有关。近年来,众多的临床实验都证实,术中单次小剂量的应用氯胺酮能够降低术后手术后认知功能障碍(pocd)发生率。
氯胺酮具有镇痛作用。亚麻醉剂量的氯胺酮常被用于抗痛觉过敏,及急慢性疼痛的治疗。研究证实麻醉诱导前氯胺酮盐水混合液漱口,能明显降低全麻气管插管引起的术后咽痛发生率及严重程度。术中阿片类药物使用使得术后阿片类药物镇痛用量增加,这种效应叫做阿片类药物耐受。而临床发现氯胺酮的使用能够防止阿片类药物耐受,还能够逆转吗啡耐受,增强吗啡的镇痛效果。亦有研究证实小剂量氯胺酮术中应用能够防止瑞芬太尼诱导的术后痛觉过敏。cagla等对膝关节镜手术的病人术后静注氯胺酮0.15mg/kg发现,氯胺酮能显著提高术后镇痛满意度,且较氯胺酮复合咪达唑仑组镇静评分更低。
氯胺酮具有肺保护作用。近年来,氯胺酮被发现具有显著地肺保护作用。有临床实验证实,胸科手术中单肺通气前经静脉和雾化都能够降低血中炎症因子的水平,而雾化吸入对心血管系统和气道压更有好处,而肺通气侧雾化效果优于双肺雾化。氯胺酮在临床中也常用于当常规治疗无效的致死性的哮喘发作的抢救,公认的其使用能够改善预后。
氯胺酮具有抗抑郁的作用。2000年berman等首次报道单次静脉注射亚麻醉剂量的氯胺酮(0.5mg/kg,超过40min静脉注射)后72h内超过50%的患者汉密顿抑郁量表评分减低50%以上(详见:bermanrm,cappielloa,ananda,etal.antidepressanteffectsofketamineindepressedpatients[j].biolpsychiatry,2000,47(4):351-354)。paulr等发现相对于消旋氯胺酮,s-氯胺酮具有相似的抗抑郁作用,但精神方面副作用更小(详见:paulr,schaaffn,padbergf,etal.comparisonofracemicketamineands-ketamineintreatment-resistantmajordepression:reportoftwocases[j].worldjbiolpsychiatry,2009,10(3):241-244)。近几年,较多的动物和临床研究进一步证实氯胺酮的抗抑郁效应。氯胺酮也被用于抑郁病人电休克治疗的麻醉。
2012年,美国政府健康及人类服务部、库珀卫生系统和斯坦福研究院共同申请了申请号为cn201280062294x,发明名称为(2r,6r)-羟基去甲氯胺酮、(s)-脱氢去甲氯胺酮以及(r,s)-氯胺酮的其他立体异构脱氢和羟基化代谢物在治疗忧郁症和神经性疼痛中的应用的专利申请。cns(中枢神经系统)副作用与(r,s)-氯胺酮对于nmda受体的活性有关,在该申请中以氯胺酮为基础,研究和合成了(2r,6r;2s,6s)-羟基去甲氯胺酮(hnk),该化合物对于nmda受体没有活性,从而避免了可能的副作用,同时该化合物据称具有治疗两极忧郁症、重度抑郁症、阿尔茨海默尔痴呆、肌萎缩侧索硬化症、复杂性区域疼痛综合症(crps)、慢性疼痛、或神经性疼痛的作用。
我们在动物实验研究中发现,(2r,6r;2s,6s)-羟基去甲氯胺酮(hnk)在给药后,药效持续时间并不长,1周内即失去疗效,这严重限制了治疗抑郁症时所希望的长效效果。因此如何对(2r,6r;2s,6s)-羟基去甲氯胺酮(hnk)进行结构修饰,以获得更长药效的药物,将具有巨大的治疗潜力。
技术实现要素:
本申请涉及一种具有抗抑郁、麻醉、镇痛、改善认知功能、肺保护、、预防或治疗肌萎缩侧索硬化症或预防或治疗复杂性区域疼痛综合症的化合物的制备方法。
本申请的化合物与现有已知的hnk类化合物相比具有更长的药效时间,具体表现在hnk在一周内即代谢,失去疗效,而本申请的化合物药效时间可以持续1周以上。
本申请提供了如下式所示的化合物:
其中m为0-3的整数,n为0-4的整数;
r1和r2独立地选自h、卤素、羟基、氨基、氰基、c1-c4烷基、c1-c4烷氧基、单-和二-c1-c4烷基氨基、c1-c2卤代烷基、c1-c2卤代烷氧基、c6-c10芳基或单环或多环杂芳基中的1种或多种;
r2独立地选自
r3独立地选自c1-c8烷基、c2-c8烯基、c2-c8炔基、c1-c8酰基;
r4独立地选自c1-c8酰基、芳基酰基或杂芳基酰基;
或上述化合物的盐、立体异构体、互变异构体。
本申请提供了如下式所示的化合物:
其中
r3独立地选自c1-c8烷基、c2-c8烯基、c2-c8炔基、c1-c8酰基、c6-c10芳基或单环或多环杂芳基;
r4独立地选自c1-c8酰基、芳基酰基或杂芳基酰基;
或上述化合物的盐、立体异构体、互变异构体。
本申请提供了如下所示的化合物:
其中m为0-3的整数,n为0-4的整数;
r1和r2独立地选自h、卤素、羟基、氨基、氰基、c1-c4烷基、c1-c4烷氧基、单-和二-c1-c4烷基氨基、c1-c2卤代烷基、c1-c2卤代烷氧基、c6-c10芳基或单环或多环杂芳基中的1种或多种;
r3独立地选自c1-c8烷基、c2-c8烯基、c2-c8炔基、c1-c8酰基;
r4独立地选自c1-c8酰基、芳基酰基或杂芳基酰基;
或上述化合物的盐、立体异构体、互变异构体。
本申请提供了如下式所示的化合物:
其中
r3独立地选自c1-c8烷基、c2-c8烯基、c2-c8炔基、c1-c8酰基、c6-c10芳基或单环或多环杂芳基;
r4独立地选自c1-c8酰基、芳基酰基或杂芳基酰基;
或上述化合物的盐、立体异构体、互变异构体。
如前所述的化合物,其特征在于为如下化合物:
如前所述的化合物,其特征在于为如下化合物:
如前所述的化合物的制备方法,其特征在于制备路线如下:
如前所述的任一化合物在制备麻醉、镇痛、改善认知功能、肺保护、抗抑郁、肌萎缩侧索硬化症、复杂性区域疼痛综合症药物中的应用。
其中所述疼痛包括:慢性疼痛或神经性疼痛;抑郁症包括:两极忧郁症、重度抑郁症、伴随神经退行性疾病的忧郁症;改善认知功能包括预防或治疗阿尔茨海默尔痴呆、帕金森等。
上述所有疾病,也涵盖了预防或治疗作用。
本申请还提供了如下式所示的中间体化合物:
其中m为0-3的整数,n为0-4的整数;
r1和r2独立地选自h、卤素、羟基、氨基、氰基、c1-c4烷基、c1-c4烷氧基、单-和二-c1-c4烷基氨基、c1-c2卤代烷基、c1-c2卤代烷氧基、c6-c10芳基或单环或多环杂芳基中的1种或多种;
r5和r6为保护基团;
或上述化合物的盐、立体异构体、互变异构体。
本申请还提供了如下式所示的中间体化合物:
其中r5和r6为h或保护基团;
或上述化合物的盐、立体异构体、互变异构体。
本申请还提供了如下式所示的中间体化合物:
本申请还提供了如下式所示的中间体化合物:
上述所有化合物的立体异构体包括对映异构体、非对映异构体。
上述所有化合物在化合物以不同互变异构形式存在的情况下,本发明不限于任一种具体互变异构体,而是包括所有的互变异构体形式。
上述所有化合物包括具有在化合物中出现的原子的所有可能的同位素的化合物。同位素包括具有相同原子序数但是不同质量数的那些原子。通过一般实例,在没有限制的情况下,氢的同位素包括氚和氘,并且碳的同位素包括11c、13c和14c。
本申请还提供了一种药物组合物,本文中公开的化合物可以以纯化学品给予,但优选作为药物组合物给予。因此,本公开提供了包括化合物或药用盐连同至少一种药用载体的药物组合物。药物组合物可以包含化合物或盐作为唯一的活性剂,但是优选包含至少一种其他活性剂。在某些实施方式中,药物组合物是在单位剂型中包含约0.1mg至约1000mg、约1mg至约500mg、或约10mg至约200mg的式i的化合物以及可选的约0.1mg至约2000mg、约10mg至约1000mg、约100mg至约800mg、或约200mg至约600mg的其他活性剂的口服剂型。
本文中公开的化合物可以以包含常规药用载体的剂量单位制剂口服、局部、非肠道、通过吸入或喷雾、舌下、透皮、通过口腔给予、直肠、作为眼用溶液、或通过其它方式来给予。可以将药物组合物配制成任何药用形式,如:气雾剂、乳膏剂、凝胶剂、丸剂、胶囊剂、片剂、糖浆剂、透皮贴剂、或眼用溶液。诸如片剂和胶囊剂的一些剂型可以再分成包含诸如达到期望目的的有效量的适当量活性组分的适当剂量单位剂型。
载体包括赋形剂和稀释剂,并且必须具有足够高的纯度和十分低的毒性以使它们适于被给予待治疗的患者。载体可以是惰性的或其可以本身具有药用益处。
载体的种类包括但不限于:粘合剂、缓冲剂、着色剂、稀释剂、崩解剂、乳化剂、调味剂、助流剂、滑润剂、防腐剂、稳定剂、表面活性剂、制片剂、以及润湿剂。一些载体可以列在多于一种的类别中,如:植物油可以在一些制剂中用作滑润剂并在其他制剂中用作稀释剂。示例性药用载体包括糖、淀粉、纤维素、西黄蓍胶粉(powderedtragacanth)、麦芽、明胶、滑石和植物油。可选的活性剂可以包括在药物组合物中,其基本上不影响本发明的化合物的生物功能。
本申请的化合物或盐可以是被给予的唯一活性剂或可以连同其他活性剂被给予。例如,本申请的化合物可以连同另一选自以下中的任一种的活性剂被给予:
抗抑郁剂:草酸依地普仑、费洛克汀、帕罗西汀、度洛西汀、舍曲林、西酞普兰、丁氨苯丙酮、文拉法辛、度洛西汀、纳屈酮、米氮平、文拉法辛、阿托莫西汀、丁氨苯丙酮、多虑平、阿米替林、氯米帕明、去甲替林、丁螺环酮、阿立哌唑、氯氮平、克塞平、奥氮平、喹硫平、利培酮、齐拉西酮、酰胺咪嗪、加巴喷丁、拉莫三嗪、苯妥英、普瑞巴林、多奈哌齐、加兰他敏、美金刚、卡巴拉汀、高牛磺酸(tramiprosate)、或它们的药物活性盐或前药、或上述的组合;
精神分裂症药物:阿立哌唑、鲁拉西酮、阿塞那平、氯氮平、齐拉西酮、利培酮、喹硫平、三氟啦嗪、奥氮平、克塞平、氟哌噻吨(flupentioxol)、佩吩嗪、氟哌丁苯、氯丙嗪、氟非那嗪、氟奋乃静、帕潘立酮;
阿尔茨海默尔痴呆药物:多奈哌齐、卡巴拉汀、加兰他敏、美金刚;
als药物:利鲁唑;
疼痛药物:醋氨酚、阿斯匹林、nsaids,包括:双氯芬酸、二氟苯水杨酸、依托度酸、非诺洛芬、氟比洛芬、布洛芬、茚甲新、酮洛芬、酮咯酸、甲氯芬那酸、甲灭酸、美洛昔康、萘丁美酮、萘普生、奥沙普秦、苯基丁氮酮、吡罗昔康、舒林酸、tolmetinopiods、cox-2抑制剂如塞来昔布,以及麻醉疼痛药物如:丁丙诺啡、布托啡诺、可待因、二氢可待因酮、氢化吗啡酮、羟甲左吗喃、哌替啶、美沙酮、吗啡、纳布啡、氧可酮、氧吗啡酮、镇痛新、丙氧芬、中枢性镇痛反胺苯环醇。
其他活性剂的前述列表是示例性的而不是全面地包括。以上列表中未包含的其他的活性剂可以结合式i的化合物被给予。尽管在一些实施方式中,其他活性剂将以小于一般规定的剂量并且在一些情况下小于批准剂量的最小值给予,但是可以根据它的批准规定信息来给予其他活性剂。
本公开包括治疗抑郁症,尤其是治疗两极忧郁症和重度抑郁症的方法,特别是治疗难治性抑郁症(treatment-resistantdepression)的方法,其中,化合物的有效量是有效缓解抑郁症状的最低剂量,其中,抑郁症状的缓解是达到在抑郁症状等级量表评分降低50%或更多,或在hrsd17上小于或等于7的分数,或在qid-sr16上小于或等于5、或在madrs上小于或等于10。
本公开提供了有效减少疼痛(或镇痛)症状的量;其中,疼痛症状的减少是达到在疼痛等级量表上疼痛症状减少50%或更多。
术语约定:
“立体异构体”是具有相同化学组成但原子或基团在空间中的排布不同的化合物。
“非对映异构体”是具有两个或更多手性中心并且其分子不是彼此的镜像的立体异构体。非对映异构体具有不同物理性能,例如:熔点、沸点、谱特性和反应活性。在拆分剂或色谱存在的情况下,使用诸如手性hplc柱,可以在诸如电泳、结晶的高分辨分析步骤下分离非对映异构体的混合物。
“对映异构体”指代彼此无重叠镜像的一种化合物的两个立体异构体。对映异构体的50:50的混合称为外消旋混合物或外消旋体,其在化学反应或处理过程中可以出现在已经没有立体选择性或立体定向性的情况下。
“烷基”包括支链和直链饱和脂肪族烃基两者,并具有指定数量的碳原子数量,一般1至约12个碳原子。如在本文中使用的术语c1-c6烷基表示具有1至约6个碳原子的烷基。当本文中结合另一基团使用c0-cn烷基时,以(苯基)c0-c4烷基为例,指定的基团,在这种情况下,苯基是通过单个共价键(c0)直接键合或通过具有指定的碳原子数(在这种情况下,1至约4个碳原子)的烷基链连接。烷基的实例包括但不限于:甲基、乙基、正丙基、异丙基、正丁基、3-甲基丁基、叔丁基、正戊基、和仲戊基。
“烯基”指包括一个或多个不饱和的碳-碳键的直链和支链烃链,碳-碳键可以出现在沿着链的任一稳定点。本文中所述的烯基通常具有2至约12个碳原子。优选烯基是低级烯基,那些烯基具有2至约8个碳原子,如:c2-c8、c2-c6、和c2-c4烯基。烯基的实例包括乙烯基、丙烯基、和丁烯基。
“烷氧基”是指具有通过氧桥连接的指定数量的碳原子的如上所定义的烷基。烷氧基的实例包括但不限于甲氧基、乙氧基、3-己氧基、和3-甲基戊氧基。
术语“杂环”表示5-至8-元饱和环、部分不饱和环、或包含选自n、o和s的1至约4个杂原子且剩余的环原子是碳的芳族环,或是7至11元饱和环、部分不饱和环、或芳族杂环系统和10至15-元三环系统,该系统包含选自n、o和s的多环系统中的至少1个杂原子并且在多环系统中的各环中包含独立地选自n、o和s的至多约4个杂原子。除非另外指明,否则杂环可以连接至它在任何杂原子和碳原子处取代并且产生稳定结构的基团。当指明时,本文中所述的杂环可以在碳或氮原子上被取代,只要得到的化合物是稳定的。可以可选地季铵化杂环中的氮原子。优选杂环基中杂原子的总数不大于4而且优选杂环基中s和o原子的总数不大于2,更优选不大于1。杂环基的实例包括:吡啶基、吲哚基、嘧啶基、哒嗪基(pyridizinyl)、吡嗪基、咪唑基、噁唑基、呋喃基、苯硫基、噻唑基、三唑基、四唑基、异噁唑基、喹啉基、吡咯基、吡唑基、苯并[b]苯硫基(benz[b]thiophenyl)、异喹啉基、喹唑啉基、喹喔啉基、噻吩基、异吲哚基、二氢异吲哚基、5,6,7,8-四氢异喹啉、吡啶基、嘧啶基、呋喃基、噻吩基、吡咯基、吡唑基、吡咯烷基、吗啉基、哌嗪基、哌啶基、和吡咯烷基。
“芳基或杂芳基”表示包含选自n、o和s的1至4个、或优选1至3个杂原子并且剩余环原子为碳的稳定的5-或6-元单环或多环。当杂芳基中s和o原子的总数超过1时,这些杂原子不彼此邻近。优选杂芳基中s和o原子的总数不大于2。尤其优选杂芳基中s和o原子的总数不大于1。可以可选地季铵化杂环中的氮原子。当指明时,这些杂芳基还可以用碳或非碳原子或基团取代。这种取代可以包括与可选地包含独立地选自n、o和s的1或2个杂原子的5至7-元饱和的环基的稠合,从而形成例如[1,3]二噁唑并[4,5-c]吡啶基。杂芳基的实例包括但不限于:吡啶基、吲哚基、嘧啶基、哒嗪基、吡嗪基、咪唑基、噁唑基、呋喃基、苯硫基、噻唑基、三唑基、四唑基、异噁唑基、喹啉基、吡咯基、吡唑基、苯并[b]苯硫基、异喹啉基、喹唑啉基、喹喔啉基、噻吩基、异吲哚基、和5,6,7,8-四氢异喹啉。
“抑郁症”包括情绪低、活动兴趣下降、心理活动减缓或烦躁、食欲改变、注意力不集中或优柔寡断、过度内疚或自卑,并且在忧郁症、两极忧郁症、以及由于其它疾病或病况引起的情绪失常、物质引发的情绪失常和其他原因不明的情绪失常的情况下可能出现自杀意念,并且也可与各种其他精神性疾病(包括但不限于精神性失常、认知障碍、摄食障碍、焦虑症和人格障碍)共同存在。疾病的发展进程(longitudinalcourse)、病史、症状类型和病因有助于将情感性疾病的各种形式彼此区分开来。
“化合物的盐”是所公开的化合物的衍生物,其中,母体化合物通过制备无毒的酸或其碱加成盐改性,并且还指这些化合物和这些盐的药用溶剂化物,包括水合物。药用盐的实例包括但不限于:碱性残基如胺类的无机或有机酸加成盐;酸性残基如羧酸的碱或有机加成盐;等等,以及包括一种或多种上述盐的组合。药用盐包括诸如从无毒无机或有机酸形成的母体化合物的无毒盐和季铵盐。例如,无毒酸性盐包括衍生自无机酸的那些,例如:盐酸、氢溴酸、硫酸、氨基磺酸、磷酸、硝酸等;其他可接受的无机盐包括金属盐如:钠盐、钾盐、铯盐等;碱土金属盐如:钙盐、镁盐等,以及包括一种或多种上述盐的组合。
化合物的有机盐包括由诸如乙酸、三氟乙酸、丙酸、丁二酸、乙醇酸、硬脂酸、乳酸、苹果酸、酒石酸、柠檬酸、抗坏血酸、扑酸、马来酸、羟基马来酸、苯乙酸、谷氨酸、苯甲酸、水杨酸、甲磺酸、乙磺酸、苯磺酸、对氨基苯磺酸、2-乙酸基苯酸、富马酸、对甲苯磺酸、甲磺酸、乙烷二磺酸、草酸、羟乙磺酸、hooc-(ch2)n-cooh(其中n为0至4)等的有机酸制备的盐;有机胺盐,如:三乙胺盐、吡啶盐、甲基吡啶盐、乙醇胺盐、三乙醇胺盐、二环己基胺盐、n,n'-二苄基乙二胺盐等;和氨基酸盐,如:精氨酸盐、天冬氨酸盐、谷氨酸盐等,以及包括一种或多种上述盐的组合。
附图说明
图1小鼠抑郁样行为测试结果;
图2差异蛋白分析;
图3差异蛋白的生物过程和分子功能的富集分析;
图4差异表达蛋白的信号传导通路的富集分析;
图5-图10化合物的nmr谱图。
具体实施方式
实施例1:化合物制备方法
步骤一:由邻三氟甲基苯甲腈出发,按照经典的氯胺酮药物合成法calvinstevens法(制备路线如上所示)得到化合物d1;
步骤二:将化合物d1(2.57g,10mmol)加入60mlthf中,加入三乙胺(2.7ml,20mmol)及boc2o(3.32g,15mmol),回流6h,冷却,旋干,过硅胶柱得到化合物e13.25克,产率91%。1hnmr(300mhz,cdcl3):δ7.80(d,j=8.1hz,1h),7.66(d,j=7.8hz,1h),7.49(t,j=7.5hz,1h),7.22(t,j=7.5hz,1h),5.76(s,1h),4.30(s,1h),3.46-3.42(m,1h),2.45–2.36(m,1h),2.35-2.22(m,1h),1.76–1.60(m,6h),1.21(s,9h).13cnmr(75mhz,cdcl3):δ208.9,151.7,149.0,148.6,136.1,133.8,132.6,130.5,129.0,128.1,128.0,127.9,127.8,121.8,121.7,88.9,80.8,73.7,40.0,29.4,28.3,27.2,23.2;
步骤三:将化合物e1(2.14g,6mmol)加入到干燥的50mlthf中,在氩气保护下,冷却至-78℃,加入4毫升hmpa,然后慢慢滴加入2m的lda的thf溶液(8ml,16mmol),搅拌30-40min,然后缓慢升温至-30℃搅拌1h,然后再冷却至-78℃并加入三甲基氯硅烷tmscl(1.73g,16mmol),缓慢升温至-50℃,搅拌3h,倒入饱和氯化铵溶液并恢复至室温,浓缩溶剂thf并加ea萃取,有机相加无水na2so4干燥,旋干溶剂并真空干燥,得到的油状物加入100ml无水的dcm溶解,冷却至-15℃,在氩气保护下,加入mcpba(1.75g,7.7mmol),搅拌1h后升温至室温,加入50mldcm再搅拌1h,然后倒入饱和硫代硫酸钠和碳酸氢钠溶液(1:1),用dcm萃取,旋干溶剂并真空干燥,得到的油状物再加入100mlthf溶解,然后冷却至-5℃,加入四丁基氟化铵(3g,11.4mmol),搅拌30min,加入饱和nahco3溶液,用ea萃取,旋干溶剂并真空干燥,过硅胶柱,得到化合物f11.34g产率60%。1hnmr(300mhz,cdcl3):δ7.95(d,j=7.8hz,1h),7.68(d,j=7.5hz,1h),7.58(t,j=7.5hz,1h),7.40(t,j=7.5hz,1h),6.44(s,1h),4.12(dd,j=11.7,6.8hz,1h),3.87(d,j=14.4hz,1h),3.38(m,1h),2.36(m,1h),1.74(m,2h),1.72–1.63(m,6h),1.30(s,9h).13cnmr(75mhz,cdcl3):208.2,153.2,131.8,131.5,128.7,128.3,79.4,72.8,66.3,60.4,40.2,28.2,27.9,19.6;
步骤四:将化合物f1(650mg,1.74mmol)溶于10ml干燥的thf,室温下通入气体hcl至饱和并搅拌4h,加入20ml干燥的乙醚,有晶体析出,过滤得到化合物t1顺式-6-羟基去甲基三氟甲胺酮t1的盐酸盐490mg,产率90%。1hnmr(400mhz,cd3od):δ8.12(d,j=8.0hz,1h),8.04(d,j=8.0hz,1h),7.97(t,j=8.0hz,1h),7.85(t,j=8.0hz,1h),4.28(dd,j1=11.6hz,j2=6.8hz,1h),3.46(dd,j1=14.4hz,j2=2.8hz,1h),2.07(m,1h),2.01–1.72(m,4h).13cnmr(100mhz,cd3od):205,133.7,131.1,130.9,128.9,128.8,127.6,73.1,67.0,60.7,44.2,38.6,38.3,29.4,28.9,18.6;
上述制备的化合物t1即为活性测试中的化合物cf3。
实施例2:活性测试方法:
1.强迫游泳实验
在强迫游泳试验(fst)前1小时将小鼠转移到实验室。测试在正常光照条件下进行,并由数码摄像机监测。在试验期间,将小鼠分别放入含有20cm水(23±1℃)的透明玻璃圆筒(高28.5cm,直径14cm)中。第一天,将小鼠训练6分钟,然后从圆筒中取出。在第二天,给小鼠施用溶剂(生理盐水)对照组,hnk,cf3,然后在1小时和7天后测试其不动时间,其中不动时间是指被动漂浮没有其他动作。在整个6分钟游泳测试的最后4分钟内,通过nodus系统的ethovisionxt(noldus,netherland)记录不动时间(castagnéetal.,2011,hajmirzaianetal.,2014,porsoltetal.,1977)。每两到三次试验后,圆筒中的水要进行更换。游泳试验后,将小鼠从水中取出并在红外灯下晾干。
2.蛋白质提取和消化
分离来自所有小鼠组的海马组织样品,在液氮中冷冻并储存在-80℃以备使用。样品在8m尿素(urea)(含有pbs(ph8.0),1x蛋白酶和磷酸酶抑制剂混合物)中悬浮,然后用sonicsvcx-150(newtown,ct,usa)超声处理。随后将匀浆物14,000g在4℃下离心30分钟以除去细胞碎片。然后将上清液收集到新的1.5ml管中。通过nanodrop2000(thermoscientific,usa)测定蛋白质浓度。根据蛋白质定量的结果,将所有样品的浓度调节至1μg/μl。汇集来自相同组的每个样品的100μg蛋白质,并获得来自每组的总共100μg蛋白质的系统。将四个合并的样品用10mmdtt在55℃下处理60分钟,然后在室温下在黑暗中用25mmiaa处理60分钟。每个合并的样品用4μg测序级修饰的胰蛋白酶在37℃消化1小时,然后用pbs(ph8.0)稀释以达到最终的1.0m尿素(urea)浓度。然后,样品继续在37℃下消化过夜。消化后,用100%fa处理肽,然后用肽脱盐旋转柱(peptidedesaltingspincolumns)(waters,mc,usa)脱盐。用真空浓缩器干燥肽,最后溶解在200mmteab中,用tmt工作溶液标记。
3.tandemmasstag(tmt)labeling(串联标记(tmt))
将每小瓶tmt用40μl99.9%乙腈(acn)再溶解以获得tmt工作溶液。然后将肽用tmt工作溶液在室温下标记1小时。不同组用不同的tmt标记:对照组用tmt-127标记,hnk组用tmt-128标记,cf3组用tmt-131标记。标记后,将来自三个组的所有肽混合,脱盐,如前所述干燥。
4.用高ph反相分离进行肽分级分离
根据高ph反相方案,按照已建立的组分对tmt标记的肽进行分离。简而言之,由于不同的肽保留行为,不同组的洗脱溶液用于tmt标记的样品。将tmt标记的肽在300μl的0.1%甲酸中分离,然后加载到反相分级分离的旋转柱中。用ph8的acn梯度缓冲溶液以8个级分洗脱加载的肽。将分离组分在高速真空浓缩器上干燥并储存在-80℃,等待lc-ms分析。
5.nanolc-ms/ms和数据库搜索
标记的分离组分在20μl0.1%fa中重构。然后,在配备有c18树脂(
6.生物信息学分析
通过各种方法和方法分析蛋白质组学结果。david版本6.7(https://david.ncifcrf.gov/)用于对差异表达蛋白质的功能类别和基因本体论(geneontology,go)注释富集分析进行分类。使用venny2.1版(http://bioinfogp.cnb.csic.es/tools/venny/index.html)对两只模型小鼠的海马蛋白质组进行逻辑分析。使用string版本10.5(https://string-db.org/)进行蛋白质-蛋白质相互作用网络分析。string生成的网络和wiki路径在cytoscape3.6.1版中可视化和编辑。
7.统计分析
所有结果表示为平均值±sem。n的数字在图例中给出。使用prism(version5.0,graphpadsoftware)和spss19.0完成数据的统计分析。所有实验均使用bonferroni'shoc测试进行参数测试(t检验,全双尾)或单因素方差分析(anova)。p<0.05的值被认为是统计学上显著的。
实施例3:实验结果
1.小鼠抑郁样行为测试结果:
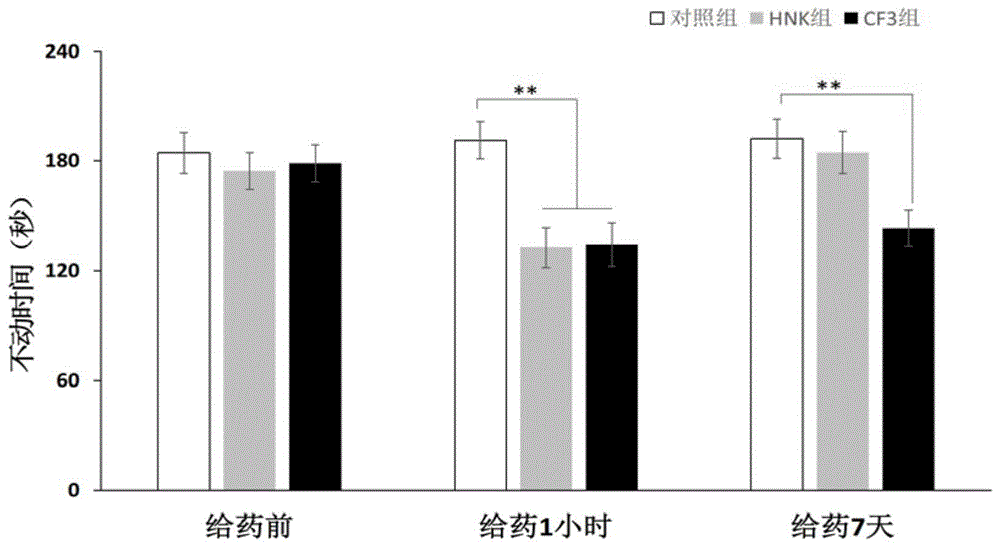
如图1所示:
通过强迫游泳测试来测量抑郁样行为。小鼠通过胃内给药接受10mghnk,cf3,并且在1小时和7天后测量不动时间。不动时间的百分比表示为:与预活性相比的平均值±sem*p<0.05,**p<0.0。每组n=8盐水:盐水小鼠;hnk:2r,6r-羟基去甲氯胺处理的小鼠;cf3,cf3处理的小鼠。
2.差异蛋白分析:
如图2所示:
a,以0.833>abundanceratio>1.2为临界点,ratio值高于1.2定义为上调蛋白,ratio值低于0.833定义为下调蛋白。与对照组相比,cf3处理组有101个差异表达蛋白,其中有39个差异表达蛋白与hnk处理组有共表达。b,与hnk处理组相比,cf3处理组有243个差异表达蛋白,其中有60个差异表达蛋白与cf3处理组有共表达。c,39个共表达的差异表达蛋白在各组间的表达丰度变化。d,60个共表达的差异表达蛋白在各组间的表达丰度变化。
3.差异蛋白生物过程和分子功能的富集分析
如图3所示:
a,与对照组相比,cf3处理组的差异表达蛋白在生物过程上的富集分析。b,与对照组相比,cf3处理组的差异表达蛋白在分子功能上的富集分析。c,与hnk处理组相比,cf3处理组的差异表达蛋白在生物过程上的富集分析。d,cf3处理组的差异表达蛋白在分子功能上的富集分析。
4.差异表达蛋白的通路富集分析
如图4所示,其中示出了:
与对照组相比,cf3处理引起的差异表达蛋白的通路富集分析;以及,与hnk处理组相比,cf3处理引起的差异表达蛋白的通路富集分析。
如上所述的结果可以看出:
1.与hnk化合物相比,cf3化合物的短期效果与hnk相当,而hnk并不具备长效效果,在1周内即失效,不再具有治疗效果。而本申请的cf3化合物在7天后仍然具有抗抑郁的效果,即其起到了长效的效果。
2.venny分析结果提示,与对照组相比,cf3处理组有101个差异表达蛋白,其中有39个差异表达蛋白与hnk处理组有共表达;与hnk处理组相比,cf3处理组共有243个差异表达蛋白,其中有60个差异表达蛋白与cf3处理组有共表达。
3.go分析结果显示,与对照组相比,cf3处理产生的差异蛋白主要富集在lensdevelopmentincamera-typeeye,camera-typeeyedevelopment,visualperception等生物过程上,以及structuralconstituentofeyelens,proteinbinding,poly(a)rnabinding等分子功能上;与hnk处理组相比,cf3处理产生的差异蛋白主要富集在transport,proteintransport,lensdevelopmentincamera-typeeye等生物过程上,以及structuralconstituentofeyelens,proteindomainspecificbinding,proteinbinding等分子功能上。4.通路分析结果提示,与对照组相比,cf3处理产生的差异表达蛋白主要富集在spliceosome和mrnasplicing上;对hnk处理组相比,cf3处理产生的差异表达蛋白主要富集在oxidativestress,wntsignalingpathway,以及long-termpotentiation上。
总之,cf3与hnk相比,具有更好的长期抗抑郁效果,cf3处理能引起小鼠海马组织多种蛋白的差异表达,其发挥作用的主要通路在于spliceosome和mrnasplicing上,而相比于hnk处理组,cf3产生的差异表达蛋白主要集中在oxidativestress,long-termpotentiation,以及线粒体相关作用上。这些结果综合说明cf3在机体中可能主要通过发挥剪接体的作用来影响oxidativestress,long-termpotentiation,以及线粒体电子传递链来发挥抗抑郁的作用的。
- 还没有人留言评论。精彩留言会获得点赞!