一种CAR-T免疫细胞治疗效果的评价方法及其装置与流程
本发明涉及一种药物器械领域,具体公开了一种car-t免疫细胞治疗效果的评价方法及其装置。
背景技术:
恶性肿瘤在全球致死率排名第2位,是仅此于心血管疾病的严重威胁人类健康和社会发展的疾病。根据国际癌症研究中心发布的数据显示,2012年全球恶性肿瘤新发病例约1409万,死亡约820万[1]。中国国家癌症中心2014年数据显示全国全国癌症新发病例约为380.4万例,发病率为278.07/10万。我国2014年癌症死亡病例约为229.6万例,死亡率为167.89/10万。中国恶性肿瘤发病例数占世界恶性肿瘤发病例数的25.49%,居世界国家第1位。因此癌症预防与治疗成为国内外研究的焦点。
肿瘤免疫治疗是近几年兴起的新型细胞治疗策略,该治疗方式通过免疫检查点抑制剂、癌症疫苗、细胞治疗、小分子抑制剂和治疗性抗体等方法重新启动并维持肿瘤-免疫循环,激活人体抗肿瘤免疫反应,从而达到控制与清除肿瘤的目的。其中嵌和抗原受体t细胞免疫疗法(chemericantigenreceptort-cellimmunotherapy,car-t)在2017年已获得美国fda批准,该治疗方案针对急性b淋巴细胞白血病cd19靶点,将病人完全缓解率从20%提高到了83%。car-t细胞治疗原理是将针对特定肿瘤的抗原的抗体与t细胞内的cd3ζ、fcεriγ相结合后在患者t细胞上表达并进行体外扩增、筛选,并大量回输入患者体内,从而清除肿瘤细胞。但是目前car-t治疗对于实体瘤的治疗效果不理想,主要由于实体瘤的异质性以及肿瘤微环境对于免疫细胞的抑制,因此开发一套模拟肿瘤微环境的car-t细胞治疗效果评价体系有利于car-t实体瘤的研究推进以及为患者筛选最有效靶点的car-t治疗方案。
肿瘤类器官(organoid)是源于肿瘤组织在体外三维(3d)培养构建出的多细胞团结构,肿瘤类器官具有自我更新和自我组织能力,在一定程度上模拟了肿瘤微环境并且维持了肿瘤组织的异质性,生理结构和功能等特点,未来将会是研究肿瘤生物学新型有力工具[2-3]。目前肿瘤类器官培养技术是病人手术或者穿刺活检得到的混合细胞包藏于细胞外基质基质胶中,然后在特定细胞因子的培养基中培养,例如含有表皮细胞生长因子、r-spondin蛋白和头蛋白足以长期维持小肠的类器官生长,而结肠来源的类器官需要添加烟酰胺、p38抑制剂sb202190、前列腺素e2和alk抑制剂a83-01等。进过一段时间培养后维持肿瘤细胞异质性等特性用于肿瘤的研究以及药物的筛选。目前已培养成功的类器官包括:肺癌,肝癌,前列腺癌,结直肠癌等[4]。
微流控技术是一项在微米尺度空间对流体进行操控的技术,以其高通量、高灵敏度、低消耗等优点备受研究者关注,是一门涉及化学、流体物理、微电子、新材料、生物学和生物医学工程的新兴交叉学科。微流控技术主要应用流体的层流和液滴现象。液滴是当两相不互溶的液体(油和水)在微流控通道中流动时,在液/液界面张力和剪切力的作用下,其中一相流体会形成高度均一的间断流,即液滴。在乳液制备的方法中,如果说基于搅拌的方法是自上而下的,那么微流控则是自下而上的方法。微流控能够以非常高的通量制备高度单分散性的液滴乳液。常见的微通道结构为t型和ψ型。在某些情况下,含有不同高分子聚合物的水相液体在微流控通道中也会形成不互溶的液滴[4]
car-t细胞治疗实体瘤一直是未能突破,主要受限于肿瘤异质性以及肿瘤特异性靶点较少。传统的car-t细胞治疗肿瘤研究模型主要是2d肿瘤细胞系模型,该模型虽然培养简单建模速度快,但由于缺乏肿瘤微环境导致肿瘤基因表达改变,不能很好的反映生理情况下肿瘤的生长,另外一种模型是pdx小鼠模型,该模型成本较高成功率低切周期较长,因此基于3d培养的肿瘤类器官能够介于2d肿瘤模型与pdx小鼠模型之间,模拟肿瘤生长环境,维持中相应特性,为肿瘤的研究和治疗提供可靠的模型。未来car-t治疗更加趋于个体化治疗,对于病人而言可选的肿瘤靶点有多种,对应可用的car-t细胞也有多种,如何筛选出最有效的car-t细胞也成为研究的热点。本专利通过微流控构建均一化的实体瘤类器官球体,用于评估不同病人对于mesothelin,cd44和rhamm三种不同靶点的car-t的治疗效果。
肿瘤个体化治疗阶段,面对越来越多靶点的car-t细胞,对其疗效的评价缺乏有力评估平台,因此本专利通过构建实体瘤类器官微流控球体,高效评估病人对于不同car-t细胞的反应性。car-t对实体瘤杀伤作用的研究缺乏高效准确的肿瘤模型,现有的肿瘤模型主要包括2d肿瘤细胞模型和pdx模型,2d细胞肿瘤细胞模型由于缺失了肿瘤组织微环境,对抗癌药物的预测准确率较低,而pdx小鼠模型周期过长,成本太高,成功率太低,且存在物种差异性而导致预测不准确,因此本专利生成的肿瘤类器官能够降低建模周期同时提高预测准确度。
参考文献:
1.torre,l.a.,etal.,globalcancerstatistics,2012.cacancerjclin,2015.
65(2):p.87-108.
2.lancasterma,knoblichja.organogenesisinadish:modelingdevelopmentanddiseaseusingorganoidtechnologies.science2014;345(6194):1247125.
3.fatehullaha,tansh,barkern.organoidsasaninvitromodelofhumandevelopmentanddisease.natcellbiol2016;18(3):246-54.
4.satot,stangede,ferrantem,etal.long-termexpansionofepithelialorganoidsfromhumancolon,adenoma,adenocarcinoma,andbarrett’sepithelium.gastroenterology.2011;141:1762-1772.
技术实现要素:
本发明一个方面提供了一种评价car-t免疫细胞治疗效果的方法,其包括以下步骤:
1)制备car-t细胞:构建car-t质粒,并包装成慢病毒;获得受试者t细胞,激活后扩增;以慢病毒感染激活后的t细胞,得到表达目的基因抗体的car-t细胞;
2)制备3d肿瘤类器官:获得与步骤1)相同受试者的肿瘤组织细胞,得到原代细胞,将原代细胞和基质胶混合,将含原代细胞的基质胶和氟油分别通入到三通装置中得到类器官球体,并进行培养;
3)将3d肿瘤类器官与步骤1)获得的car-t细胞共同培养;
4)测肿瘤类器官球体中肿瘤细胞的存活度,获得car-t细胞治疗效果。
在本发明的技术方案中,所述的car-t质粒是以肿瘤相关抗原作为靶点,所述肿瘤相关抗原选自表皮生长因子受体(egfr)、间皮素、前列腺特异膜抗原(psma)、甲胎蛋白(afp)、表皮生长因子受体变体iii(egfrviii)、癌胚抗原(cea)、人神经细胞粘附分子配体1(ncam-l1cd171)、磷脂酰肌醇蛋白聚糖3(gpc3)、双唾液酸神经节苷脂(gd2)、透明质酸结合受体(rhamm)、cd44。
在本发明的技术方案中,所述的肿瘤组织细胞为实体肿瘤细胞,所述的实体肿瘤细胞选自肺癌、卵巢癌、结肠癌、直肠癌、黑色素瘤、肾癌、膀胱癌、乳腺癌、肝癌、淋巴瘤、恶性血液病、头颈癌、胶质瘤、胃癌、鼻咽癌、喉癌、宫颈癌、子宫体瘤、骨肉瘤、骨癌、胰腺癌、皮肤癌、前列腺癌、皮肤或眼内恶性黑色素瘤、子宫癌、肛区癌、睾丸癌、输卵管癌、子宫内膜癌、阴道癌、何杰金病、非何杰金氏淋巴瘤、食道癌、小肠癌、内分泌系统癌、甲状腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌细胞。
在本发明的技术方案中,所述制备3d肿瘤类器官的方法为:将原代细胞与基质胶混合,将含原代细胞的基质胶以及氟油分别通入到三通装置两端中在2~8℃环境中,使含原代细胞的基质胶以及氟油分别匀速的从三通的第三个端口溢出,并利用剪切力形成立体的3d肿瘤类器官,将立体的3d肿瘤类器官置于37℃,含5%co2培养箱凝固。
在本发明的技术方案中,所述含细胞的基质胶的流速为1~100μl/min;优选为20μl/min;
优选地,所述氟油的流速为1~500μl/min;优选为50μl/min。
在本发明的技术方案中,基质胶中原代细胞的数量为1×104个/μ~l×105个/μl。
在本发明的技术方案中,步骤2)中3d肿瘤类器官在改良的(advanced)dmem/f12培养基中进行培养,优选地,改良的dmem/f12培养基中包含生长因子。
在本发明的技术方案中,所述的t细胞来自外周血。
在本发明的技术方案中,测肿瘤类器官球体中肿瘤细胞的存活度的方法为atp含量化学发光检测法:实验分对照组和实验组,对照组为肿瘤类器官和t细胞共培养,实验组为肿瘤类器官和car-t细胞共培养,培养3天后,加入3d细胞atp检测试剂,根据化学发光量计算细胞活力。
本发明的方法是非诊断和治疗目的的。
本发明另一个方面提供了一种car-t免疫细胞治疗评价用装置,其包括car-t细胞,以及3d肿瘤类器官,以及细胞培养基。
本发明再一个方面提供了所述car-t免疫细胞治疗评价用装置的制备方法,其包括以下步骤:
1)制备car-t细胞:构建car-t质粒,并包装成慢病毒;获得受试者t细胞,激活后扩增;以慢病毒感染激活后的t细胞,得到表达目的基因抗体的car-t细胞;
2)制备3d肿瘤类器官:获得与步骤1)相同受试者的肿瘤组织细胞,得到原代细胞,将含原代细胞的基质胶和氟油分别通入到三通装置中得到类器官球体,利用三通制作3d肿瘤类器官,并进行培养。
本发明再一个方面提供了所述car-t免疫细胞治疗评价用装置在检测car-t细胞治疗效果中的应用。
有益效果
1.相较于传统的类器官3d培养技术,本发明可利用微流控高通量生成单分散生物材料球体(或长条/柱状)。
2.本发明类器官的大小、形状和结构可控且均一
3.相比于2d肿瘤敏感性预测模型,本发明结合了肿瘤微环境因素预测结果更准确。
4.相比于pdx小鼠肿瘤敏感性预测模型,本发明建模周期更短,费用更低。
5.相比于基因测序,本发明临床预测率更高。
附图说明
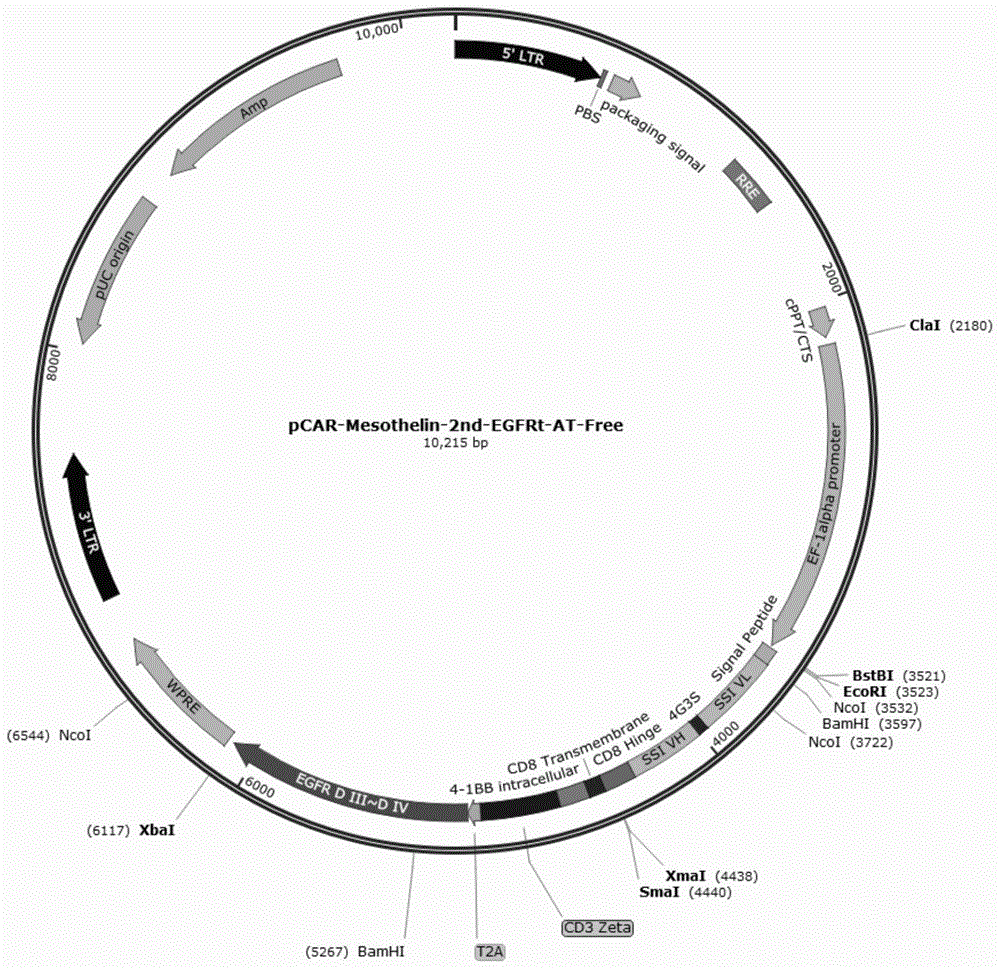
图1为以mesothelin为靶点的二代car-t质粒图谱。
图2为显微镜观察实体瘤类器官球体。
具体实施方式
实施例1
1.分离人外周血淋巴细胞:抽取病人新鲜外周血50ml,加入至30mlficoll淋巴细胞分离液中,800g离心20分钟,取白膜层细胞用d-pbs(-)50ml混匀,500g离心10分钟,加入25ml5%人血白蛋白重悬细胞,并且过70μm筛网,细胞计数。
2.筛选cd4/cd8阳性t细胞:每20μlcd4/cd8磁珠加入107细胞,4度孵育15min,然后加入2ml分选缓冲液,250g,4度,离心10分钟,加入5ml分选缓冲液重悬细胞,利用磁力架和ls分离柱分离cd4/cd8细胞,加入aim-v培养基重悬细胞,2×105~1×106u/lifn-γ因子。
3.t细胞激活:将1×103ug/l~1×104ug/lcd3单克隆抗体和1×103ug/l~1×104ug/lcd28单克隆抗体加入24孔板,封口膜封口,4℃过夜包被,将分选得到的细胞悬液接种到24孔板中,混匀,放入37℃、5%co2培养箱中培养。
4.car基因转导及car-t细胞诱导培养:按照moi=5~50的量加入包装好的病毒感染t细胞,24h后更换培养基继续培养,利用egfr荧光抗体标记细胞后分选成功的car-t细胞,体外扩增备用。
5.肿瘤类器官构建:利用原代细胞提取办法提取手术来源或穿刺活检得到的肿瘤原代细胞,细胞计数;在4℃环境中将2.0×106个细胞与100μl基质胶充分混匀,注入1ml注射器中,另外一个注射器注入氟油,分别将氟油和胶分别置于两个注射泵中并放入4℃冰箱。注射器分别连接直径为800μm的聚四氟乙烯(ptfe)管,两管汇合至聚二甲基硅氧烷(pmds)三通中,然后三通连接另外一根直径800μm的ptfe管。整个平台置于4℃冰箱中,含胶注射泵流速20μl/min,含氟油注射泵流速50μl/min,生成均匀的含肿瘤类器官球体,将生成的球体置于37℃,含5%co2培养箱凝固。利用改良型dmem/f12培养基加入100ng/mlnoggin培养肿瘤类器官球体7天。
6.car-t治疗效果评估:96孔板中每孔加入一个肿瘤类器官球体,3×103个car-t细胞,对照组加入cd4/cd8t细胞,经过三天共培养后,利用cck8细胞活力检测试剂盒检测细胞存活情况,评估car-t细胞治疗效果。直接得到car-t杀伤肿瘤细胞的百分数,如杀伤率30%,具体是否有效由使用者判断。
实施例2
1.利用原代细胞提取办法提取原代细胞,细胞计数;
2.在4℃环境中将2.0×106个细胞与100μl基质胶充分混匀,注入1ml注射器中,另外一个注射器注入氟油,分别将氟油和胶分别置于两个注射泵中并放入4℃冰箱
3.注射器分别连接直径为800μm的聚四氟乙烯(ptfe)管,两管汇合至聚二甲基硅氧烷(pmds)三通中,然后三通连接另外一根直径800μm的ptfe管。整个平台置于4℃冰箱中。
4.含胶注射泵流速20μl/min,含氟油注射泵流速50μl/min,生成均匀的含肿瘤类器官球体,将生成的球体置于37℃,含5%co2培养箱凝固。
5.凝固后的球体转移至含生长因子noggin、fgf-basic、fgf-4的改良型dmem/f12培养基中培养。
图2为术后切除的肝癌组织,提取肝癌细胞后按照上述方法实验得到的结果,第1天到第7天细胞的形态特征。
- 还没有人留言评论。精彩留言会获得点赞!