LED可见光诱导释放一氧化氮的荧光化合物及其制备与应用的制作方法
(一)技术领域
本发明涉及一种可led可见光诱导释放一氧化氮的荧光化合物,及其制备方法与应用。
(二)
背景技术:
一氧化氮(no)被认为是一种重要的气体信号分子,在多种生理和病理过程中起着重要作用,参与血管生成,血流和血管功能的调节。近年来no不仅被发现了它在各种生物功能中的重要作用,而且具备潜在的抗癌活性,肿瘤中的no水平及其微环境可直接影响癌细胞的反应过量的no(高于数百纳摩尔)可以通过凋亡机制破坏dna或线粒体,抑制关键代谢途径,阻断生长或完全杀死癌细胞。no也可以对感染性微生物发挥局部细胞毒作用;还能作为自由基消除剂减少自由基介导的氧化过程。所以,构建快速精准的时空控制,同时具有荧光响应功能和癌细胞毒性的一氧化碳释放分子具有重要应用价值。
迄今为止已经开发了几类具有不同释放机制和动力学的一氧化氮释放分子,但难以进行实时监测和释放浓度的控制,部分存在重金属毒性。相比之下,光诱导开/关触发的一氧化氮释放分子则具有相对温和的优点,目前存在的光诱导释放的荧光分子使用紫外光源、脉冲光源和卤素灯光源诱导,存在光毒性大,成本高昂,使用不便的缺陷。
(三)
技术实现要素:
本发明目的是提供一种led可见光诱导释放一氧化氮的荧光化合物,及其制备方法与应用。
本发明采用的技术方案是:
一种led可见光诱导释放一氧化氮的荧光化合物,其结构如式(i)所示:
本发明化合物(i)和类似作用的化合物相比,首次使用led黄光光源诱导一氧化氮释放的荧光分子,荧光响应明显,光毒性小且光稳定性高,具备长时间光照释放一氧化氮的性能,可应用于抑制细胞增殖,同时满足一氧化氮释放的监测和生物细胞成像的要求。
本发明还涉及制备所述荧光化合物的方法,所述方法包括:在0℃冰浴和氮气保护条件下,在加入nah的无水四氢呋喃溶液中,加入无水四氢呋喃溶解的式(ii)所示化合物,低温持续反应1~2个小时,加入无水四氢呋喃溶解的式(iii)所示化合物,在室温条件下继续反应5~6个小时,反应结束后分离纯化得到式(i)所示化合物;
优选的,所述化合物(ii)、化合物(iii)和nah物质的量之比为1:0.7:3。所述无水四氢呋喃体积用量以式(ii)所示化合物物质的量计为20ml/mmol。
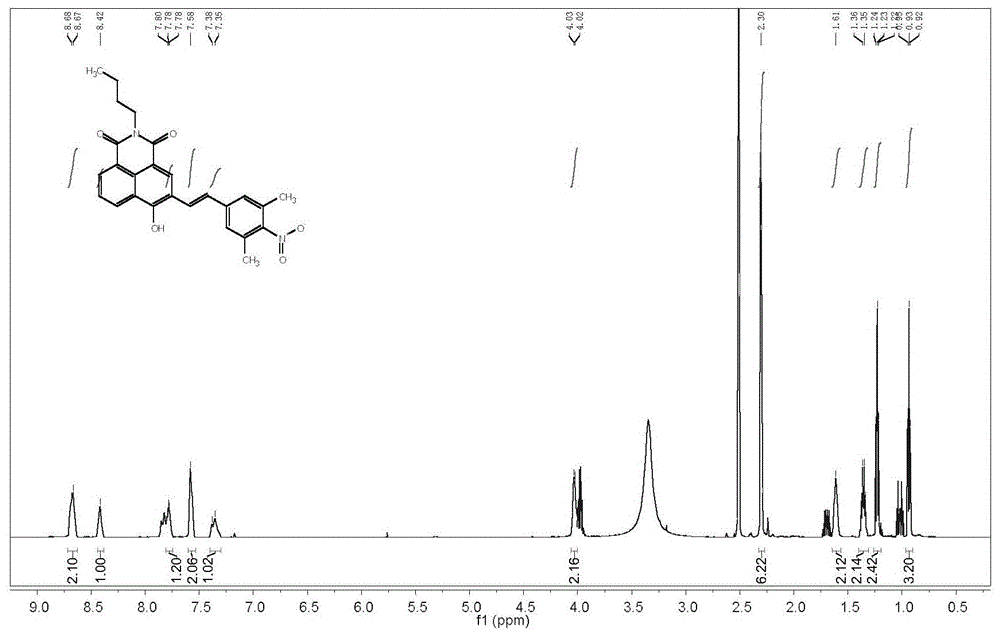
具体的,所述分离纯化方法如下:反应液减压旋蒸去除溶剂,取浓缩物进行硅胶柱分离,以二氯甲烷:甲醇体积比20:1的混合液为洗脱剂,收集目标组分,干燥,获得所述式(i)荧光化合物(核磁氢谱图见图1a,质谱图见图1b)。
本发明所述式(ii)为公开的化合物,其制备方法可参考文献:[t.suzuki,o.nagae,y.kato,h.nakagawa,k.fukuhara,andn.miyata,photoinducednitricoxidereleasefromnitrobenzenederivatives,j.am.chem.soc.,127(2005)1720-11726.]
本发明所述式(iii)为公开的化合物,其制备方法可参考文献:[h.park,s.-k.chang,signalingofwatercontentinorganicsolventsbysolvatochromismofahydroxynaphthalimide-basedmerocyaninedye,dyespigm,122(2015)324-330.]
本发明还涉及所述的荧光化合物在制备荧光探针中的应用。
具体的,所述荧光探针用于光诱导监测释放一氧化氮。
所述式(i)一氧化氮释放荧光化合物的合成路径如下:
本发明同时制备了其它两种新的一氧化氮释放荧光分子:
检测实验证明,化合物(a)(质谱图见图3a)和化合物(b)(质谱图见图3b)中的邻三氟甲基硝基苯光释放基团,不能在led可见光光源下有效释放一氧化氮。化合物(a)的cy-7母体因庞大的共轭结构,容易在光照条件下裂解,不具备应用能力;化合物(b)的内萘酰亚胺母体满足长时间光照的要求,能够在紫外光照条件下有效释放一氧化氮,但其基于光诱导电子转移的荧光淬灭和光诱导turn-on效果不明显。相对的,荧光化合物(i)则以光稳定性好的内萘酰亚胺为母体,共轭连接邻二甲基硝基苯,产生了很好的荧光淬灭和光诱导释放一氧化氮后的荧光turn-on性能。
本发明中,化合物(i)的2,6-二甲基硝基苯结构作为一氧化氮供体,由于硝基邻位甲基造成大的空间位阻,硝基不稳定地垂直于苯环平面。在18w黄色led灯源照射条件下,萘酰亚胺荧光母体吸收照射光能并传递到供体,容易释放no分子,2,6-二甲基硝基苯结构转化为2,6-二甲基硝基苯酚结构(高效液相色谱图见图2a,质谱图见图2b)。此时由于分子内电荷转移效应,荧光化合物(i)发生荧光turn-on。
本发明一氧化氮释放荧光化合物i的荧光检测的方法如下:光照射化合物(i)的溶液,光照条件为18w黄色led灯源,灯距为20厘米。在光照射后使用酶标仪检测荧光响应,荧光激发波长设置为410nm,最大荧光发射波长为520nm,获得化合物i的光照时间荧光光谱和浓度梯度荧光光谱。
具体的,所述荧光探针可用于荧光共聚焦细胞成像。具体方法可如下:以化合物(i)作为荧光探针,与hela细胞在培养液中共孵育30分钟,led可见光源照射后,在共聚焦显微镜下进行荧光成像。
本发明还涉及所述的荧光化合物在制备抑制癌细胞增殖的药物中的应用。化合物(i)和癌细胞共孵育1小时,所述灯源照射一定时间后继续培养12小时,mtt法测定细胞存活率,发现其对癌细胞有明显的抑制作用。
优选的,所述癌细胞为hela细胞。
本发明的有益效果主要体现在:本发明化合物(i)在led黄光诱导下,能充足释放一氧化氮,达到了类似化合物以紫外诱导释放的一氧化氮浓度;同时在pbs溶液中,led黄光诱导的荧光响应高于常见紫外(365nm/8w)诱导的荧光响应,这更好的应用于细胞生物成像;本发明采用led黄色光源(18w)作为一氧化氮释放的触发光源,双光子染料作为化合物荧光母体,在应用时的光毒性大大减弱,生物和细胞损害减小;由于包含内萘酰亚胺的共轭结构有良好的光稳定性和热稳定性,化合物(i)能够在生物体中长时间进行光照射,并长时间地持续释放一氧化氮,可应用于抑制癌细胞增殖。
(四)附图说明
图1a为本发明中化合物(i)的核磁氢谱图。
图1b为本发明中化合物(i)质谱图。
图2a为本发明中化合物(i)溶液光照后的高效液相色谱图。
图2b为本发明中化合物(i)光照产物的质谱图。
图3a为本发明中化合物(a)的质谱图。
图3b为本发明中化合物(b)的质谱图。
图4为本发明中化合物(i)在1%二甲亚砜的pbs溶液中,浓度为50μm时,用18w黄色led灯源照射,荧光强度随光照时间的变化图,激发波长为410nm,发射波长为520nm。
图5为本发明中化合物(i)在1%二甲亚砜的pbs溶液中,所述灯源照射30分钟,荧光强度随其浓度的变化图,激发波长为410nm,发射波长为520nm。
图6为本发明中化合物(i)在1%二甲亚砜的pbs溶液中,浓度为100μm时,不同光源照射2小时后荧光强度的变化,激发波长为410nm,发射波长为520nm。
图7a为本发明中化合物(i)在1%二甲亚砜的pbs溶液中,浓度为50μm时,18w黄色led灯源光照不同时长后溶液内的一氧化氮释放浓度;图7b为标准曲线。
图8a为本发明中探针(i)在1%二甲亚砜的pbs溶液中,化合物(i)浓度为2μm、5μm、10μm、50μm、100μm时,所述灯源光照1小时内溶液里的一氧化氮释放浓度;图8b为标准曲线。
图9为18w黄色led灯源照射培养液里的hela细胞10分钟、30分钟、60分钟,继续培养12小时后的细胞存活率。
图10为2μm、5μm、10μm、50μm、100μm浓度的化合物(i),在hela细胞培养液中分别避光和光照30分钟,继续培养12小时后的细胞存活率。
图11为本发明中化合物(i)在hela细胞中所述灯源光照射不同时间的荧光共聚焦成像图。1)、2)、3)光照射时间为0分钟,4)、5)、6)光照射时间为30分钟,7)、8)、9)光照射时间为60分钟。
(五)具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
实施例1:化合物(i)的合成
在50ml的圆底烧瓶中,在0℃和氮气保护条件下,100mg化合物6(0.33mmol)溶于1ml无水四氢呋喃,加入40mg溶在3ml无水四氢呋喃溶液的nah(含量60%,1.00mmolnah),搅拌1.5小时。再将70mg化合物8(0.23mmol)溶于3ml无水四氢呋喃并加入反应液,反应在常温下进行6小时。tlc点板反应完全,混合液减压旋蒸去除溶剂,取浓缩物进行硅胶柱分离(二氯甲烷:甲醇=20:1,v/v),得到红色固体63.5mg,产率62%。核磁氢谱见图1a,质谱图见图1b。
1hnmr(600mhz,dmso)δ8.67(d,j=7.7hz,2h),8.42(s,1h),7.81–7.75(m,1h),7.58(s,2h),7.37(d,j=16.4hz,1h),4.03(d,j=6.0hz,2h),2.30(s,6h),1.61(s,2h),1.35(dd,j=14.7,7.4hz,2h),1.23(t,j=7.0hz,2h),0.93(t,j=7.4hz,3h).c26h24n2o5[m-h]444.17,found443.48.
实施例2:
化合物(i)准确称取4.45mg的化合物(i),用二甲基亚砜配制成浓度为10mm的探针母液,移液枪吸取5μl加入到995μlpbs溶液(ph7.2,50mmol/l)中,化合物(i)浓度为50μm,分别用18w黄色led光照射3分钟、10分钟、30分钟、1小时、1.5小时、2小时,在37℃下测定其荧光值,激发波长为410nm,发射波长为520nm,荧光谱图见图4。光照产物的高效液相图见图2a,质谱图见图2b。c26h25no4[m-h]414.18,found414.35.
实验证明,在pbs溶液中,发射波长为520nm的条件下,光照使化合物(i)荧光turn-on,随光照时间增长荧光强度增高,2小时后荧光增强60倍。lc-ms谱图同时证明了溶液中光照产物化合物ii的生成,证明了所述机理的正确性。
实施例3:
移液枪吸取10μl的化合物(i)母液(10mm)加入到990μlpbs溶液(ph7.2,50mmol/l)中,化合物(i)浓度为100μm,依次稀释为不同浓度(0μm、1μm、5μm、10μm、20μm、50μm),18w黄色led光照射30分钟,37℃、410nm激发下测定其荧光值。发射波长为520nm,荧光谱图见图5。
实验证明,在pbs溶液中,发射波长为520nm的条件下,荧光化合物(i)在光照射30分钟后,荧光强度随着化合物(i)浓度提高逐渐增强,表现出一定的线性关系。
实施例4:
移液枪吸取10μl的化合物(i)母液(10mm)加入到990μlpbs溶液(ph7.2,50mmol/l)中,探针浓度为100μm。分别在18w黄色led灯源、紫外365nm灯源(8w)、自然光条件下照射2小时,避光条件为对照,37℃下测定其荧光值,激发波长为410nm,发射波长为520nm,荧光谱图见图6。
实验证明,在pbs溶液中,化合物(i)对18w的led黄色灯源照射有很好的荧光响应,优于常见的紫外灯源。
实施例5:
配制0到100μm的梯度nano2溶液,加入griess试剂后测得540nm处吸收值,得到no浓度标准曲线(图7b)。移液枪吸取5μl的化合物(i)母液(10mm)加入到995μlpbs溶液(ph7.2,50mmol/l)中,化合物(i)浓度为50μm。设置4组平行,用18w黄色led灯照射10分钟、20分钟、30分钟、40分钟,每个样取50μl加入96孔板。每孔再加入griessⅰ、ⅱ液各50μl,孵育10分钟后用酶标仪测定540nm处吸收值,根据标准曲线得到no释放浓度(见图7a)。
实验证明,化合物(i)在18w黄色led灯光下能够有效释放一氧化氮,释放浓度随光照时间增高,释放持续时间在1小时以上。
实施例6:
配制0到100μm的梯度nano2溶液,加入griess试剂后测得540nm处吸收值,得到no浓度标准曲线(图8b)。移液枪吸取10μl的化合物(i)母液(10mm)加入到990μlpbs溶液(ph7.2,50mmol/l)中。依次稀释为不同浓度(0μm、1μm、5μm、10μm、20μm、50μm),设置4组平行。在18w黄色led灯光照1小时后,每个样取50μl加入透明96孔板。每孔再加入griessⅰ、ⅱ液各50μl,孵育10分钟后用酶标仪测定540nm处吸收值,根据标准曲线得到no释放浓度(见图8a)。
实验证明,不同浓度的探针(i)在18w黄色led灯光下能够有效释放一氧化氮,释放浓度随探针浓度增高,100μm化合物(i)一氧化氮释放浓度可达10μm。
实施例7:
将hela细胞在透明96孔板中,37℃、5%co2条件下进行恒温培养,贴满孔板后,在18w黄色led灯源条件下分别照射10分钟、30分钟、60分钟,以避光培养的细胞为对照,所有样设置5组平行。继续恒温培养12小时,吸出培养液并加入新鲜的培养液,再加入mtt的pbs溶液10μl(5mg/ml),继续培养4小时后终止培养,吸出培养液后,每孔加入150μldmso,酶标仪检测490nm处吸收值,以避光培养的od值为1,并计算细胞存活率。(见图9)。
实验证明,本发明所使用led可见光源,光毒性小,照射60分钟对细胞生长的正常增殖影响不超过正常培养细胞总数的10%。
实施例8:
hela细胞在透明96孔板中,37℃、5%co2条件下进行恒温培养,贴满孔板后,加入1μl不同浓度的化合物i到培养液中,使终浓度为0μm、10μm、30μm、50μm。37℃、5%co2条件下进行恒温培养,孵育1小时后,在18w黄色led灯源条件下照射30min,以加入了同等浓度化合物(i)避光培养的细胞为对照,所有浓度设置5组平行。继续培养12小时,吸出培养液并加入新鲜的培养液,再加入mtt的pbs溶液10μl(5mg/ml),继续培养4小时后终止培养,吸出培养液后,每孔加入150μldmso,酶标仪检测490nm处吸收值,以未加化合物(i)避光培养的od值为1,并计算细胞存活率。(见图10)。
实验证明,光照之后化合物(i)释放了超过抑制浓度的一氧化氮,在和细胞的共培养中,化合物(i)浓度为50μm时,平均抑制率达到了49.1%。
实施例9:
hela细胞以接近3ⅹ105个细胞分别接种培养在3个共聚焦盘中,由dmem培养液在37℃、5%co2条件下进行恒温培养,培养24小时后,移除dmem培养液,pbs7.2缓冲液洗涤3次,1μl化合物(i)的dmso溶液加入到999μl新鲜dmem培养基中,终浓度为25μm。混合均匀后加入共聚焦盘中细胞中,37℃下孵育15分钟。分别用黄色led光源照射0分钟、30分钟、60分钟。继续恒温培养2小时,移除dmem培养液,pbs7.2缓冲液洗涤3次,用荧光共聚焦显微镜进行荧光成像,发射波长为520nm。(见图11)。1)、2)、3)为避光培养;4)、5)、6)为光照30分钟后培养;7)、8)、9)为光照60分钟后培养。其中1)、4)、7)为明场图像;2)、5)、8)为荧光成像;3)、6)、9)为重叠图像。
实验证明,随着光照时间增长,细胞中的荧光信号逐渐增强,和避光培养的细胞相比,部分细胞形态发生变化。说明化合物(i)具备细胞内荧光成像的功能,并且释放的一氧化氮对癌细胞生长有破坏作用。
- 还没有人留言评论。精彩留言会获得点赞!