一种用于蓝舌病病毒8型检测的试剂、检测方法及应用与流程
本申请涉及蓝舌病病毒8型检测领域,特别是涉及一种用于蓝舌病病毒8型检测的试剂、检测方法及应用。
背景技术:
蓝舌病(Bluetongue,BT)是一种传染性、非接触性、通过库蠓等虫媒传播的病毒性疾病,该病的病原为蓝舌病病毒(Bluetongue virus,BTV),属于呼肠弧病毒科环状病毒属。BT主要影响野生和家养的绵羊、山羊、牛、水牛、鹿、大多数非洲羚羊等反刍动物。染疫动物的平均病死率为30%,其中绵羊的病死率可高达80%。BT严重影响着许多国家的畜牧业和国际贸易的发展,世界卫生组织将其列为须呈报的动物疫病,中国将其列为一类动物疫病。BTV血清型众多,目前OIE已确认有26个血清型,不同血清型病毒之间缺乏交叉免疫保护,给疫病的防控带来了极大挑战。2006年,蓝舌病病毒8型(BTV-8)在荷兰首次被发现,除了绵羊和山羊,牛感染BTV-8后也引起了严重的疾病,BTV-8随后在欧洲出现大规模流行,造成了严重的经济损失,目前暂未见BTV-8在中国的报道。中国主要流行12种血清型蓝舌病病毒,包括BTV-1、BTV-2、BTV-3、BTV-4、BTV-5、BTV-7、BTV-9、BTV-12、BTV-15、BTV-16、BTV-21和BTV-24。
BTV基因组由十个双链RNA(dsRNA)片段组成,它们编码11种不同的病毒蛋白,包括7种结构蛋白(VP1-VP7)和4种非结构蛋白(NS1-NS4)。BTV颗粒由三个蛋白质层组成,外衣壳层包含VP2和VP5两种蛋白,其中基因组片段2(Seg-2)编码的VP2是主要的中和抗原和血清型特异性的主要决定因素;去除外层VP2/VP5后留下双层二十面体核心粒子,该双层核心粒子外层完全由VP7壳粒组成,完整的内衣壳(亚核层),包围10个双链RNA基因组区段和次要结构蛋白。不同血清型的基因组片段2(segment 2)长度不同,约3000bp左右,该片段编码外壳蛋白VP2,该蛋白氨基酸序列差异从22.4%到73%不等,表明VP2基因序列可用于血清型的鉴定。
传统的蓝舌病病毒鉴定需要在鸡胚、库蠓细胞、敏感反刍动物的组织培养或接种中分离和扩增病毒,然后进行血清组和血清型特异性试验。然而,上述方法成本高、耗时长,并且需要获得参考病毒或抗血清。近年来实时荧光PCR在动物疫病诊断检测方面应用广泛,与传统血清学方法相比,该方法快速、可靠,已成为许多实验室的标准诊断检测方法。目前已经有部分关于BTV种或血清组特异性PCR检测的相关研究和报道;但是,这些检测都需要借助特殊的仪器设备,并且检测流程相对复杂,难以适用于现场检测。BTV-8是一种外来病,虽然中国暂未见发现该病的报道,但随着中国进口动物及动物产品贸易量的不断增长,BTV-8存在传入中国的风险,一旦传入将会给我国的养殖业造成巨大影响,因此亟需建立一种能够更好的适用于现场快速检测的BTV-8检测方法,以防止BTV-8传入或扩散。
技术实现要素:
本申请的目的是提供一种用于蓝舌病病毒8型检测的试剂、检测方法及应用。
本申请采用了以下技术方案:
本申请的一方面公开了一种用于蓝舌病病毒8型检测的试剂,该试剂包括用于一步法逆转录重组酶聚合酶扩增的蓝舌病病毒8型特异性引物对和探针,探针在引物对的扩增靶标区域内,引物对的上游引物为Seq ID No.1所示序列,下游引物为Seq ID No.2所示序列,探针为Seq ID No.3所示序列;
Seq ID No.1:5’-GAGGTTGTGATTGGAACGGCTCACACCGACGATCC-3’
Seq ID No.2:5’-GTCGTACATCATAGTATCTTGCTAGACAATATCGC-3’
Seq ID No.3:
5’-CTGTAGGGCGCAGCGCGAAGGCGTTCACACATGATCCTTTTGACCTGCA-3’
其中,SEQ ID No.3所示的探针序列中,第32个碱基修饰荧光淬灭基团-dT,第33个碱基替换为碱基类似物,第35个碱基修饰荧光基团-dT,3’末端修饰C3Spacer。
需要说明的是,本申请的试剂中,引物对和探针是针对蓝舌病病毒8型设计的,是特别用于一步法逆转录重组酶聚合酶扩增的引物和探针。一步法逆转录重组酶聚合酶扩增,缩写RT-RPA,是在重组酶聚合酶扩增反应体系的基础上添加逆转录酶,使其可以直接对RNA模板进行一步法快速扩增。重组酶聚合酶扩增,缩写RPA,是英国TwistDx公司开发的一种新型的核酸等温扩增技术;该技术的关键之一是设计合适的扩增引物对和探针。但是,常规PCR引物对和探针并不适合RPA;常规PCR的引物相对太短、重组效率低;常规的探针系统,与RPA也不兼容。因此,无法通过常规的引物或探针设计软件直接输出适用于RPA的引物对和探针。目前设计RPA引物对和探针,主要根据TwistDx公司网站上提供的筛选指南,人工设计多条特异性引物和探针进行试验筛选,以获得扩增效率高、灵敏度高、特异性强的引物和探针。本申请的一种实现方式中,分别设计了2条RPA探针,并针对每条探针分别设计了3-4条上游引物和3-4条下游引物,用于试验筛选,最终筛选出Seq ID No.1所示序列和Seq ID No.2所示序列的引物对,以及SEQ ID No.3所示序列的探针,作为本申请的蓝舌病病毒8型检测试剂。
还需要说明的是,RPA的原理是采用三个酶,在恒温下使一对引物对靶标进行指数扩增;本申请的试剂中,考虑到通过荧光检测的方式对RPA扩增产物进行检测,因此,在一对特异性引物的基础上提供了相应的特异性探针。可以理解,RPA扩增产物也可以采用其它方式,例如侧流层析试纸条、生物芯片、凝胶电泳等进行检测;因此,如果不采用荧光检测,则可以不使用SEQ ID No.3所示序列的探针。也就是说,本申请的试剂中,可以单独使用Seq ID No.1和Seq ID No.2所示序列的引物,也可以与探针一起使用,具体使用方式可以根据检测条件和环境选择。本申请的一种实现方式中,由于采用便携式的常温等温扩增荧光检测仪,优选的将引物和探针一起使用,通过荧光法对RPA扩增产物进行检测。
优选的,荧光淬灭基团-dT为BHQ1-dT。
优选的,碱基类似物为dSpacer。
优选的,荧光基团-dT为6-FAM-dT。
需要说明的是,根据探针的设计原则,只需要在碱基类似物的两端分别修饰荧光基团和荧光淬灭基团即可,本申请的优选方案中,优选的使用FAM荧光基团和BHQ1荧光淬灭基团。可以理解,荧光基团的选择是根据所使用的荧光检测仪的荧光通道进行的,不同的荧光检测仪具有检测一种或多种荧光基团的通道,例如FAM、TET、JOE、HEX、CY3、CY5等;而荧光淬灭基团则是根据荧光基团进行选择的,荧光淬灭基团的吸收光谱只要能够覆盖荧光基团的发射光谱即可,不只限于BHQ1。
本申请的另一面公开了本申请的用于蓝舌病病毒8型检测的试剂在蓝舌病病毒8型非诊断治疗目的的检测中的应用。
可以理解,本申请的蓝舌病病毒8型的检测试剂和方法,虽然可以为蓝舌病病毒8型的诊断或治疗提供参考依据;但是,本申请的目的并非通过本申请的试剂或方法对蓝舌病病毒8型进行诊断,本申请的目的是采用本申请的试剂或方法对相关的动物产品或动物源产品进行检测,以避免其携带蓝舌病病毒8型,造成蓝舌病病毒8型的传播或扩散。另外,本申请的试剂和方法也可以应用于蓝舌病病毒8型的基础研究。
本申请的另一面公开了本申请的用于蓝舌病病毒8型检测的试剂在制备蓝舌病病毒8型检测试剂盒、检测试纸条或检测芯片中的应用。
可以理解,本申请用于蓝舌病病毒8型检测的试剂还可以采用侧流层析试纸条、生物芯片等进行检测;因此,本申请的试剂可以用于制备特异性的用于蓝舌病病毒8型检测的检测试纸条或检测芯片。
本申请的再一面公开了一种用于蓝舌病病毒8型检测的试剂盒,该试剂盒中含有本申请的用于蓝舌病病毒8型检测的试剂。
优选的,本申请的用于蓝舌病病毒8型检测的试剂盒中还含有用于一步法逆转录重组酶聚合酶扩增的反应液、酶和反应添加剂。
需要说明的是,本申请的试剂盒,是特别针对蓝舌病病毒8型的重组酶聚合酶扩增检测设计的,因此,为了使用方便,试剂盒中完全可以进一步的包括用于一步法逆转录重组酶聚合酶扩增的反应液、酶和反应添加剂。其中,反应液在本申请的一种实现方式中为Rehydration Buffer,酶可以是混合有多种酶的RPA冻干酶粉,反应添加剂在本申请的一种实现方式中采用的是MgAc;另外,考虑到一步法逆转录的实现,本申请的一种实现方式中还包括了反转录酶MMLV Reverse Transcriptase和RNA酶抑制剂Recombinant RNase Inhibitor。
本申请的再一面公开了一种蓝舌病病毒8型的非诊断治疗目的的检测方法,包括采用本申请的用于蓝舌病病毒8型检测的试剂,或本申请的用于蓝舌病病毒8型检测的试剂盒,对待测样品的核酸进行一步法逆转录重组酶聚合酶扩增检测,并采用荧光检测仪收集荧光。
需要说明的是,本申请的检测方法,通过一步法逆转录重组酶聚合酶扩增对蓝舌病病毒8型进行快速检测,一方面,一步法逆转录重组酶聚合酶扩增检测速度快,只需要十几二十分钟就可以完成检测;另一方面,整个检测只需要在相对较低的恒温下就可以完成,例如采用便携式的常温等温扩增荧光检测仪即可。因此,本申请检测方法特别适合于蓝舌病病毒8型的现场快速检测,为疫病的快速检测和防控提供有力的科学依据。
优选的,一步法逆转录重组酶聚合酶扩增的反应条件为,40℃恒温反应15分钟。
需要说明的是,RPA所采用的酶的活性最适合温度范围为37℃-42℃,RPA通常二十分钟内就可以完成检测;本申请优选的方案中,引物探针扩增效率较高,优选在40℃恒温反应15分钟。
本申请的有益效果在于:
本申请用于蓝舌病病毒8型检测的试剂,能够通过一步法逆转录重组酶聚合酶扩增,对蓝舌病病毒8型进行敏感、特异、高效的检测。采用本申请的试剂可以方便的对蓝舌病病毒8型进行现场检测,并且可以快速的获得检测结果;这对于蓝舌病病毒8型的快速防控,防止疫情传播,最大限度的保障生产安全具有重大意义。
附图说明
图1和图2是本申请实施例中蓝舌病病毒8型RT-RPA特异性检测结果;
图3是本申请实施例中蓝舌病病毒8型RT-RPA灵敏度检测结果;
图4是本申请实施例中采用Bernd H文献中实时荧光RT-PCR法进行蓝舌病病毒8型灵敏度检测的结果;
图5是本申请实施例中蓝舌病病毒8型RT-RPA重复性检测结果。
具体实施方式
近年来,多种恒温核酸扩增技术的出现解决了传统PCR技术成本高、耗时长、依赖精密温度循环仪器等局限。其中,重组酶聚合酶扩增技术(Recombinase PolymeraseAmplification,RPA)是一种新型的等温核酸扩增技术,被视为“最可能替代传统PCR”的恒温扩增技术。RPA技术主要依赖三种酶:单链DNA结合蛋白(Single-stranded DNABingding,SSB)、重组酶、链置换DNA聚合酶。该技术原理是在恒温下,重组酶与引物结合形成复合体,酶促使引物定位到DNA双链模板的同源靶序列上,并在单链DNA结合蛋白的协助下,解链模板DNA,随后在DNA聚合酶的作用下,形成新的DNA互补链,循环进行从而实现DNA的指数增长,反应体系中增加反转录酶则可以对RNA模板进行一步法快速扩增,即本申请采用的一步法逆转录重组酶聚合酶扩增。RPA最佳反应温度范围是37℃至42℃,反应时间少于二十分钟。结合荧光探针使用的实时RPA检测技术,可在便携式恒温扩增荧光检测仪中实现检测结果的直接读取,极大简化了反应程序,检测时间和便利性优于传统PCR法,非常适用于设备简配的基层或现场实验室,在动物疫病检测方面具有广泛的应用前景,因此,本申请研发了用于蓝舌病病毒8型快速检测的试剂。该试剂包括用于一步法逆转录重组酶聚合酶扩增的蓝舌病病毒8型特异性引物对和探针,探针在引物对的扩增靶标区域内,引物对的上游引物为Seq ID No.1所示序列,下游引物为Seq ID No.2所示序列,探针为Seq ID No.3所示序列或者Seq ID No.3所示序列的反向互补序列;其中,SEQ ID No.3所示的探针序列中,第32个碱基修饰荧光淬灭基团-dT,第33个碱基替换为碱基类似物,第35个碱基修饰荧光基团-dT,3’末端修饰C3 Spacer。
本申请的蓝舌病病毒8型检测试剂,在本申请的一种实现方式中,其灵敏度可以达到7×101copies/μL,可用于对蓝舌病病毒8型的现场快速检测,防止疫情传入,从而更有效的保障养殖生产安全。
下面通过具体实施例对本申请作进一步详细说明。以下实施例仅对本申请进行进一步说明,不应理解为对本申请的限制。
实施例
一、材料与方法
1.试验用质粒及核酸样品
本例根据NCBI GenBank中公布的蓝舌病病毒8型VP2基因序列,送生工生物工程(上海)股份有限公司合成该基因片段并克隆到pUC载体中,命名为BTV8-VP2。本例所用灭活抗原核酸包括二十四种蓝舌病病毒核酸、鹿流行性出血热病毒核酸、牛病毒性腹泻病毒核酸和口蹄疫病毒核酸。其中,二十四种蓝舌病病毒核酸即BTV-1至BTV-24。
2.主要的试剂和仪器
TwistAmp exo kit(TwistDx),MMLV Reverse Transcriptase(Takara),Recombinant RNase Inhibitor(Takara),恒温扩增仪(Axxin),5415R型高速离心机(Eppendorf),7500 Fast荧光PCR仪(ABI),超微量核酸蛋白浓度分析仪(BioDrop)等。
3.RT-RPA引物和探针的设计与筛选
本例根据蓝舌病病毒8型VP2基因(Segment 2)序列,设计了多条特异性的引物和探针,设计好引物和探针后,通过BLAST比对确定其特异性,然后再用于后续试验筛选,引物和探针具体序列如表1所示。本例所有的引物和探针均由生工生物工程(上海)股份有限公司合成。
表1重组酶聚合酶扩引物和探针
表1中,SEQ ID No.3所示序列的BTV8RPA-P2探针中,第32个碱基修饰荧光淬灭基团-dT,第33个碱基替换为碱基类似物,第35个碱基修饰荧光基团-dT,3’末端修饰C3 Spacer。SEQ ID No.10所示序列的BTV8RPA-P1探针中,第32个碱基修饰荧光淬灭基团-dT,第33个碱基替换为碱基类似物,第34个碱基修饰荧光基团-dT,3’末端修饰C3 Spacer。
需要说明的是,RT-RPA引物和探针的设计实际上与RPA引物和探针是一样的,只是在反应体系中增加了反转录酶及RNA酶抑制剂,从而实现一步法逆转录重组酶聚合酶扩增。在对实际样品进行检测时,是提取样品的RNA用于检测,其余步骤和条件都与RPA相同。
4.反应体系和反应条件
本例采用TwistAmp exo Kit试剂盒进行RT-RPA扩增。
反应体系为50μL。将RehydrationBuffer 29.5μL、两条浓度为10μM的引物各2.1μL、浓度为10μM的探针0.6μL、200U/μL MMLV Reverse Transcriptase 1μL、40U/μL Recombinant RNase Inhibitor 1μL、DEPC水8.7μL、核酸模板2.5μL混合均匀后加入到RPA冻干酶粉的反应管中,混匀,最后加入浓度为280mM的MgAc溶液2.5μL,混匀。将上述反应管置于Axxin恒温扩增仪中,40℃反应15分钟,反应过程中实时读取荧光信号。
其中,两条浓度为10μM的引物是指上游引物和下游引物。本例的反应体系与常规的RPA反应体系不同的是,增加了反转录酶MMLV Reverse Transcriptase和RNA酶抑制剂Recombinant RNase Inhibitor,其余组份和反应条件都与RPA相同。本例的反应体系可以对DNA进行检测,也可以直接检测RNA。如果是对DNA进行检测,则反转录酶和RNA酶抑制剂不发挥作用。如果是对RNA进行检测,则反转录酶在反应过程中同时进行反转录,将RNA反转录为cDNA,然后进行重组酶聚合酶扩增,该过程是在一个反应体系中同步进行。
5.引物和探针筛选
在筛选的过程中,先采用其中一条上游引物,对下游引物进行筛选,然后再根据筛选出来的下游引物,再去筛选上游引物,以获得最佳的蓝舌病病毒8型检测用引物探针组合。引物和探针筛选采用“4.反应体系和反应条件”。
6.特异性试验
采用筛选的引物和探针组合,按“4.反应体系和反应条件”,对二十四种蓝舌病病毒核酸、鹿流行性出血热病毒核酸、牛病毒性腹泻病毒核酸和口蹄疫病毒核酸等模板进行检测。并设置阴性对照和空白水对照,其中阴性对照是指从阴性的牛血中提取的RNA样品。
7.灵敏度试验
本例将BTV8-VP2按10倍梯度稀释至10-7,采用各梯度浓度的稀释核酸模板,按“4.反应体系和反应条件”进行RPA试验,试验中设置一个水空白对照,以测试引物探针的灵敏度。同时,与文献报道的实时荧光RT-PCR法进行比较,即采用相同的稀释核酸模板,按照文献报道的实时荧光RT-PCR法对各稀释核酸模板进行检测。
其中,文献报道的实时荧光RT-PCR法是指,Bernd H,Michael E,Martin B.Real-Time Quantitative Reverse Transcription-PCR Assays Specifically Detecting Bluetongue Virus Serotypes 1,6and 8[J].Journal of clinical microbiology,2009,47(9):2992-2994.中提供的实时荧光RT-PCR法。本例合成了该文献中BTV8的检测引物和探针,并按照文献中的反应体系和条件进行对比试验。
8.重复性试验
采用10-3、10-5稀释浓度的核酸为模板,按“4.反应体系和反应条件”进行RPA试验,重复检测三次分析其稳定性。
9.样品的检测
对实验室保存的27份鹿血样品,52份牛血样品,36份羊血样品按照“4.反应体系和反应条件”进行检测,并设置阳性对照、阴性对照和水空白对照,同时用文献报道的实时荧光RT-PCR法进行检测。所有样品均由深圳海关动植中心提供和保藏。各血样品采用RNA提取试剂盒提取RNA后直接进行检测。其中,文献报道的实时荧光RT-PCR法即“7.灵敏度试验”中采用的实时荧光RT-PCR法。
二、结果和分析
1.引物和探针筛选
经过筛选,本例最终从表1的引物探针中,筛选出Seq ID No.1所示序列的上游引物BTV8RPA-F4、Seq ID No.2所示序列的下游引物BTV8RPA-R4和Seq ID No.3所示序列的探针BTV8RPA-P2,该引物和探针组合可用于对蓝舌病病毒8型进行特异性检测。
根据筛选结果可见,即使是相同的探针,不同的上游和下游引物组合,对重组酶聚合酶扩增的扩增效率、特异性和灵敏度都有影响。
2.特异性试验结果
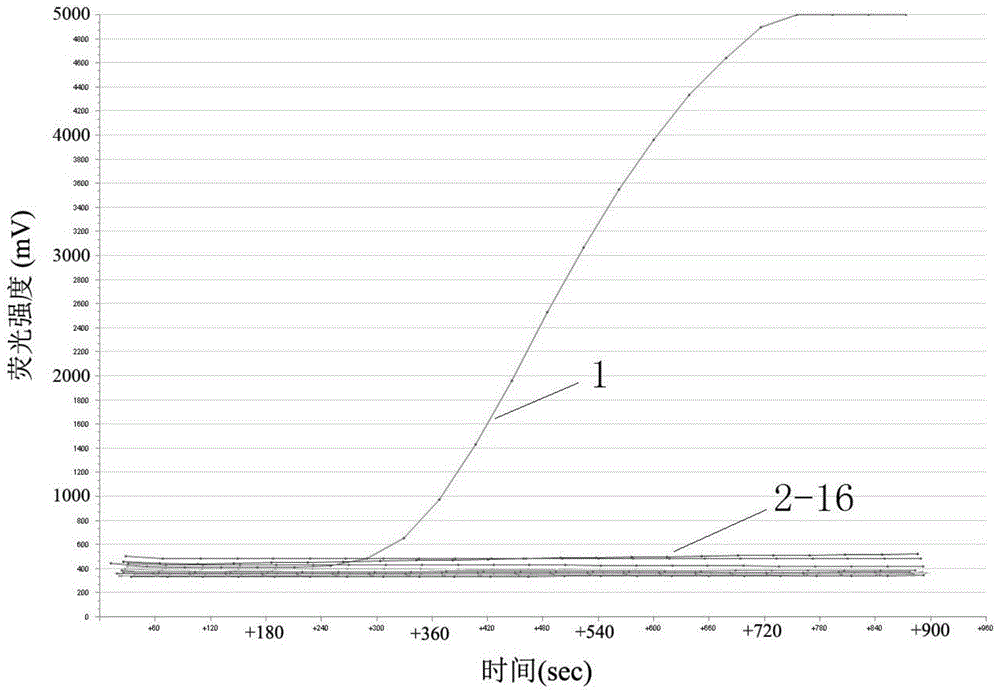
本例分两次进行特异性试验,检测结果如图1和图2所示,图1中,曲线1为BTV-8的检测结果,曲线2-16分别为BTV-1、BTV-2、BTV-3、BTV-4、BTV-5、BTV-6、BTV-7、BTV-9、BTV-10、BTV-11、BTV-12、BTV-13、BTV-14、阴性对照和水空白对照的检测结果;图2中,曲线1为BTV-8的检测结果,曲线2-16分别为BTV-15、BTV-16、BTV-17、BTV-18、BTV-19、BTV-20、BTV-21、BTV-22、BTV-23、BTV-24、鹿流行性出血热病毒核酸、牛病毒性腹泻病毒核酸、口蹄疫病毒核酸、阴性对照和水空白对照的检测结果。可见,仅BTV-8有荧光曲线,呈阳性;而其它病原核酸和阴性对照、水空白对照都没有荧光曲线,呈阴性。因此,本例的引物和探针能对BTV-8进行特异性检测,与蓝舌病病毒其它血清型、鹿流行性出血热病毒核酸、牛病毒性腹泻病毒核酸、口蹄疫病毒核酸等无交叉反应,具有良好的特异性。
3.灵敏度试验结果
本例的引物和探针对BTV8-VP2的灵敏度检测结果如图3所示,图3中,曲线1至曲线5依序为BTV8-VP2稀释度为10-1、10-2、10-3、10-4、10-5的扩增曲线,曲线6至曲线8依序为10-6、10-7以及水空白对照的扩增曲线。由检测结果可知,本例中RPA最低可以检测到BTV8-VP210-4稀释度。测得质粒BTV8-VP2原始浓度后,换算成拷贝数为7×105copies/μL,10-4稀释度对应的质粒浓度为7×101copies/μL。
对相同的稀释核酸模板,使用文献报道的实时荧光RT-PCR法进行灵敏度检测,检测结果如图4所示,图4中,曲线1至曲线6依序为BTV8-VP2稀释度为10-1、10-2、10-3、10-4、10-5、10-6的扩增曲线,曲线7、曲线8分别为10-7以及水空白对照的扩增曲线。由检测结果可知文献报道的实时荧光RT-PCR法最低可以检测到BTV8-VP210-6稀释度,对应的质粒浓度为7×100copies/μL。
可见,相对于目前常规使用的实时荧光RT-PCR检测方法,本例的BTV-8RT-RPA检测方法可以达到相近的灵敏度;但是,本例的检测方法,其检测时间短,不需要大型仪器设备,大大缩短了检测时间,提升了检测效率。
4.重复性试验结果
重复性检测结果如图5所示,图中,曲线1至曲线3为10-3稀释的BTV8-VP2扩增曲线,曲线4至曲线6为10-5稀释的BTV8-VP2扩增曲线,曲线7至曲线9为水空白对照的扩增曲线。可见曲线1至曲线3检测结果一致,曲线4至曲线6检测结果一致,在相同位置均可观察到相对应的荧光曲线,说明本例RT-RPA方法重复性良好。
5.样品的检测
样品检测结果显示,采用本例的引物和探针对27份鹿血样品,52份牛血样品,36份羊血样品共115份样品进行RT-RPA检测,阳性对照出现荧光扩增曲线,阴性对照、水空白对照及样品均无扩增曲线出现,样品检测结果为阴性,与文献报道的实时荧光RT-PCR法检测结果相同。
本例的蓝舌病病毒8型检测方法和试剂,检测时间短,反应条件简单且无需大型仪器设备,大大提升了检测效率。
以上内容是结合具体的实施方式对本申请所作的进一步详细说明,不能认定本申请的具体实施只局限于这些说明。对于本申请所属技术领域的普通技术人员来说,在不脱离本申请构思的前提下,还可以做出若干简单推演或替换。
SEQUENCE LISTING
<110> 深圳海关动植物检验检疫技术中心
武定县动物疫病预防控制中心
<120> 一种用于蓝舌病病毒8型检测的试剂、检测方法及应用
<130> 19I28582
<160> 16
<170> PatentIn version 3.3
<210> 1
<211> 35
<212> DNA
<213> 人工序列
<400> 1
gaggttgtga ttggaacggc tcacaccgac gatcc 35
<210> 2
<211> 35
<212> DNA
<213> 人工序列
<400> 2
gtcgtacatc atagtatctt gctagacaat atcgc 35
<210> 3
<211> 49
<212> DNA
<213> 人工序列
<400> 3
ctgtagggcg cagcgcgaag gcgttcacac atgatccttt tgacctgca 49
<210> 4
<211> 35
<212> DNA
<213> 人工序列
<400> 4
cgcgyacatc ggcacgggtt cggccctgag tttgc 35
<210> 5
<211> 35
<212> DNA
<213> 人工序列
<400> 5
gattttgaga aggacgcgca catcggcacg ggttc 35
<210> 6
<211> 35
<212> DNA
<213> 人工序列
<400> 6
acgattgatt ttgagaagga cgcgcacatc ggcac 35
<210> 7
<211> 35
<212> DNA
<213> 人工序列
<400> 7
atatcgctgc aggtcaaaag gatcatgtgt gaacg 35
<210> 8
<211> 35
<212> DNA
<213> 人工序列
<400> 8
tgcgccctac agctggatcg tcggtgtgag ccgtt 35
<210> 9
<211> 35
<212> DNA
<213> 人工序列
<400> 9
cgcgctgcgc cctacagctg gatcgtcggt gtgag 35
<210> 10
<211> 49
<212> DNA
<213> 人工序列
<400> 10
ttactataac aaatggataa ttgctccgat gtttaacgct aagttacgc 49
<210> 11
<211> 35
<212> DNA
<213> 人工序列
<400> 11
attaccgagg ttgtgattgg aacggctcac accga 35
<210> 12
<211> 35
<212> DNA
<213> 人工序列
<400> 12
taagttacgc attaccgagg ttgtgattgg aacgg 35
<210> 13
<211> 35
<212> DNA
<213> 人工序列
<400> 13
ttgctccgat gtttaacgct aagttacgca ttacc 35
<210> 14
<211> 35
<212> DNA
<213> 人工序列
<400> 14
cataccaggt cgtacatcat agtatcttgc tagac 35
<210> 15
<211> 35
<212> DNA
<213> 人工序列
<400> 15
gcccatcata ccaggtcgta catcatagta tcttg 35
<210> 16
<211> 35
<212> DNA
<213> 人工序列
<400> 16
gagcgcggcc catcatacca ggtcgtacat catag 35
- 还没有人留言评论。精彩留言会获得点赞!