一种测定蛋白酶活力的新方法与流程
本发明属于生物工程领域,具体涉一种测定蛋白酶活力的新方法。
背景技术:
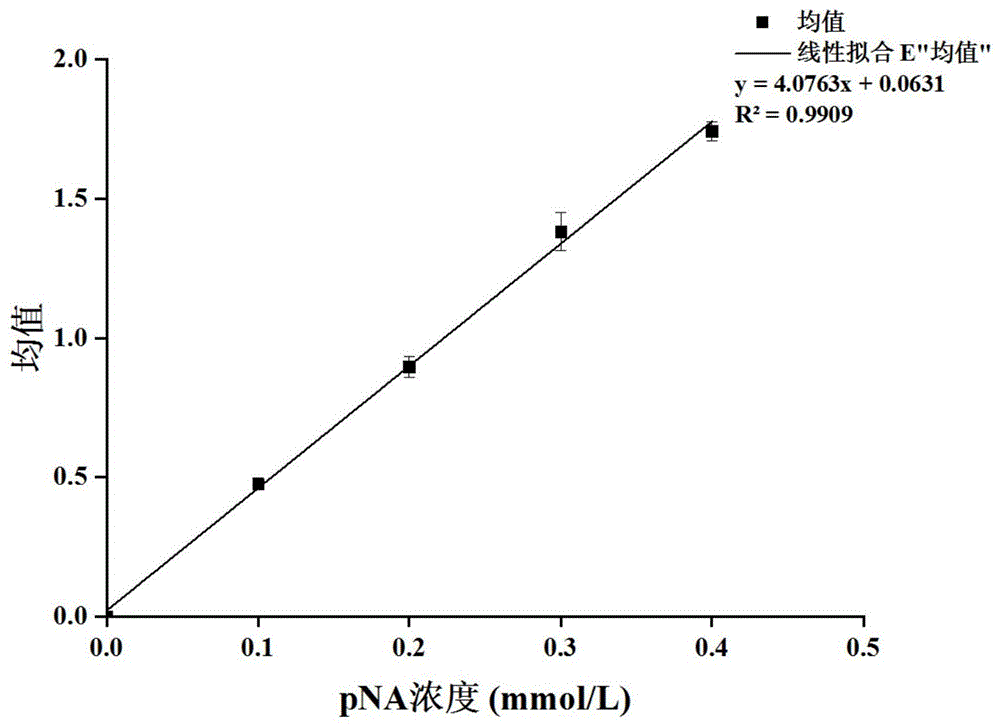
:在众多的酶制剂中,蛋白酶因其在工业中的广泛应用而占有很重要的地位。蛋白酶可以催化蛋白质大分子中的肽键,将其水解为氨基酸、肽、胨,所以也称为肽酶。由于蛋白酶具有的水解作用,而被广泛用于制革工业、洗涤剂、医药、食品和饲料加工等行业。在洗涤剂中使用枯草溶菌素的一种蛋白酶,大大提升了洗涤效果。蛋白酶是生物行业最重要和最丰富的酶系之一,蛋白酶的来源较广,广泛分布在动物内脏、微生物和植物茎叶、果实中,其中细菌来源的蛋白酶占据全球市场近20%。从植物提取的蛋白酶主要是中性蛋白酶,其中具有代表性的是木瓜蛋白酶、角蛋白酶、菠萝蛋白酶、和无花果蛋白酶。当前蛋白酶的来源包括植物来源,动物来源,微生物来源。其中,微生物来源的蛋白酶占据了全球蛋白酶销售额的60%以上。蛋白酶按照不同的分类方式分为不同的类型,有的以活性中心来分,或以作用的方式来分,也有的以最适ph来分,学术上都以活性中心来分。按活性中心可将蛋白酶分为以下四类:(1)丝氨酸蛋白酶,(2)半胱氨酸蛋白酶,(3)天门冬氨酸蛋白酶,(4)金属蛋白酶。丝氨酸蛋白酶家族的成员广泛存在于细菌、动物胰脏、霉菌中。丝氨酸蛋白酶以其专一性还可分为胰蛋白酶型、糜蛋白酶型、葡萄球菌型和粘细菌四种类型。丝氨酸蛋白酶的最适ph值在9.5-10.5是碱性蛋白酶,但有个别丝氨酸蛋白酶属于中性蛋白酶。它们的活性部位都含ser、his、asp,并且具有相同的催化机制。它们与底物结合部位的差异也决定了各自对底物的专一性。蛋白酶水解肽键,产生氨基酸单体,国标法测定蛋白酶酶活力的原理是利用蛋白酶水解酪蛋白产生的酪氨酸上的酚基,能够在碱性环境同福林酚反应产生蓝色沉淀,这种蓝色沉淀在od680有吸收峰的原理,测定蛋白酶水解底物中酪氨酸形成的肽键的能力。依据国标法测定蛋白酶活力的原理可知,国标法测定的酶活力仅是针对蛋白酶水解底物中酪氨酸产生的肽键的能力,而实际上蛋白酶能够水解全部种类的氨基酸构成的肽键,因此国标法测定的酶活力实际为蛋白酶全部水解肽键的能力的子集。国标法测定酶活的过程中,需要经过稀释样品,底物水解反应,终止反应,反应液离心取上清,福林酚显色等步骤,单个样品测定酶活所需时间较长且样品需求量较大。国标中使用的底物干酪素是等电点为ph4.8的两性蛋白质,在牛奶中以磷酸二钙、磷酸三钙或两者的复合物形式存在,构造极为复杂,直到现在没有完全确定的分子式,分子量大约为57000-375000。技术实现要素:本发明的目的在于针对现有技术中蛋白酶活力测定方法的不足,提供一种测定蛋白酶活力的新方法,能够更全面、更准确地评价蛋白酶的实际水解能力。本发明技术方案概述如下:本发明方法主要是利用一种由20种寡肽化合物组成的组合物作为底物,所述寡肽化合物具有通式suc-ala-ala-pro-x-pna(缩写:aapx,分子结构式如下所示),其中x代表20种常见氨基酸中的任一种;利用该方法可测得蛋白酶水解全部肽键的酶活力。合成20种寡肽化合物,配制混合底物溶液与缓冲液、蛋白酶液组成的反应体系,蛋白酶水解氨基酸x与对硝基苯胺pna之间的肽键后产生的pna单体在od410处有吸收峰,水解反应后测定od410的吸光值,可得蛋白酶的最大酶活力。进一步地,通过配置不同ph的缓冲液,该方法广泛适用于测定酸性蛋白酶、中性蛋白酶、碱性蛋白酶的最大酶活力。进一步地,本发明的酶活测定方法主要包括如下步骤:1、用dmso配制20种寡肽化合物的混合底物溶液,其中每种寡肽化合物的浓度均为4mm;2、反应体系组成:按照溶液体积,8份缓冲液,2份混合底物溶液,10份稀释后蛋白酶液;3、混合均匀,40℃静置反应10min,测定od410时的吸光值;4、以硝基苯胺标准溶液的浓度和od410吸光值绘制标准曲线,根据标准曲线计算得到所测定样品酶液中的酶活力。优选的,所述稀释后蛋白酶液的酶活在3u/ml-4u/ml。优选的,所述缓冲液为ph7.5的磷酸盐缓冲液(适用于测定中性蛋白酶);或ph2.0的乳酸-乳酸钠缓冲液(适用于测定酸性蛋白酶);或ph10.5的硼砂-氢氧化钠缓冲液(适用于测定碱性蛋白酶)。有益效果:1、本发明利用含有20种氨基酸肽键的混合底物测定蛋白酶的酶活力,可以全面评价蛋白酶水解过程中的最大效力,测得的酶活指标更接近蛋白酶在实际应用中的真实水解能力。2、本发明方法操作步骤简单,速度快,耗时短,样品需求量小,可以同时进行多个样品的酶活测定工作,能够满足大批量样品测定工作的需求。附图说明:图1:本发明方法测定蛋白酶活力的标准曲线。具体实施方式:下面通过具体的实施方案叙述本发明方法。除非特别说明,本发明所用的技术手段均为本领域技术人员所公知的方法。另外,实施方案应理解为说明性的,而非限制本发明的范围,本发明的实质和范围仅由权利要求书所限定。对于本领域技术人员而言,在不背离本发明实质和范围的前提下,对这些实施方案中的物料成分和用量进行的各种改变或改动也属于本发明的保护范围。本发明实施例中所用部分缓冲溶液的配制如下:磷酸盐缓冲液(ph7.5):称取磷酸氢二钠6.02g和磷酸二氢钠0.5g,加水溶解并定容至1000ml后利用ph计测定并校正。乳酸-乳酸钠缓冲液(ph2.0):甲液:称取乳酸(60%-85%)12.0g,加水溶解并定容至1000ml,乙液:称取乳酸钠(50%-70%)18.0g,加水溶解并定容至1000ml。配制:取甲液10ml,加乙液2ml,混匀,稀释一倍后形成0.05mol/l酸性冲溶液,再利用ph计测定并校正。硼砂-氢氧化钠缓冲液(ph10.5):甲液:称取硼酸钠(硼砂)10.0g,加水溶解并定容至500ml,乙液:称取氢氧化钠2.0g,加水溶解并定容至500ml。制备:取甲液500ml、乙液400ml混匀,用水稀释至1000ml后利用ph计测定并校正。20种常见氨基酸是指甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、脯氨酸、色氨酸、丝氨酸、酪氨酸、半胱氨酸、蛋氨酸、天冬酰胺、谷氨酰胺、苏氨酸、天冬氨酸、谷氨酸、赖氨酸、精氨酸和组氨酸这二十种组成人体蛋白质的氨基酸。本发明测定方法对于酶活单位的定义如下:1个酶活力单位是指1g酶粉或1ml酶液在特定条件(40℃,其它为最适条件)下,在1分钟内能转化1微摩尔底物的酶量。实施例1:混合底物测定蛋白酶酶活的标准曲线的绘制1)用dmso配制不同浓度的对硝基苯胺溶液。2)反应体系组成:80μl磷酸盐缓冲液(ph=7.5),20μl对硝基苯胺溶液,100μl磷酸盐缓冲液(ph=7.5)。3)以不含对硝基苯胺的0管为空白,在od410时分别测定吸光度。4)以吸光度a为纵坐标,对硝基苯胺的终浓度c为横坐标,绘制标准曲线(曲线应通过零点)。根据作图计算出当吸光度为1时的对硝基苯胺的浓度,即为吸光度常数k值。标准曲线如图1所示。实施例2:利用寡肽组合物测定多种蛋白酶的酶活力1、利用寡肽组合物测定1398中性蛋白酶的酶活力1)用dmso配制20种寡肽化合物的混合底物溶液,其中每种寡肽化合物的浓度均为4mm;2)反应体系组成:80μl磷酸盐缓冲液(ph=7.5),20μl混合底物溶液,100μl稀释后待测样品酶液(3-4u/ml);3)混合均匀,40℃静置反应10min,测定od410时的吸光值;4)计算待测酶液中的酶活力,结果用一位小数表示。2、利用寡肽组合物测定克劳氏芽孢杆菌来源的碱性蛋白酶的酶活力1)用dmso配制20种寡肽化合物的混合底物溶液,其中每种寡肽化合物的浓度均为4mm;2)反应体系组成:80μl硼砂-氢氧化钠缓冲液(ph=10.5),20μl混合底物溶液,100μl稀释后待测样品酶液(3-4u/ml);3)混合均匀,40℃静置反应10min,测定od410时的吸光值;4)计算酶溶液中的酶活性,结果用一位小数表示。3、利用寡肽组合物测定地衣芽孢杆菌来源的2709碱性蛋白酶的酶活力1)用dmso配制20种寡肽化合物的混合底物溶液,其中每种寡肽化合物的浓度均为4mm;2)反应体系组成:80μl硼砂-氢氧化钠缓冲液(ph=10.5),20μl混合底物溶液,100μl稀释后待测样品酶液(3-4u/ml);3)混合均匀,40℃静置反应10min,测定od410时的吸光值;4)计算酶溶液中的酶活性,结果用一位小数表示。4、利用寡肽组合物测定角蛋白酶的酶活力1)用dmso配制20种寡肽化合物的混合底物溶液,其中每种寡肽化合物的浓度均为4mm;2)反应体系组成:80μl硼砂-氢氧化钠缓冲液(ph=10.5),20μl混合底物溶液,100μl稀释后待测样品酶液(3-4u/ml);3)混合均匀,40℃静置反应10min,测定od410时的吸光值;4)计算酶溶液中的酶活性,结果用一位小数表示。5、利用寡肽组合物定酸性蛋白酶的酶活力1)用dmso配制20种寡肽化合物的混合底物溶液,其中每种寡肽化合物的浓度均为4mm;2)反应体系组成:80μl乳酸-乳酸钠缓冲液(ph2.0),20μl混合底物溶液,100μl稀释后待测样品酶液(3-4u/ml);3)混合均匀,40℃静置反应10min,测定od410时的吸光值;4)计算酶溶液中的酶活性,结果用一位小数表示。上述蛋白酶活力测定结果如下表所示:实施例3:胰蛋白酶活力测定胰蛋白酶是一种特异性较显著的蛋白酶,针对精氨酸(r)和赖氨酸(k)形成的肽键有较高的切割效率,使用该酶分别与20种寡肽化合物反应,可以验证用寡肽组合物反映蛋白酶底物切割特异性的可行性。分别使用混合底物及20种寡肽化合物与胰蛋白酶反应,具体操作如下:1)用dmso分别配制4mm的aapx底物溶液(x代表20种常见氨基酸中的任一种);反应体系组成:80μl磷酸盐缓冲液(ph=7.5),20μlaapx底物溶液,100μl稀释后酶液(3-4u/ml);2)用dmso配制20种寡肽化合物的混合底物溶液,其中每种寡肽化合物的浓度均为4mm;反应体系组成:80μl磷酸盐缓冲液(ph=7.5),20μl混合底物溶液,100μl稀释后酶液(3-4u/ml);3)混合均匀,40℃静置反应10min,测定od410时的吸光值;4)计算待测酶液中的酶活力,结果用一位小数表示。实验结果如下:底物种类aapkaapiaaphaapgaapfaapeaapd酶活(u/ml)67.10.30.70.94.40.20底物种类aapcaapwaapvaaptaapsaapraapq酶活(u/ml)0.60.400033.10底物种类aappaapnaapmaapyaapaaapl混合底物酶活(u/ml)00.51.54.50.21.679.2结果显示,胰蛋白酶分别与aapk、aapr反应后有较高的酶活数据,侧面证明该类底物可用于测定蛋白酶的酶活并显示蛋白酶切割肽键时的特异性。混合底物中包含20中底物,在20中底物全部存在的情况下,胰蛋白酶依然会针对aapk,aapr有较高的切割特异性,但会小频率的切割其余底物。测定获得的酶活数据略高于最适底物测得的酶活数据。实施例4:碱性蛋白酶活力测定碱性蛋白酶可水解蛋白质中的肽键,还具有水解酰胺键、酯键以及转酯和转肽的功能。分别使用混合底物及20种寡肽化合物与碱性蛋白酶反应,测定酶活数据。具体操作步骤如下:1)用dmso分别配制4mm的aapx底物溶液(x代表20种常见氨基酸中的任一种);反应体系组成:80μl磷酸盐缓冲液(ph=7.5),20μlaapx底物溶液,100μl稀释后酶液(3-4u/ml);2)用dmso配制20种寡肽化合物的混合底物溶液,其中每种寡肽化合物的浓度均为4mm;反应体系组成:80μl磷酸盐缓冲液(ph=7.5),20μl混合底物溶液,100μl稀释后酶液(3-4u/ml);3)混合均匀,40℃静置反应10min,测定od410时的吸光值;4)计算待测酶液中的酶活力,结果用一位小数表示。实验结果如下:底物种类aapkaaapiaaphaapgaapfaapeaapd酶活(u/ml)6.10.67.51.275.10.975.1底物种类aapcaapwaapvaaptaapsaapraapq酶活(u/ml)2.55.13.60.60.30.30.8底物种类aappaapnaapmaapyaapaaapl混合底物酶活(u/ml)7.17.119.425.23.417.5126.3实验结果显示:实验中使用的碱性蛋白酶切割肽键时的特异性不强,针对20种不同的底物中的肽键均有切割能力,且存在倾向性。碱性蛋白酶切割苯丙氨酸形成的肽键的效率最高,切割酪氨酸形成的肽键的效率次于切割苯丙氨酸形成的肽键的效率,说明aapy可能并不是碱性蛋白酶的最适底物。国标法测定蛋白酶活力的原理,是利用蛋白酶水解酪蛋白产生的酪氨酸上的酚基能够在碱性环境同福林酚反应产生蓝色沉淀,通过检测这种蓝色沉淀在od680处的吸收峰,从而得出蛋白酶活力。依据国标法测定蛋白酶活力的原理可知,以国标法所表征的蛋白酶活力,实际上仅是蛋白酶切割酪氨酸肽键的能力,但未能反映出蛋白酶切割其他氨基酸肽键的能力,即蛋白酶全部的水解活力。而本发明方法通过含有20种氨基酸肽键的组合物作为水解底物,可以更加全面、彻底地反映出蛋白酶的水解活力。实验结果显示,混合底物测定的碱性蛋白酶的酶活数据高于所有单个底物测定的碱性蛋白酶的酶活数据。实施例5:利用国标法与本发明方法同时测定多个碱性蛋白酶样品在枯草芽孢杆菌中表达克劳氏芽孢杆菌来源的碱性蛋白酶基因及其变体,获得多个菌株,在此实验中发酵测定这些菌株的酶活数据。克劳氏芽孢杆菌来源的蛋白酶基因编号为:cp019985.1。选取原始菌株及5个突变株进行该实验。突变株的命名规则:采用“原始氨基酸位置替换的氨基酸”来表示突变株,氨基酸残基使用公认命名法中单字母符号形式,例如g283a,表示第283位的氨基酸由亲本蛋白酶的甘氨酸(g)替换成丙氨酸(a),位置的编号对应于由ncbi编号cp019985.1的基因序列所编码的蛋白酶的氨基酸序列编号。国标法中的样品制备:1.从甘油管中接菌至平板,37℃培养12h。2.挑单菌落接入lb培养基试管,37℃,220rpm,培养12h。3.250mllb摇瓶发酵,2%的接种量,37℃,220rpm,培养48h。4.将发酵液离心取上清,制得酶液样品。国标法:1.通过梯度稀释将样品稀释至合适的倍数(稀释后样品每毫升酶活在10-15u)。2.将稀释后的样品与配制好的酪氨酸底物反应,十分钟后终止反应。3.取终止反应后的反应液离心取上清。4.上清同福林酚反应,20min,40℃。5.测定显色反应液的od680数值,计算酶活。具体操作步骤见国标gb/t23527-2009。国标法中酶活定义:1g固体酶粉(或1ml液体酶),在一定温度和ph值条件下,1min水解酪蛋白产生1μg酪氨酸,即为1个酶活力单位,以u/g(u/ml)表示。本发明方法的样品制备:1.从甘油管中接菌至平板,37℃培养12h。2.挑单菌落接入lb培养基试管,37℃,220rpm,培养12h。3.使用48孔板发酵,2%接种量,37℃,750rpm,培养48h。4.发酵液离心取上清,获得酶液样品。本发明方法测定碱性蛋白酶及其突变体的酶活力,步骤如下:1)用dmso配制20种寡肽化合物的混合底物溶液,其中每种寡肽化合物的浓度均为4mm;2)反应体系组成:80μl乳酸-乳酸钠缓冲液(ph2.0),20μl混合底物溶液,100μl稀释后待测样品酶液(3-4u/ml);3)混合均匀,40℃静置反应10min,测定od410时的吸光值;4)计算酶溶液中的酶活性,结果用一位小数表示。酶活测定结果如下:国标测定方法与本发明方法对于酶活单位的定义不同,获得的数据不能直接用于比较酶活高低。本发明方法可以测得蛋白酶水解肽键的最大能力,相较于国标法更加的全面和准确。国标法测定酶活时需要的样品量较大,因此需要通过摇瓶发酵获得足量的样品。使用本发明方法,需要的样品量较少,可以通过48孔板发酵获得样品,大大简化了发酵过程。国标法测定酶活的过程中,需经过反应,离心,显色等步骤,误差较大,操作繁琐,且反应体系较大,单个样品测定时间较长,需一个小时完成。使用本发明方法测定酶活时,仅需一步反应,且反应体系较小,在96孔板中即可完成,可使用排枪批量测定酶活,一次(一批)反应15分钟即可获得结果,适合大批量样品的测定工作。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1