一种基于RT-LAMP-LFD检测猕猴桃褪绿环斑相关病毒的快速检测方法与流程
本发明属于植物病毒检测技术领域,特别涉及一种基于rt-lamp-lfd检测猕猴桃褪绿环斑相关病毒的快速检测方法。
背景技术:
猕猴桃是全球重要的园艺产品之一,因其果肉含有丰富的维生素c、矿物质及膳食纤维,深受大众的青睐。2017年,世界猕猴桃产量已达到403万吨,但病害的侵染会影响猕猴桃的产量和质量,甚至影响猕猴桃产业的健康发展。病毒病是一种潜伏期长、在生产上存在巨大隐患的病害。猕猴桃褪绿环斑相关病毒(actinidiachloroticringspotsassociatedvirus,acrav)为的欧洲花楸环斑病毒属的负义单链rna病毒。在自然条件下该病毒可侵染猕猴桃,叶片呈现褪绿斑驳、褪绿环斑和叶脉黄化等症状,对果树的正常生长发育产生一定的影响。同时,我国在湖北,陕西,四川等地区的猕猴桃栽品种中均有检测到该病毒。目前,针对猕猴桃病毒病目前尚无药剂防治,一旦感染将终身携带病毒,因此,病毒对猕猴桃的潜在威胁不容忽视。
果树病毒的检测是病毒病害预测、预报及防治的关键环节。目前病毒病的检测技术主要有普通rt-pcr、实时荧光定量rt-pcr、酶联免疫吸附测定(elisa)、电子显微镜检测等方法。
1、聚合酶链式反应(polymerasechainreaction,pcr),它是根据靶基因序列设计1对特异的引物,在体外模拟dna的天然复制过程,其特异性依赖于与靶序列的引物,由变性-退火-延伸三个基本反应步骤组成。在2-3h内即实现对靶基因扩增放大几百万倍。
2、实时荧光定量pcr(real-timefluorescencequantitativepcr),该方法是通过荧光染料或荧光标记的特异性探针,通过荧光信号标记跟踪pcr产物,可对靶基因的扩增情况进行实时监测。
上述两种技术对仪器设备要求较高,需要能够实现pcr三个基本反应的普通pcr仪器,一般的pcr扩增仪器设备价格都在2-3万不等,定量pcr设备价格更高;同时荧光染料或荧光标记的特异性探针价格昂贵,扩增效果的检测同样需要特定的检测仪器,这些设备价格十分昂贵,且扩增的试剂价格高、反应所需的时间较长。导致检测总成本高,不适用于田间样品的快速检测。
3、酶联免疫吸附法(enzyme-linkedimmunosorbentassay,elisa)是最常用的病毒血清学检测方法,于20世纪70年代开始应用于植物病毒检测。该技术特异性较强并具有高敏感度,操作简单、准确、快速。elisa利用抗体和抗原特异性结合的原理作为一个检测系统。该方法的主要制约因素是需要相应的特异抗体,抗体的制作过程较为复杂,特异抗体的准备过程繁琐,耗时耗力,需要花费几个月不等的时间;虽然有些抗体可以商业购买,但是价格昂贵。同时,该病毒为新报道病毒,目前还未商品化的抗体。
4、电子显微镜检测是通过电镜了解病毒结构、病毒的侵染、复制等。电镜是判断病毒是否存在最直观的检测方法。其检测结果的准备性依赖于电镜的品质,先进的仪器设备往往价格昂贵。同时,检测人员必须掌握良好的电镜操作技术及病毒学知识。
技术实现要素:
本发明的目的在于克服现有技术的不足,提供一种方便快捷的用于检测猕猴桃褪绿环斑相关病毒的引物及检测方法。
本发明的目的是通过以下技术方案来实现的:基于rt-lamp-lfd检测猕猴桃褪绿环斑相关病毒的引物,包括4条引物:内引物:fip和bip;外引物:f3和b3,其中fip和bip的5′末端分别用异硫氰酸荧光素标记与生物素标记;各引物的序列分别如下:
f3:cttttgtaagatcatgcttcct,如seqidno.1所示;
b3:tctatttctatagtgaatcgtcttg,如seqidno.2所述;
fip:fitc-ggttagattggaatgtcgtaaagctaccagtgaatttacaatctcag,如seqidno.3所示;
bip:biotin-aactcatatcctggaacaaccatccaggacaaatgaggctacc,如seqidno.4所示。
本发明还公开了一种基于rt-lamp-lfd检测猕猴桃褪绿环斑相关病毒的快速检测方法,包括以下步骤:
s1、提取猕猴桃待检测样品rna;
s2、将提取的猕猴桃待检测样品rna反转录为cdna;
s3、以猕猴桃待检测样品cdna为模板,配于引物fip、bip、f3和b3进行等温扩增;
s4、利用lfd试纸条对步骤s3所得等温扩增物进行检测,判断猕猴桃待检测样品是否含有猕猴桃褪绿环斑相关病毒。
进一步地,所述步骤s1包括以下子步骤:
s11、取猕猴桃样品置于灭菌预冷研钵中,加入液氮后,快速研磨成粉末;
s12、将100mg步骤s11得到的猕猴桃样品粉末放入1.5ml离心管中,加入1ml65℃预热的2%的ctab提取液,震荡混匀,然后放置于65℃的水浴中20min,每隔2min颠倒混匀一次;
s13、在4℃环境中,于10000rpm转速下离心5min,将700μl上清液转移至新离心管;
s14、加入700μl苯酚、氯仿和异戊醇混合溶液,剧烈震荡混匀,所述苯酚、氯仿和异戊醇混合溶液中苯酚、氯仿和异戊醇的体积比为25:24:1;
s15、在4℃环境中,于12000rpm转速下离心10min,然后将400μl上清液转移至新离心管;
s16、加入400μl的预冷的6mol/l的licl溶液,并在-20℃环境中静置1h;
s17、在4℃环境中,于12000rpm转速下离心10min,然后静置5min,倒掉上清液,沉淀用70%乙醇洗涤2次,并在室温下干燥3~5min;
s18、加入50μldepc处理水溶解步骤s17得到的产物,然后-20℃保存备用。
进一步地,所述步骤s3中,进行等温扩增时,所述扩增反应体系为:3.5μl检测反应缓冲液10xtermopolbuffer、1.5μl终浓度为6mmol/l的mgso4、2.5μl终浓度为1mmol/l的dntpmix、2μl终浓度为0.8μmol/l的内引物fip和bip、0.5μl终浓度为0.2μmol/l外引物f3和b3、1μl终浓度为320u/ml的bstdna聚合酶、1μl样品cdna模板。
进一步地,所述步骤s3具体反应过程为:将配置好的扩增反应体系配制于pcr管中,将pcr管中混合液瞬时离心混匀,于62℃的恒温条件下反应60min,然后将反应混合液再置于80℃恒温条件下反应10min。
进一步地,所述步骤s4中,利用lfd试纸条对步骤s3所得等温扩增物进行检测,具体实现方法为:从步骤s3得到的反应混合液中吸取5μl混合液加入到100μllfdbuffer中混匀,将lfd试纸条浸入其中,反应5分钟后读取检测结果;若lfd试纸条出现两条红色条带则表明检测结果为阳性,猕猴桃待检测样品含有猕猴桃褪绿环斑相关病毒;lfd试纸条仅在质控线出现红色条带表明检测结果呈阴性,猕猴桃待检测样品不含猕猴桃褪绿环斑相关病毒。(试纸条上方条带为质控线,下方出现条带为检测线,只有当质控线和检测线同时出现条带才表明该检测结果为阳性,如果仅出现质控线表明检测结果为阴性。)
本发明的有益效果是:本发明根据猕猴桃褪绿环斑相关病毒外壳蛋白核苷酸序列设计lamp引物,结合lfd试纸可视化的结果,实现了对猕猴桃褪绿环斑相关病毒(accrav)的快速检测,利用这一方法可以在猕猴桃植株或组培苗快速鉴定出是否含有该病毒,进而达到预防以及采取针对性措施的目的,减少病害带来的损失;并且本发明的检测方法检测时间短,所需要设备简单,对操作人员要求低,检测结果可视化,能够有效降低检测成本。
附图说明
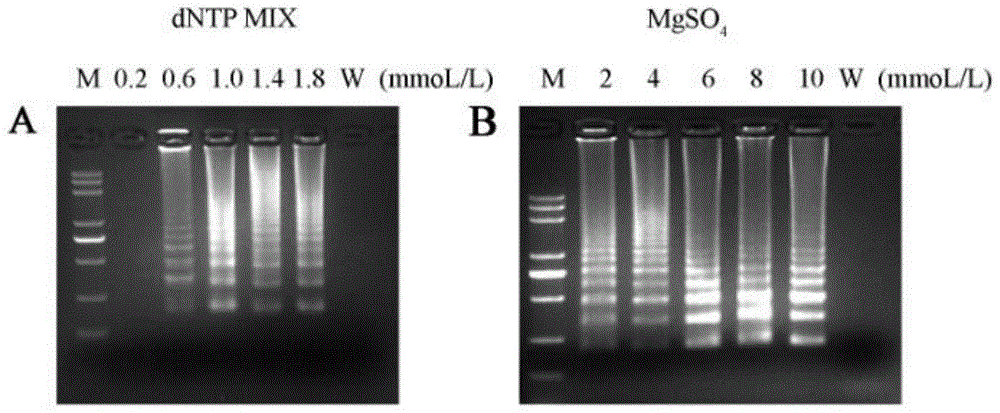
图1为不同浓度的dntp和mgso4进行反应的检测结果;
图2为不同浓度的引物进行反应的检测结果;
图3为不同反应时间和温度下进行反应的检测结果;
图4为本发明的检测方法对猕猴桃不同病毒的检测结果图;
图5为利用本发明的检测方法对15个猕猴桃样品中accrav进行检测的结果图。
具体实施方式
环介导等温扩增检测技术(loop-mediatedisothermalamplification,lamp)是日本notomi等人开发的一种在等温条件下实现高灵敏链置换技术,是一种快速核酸扩增的分子检测方法。lamp检测技术针对靶基因的6个区域设计特异引物,包括内引物(fip、bpi)和外引物(f3、b3),在具有链置换活性的dna聚合酶(bstdnapolymerase)作用下,在恒温(60-65℃左右)条件下对靶基因进行连续置换扩增反应,反应30-80min即可完成核酸扩增反应。该方法与常规pcr相比,无需昂贵的特定仪器设备,且灵敏度、特异性和检测范围等技术指标上与常规pcr技术无差异,且反应结果的监测可通过横向流动试纸条(lfd)准确检测lamp产物,可直接得到清晰的反应结果。仅需在lamp引物设计时对fip和bip引物的5’末端分别添加异硫氰酸荧光素(fitc)标记与生物素(biotin)标记的探针,通过酶联免疫反应在试纸条中的检测线和质控线条带生成判断检测结果。该可视化方法反应迅速、特异性、操作简便安全。目前已广泛应用于人类和动植物中各种病原物等引起的疾病检测和快速诊断中。
下面结合附图进一步说明本发明的技术方案。
本发明公开了一种基于rt-lamp-lfd检测猕猴桃褪绿环斑相关病毒(accrav)的引物,根据ncbi已报道猕猴桃褪绿环斑相关病毒外壳蛋白核苷酸序列,通过软件dnaman分析后选择相对保守区域400bp,利用在线引物设计软件primerexplorerv5(http://primerexplorer.jp/lampv5e/index.html)设计了4条引物:内引物:fip和bip;外引物:f3和b3,其中fip和bip的5′末端分别用异硫氰酸荧光素(fitc)标记与生物素(biotin)标记;得到各引物的序列如表1所示。
表1
本发明提供一种基于rt-lamp-lfd检测猕猴桃褪绿环斑相关病毒的快速检测方法,包括以下步骤:
s1、提取猕猴桃待检测样品rna;包括以下子步骤:
s11、取猕猴桃样品置于灭菌预冷研钵中,加入液氮后,快速研磨成粉末;
s12、将100mg步骤s11得到的猕猴桃样品粉末放入1.5ml离心管中,加入1ml65℃预热的2%的ctab提取液,震荡混匀,然后放置于65℃的水浴中20min,每隔2min颠倒混匀一次;
s13、在4℃环境中,于10000rpm转速下离心5min,将700μl上清液转移至新离心管;
s14、加入700μl苯酚、氯仿和异戊醇混合溶液,剧烈震荡混匀,所述苯酚、氯仿和异戊醇混合溶液中苯酚、氯仿和异戊醇的体积比为25:24:1;
s15、在4℃环境中,于12000rpm转速下离心10min,然后将400μl上清液转移至新离心管;
s16、加入400μl的预冷的6mol/l的licl溶液,并在-20℃环境中静置1h;
s17、在4℃环境中,于12000rpm转速下离心10min,然后静置5min,倒掉上清液,沉淀用70%乙醇洗涤2次,并在室温下干燥3~5min;
s18、加入50μldepc处理水溶解步骤s17得到的产物,然后-20℃保存备用。
s2、将提取的猕猴桃待检测样品rna反转录为cdna;根据primescriptii1ststrandcdnasynthesiskit反转录试剂盒(大连宝生物)合成cdna。
s3、以猕猴桃待检测样品cdna为模板,配于引物fip、bip、f3和b3进行等温扩增;
进行等温扩增时,所述扩增反应体系为:3.5μl检测反应缓冲液10xtermopolbuffer、1.5μl终浓度为6mmol/l的mgso4、2.5μl终浓度为1mmol/l的dntpmix、2μl终浓度为0.8μmol/l的内引物fip和bip、0.5μl终浓度为0.2μmol/l外引物f3和b3、1μl终浓度为320u/ml的bstdna聚合酶、1μl样品cdna模板。
具体反应过程为:将配置好的扩增反应体系配制于pcr管中,将pcr管中混合液瞬时离心混匀,于62℃的恒温条件下反应60min,然后将反应混合液再置于80℃恒温条件下反应10min。
s4、利用lfd试纸条对步骤s3所得等温扩增物进行检测,判断猕猴桃待检测样品是否含有猕猴桃褪绿环斑相关病毒。利用lfd试纸条对步骤s3所得等温扩增物进行检测,具体实现方法为:从步骤s3得到的反应混合液中吸取5μl混合液加入到100μllfdbuffer中混匀,将lfd试纸条浸入其中,反应5分钟后读取检测结果;若lfd试纸条出现两条红色条带则表明检测结果为阳性,猕猴桃待检测样品含有猕猴桃褪绿环斑相关病毒;lfd试纸条仅在质控线出现红色条带表明检测结果呈阴性,猕猴桃待检测样品不含猕猴桃褪绿环斑相关病毒。(试纸条上方条带为质控线,下方出现条带为检测线,只有当质控线和检测线同时出现条带才表明该检测结果为阳性,如果仅出现质控线表明检测结果为阴性。)
试验1:上述步骤s3中dntpmix浓度和mgso4浓度的优化
为了研究rt-lamp反应最佳的dntpmix浓度和mgso4浓度,参考已报道的rt-lamp反应条件确立初步反应体系,dntpmix浓度从0.2mmol/l到1.8mmol/l之间以0.4mmol/l为间隔设置5种浓度梯度,以阳性cdna为模板,同时以无菌水为模板作空白对照,按反应过程进行反应并观察检测结果,不同浓度dntp下的检测结果图如图1a所示。结果显示加入2.5μldntpmix浓度为1.0mmol/l时凝胶电泳条带最为显著,因此,dntpmix用量为2.5μl。同理,mgso4浓度从2mmol/l到10mmol/l之间以2mmol/l为间隔设置5种浓度梯度,按反应过程进行反应并观察检测结果(其中dntpmix已确定为2.5μl),不同浓度mgso4下的检测结果如图1b所示。结果显示加入1.5μlmgso4浓度为6.0mmol/l时凝胶电泳条带最为显著,因此,mgso4用量为1.5μl。
试验2:上述步骤s3中内引物(fip、bip)与外引物(f3、b3)用量的优化
为了研究rt-lamp反应最佳的内引物和外引物用量,以外引物总用量为1μl(f3、b3各0.5μl,终浓度为0.2μmol/l),设置8个内引物浓度梯度从0.2μmol/l至1.6μmol/l,内外引物比为1:1-1:8,按反应过程进行反应并观察检测结果(其中dntpmix已确定为2.5μl,mgso4用量为1.5μl),得到的检测结果如图2所示。结果显示加入内引物fip、bip浓度在0.8μmol/l时凝胶电泳条带最为清晰、显著;因此,rt-lamp检测体系中内引物fip、bip用量为2μl终浓度为0.8μmol/l,外引物用量为0.5μl终浓度为0.2μmol/l。
试验3:上述步骤s3中反应温度与反应时间的确定
为确定反应的温度和反应时间,以优化的反应体系:3.5μl检测反应缓冲液,1.5μl的mgso4,2.5μl的dntpmix,5μl的引物组混合液(fip、bip各2μl;f3、b3各0.5μl),1μlbstdna聚合酶,1mlcdna模板,无菌水补足25μl,在不同温度(50℃至64℃,温度间隔2℃)下,进行等温扩增反应并观察检测结果,得到不同反应温度下的检测结果如图3a所示。结果显示温度在62℃时,凝胶电泳条带最为清晰明显,因而反应温度选择62℃。同理,在不同扩增时间(30min-80min,时间间隔为10min)下,进行等温扩增反应并观察检测结果(在62℃条件下反应),得到不同扩增时间下的反应结果如图3b所示。结果显示,扩增时间在60-80min时均有明显且清晰的条带。鉴于快速检测的要求,选择扩增时间为60min。
试验4:rt-lamp-lfd检测猕猴桃褪绿环斑相关病毒(accrav)特异性试验
为确定优化后的rt-lamp-lfd对猕猴桃褪绿环斑相关病毒(accrav)的检测具有特异性,以含有accrav病毒的猕猴桃样品cdna和鉴定确定含有其它病毒(猕猴桃病毒a,acva;猕猴桃病毒1,acv-1;柑橘叶斑驳病毒,clbv;黄瓜花叶病毒,cmv)的猕猴桃样品cdna为模板,进行等温扩增检测,得到各种病毒检测结果如图4所示:a:rt-lamp检测方法扩增病毒凝胶电泳结果图;b:rt-lamp-lfd横向流动试纸条检测结果图;1:受accrav感染的猕猴桃植株;2:受猕猴桃病毒1(acv-1)感染的猕猴桃植株;3:受猕猴桃病毒a(acva)感染的猕猴桃植株;4:受柑橘叶斑驳病毒(clbv)感染的猕猴桃植株;5:健康的猕猴桃植株;w:以无菌水为模板作空白对照。结果显示仅感染accrav的猕猴桃样品经rt-lamp检测出现了典型的阶梯状条带,检测结果呈阳性,空白对照和未感染accrav但感染了其他种类病毒的样品均无条带生成,结果为阴性。表明本发明方法与其他4种猕猴桃主要病毒(猕猴桃病毒a,acva;猕猴桃病毒1,acv-1;柑橘叶斑驳病毒,clbv;黄瓜花叶病毒,cmv)不发生交叉反应,本检测方法具有特异性。同时,结合lfd试纸条的可视化判读中,仅accrav阳性样本反应在试纸条中出现两条特异性条带,显示为阳性;而阴性和非accrav样本仅在质控线出现红色条带,表明检测结果呈阴性(图4b)。这表明,建立的rt-lamp-lfd检测方法可通过肉眼观察直接判断结果,简单快捷。
试验5:利用建立的rt-lamp-lfd检测方法对田间猕猴桃样品进行检测
琼脂糖凝胶电泳是常用的检测结果可视化的方法,具有较高准确性,但仪器设备昂贵。为了在田间样品上验证lfd试纸条可视化的准确性,采用rt-lamp方法检测15个猕猴桃样品受accrav受染情况,按照本发明的步骤进行检测。实验结果显示:rt-lamp凝胶成像显示结果和rt-lamp-lfd试纸条检测结果显示一致,即有10个样品显示accrav阳性,6个样品没有明显的条带,结果为阴性(图5a、b分别为rt-lamp检测疑似带毒猕猴桃样品中accrav凝胶电泳图和rt-lamp检测疑似带毒猕猴桃样品中accrav的横向流动试纸条lfd结果图)。这表明本发明rt-lamp(反转录-环介导等温扩增,reversetranscriptionloopmediatedisothermalamplification,rt-lamp)检测方法结合lfd横向流动试纸条可用于田间样品的检测。
本领域的普通技术人员将会意识到,这里所述的实施例是为了帮助读者理解本发明的原理,应被理解为本发明的保护范围并不局限于这样的特别陈述和实施例。本领域的普通技术人员可以根据本发明公开的这些技术启示做出各种不脱离本发明实质的其它各种具体变形和组合,这些变形和组合仍然在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!