制备固定化酶或固定化蛋白质的方法以及固定化酶或固定化蛋白质
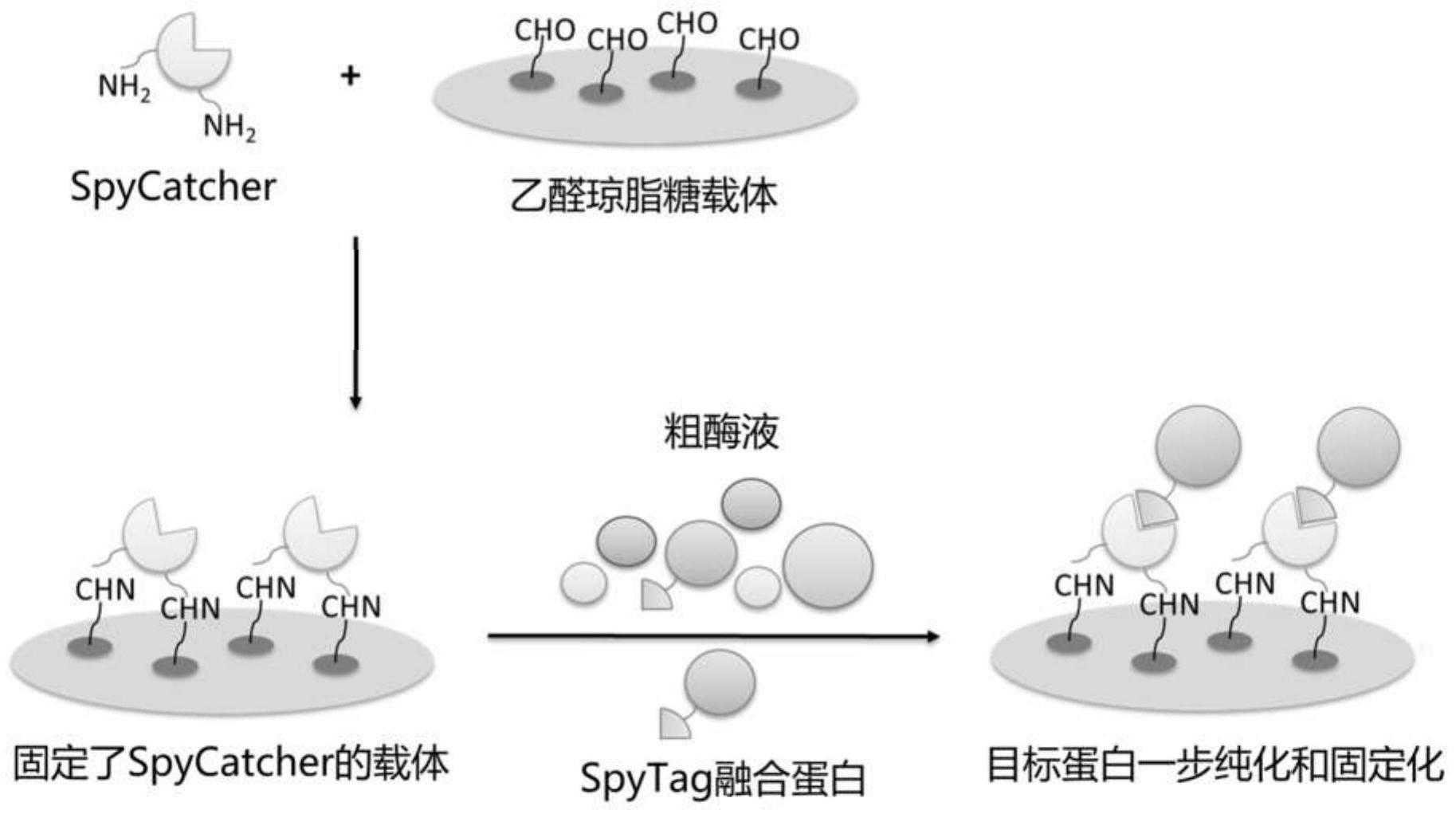
1.本发明涉及一种制备固定化酶或固定化蛋白质的方法,尤其涉及利用结合有spycatcher的载体将融合有spytag的目标酶或目标蛋白质从蛋白质混合物中纯化并固定到载体上来制备固定化酶或固定化蛋白质的方法,以及由该方法获得的固定化酶或固定化蛋白质。本发明还涉及一种共价结合有spycatcher的载体及其用于从蛋白质混合物中将n端或c端融合有spytag的目标酶或目标蛋白质选择性固定化的用途。
技术背景
2.酶(蛋白质)作为生物催化剂具有反应条件温和、选择性高、特异性高、转化率高等优点,因此,具有良好工业应用前景。然而,游离的酶由于其性质与工业要求相差甚远,因此,在工业应用上有很多限制。此外,目标酶经常与其他杂蛋白在制备过程中一同产生,这些杂蛋白常常需要用纯化方法来去除,而额外的纯化步骤必然会增加成本。另一方面,为了满足在工业应用中大规模使用的需要以及提高酶与反应液的分离效率,在工业应用中常常采用固定化酶。
3.通常,酶的纯化与酶的固定化是酶的工业应用中非常重要的两个环节。为了减少工艺步骤,提高效率,并降低成本,尝试了将酶的纯化与固定化在一个步骤中完成,例如,在gaberc-porekar v,menart v,gaberc-porekar v,et al.perspectives of immobilized-metal affinity chromatography[j].jbiochembiophysmethods.2001,49:335-360中报道了采用固定化金属亲和层析方法,但是,这种方法中需要使用氧化剂和还原剂,反应条件对酶而言不够温和,同时,这种方法中会出现金属离子浸出的情况,导致酶与载体的结合不够稳定。
技术实现要素:
[0004]
为了解决上述问题,本发明提供了一种简单的、条件温和的并且酶与载体的结合稳定的固定化酶或固定化蛋白质的制备方法,该方法通过一个步骤将目标酶或目标蛋白质与杂蛋白分离并使得目标酶或目标蛋白质与载体结合从而获得固定化酶或固定化蛋白质。所获得的固定化酶或固定化蛋白质具有高的稳定性,保持了高酶活性并能够满足工业应用需要。此外,本发明还提供了一种共价结合了spycatcher的载体,并涉及所述共价结合了spycatcher的载体在从蛋白质混合物中将n端或c端融合有spytag的目标酶或目标蛋白质进行选择性固定化的用途。
[0005]
上述问题是通过以下技术方案解决的。
[0006]
1.一种制备固定化酶或固定化蛋白质的方法,该方法包括:
[0007]-将spycatcher共价结合到载体上;
[0008]-构建在n端或c端融合有spytag的目标酶或目标蛋白质;
[0009]-使共价结合有spycatcher的载体与融合有spytag的目标酶或目标蛋白质相互接
no.8的基因编码序列,所述亮氨酸脱氢酶具有seq id no.9的基因编码序列。
[0028]
本发明的固定化酶或固定化蛋白质制备方法的优点是可以在一个步骤中将目标酶或目标蛋白质从蛋白质混合液中分离出来并进行固定化,具有高的固定化率,同时,获得的固定化酶保持高的酶活以及良好的热稳定性,获得的固定化蛋白质具有良好的热稳定性。
附图说明
[0029]
图1示意性地表示了以乙醛琼脂糖为载体的制备固定化酶或固定化蛋白质的过程。
具体实施方式
[0030]
除非另外说明,本发明提到的所有的出版物、专利申请、专利和其它参考文献都以引用的方式全文结合入本文中,相当于全文呈现于本文。
[0031]
除非另外定义,本文中使用的所有技术和科学术语具有本发明所属领域普通技术人员通常所理解的同样含义。在抵触的情况下,以本说明书包括定义为准。
[0032]
除非另外说明,所有的百分数、份数、比例等都以重量计。
[0033]
当以范围、优选范围、或者优选的数值上限以及优选的数值下限的形式表述某个量、浓度或其它值或参数的时候,应当理解相当于具体揭示了通过将任意一对范围上限或优选数值与任意范围下限或优选数值结合起来的任何范围,而不考虑该范围是否具体揭示。除非另外指出,本文所列出的数值范围旨在包括范围的端点,和该范围之内的所有整数和分数。
[0034]
在本文中,术语“由
……
形成”或“由
……
构成”等同于“包含/包括”。本文中所用的术语“包括”、“包含”、“具有”、“有”“含有”或它们的任意其他变体,是意图包括非排它性的包含。
[0035]
另外,用于本发明某种要素或组分之前的词语“一种”对该要素或组分的数量没有限制性。因此“一种”应理解为包括一种或至少一种,除非明确数量为单数,否则单数形式的所述要素或组分也包括复数的情况。
[0036]
除非有另外的说明,本发明的材料、方法和实施例仅仅是示例性的,而非限制性的。虽然在本发明的实施或测试中可以采用类似于或等同于本文所述的那些方法和材料,但本说明书下文已描述了合适的方法和材料。
[0037]
当使用术语“约”描述值或范围的端点时,应当被理解为包括具体的值或所涉及的端点的
±
10%、
±
5%、
±
3%或
±
1%范围内。在本发明中,提到的每个具体数值都应当被视为用“约”修饰。
[0038]
在本申请的一个方面,提供了一种制备固定化酶或固定化蛋白质的方法,该方法包括:
[0039]-将spycatcher共价结合到载体上;
[0040]-构建在n端或c端融合有spytag的目标酶或目标蛋白质;
[0041]-使共价结合有spycatcher的载体与融合有spytag的目标酶或目标蛋白质相互接触。
[0042]
在本申请中,spycatcher和spytag具有本领域常规的含义。spytag是一个多肽段,spycatcher是与之相对应的一个蛋白质,它们之间可以自发形成异肽键而共价结合(zakeri bf,j.o.;celik,e.;chittock,e.c.;schwarz-linek,u.;moy,v.t.;howarth,m.peptide tag forming a rapid covalent bond to a protein,through engineering a bacterial adhesin.proceedings of the national academy of sciences 2012;2012,109(12),:e690-e7.)。
[0043]
优选地,在本申请中,spycatcher具有seq id no.1的基因编码序列,或者具有seq id no.3的基因编码序列,或者具有seq id no.6的基因编码序列,或者具有seq id no.7的基因编码序列。
[0044]
在本申请中,为了从描述上方便区分,分别将具有seq id no.1的基因编码序列的spycatcher称为ospycatcher,将具有seq id no.6的基因编码序列的spycatcher称为aspycatcher,将具有seq id no.7的基因编码序列的spycatcher称为cspycatcher,将具有seq id no.3的基因编码序列的spycatcher称为mspycatcher。应当理解,上述ospycatcher、aspycatcher、cspycatcher、mspycatcher均涵盖在术语“spycatcher”的范围内。
[0045]
具有seq id no.3、seq id no.6或seq id no.7的基因编码序列的spycatcher是具有seq id no.1的基因编码序列的spycatcher的突变体。其中,具有seq id no.6的基因编码序列的spycatcher是在具有seq id no.1的基因编码序列的spycatcher的基础上,将蛋白c端增加多个赖氨酸肽链(lysglylysglylysgly)而获得的突变体;具有seq id no.7的基因编码序列的spycatcher是在具有seq id no.1的基因编码序列的spycatcher的基础上,将其28位、37位和64位的赖氨酸突变为精氨酸而获得的突变体;具有seq id no.3的基因编码序列的spycatcher是在具有seq id no.1的基因编码序列的spycatcher的基础上,组合了上述两种突变方式的突变体。
[0046]
在本发明的方法中,将spycatcher共价结合到载体上的方法是本领域常规的酶(蛋白质)固定化方法。此处的固定化方法是通过spycatcher中的氨基与载体上能够与氨基形成共价键的基团结合而进行。
[0047]
在本发明中,相对于结合有ospycatcher的载体,结合有aspycatcher、cspycatcher和mspycatcher的载体能够进一步地改进目标酶或目标蛋白质的固定化率以及固定化稳定性。不希望受理论的束缚,发明人认为,在ospycatcher的c端增加含多个赖氨酸的肽链(lysglylysglylysgly)(aspycatcher)能够使得其与载体进行定向固定化,且结合更牢固,将ospycatcher的28位、37位和64位的赖氨酸突变为精氨酸(cspycatcher)能够使得spycatcher在载体上的固定化方向更有利于后序对spytag的结合,因此,组合了这两种突变方式的mspycatcher更是兼具了这两个优点。
[0048]
通常,在载体是琼脂糖载体时,首先采用环氧丙醇和高碘酸钠对琼脂糖载体进行预处理,使其带有乙醛基,然后通过spycatcher中的氨基与载体上的醛基形成共价键而结合。在载体是环氧载体时,通常不需要对载体进行预处理,直接通过spycatcher中的氨基与载体上的环氧基形成共价键而结合。在采用本领域其它常规载体时,通过本领域技术已知处理或结合方法将spycatcher共价结合到载体上。
[0049]
优选地,本申请中的spytag具有seq id no.2的基因编码序列。
[0050]
在本申请中,spytag可以融合在目标酶或目标蛋白质的n端或c端。可以通过本领域常规方法将spytag肽段融合到目标酶或目标蛋白质的n端或c端,例如megawhop方法获得编码融合蛋白的基因。
[0051]
在本申请中,使共价结合有spycatcher的载体与融合有spytag的目标酶或目标蛋白质相互接触,接触条件没有特别的限制,例如可以在常温常压环境下,例如,在4℃-37℃(例如20℃-35℃)下接触,例如接触8-20小时,例如10-16小时,ph也没有特别的限制,只要适合蛋白质存在而不变性的条件即可,例如ph5-10,ph5.5-9。
[0052]
在本申请的另一方面涉及根据本发明的方法获得的固定化酶或固定化蛋白质。
[0053]
在本申请的又一方面涉及固定化酶或固定化蛋白质,包含
[0054]-载体;
[0055]-与所述载体共价结合的spycatcher;和
[0056]-在n端或c端融合有spytag的目标酶或目标蛋白质,
[0057]
其中,所述目标酶或目标蛋白质通过所述spytag与spycatcher共价结合而固定在载体上。
[0058]
前述对制备固定化酶或固定化蛋白质的方法中的描述和定义同样适用于本方面的固定化酶或固定化蛋白质。
[0059]
在本申请的又一方面涉及共价结合有spycatcher的载体,前述对制备固定化酶或固定化蛋白质的方法中的描述的将spycatcher与载体共价结合的内容也适合此方面。
[0060]
在本申请的又一方面涉及共价结合有spycatcher的载体用于从蛋白质混合物中将n端或c端融合有spytag的目标酶或目标蛋白质选择性固定化的用途,前述对制备固定化酶或固定化蛋白质的方法中的描述和定义同样适用于本方面的用途。
[0061]
实施例
[0062]
以下通过实施例更详细地介绍本发明,但是应当理解本发明的范围并不局限于实施例。
[0063]
实施例中使用的测定和计算方法:
[0064]
1)酶的热稳定性
[0065]
将游离酶或固定化酶在60℃温育,并以规则的间隔取出样品以测定残留活性。
[0066]
2)绿色荧光蛋白(gfp)的固定化率
[0067]
使用多功能酶标仪分别在488nm和508nm的激发和发射波长下测量游离gfp和固定化gfp在100mm磷酸盐缓冲液(pb),温度28℃,ph 8.5中的荧光强度。
[0068]
spytag-gfp固定化率的计算方法为:
[0069]
spytag-gfp固定化率=(固定化零时刻上清中spytag-gfp荧光-固定化结束时上清中spytag-gfp残余荧光)/固定化零时刻上清中spytag-gfp荧光
×
100%
[0070]
3)l-苯丝氨酸醛缩酶(lpa)活性和固定化率
[0071]
lpa酶活定义:在30℃、ph为8.5和l-苯丝氨酸浓度为10mmol/l的条件下,每分钟催化l-苯丝氨酸生成1μmol苯甲醛所需的酶量为1个活力单位(u)。
[0072]
用enspire2300多功能酶标仪在30℃下在紫外290nm处测定生成苯甲醛的浓度而计算酶活。
[0073]
spytag-lpa固定化率的计算方法为:
[0074]
spytag-lpa固定化率=(固定化零时刻上清中spytag-lpa酶活-固定化结束时上清中spytag-lpa酶活)/固定化零时刻上清中spytag-lpa酶活
×
100%
[0075]
4)亮氨酸脱氢酶活性(ldh)的酶活和固定化率
[0076]
ldh酶活定义:用900mm ph=9.5的nh
3-nh4cl缓冲液配制含4.5mm 2-丁酮酸和0.204mm nadh的底物溶液,用enspire2300多功能酶标仪在30℃下检测酶活,每分钟催化消耗1μmol nadh所需的酶量定义为1u。
[0077]
用enspire2300多功能酶标仪在30℃下在紫外340nm处测定nadh浓度变化值和时间计算酶活。
[0078]
spytag-ldh固定化率的计算方法为:
[0079]
spytag-ldh固定化率=(固定化零时刻上清中spytag-ldh酶活-固定化结束时上清中spytag-ldh酶活)/固定化零时刻上清中spytag-ldh酶活
×
100%
[0080]
实施例a:结合有spycatcher的载体的制备
[0081]
构建spycatcher基因工程表达菌及培养
[0082]
使用megawhop(sanchis j,layla fern
á
ndez,carballeira j d,et al.improved pcr method for the creation of saturation mutagenesis libraries in directed evolution:application to difficult-to-amplify templates[j].applied microbiology and biotechnology,2008,81(2):387-397.)的方法,以具有seq id no.5的基因编码序列的pet28a spytag-gfp-spycatcher为模板,构建pet28a-ospycatcher;采用seq id no.14和seq id no.15的dna序列的引物,通过pcr得到第一轮pcr产物,再用第一轮pcr产物作为第二轮全质粒扩增时的长引物进行pcr获得第二轮pcr产物,将megawhop所得第二轮pcr产物进行dpni酶解,然后将dpni酶解转化e.coli bl21(de3)感受态细胞,通过质粒的dna测序验证,得到基因工程菌株e.coli bl21(de3)/pet28a-ospycatcher。
[0083]
以pet28a-ospycatcher为模板,采用seq id no.16和seq id no.17dna序列的引物,通过megawhop的方法构建具有seq id no.6的基因编码序列的在c-端加多赖氨酸肽链(lysglylysglylysgly)的突变体(aspycatcher,基因编码序列seq id no.6),通过测序验证,最终获得基因工程菌株e.coli bl21(de3)/pet28a-aspycatcher。
[0084]
同样,以pet28a-ospycatcher为模板,采用seq id no.18、seq id no.19、seq id no.20和seq id no.21dna序列的引物,通过megawhop的方法构建将三个赖氨酸(28位、37位、64位)突变为精氨酸的突变体(cspycatcher,基因编码序列seq id no.7),最终获得基因工程菌株e.coli bl21(de3)/pet28a-cspycatcher。
[0085]
最后,将这两种突变方法结合起来,构建突变体(mspycatcher),以cspycatcher为模板,采用seq id no.16和seq id no.17dna序列的引物,通过megawhop的方法,用构建aspycatcher时的引物进行pcr,得到突变体mspycatcher(基因编码序列seq id no.3),构建得到的基因工程菌为e.coli bl21(de3)/pet28a-mspycatcher。
[0086]
在lb培养基中,37℃,200r/min,对基因工程大肠杆菌bl21(de3)/pet28a-ospycatcher、bl21(de3)/pet28a-mspycatcher、bl21(de3)/pet28a-aspycatcher、bl21(de3)/pet28a-cspycatcher进行培养12h,以1%接种量接种到乳糖培养基中,28℃,200r/min,培养24h。4000rpm离心10min收获菌体。其中,lb培养基和乳糖培养基成分如下:
[0087]
lb培养基:1%的nacl,1%的蛋白胨、0.5%的酵母粉和50μg/ml的卡那霉素。
[0088]
乳糖自诱导培养基:蛋白胨10g/l,酵母粉5g/l,na2hpo
4 8.95g/l,kh2po
4 3.4g/l,nh4cl 2.67g/l,na2so
4 0.7g/l,mgso
4 0.24g/l,甘油5g/l,葡萄糖0.5g/l,乳糖2g/l,50μg/ml的卡那霉素。
[0089]
spycatcher的纯化
[0090]
将收获的菌体分别用0.1m的磷酸盐缓冲液(ph8.5)重悬,超声波破碎菌体。超声的条件是:超声5秒,间隔5秒,99个循环,超声功率200w,共破碎两次。4℃下,20000rpm离心5min,上清液即为包含spycatcher的蛋白液。
[0091]
将各种spycatcher蛋白液分别加载到ni-nta树脂柱上,调节其ph值至ph8.5,用30mm咪唑缓冲液洗涤柱子,洗去杂蛋白,再用200mm咪唑缓冲液洗脱,得到各种spycatcher纯化液,即ospycatcher纯化液、aspycatcher纯化液、cspycatcher纯化液和mspycatcher纯化液。4℃保存备用。
[0092]
i)固定在乙醛琼脂糖载体上
[0093]
在常温下将洗涤的6%交联琼脂糖称取5.6g,在冰浴中缓慢加入1mnaoh和0.5m nabh4混合液4ml,然后加入1.6ml环氧丙醇(终浓度2m),25℃,200rpm摇床中反应15h。将搅拌好的琼脂糖洗涤,抽干。称取5g加入43ml去离子水,再向其中加入0.23g高碘酸钠(终浓度20mm)。25℃,100rpm摇床2h。用大量去离子水(500ml)洗涤载体,抽滤。
[0094]
称取1g载体,分别加入不同量的上述spycatcher纯化液以及0.2m碳酸氢钠缓冲液,将体系ph调节至10。25℃,100rpm摇床3h,3h后用加入一定量的硼氢化钠,使其终浓度为1mg/ml,室温下温和搅拌30min,用25mm的ph8.0的磷酸缓冲液洗涤,抽干。分别得到ospycatcher-琼脂糖载体、aspycatcher-琼脂糖载体、cspycatcher-琼脂糖载体和mspycatcher-琼脂糖载体。洗涤、抽干后备用。
[0095]
ii)固定在环氧基载体上
[0096]
称取1g载体,分别加入不同量的上述spycatcher纯化液体以及1.25m磷酸缓冲液,将体系ph调节至8。25℃,200rpm摇床24h,分别得到ospycatcher-环氧基载体、aspycatcher-环氧基载体、cspycatcher-环氧基载体和mspycatcher-环氧基载体。洗涤、抽干后备用。
[0097]
实施例b:融合了spytag的酶或蛋白质的制备
[0098]
使用megawhop的方法,以前述的pet28a spytag-gfp-spycatcher为模板,构建具有seq id no.4的pet28a-spytag-gfp,采用seq id no.12和seq id no.13dna序列的引物,通过pcr得到第一轮pcr产物,再用第一轮pcr产物作为第二轮全质粒扩增时的长引物进行pcr,得到第二轮pcr产物。将megawhop所得第二轮pcr产物进行dpni酶解,然后将dpni酶解转化e.coli bl21(de3)感受态细胞,通过测序验证,得到基因工程菌株e.coli bl21(de3)/pet28a-spytag-gfp。用goldengate(engler,c.,&marillonnet,s.(2014).golden gate cloning.in dna cloning and assembly methods(pp.119-131).humana press,totowa,nj.)的方法将pet-spytag-gfp中的gfp换成具有seq id no.8基因编码序列的l-苯丝氨酸醛缩酶(lpa)和具有seq id no.9基因编码序列的亮氨酸脱氢酶(ldh)。
[0099]
首先需要构建含有bsai酶切位点的质粒骨架(pet-spytag质粒骨架)和目的片段(lpa和ldh),构建质粒骨架时采用具有seq id no.22和seq id no.23的引物,构建目的片段(lpa和ldh)时采用具有seq id no.24、seq id no.25、seq id no.26和seq id no.27的
引物,使用goldengate的方法,通过酶切连接的方式得到重组质粒pet-spytag-lpa(spytag-lpa的基因编码序列为seq id no.10)和pet-spytag-ldh(spytag-ldh的基因编码序列为seq id no.11)。
[0100]
在lb培养基中,37℃,200r/min,对基因工程大肠杆菌bl21(de3)/pet28a-spytag-gfp、bl21(de3)/pet28a-spytag-lpa或bl21(de3)/pet-spytag-ldh进行培养12h,以1%接种量接种到乳糖培养基中,28℃,200r/min,培养24h。4000rpm离心10min收获菌体。其中,lb培养基和乳糖培养基成分如下:
[0101]
lb培养基:1%的nacl,1%的蛋白胨、0.5%的酵母粉和50μg/ml的卡那霉素。
[0102]
乳糖自诱导培养基:蛋白胨10g/l,酵母粉5g/l,na2hpo
4 8.95g/l,kh2po
4 3.4g/l,nh4cl 2.67g/l,na2so
4 0.7g/l,mgso
4 0.24g/l,甘油5g/l,葡萄糖0.5g/l,乳糖2g/l,50μg/ml的卡那霉素。
[0103]
将收获的菌体分别用0.1m的磷酸盐缓冲液(ph8.5)重悬,超声波破碎菌体。超声的条件是:超声5秒,间隔5秒,99个循环,超声功率200w,共破碎两次。4℃下,20000rpm离心5min,上清液即为包含融合了spytag的目标蛋白(spytag-gfp、spytag-lpa或spytag-ldh)的杂蛋白液。
[0104]
实施例c1:固定化gfp:ospycatcher-琼脂糖载体+spytag-gfp
[0105]
如实施例a制备ospycatcher-琼脂糖载体,每克载体使用1mgospycatcher进行固定化。
[0106]
将制得的ospycatcher-琼脂糖载体与上述实施例b制备的spytag-gfp在离心管中混合,每克ospycatcher-琼脂糖载体加入5mg的spytag-gfp,置于28℃,用hcl调节ph=5.5。
[0107]
在混合零时刻取样上清液,并在混合20h后取样上清液,如前所述测量上清液的荧光值。按照前述公式计算,经过20h,spytag-gfp在ospycatcher-琼脂糖载体上的的固定化率为40.78%。
[0108]
实施例c2:固定化gfp:mspycatcher-琼脂糖载体+spytag-gfp
[0109]
如实施例a制备mspycatcher-琼脂糖载体,每克载体使用1mgmspycatcher进行固定化。
[0110]
将制得的mspycatcher-琼脂糖载体与上述实施例b制备的spytag-gfp在离心管中混合,每克mspycatcher-琼脂糖载体加入5mg的spytag-gfp,置于28℃,用hcl调节ph=5.5。
[0111]
在混合零时刻取样上清液,并在混合20h后取样上清液,如前所述测量上清液的荧光值。按照前述公式计算,经过20h,spytag-gfp在mspycatcher-琼脂糖载体上的固定化率为55.56%。
[0112]
实施例c3:固定化gfp:ospycatcher-琼脂糖载体+spytag-gfp
[0113]
如实施例a制备ospycatcher-琼脂糖载体,每克载体使用5mgospycatcher进行固定化。
[0114]
将制得的ospycatcher-琼脂糖载体与上述实施例b制备的spytag-gfp在离心管中混合,每克ospycatcher-琼脂糖载体加入5mg的spytag-gfp,置于30℃,用hcl调节ph=6.5。
[0115]
在混合零时刻取样上清液,并在混合16h后取样上清液,如前所述测量上清液的荧光值。按照前述公式计算,经过16h,spytag-gfp在ospycatcher-琼脂糖载体上的固定化率为71.21%。
[0116]
实施例c4:固定化gfp:mspycatcher-琼脂糖载体+spytag-gfp
[0117]
如实施例a制备mspycatcher-琼脂糖载体,每克载体使用5mgmspycatcher进行固定化。
[0118]
将制得的mspycatcher-琼脂糖载体与上述实施例b制备的spytag-gfp在离心管中混合,每克mspycatcher-琼脂糖载体加入5mg的spytag-gfp,置于30℃,用hcl调节ph=6.5。
[0119]
在混合零时刻取样上清液,并在混合16h后取样上清液,如前所述测量上清液的荧光值。按照前述公式计算,经过16h,spytag-gfp在mspycatcher-琼脂糖载体上的固定化率为82.90%。
[0120]
实施例c5:固定化lpa:ospycatcher-琼脂糖载体+spytag-lpa
[0121]
如实施例a制备ospycatcher-琼脂糖载体,每克载体使用5mgospycatcher进行固定化。
[0122]
将制得的ospycatcher-琼脂糖载体与上述实施例b制备的spytag-lpa在离心管中混合,每克ospycatcher-琼脂糖载体加入5mg的spytag-lpa,置于25℃,用hcl调节ph=7.5。
[0123]
在混合零时刻取样上清液,并在混合22h后取样上清液,如前所述测量上清液的酶活。按照前述公式计算,经过22h,spytag-lpa在ospycatcher-琼脂糖载体上的固定化率为59%。
[0124]
热稳定性:
[0125]
按照前述的测定方法,分别测定游离lpa酶与本实施例中固定化spytag-lpa的热稳定性。
[0126]
0时刻游离lpa酶酶活为9.50u/ml,100min后游离lpa酶酶活为2.67u/ml,残余酶活比例为28.13%。
[0127]
0时刻固定化lpa酶酶活26.96u/g,100min后固定化lpa酶酶活16.17u/g,残余酶活比例为59.96%。
[0128]
实施例c6:固定化lpa:mspycatcher-琼脂糖载体+spytag-lpa
[0129]
如实施例a制备mspycatcher-琼脂糖载体,每克载体使用5mgmspycatcher进行固定化。
[0130]
将制得的mspycatcher-琼脂糖载体与上述实施例b制备的spytag-lpa在离心管中混合,每克mspycatcher-琼脂糖载体加入5mg的spytag-lpa,置于25℃,用hcl调节ph=7.5。
[0131]
在混合零时刻取样上清液,并在混合22h后取样上清液,如前所述测量上清液的酶活。按照前述公式计算,经过22h,spytag-lpa在mspycatcher-琼脂糖载体上的固定化率为73%。
[0132]
热稳定性:
[0133]
按照前述的测定方法,分别测定游离lpa酶与本实施例中固定化spytag-lpa的热稳定性。
[0134]
0时刻游离酶lpa酶活为9.50u/ml,100min后游离lpa酶酶活为2.67u/ml,残余酶活比例为28.13%。
[0135]
0时刻固定化lpa酶酶活34.07u/g,100min后固定化lpa酶酶活22.84u/g,残余酶活比例为67.05%。
[0136]
实施例c7:固定化ldh:ospycatcher-琼脂糖载体+spytag-ldh
[0137]
如实施例a制备ospycatcher-琼脂糖载体,每克载体使用5mgospycatcher进行固定化。
[0138]
将制得的ospycatcher-琼脂糖载体与上述实施例b制备的spytag-ldh在离心管中混合,每克ospycatcher-琼脂糖载体加入5mg的spytag-ldh,置于20℃,ph=8.5。
[0139]
在混合零时刻取样上清液,并在混合15h后取样上清液,如前所述测量上清液的酶活。按照前述公式计算,经过15h,spytag-ldh在ospycatcher-琼脂糖载体上的固定化率为54%。
[0140]
热稳定性:
[0141]
按照前述的测定方法,分别测定游离ldh酶与本实施例中固定化spytag-ldh的热稳定性。
[0142]
0时刻游离ldh酶酶活为12.72u/ml,100min后游离ldh酶酶活2.83u/ml,残余酶活比例为22.24%。
[0143]
0时刻固定化ldh酶酶活为15.92u/g,100min后固定化ldh酶酶活为14.68u/g,残余酶活比例为92.19%。
[0144]
实施例c8:固定化ldh:mspycatcher-琼脂糖载体+spytag-ldh
[0145]
如实施例a制备mspycatcher-琼脂糖载体,每克载体使用5mgmspycatcher进行固定化。
[0146]
将制得的mspycatcher-琼脂糖载体与上述实施例b制备的spytag-ldh在离心管中混合,每克mspycatcher-琼脂糖载体加入5mg的spytag-ldh,置于20℃,ph=8.5。
[0147]
在混合零时刻取样上清液,并在混合15h后取样上清液,如前所述测量上清液的酶活。按照前述公式计算,经过15h,spytag-ldh在mspycatcher-琼脂糖载体上的固定化率为85%。
[0148]
热稳定性:
[0149]
按照前述的测定方法,分别测定游离ldh酶与本实施例中固定化spytag-ldh的热稳定性。
[0150]
0时刻游离ldh酶酶活为12.72u/ml,100min后游离ldh酶酶活2.83u/ml,残余酶活比例为22.24%;
[0151]
0时刻固定化ldh酶酶活为23.46u/g,100min后固定化ldh酶酶活为22.29u/g,残余酶活比例为95.02%。
[0152]
实施例c9:固定化gfp:aspycatcher-琼脂糖载体+spytag-gfp
[0153]
如实施例a制备aspycatcher-琼脂糖载体,每克载体使用5mgaspycatcher进行固定化。
[0154]
将制得的aspycatcher-琼脂糖载体与上述实施例b制备的spytag-gfp在离心管中混合,每克aspycatcher-琼脂糖载体加入5mg的spytag-gfp,置于28℃,用hcl调节ph=7.5。
[0155]
在混合零时刻取样上清液,并在混合20h后取样上清液,如前所述测量上清液的荧光值。按照前述公式计算,经过20h,spytag-gfp在aspycatcher-琼脂糖载体上的的固定化率为76.78%。
[0156]
实施例c10:固定化gfp:cspycatcher-琼脂糖载体+spytag-gfp
[0157]
如实施例a制备cspycatcher-琼脂糖载体,每克载体使用5mgcspycatcher进行固
定化。
[0158]
将制得的cspycatcher-琼脂糖载体与上述实施例b制备的spytag-gfp在离心管中混合,每克cspycatcher-琼脂糖载体加入5mg的spytag-gfp,置于28℃,用hcl调节ph=7.5。
[0159]
在混合零时刻取样上清液,并在混合20h后取样上清液,如前所述测量上清液的荧光值。按照前述公式计算,经过20h,spytag-gfp在cspycatcher-琼脂糖载体上的的固定化率为77.30%。
[0160]
实施例c11:固定化gfp:ospycatcher-环氧基载体+spytag-gfp
[0161]
如实施例a制备ospycatcher-环氧基载体,每克载体使用20mgospycatcher进行固定化。
[0162]
将制得的ospycatcher-环氧基载体与上述实施例b制备的spytag-gfp在离心管中混合,每克aspycatcher-环氧基载体加入5mg的spytag-gfp,置于28℃,用hcl调节ph=7.5。
[0163]
在混合零时刻取样上清液,并在混合14h后取样上清液,如前所述测量上清液的荧光值。按照前述公式计算,经过14h,spytag-gfp在ospycatcher-环氧基载体上的的固定化率为50.0%。
[0164]
实施例c12:固定化gfp:mspycatcher-环氧基载体+spytag-gfp
[0165]
如实施例a制备mspycatcher-环氧基载体,每克载体使用20mgmspycatcher进行固定化。
[0166]
将制得的mspycatcher-环氧基载体与上述实施例b制备的spytag-gfp在离心管中混合,每克mspycatcher-环氧基载体加入5mg的spytag-gfp,置于28℃,用hcl调节ph=7.5。
[0167]
在混合零时刻取样上清液,并在混合14h后取样上清液,如前所述测量上清液的荧光值。按照前述公式计算,经过14h,spytag-gfp在mspycatcher-环氧基载体上的的固定化率为72.0%。
[0168]
对比例1:空白乙醛琼脂糖载体+spytag-gfp
[0169]
如实施例a制备空白乙醛琼脂糖载体,即称取1g活化好的乙醛琼脂糖载体,加入去离子水以及0.2m碳酸氢钠缓冲液,将体系ph调节至10。25℃,100rpm摇床3h,得到空白乙醛琼脂糖载体。
[0170]
将制得的空白乙醛琼脂糖载体与上述实施例b制备的spytag-gfp在离心管中混合,每克空白乙醛琼脂糖载体加入5mg的spytag-gfp,置于28℃,用hcl调节ph=8.0。
[0171]
在混合零时刻取样上清液,并在混合20h后取样上清液,如前所述测量上清液的荧光值。按照前述公式计算,经过20h,spytag-gfp在空白乙醛琼脂糖载体上的固定化率为约0%。同时,在荧光显微镜下检测,经过固定化处理的空白乙醛琼脂糖载体颗粒无荧光。
[0172]
对比例2:空白乙醛琼脂糖载体+spytag-lpa
[0173]
如对比例1制备空白乙醛琼脂糖载体。
[0174]
将制得的空白乙醛琼脂糖载体与上述实施例b制备的spytag-lpa在离心管中混合,每克空白乙醛琼脂糖载体加入5mg的spytag-lpa,置于25℃,用hcl调节ph=7.5。
[0175]
在混合零时刻取样上清液,并在混合22h后取样上清液,如前所述测量上清液的酶活。按照前述公式计算,经过22h,spytag-lpa在空白乙醛琼脂糖载体上的固定化率为约0%。同时,经过固定化的空白乙醛琼脂糖载体颗粒没有检测到酶活。
[0176]
对比例3:空白乙醛琼脂糖载体+spytag-ldh
[0177]
如对比例1制备空白乙醛琼脂糖载体。
[0178]
将制得的空白乙醛琼脂糖载体与上述实施例b制备的spytag-ldh在离心管中混合,每克空白乙醛琼脂糖载体加入5mg的spytag-ldh,置于30℃,ph=8.5。
[0179]
在混合零时刻取样上清液,并在混合15h后取样上清液,如前所述测量上清液的酶活。按照前述公式计算,经过15h,spytag-ldh在空白乙醛琼脂糖载体上的固定化率为约0%。同时,经过固定化的空白乙醛琼脂糖载体颗粒没有检测到酶活。
[0180]
对比例4:空白环氧基载体+spytag-gfp
[0181]
如实施例a制备空白环氧基载体,即称取1g环氧基载体,加入去离子水以及1.25m磷酸盐缓冲液,将体系ph调节至8-9。25℃,200rpm摇床24h,得到空白环氧基载体。
[0182]
将制得的空白环氧基载体与上述实施例b制备的spytag-gfp在离心管中混合,每克空白环氧基载体加入5mg的spytag-gfp,置于28℃,ph=8.5。
[0183]
在混合零时刻取样上清液,并在混合20h后取样上清液,如前所述测量上清液的荧光值。按照前述公式计算,经过20h,spytag-gfp在空白环氧基载体上的固定化率为约0%。同时,在荧光显微镜下检测,经过固定化的空白乙环氧基载体颗粒无荧光。
[0184]
最后所应说明的是:以上实施例仅用以说明而非限制本发明的技术方案,尽管参照上述实施例对本发明进行了详细说明,本领域的普通技术人员应该理解:依然可以对本发明进行修改或者等同替换;而不脱离本发明的精神和范围的任何修改或局部替换,均应涵盖在本发明的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1