检测猪流行性腹泻病毒野毒株的特异性引物、试剂盒及方法与流程
本发明涉及一种检测猪流行性腹泻病毒野毒株的特异性引物、试剂盒及方法,属于分子生物学技术领域。
背景技术:
猪流行性腹泻(porcineepidemicdiarrhea,ped)是由猪流行性腹泻病毒(porcineepidemicdiarrheavirus,pedv)引起的一种猪的急性、高度接触性肠道传染病。不同年龄阶段的猪只均可感染,本病对哺乳仔猪的危害最大,7日龄以内的仔猪感染后死亡率可高达100%。近年来,由pedv变异毒株导致的ped再度流行,给世界养猪业造成了巨大经济损失。未经传代致弱的pedv野毒株orf3包含675个核苷酸,编码含224个氨基酸残基的多肽,而致弱的疫苗毒株orf3基因会出现部分片段缺失。根据基因序列差异,可以在此处设计鉴别引物,用于猪流行性腹泻病毒野毒株和疫苗毒株的区分。
荧光定量pcr技术是通过荧光染料或荧光探针,对pcr产物进行标记跟踪,利用荧光信号的积累实时监测pcr进程。当前关于pedv荧光定量检测方法报道较多,然而借助染料法荧光定量pcr来特异性检测猪流行性腹泻病毒野毒株的研究未见报道。
技术实现要素:
针对上述现有技术,本发明以猪流行性腹泻病毒野毒株(yn15毒株genbank:kt021228.1))和疫苗毒株(cv777kt323979.1)为研究对象,建立了特异性检测猪流行性腹泻病毒野毒株的荧光定量pcr方法,提供了检测猪流行性腹泻病毒野毒株的特异性引物、试剂盒以及方法。
本发明是通过以下技术方案实现的:
检测猪流行性腹泻病毒野毒株的特异性引物,包括pedv-δorf3-f1和pedv-δorf3-r1,核苷酸序列如下所示(5’-3’):
pedv-δorf3-f1:gcccacttttatattactg,如seqidno.1所示;
pedv-δorf3-r1:ctgccaataagtgtgcaac,如seqidno.2所示。
上述检测猪流行性腹泻病毒野毒株的特异性引物在制备检测猪流行性腹泻病毒野毒株的试剂盒中的应用。
检测猪流行性腹泻病毒野毒株的试剂盒,包括上述特异性引物,以及检测所必须的试剂。
进一步地,所述检测猪流行性腹泻病毒野毒株的试剂盒中还包括:猪流行性腹泻病毒野毒株阳性对照品,猪流行性腹泻病毒疫苗毒株阳性对照品、阴性对照品和空白对照品。
进一步地,所述检测所必须的试剂,包括2×m5hipersybrpremixestap、cdna模板和双蒸水。
所述检测猪流行性腹泻病毒野毒株的试剂盒在检测猪流行性腹泻病毒野毒株中的应用。
一种检测猪流行性腹泻病毒野毒株的方法:提取待检测样品组织中的病毒rna,反转录为cdna,利用上述特异性引物或试剂盒对cdna进行pcr扩增;结果判断:若有扩增产物,则为阳性,若无扩增产物,则为阴性。
进一步地,pcr扩增的反应体系如下:20μlpcr扩增体系为:2×m5hipersybrpremixestap10μl,pedv-δorf3-f1和pedv-δorf3-r1各0.5μl,引物终浓度为2~5μm,0.5~50ng/μl的dna模板2μl,双蒸水补足20μl。
进一步地,pcr扩增的反应条件如下:预变性95℃,30s,扩增程序:95℃,5s;60℃,30s,40个循环。
进一步地,设置猪流行性腹泻病毒野毒株阳性对照,猪流行性腹泻病毒疫苗毒株阳性对照、阴性对照和空白对照。
进一步地,pcr扩增在荧光定量pcr仪上进行,判断时可根据荧光信号进行定性,或定量检测。
本发明的特异性引物,试剂盒,及检测方法,具有高度的特异性与专一性,并且扩增效率高,灵敏度好,准确率高,重现性好,检测周期短,具有很高的可行性与应用前景。
本发明使用的各种术语和短语具有本领域技术人员公知的一般含义。提及的术语和短语如有与公知含义不一致的,以本发明所表述的含义为准。
附图说明
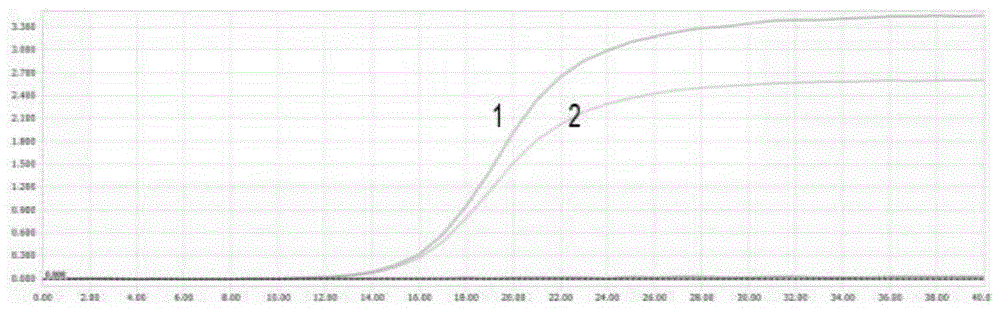
图1:猪流行性腹泻病毒野毒株不同引物对的扩增曲线图,横坐标为cq值,纵坐标为荧光强度,从扩增曲线中可以得出,pedv-δorf3-f1/r1组引物具最高的扩增效率。
图2:猪流行性腹泻病毒野毒株检测引物对不同退火温度的扩增曲线图,从扩增曲线中可以得出,pedv-δorf3-f1/r1组引物于60℃时扩增效率最高,且仅针对猪流行性腹泻病毒野毒株扩增。
图3:猪流行性腹泻病毒野毒株检测引物对不同浓度扩增曲线图,从扩增曲线中可以得出,pedv-δorf3-f1/r1组引物在0.5μl/wall时具最高的扩增效率,且仅针对猪流行性腹泻病毒野毒株扩增。
图4:猪流行性腹泻病毒野毒株分别为5.9×108copies/ml、5.9×107copies/ml、5.9×106copies/ml、5.9×105copies/ml、5.9×104copies/ml、5.9×103copies/ml、5.9×102copies/ml、5.9×101copies/ml、5.9×100copies/ml时的灵敏度扩增曲线图,从扩增曲线中可以得出,pedv-δorf3-f1/r1组引物对的扩增极值于5.9×102copies/ml,且仅针对猪流行性腹泻病毒野毒株扩增。
图5:猪流行性腹泻pedv-δorf3-f1/r1组引物对特异性检测,从扩增曲线中可以得出,pedv-δorf3-f1/r1组引物具良好的特异性。
具体实施方式
下面结合实施例对本发明作进一步的说明。然而,本发明的范围并不限于下述实施例。本领域的专业人员能够理解,在不背离本发明的精神和范围的前提下,可以对本发明进行各种变化和修饰。
本发明对试验中所使用到的材料以及试验方法进行一般性和/或具体的描述。虽然为实现本发明目的所使用的许多材料和操作方法是本领域公知的,但是本发明仍然在此作尽可能详细描述。
下述实施例中所涉及的仪器、试剂、材料等,若无特别说明,均为现有技术中已有的常规仪器、试剂、材料等,可通过正规商业途径获得。下述实施例中所涉及的实验方法,检测方法等,若无特别说明,均为现有技术中已有的常规实验方法,检测方法等。
本发明中所用的实验材料、试剂与仪器:
1、实验材料:猪流行性腹泻病毒野毒株(pedv-yn15)、猪流行性腹泻病毒疫苗毒株(cv777)、猪轮状病毒(rv)、猪伪狂犬病病毒(prv)、猪繁殖与呼吸综合征病毒(prrsv)、猪圆环病毒2型(pcv2)、猪传染性胃肠炎病毒(tgev)。
2、主要试剂magabioplusvirusdna/rnapurificationkit购自杭州博日科技有限公司;hiscriptcdna第一链合成试剂盒购自北京康润诚业生物科技有限公司;引物由abi公司的primerexpresssoftwarev2.0设计,由上海生工生物工程技术服务有限公司合成。
3、所用仪器:lightcycler96荧光定量pcr仪为roche公司产品,pcr仪为thermofisher公司产品。
实施例1检测猪流行性腹泻病毒野毒株的特异性引物、试剂盒及方法
1.1引物设计与合成
序列参照genebank数据库中各目的基因的序列,设计能扩增猪流行性腹泻病毒野毒株的特异性引物,引物由abi公司的primerexpresssoftwarev2.0设计,由上海生工生物工程技术服务有限公司合成,置-20℃保存备用。
设计得到了3对引物,其核苷酸序列如表1所示。
表1引物的核苷酸序列
1.2病毒核酸提取和cdna合成
magabioplusvirusdna/rnapurificationkit提取病毒rna,用takara反转录试剂盒对病毒rna进行反转录:按照rna8μl,5×反转录酶2μl配制成10μl溶液,37℃,30min;85℃,5s;4℃,保存。所得的样品即为目的cdna。
1.3荧光定量pcr反应条件的优化
反应体系见表2。
表2rt-pcr反应扩增体系(20μl)
1.4荧光定量pcr扩增条件为:预变性95℃,30s;95℃,5s,60℃,30s,40个循环。
利用设计的引物对猪流行性腹泻病毒野毒株进行扩增,扩增条件为:扩增总体系为20ul,其中2×m5hiperpremixestap10ul,cdna2ul,primer-f0.5ul,primer-r0.5ul,ddh2o7ul;扩增条件为预变性95℃,30s;95℃,5s,60℃,30s,40个循环。
,扩增曲线如图1所示(其中,1为pedv-δorf3-f1/r1组引物的扩增曲线,2为pedv-δorf3-f2/r2组引物的扩增曲线,3为pedv-δorf3-f/r组引物,因引物特异性不好,并未出现扩增曲线,所以图中仅有两条扩增曲线),从扩增曲线中可以得出,pedv-δorf3-f1/r1组引物具最高的扩增效率。
利用pedv-δorf3-f1/r1组引物在不同退火温度下对猪流行性腹泻病毒野毒株进行扩增,扩增条件如上述所述(退火温度分别设置为50℃、52.8℃、58℃、60℃),扩增曲线如图2所示(在反应体系不变的情况下,1为50℃时pedv-δorf3-f1/r1组引物扩增曲线,2为52.8℃时pedv-δorf3-f1/r1组引物扩增曲线,3为58℃时pedv-δorf3-f1/r1组引物扩增曲线,4为60℃时pedv-δorf3-f1/r1组引物扩增曲线),从扩增曲线中可以得出,pedv-δorf3-f1/r1组引物于60℃时扩增效率最高。
利用pedv-δorf3-f1/r1组引物在不同浓度下对猪流行性腹泻病毒野毒株进行扩增,扩增条件为:扩增体系分别为2×m5hiperpremixestap10ul,cdna2ul,pedv-δorf3-f10.5ul,pedv-δorf3-r10.5ul,ddh2o7ul;2×m5hiperpremixestap10ul,cdna2ul,pedv-δorf3-f10.4ul,pedv-δorf3-r10.4ul,ddh2o7.2ul;2×m5hiperpremixestap10ul,cdna2ul,pedv-δorf3-f10.3ul,pedv-δorf3-r10.3ul,ddh2o7.4ul;2×m5hiperpremixestap10ul,cdna2ul,pedv-δorf3-f10.2ul,pedv-δorf3-r10.2ul,ddh2o7.6ul;扩增条件为预变性95℃,30s;95℃,5s,60℃,30s,40个循环,扩增曲线如图3所示(1为引物浓度为0.2ul时扩增曲线;2为引物浓度为0.3ul时扩增曲线;3为引物浓度为0.4ul时扩增曲线;4为引物浓度为0.5ul时扩增曲线),从扩增曲线中可以得出,pedv-δorf3-f1/r1组引物在0.5μl/wall时具最高的扩增效率。
1.5试剂盒的特异性试验
应用该试剂盒进行特异性试验,分别以轮状病毒、猪繁殖与呼吸综合征病毒、猪伪狂犬病病毒、猪圆环病毒2型、猪传染性胃肠炎病毒、猪流行性腹泻病毒野毒株和疫苗毒株为模板,使用该试剂盒,采用优化的pcr反应条件进行荧光定量pcr,结果发现,只有猪流行性腹泻病毒野毒株能够有效扩增,见图5(1为猪流行性腹泻野毒株扩增曲线;2为猪流行性腹泻疫苗毒株扩增曲线;3为轮状病毒株扩增曲线;4为猪圆环病毒2型毒株扩增曲线。2、3、4扩增曲线cq值均大于35,为非特异性扩增,可视为阴性。其他毒株并未出现扩增曲线),轮状病毒、猪繁殖与呼吸综合征病毒、猪伪狂犬病病毒、猪圆环病毒2型、猪传染性胃肠炎病毒、猪流行性腹泻病毒疫苗毒株均不能有效扩增,说明本研究所设计的引物具有较强的特异性。
1.6应用该试剂盒进行敏感性试验
将猪流行性腹泻病毒野毒株的阳性质粒定量至5.9×108copies/ml,按10×梯度稀释,每个梯度均取2.0μl为模板量,设置9个浓度组:5.9×108copies/ml、5.9×107copies/ml、5.9×106copies/ml、5.9×105copies/ml、5.9×104copies/ml、5.9×103copies/ml、5.9×102copies/ml、5.9×101copies/ml、5.9×100copies/ml,进行实时荧光定量pcr检测,评估本发明的检测限。结果见图4(1为模版浓度为5.9×108copies/ml时反应体系的扩增曲线;2为模版浓度为5.9×107copies/ml时反应体系的扩增曲线;3为模版浓度为5.9×106copies/ml时反应体系的扩增曲线;4为模版浓度为5.9×105copies/ml时反应体系的扩增曲线;5为模版浓度为5.9×104copies/ml时反应体系的扩增曲线;6为模版浓度为5.9×103copies/ml时反应体系的扩增曲线;7为模版浓度为5.9×102copies/ml时反应体系的扩增曲线。当模版浓度低于5.9×102copies/ml时,无法检测到反应体系的扩增曲线),结果表明本方法在样品浓度稀释到5.9×102copies/ml时也有极好的线性关系,表明该试剂盒具有极高的灵敏度。
每个样品做三次平行实验,图中的结果是选取的平行实验中结果最好的。
给本领域技术人员提供上述实施例,以完全公开和描述如何实施和使用所主张的实施方案,而不是用于限制本文公开的范围。对于本领域技术人员而言显而易见的修饰将在所附权利要求的范围内。本说明书引述的所有出版物、专利和专利申请通过引用并入本文,如同这些出版物、专利和专利申请各自特别地和个别地表明通过引用并入本文。
序列表
<110>山东省农业科学院家禽研究所
<120>检测猪流行性腹泻病毒野毒株的特异性引物、试剂盒及方法
<140>2019110538865
<141>2019-10-31
<160>2
<170>siposequencelisting1.0
<210>1
<211>19
<212>dna
<213>artificialsequence
<400>1
gcccacttttatattactg19
<210>2
<211>19
<212>dna
<213>artificialsequence
<400>2
ctgccaataagtgtgcaac19
- 还没有人留言评论。精彩留言会获得点赞!
- 玉米低镁条件下特异性转运镁离子基因ZmMGT10及其应用的制造方法与工艺
- CRISPR‑Cas9特异性敲除猪SLA‑3基因的方法及用于特异性靶向SLA‑3基因的sgRNA与制造工艺
- 毛酸浆的分子特异性标记引物及鉴别方法与制造工艺
- 一种检测CYP2C9基因多态性的ARMS引物的制造方法与工艺
- 构建在海马体区域特异性敲除IKKα基因的小鼠模型的方法及打靶载体和试剂盒与制造工艺
- 使用重叠非等位基因特异性引物和等位基因特异性阻断剂寡核苷酸的组合物进行等位基因特异性扩增的制造方法与工艺
- 一种利用线粒体D-loop区特异区域鉴定鼋的标记引物及方法
- 一种用于检测大豆拟茎点种腐病菌的特异性lamp引物组合物及其应用
- 一种针对膨胀污泥中Eikelboom Type 0092型丝状菌群特异性引物和方法
- 脯氨酸特异性蛋白酶基因及其应用