辣椒疫霉菌PcMPK12基因及其载体与应用的制作方法
本发明涉及分子生物学技术领域,尤其涉及一种辣椒疫霉菌促有丝分裂原蛋白激酶pcmpk12基因及其载体与应用。
背景技术:
辣椒疫霉(phytophthoracapsici)是一种存在范围比较广且破坏力强大的植物病原菌,能够侵染多种寄主植物。辣椒疫霉菌通常以卵孢子在土壤中或病残体中进行越冬,借助风、水及其他农事活动传播病害。由辣椒疫霉菌侵染辣椒引起的辣椒疫病,在美国、加拿大、韩国及我国等国家和地区严重发生,均造成不同程度的经济损失,这也迫使有效防治此病的发生成为目前的主要任务。由于辣椒疫病的抗病育种工作进展较为缓慢,现阶段对病害的预防和控制主要依靠化学防治,化学药剂的大量使用使得疫霉菌的抗药性不断提高,并且造成农药残留和环境污染。因此,寻找辣椒疫霉菌的关键致病基因及其致病机制成为近年来的研究热点。
技术实现要素:
本发明的目的在于克服现有技术之缺陷,提供了一种辣椒疫霉菌促有丝分裂原蛋白激酶pcmpk12基因及其载体与应用。
本发明是这样实现的:
本发明目的之一在于提供一种辣椒疫霉菌pcmpk12基因,其核苷酸序列为seqidno.1所示。
本发明的目的之二在于提供所述辣椒疫霉菌pcmpk12基因所编码的辣椒疫霉菌pcmpk12蛋白,该蛋白的氨基酸序列如seqidno:2所示。
本发明的目的之三在于提供一种包含所述的辣椒疫霉菌pcmpk12基因的重组载体。
优选地,所述的重组载体以pbingfp2表达载体为出发载体,将所述的辣椒疫霉菌pcmpk12基因插入pbingfp2表达载体的bamhi和hindiii酶切位点间所得。
更为优选地,所述的重组载体以辣椒疫霉cdna为模板,如seqidno:3-4所示的引物,进行pcr扩增;将pcr产物和pbingfp2表达载体进行双酶切,回收纯化,连接转化大肠杆菌获得重组表达载体pbin-pcmpk12。
本发明的目的之四在于提供一种包含所述重组载体的转化体。
优选地,所述转化体为包含所述重组载体的农杆菌。将所得的含有所述重组载体的农杆菌转化菌株即得到一种植物过表达菌株,所述菌株能够表达辣椒疫霉菌pcmpk12蛋白。
本发明的目的之五在于提供一种沉默载体,以pbin-pcmpk12质粒为模板,如seqidno:5-6所示的引物进行pcr扩增,将pcr产物通过ecori和ecorv酶切位点反向插入ptoregfp沉默载体,双酶切后回收纯化,连接转化大肠杆菌获得重组沉默载体ptor-pcmpk12。
本发明的目的之六在于提供所述的辣椒疫霉菌pcmpk12基因在调控病原物的侵染上的应用。
本发明的目的之七在于提供所述的重组载体在调控病原物的侵染上的应用。
本发明的目的之八在于提供所述的沉默载体在调控病原物的侵染上的应用。
与现有技术相比,本发明具有如下优点和效果:
本发明首次克隆辣椒疫霉菌的促有丝分裂原蛋白激酶pcmpk12基因,并构建得到了瞬时过表达载体及沉默载体;利用农杆菌介导的瞬时表达系统及沉默载体初步探究pcmpk12基因生物学功能,结果显示pcmpk12基因促进病原物侵染,在致病进程中扮演正调控角色;沉默载体(沉默pcmpk12基因)可降低辣椒疫霉菌的生长发育(两个沉默转化子的菌丝侧枝增多,孢子囊成熟更晚,且孢子活性降低,无法从孢子囊中完全释放),说明pcmpk12基因沉默转化子使得辣椒疫霉侵染辣椒的能力下降了,降低了辣椒疫霉的致病性。
附图说明
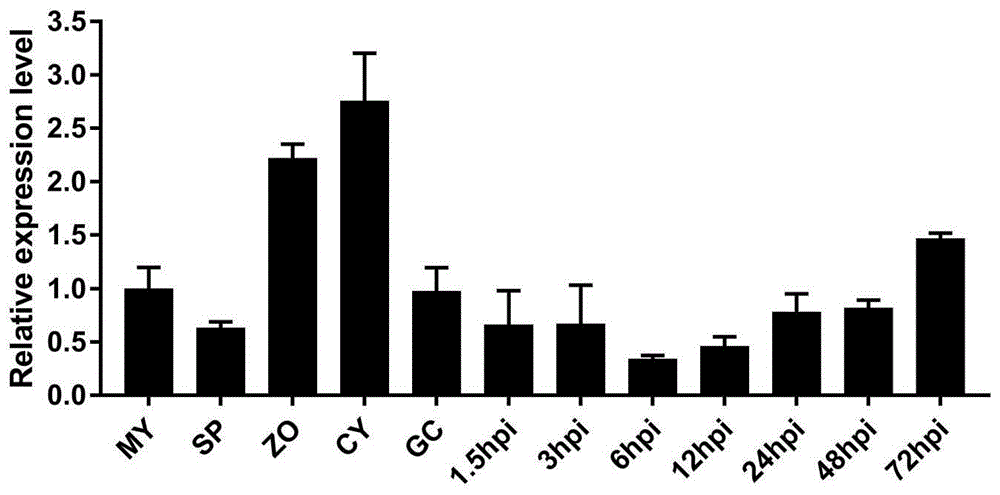
图1为辣椒疫霉菌生长发育及不同侵染时期转录水平分析;
图2为亚细胞定位及蛋白表达检测,a、pcmpk12亚细胞定位结果与ev亚细胞定位结果;b、westernblot检测蛋白表达结果;
图3为病原菌侵染检测,a、辣椒疫霉侵染紫外照相结果;b、面积统计结果;
图4为沉默转化子生长速率及沉默效率,a、野生菌株、空对照转化子和沉默转化子在npb培养基上25℃黑暗培养5d时菌丝拍照结果;b、沉默效率;c、菌丝面积;
图5为沉默转化子表型分析,a、野生型菌丝与沉默转化子t2,在npb培养基25℃爬片培养4d后,菌丝形态观察结果;b、经诱导后,野生型及沉默转化子游动孢子释放状态观察结果;
图6为沉默转化子致病性检测结果;
图7为不同胁迫条件下菌丝生长的测定结果,其中a为野生型(wt)、对照菌株(ck)和pcmpk12沉默转化子在不同培养基上的菌丝生长情况;b为野生型(wt)、对照菌株(ck)和pcmpk12沉默转化子在不同培养基上的生长5天后的菌落直径。
具体实施方式
实施例1、辣椒疫霉菌pcmpk12基因克隆与序列分析
本发明人基于辣椒疫霉lt1534全基因组测序、进行大量生物信息学分析筛选获得的了辣椒疫霉菌pcmpk12基因。
接着以辣椒疫霉lt1534全基因组cdna为模板,按相应的pcr反应体系扩增pcmpk12基因序列,反应体系为:25μl2×phantamaxmastermix,4μldna,17μlddh2o,2μlforwardprimer(10μm),2μlreverseprimer(10μm),共50μl体系。pcr反应程序为:95℃预变性5min;95℃变性30s,60℃退火30s,72℃延伸若干分钟(由所克隆基因长度所决定,约1kb/min)32个循坏;72℃延伸10min。采用相同的方法克隆pcmpk12基因特异性序列片段。
经过公司测序后,分析得到pcmpk12基因序列全长1476bp,开放阅读框orf为1476bp,共编码491个氨基酸,蛋白分子量大小约为55kda。使用生物信息学分析网站对该序列进行分析,结果显示pcmpk12基因无信号肽区域,无跨膜区域。
实施例2辣椒疫霉菌pcmpk12基因表达模式分析
分别收取辣椒疫霉lt1534菌丝、孢子囊时期、游动孢子、休止孢、萌发孢时期样品,及辣椒疫霉lt1534游动孢子侵染辣椒叶片后,分别在1.5h,3h,6h,12h,24h,48h,72h时样品,采用omagn试剂盒提rna,诺唯赞试剂盒反转录为cdna,以此为模板,以菌丝体时期的cdna为对照,以辣椒疫霉actin作为内参基因,做qrt-pcr检测pcmpk12基因不同时期的表达量。取三次qrt-pcr结果平均值并方差分析。
结果如图1所示,横坐标上的条形图为其生活史各阶段,分别为菌丝(my)、孢子囊(sp)、游动孢子(zo)、休止孢(cy)、萌发孢子(gc)、侵染寄主1.5h、侵染寄主3h、侵染寄主6h、侵染寄主12h、侵染寄主24h、侵染寄主48h、侵染寄主72h;纵坐标为pcmpk12转录水平分析结果,以辣椒疫霉actin基因作为内参;表达模式分析显示,辣椒疫霉菌pcmpk12基因在发育早期游动孢子及休止孢时期表达上调最为明显,之后表达量逐渐下降,侵染后期72h后略微上升。
实施例3载体的构建
pcmpk12基因过表达载体的构建:根据辣椒疫霉pcmpk12基因的cdna序列(序列号:mn577461),设计一对特异性引物pbin-pcmpk12--f(seqidno:3所示)和pbin-pcmpk12--r(seqidno:4所示),分别在上、下游引物添加了bamhi和hindiii酶切位点。以辣椒疫霉cdna为模板,pbin-pcmpk12--f和pbin-pcmpk12--r为引物,进行pcr扩增。将pcr产物和pbingfp2表达载体进行双酶切,回收纯化,连接转化大肠杆菌dh5α,获得重组表达载体pbin-pcmpk12。
实施例4辣椒疫霉菌pcmpk12亚细胞定位分析
采用冻融法将瞬时过表达载体pbin-pcmpk2(实施例3制备得到):pcmpk12转化农杆菌感受态gv3101,方法如下:
(1)向含有重组质粒的离心管中加入30μl农杆菌感受态,轻轻吸打混匀后,冰浴30min。
(2)液氮速冻1min后,在37℃水浴锅中水浴5min。
(3)加入500μl无抗性的液体lb,于28℃,200rpm震荡培养箱震荡培养3-5h。
(4)低速离心2min,将离心好的菌液均匀涂在含有rif、kana抗性的固体lb培养基中黑暗培养2天。
(5)观察到固体lb中出现单克隆菌落时,沾取单克隆菌斑到含rif、kana抗性的1ml液体lb培养基中震荡培养10h-18h。
(6)吸取菌液,用载体引物进行菌落pcr检验,如果检验正确即转化成功,便可保存菌液以备后续实验。
将含重组质粒的农杆菌菌液培养16~18h后,离心收集菌液,加入适量的10mmmgcl2(含10mmmes,200μmas)缓冲溶液悬浮菌体,使悬浮液od600值达到0.5~0.6;利用注射器将悬浮液接种本氏烟48h后,利用超高分辨率共聚焦显微镜zeisslsm800观察其亚细胞定位情况。
亚细胞定位情况如图2-a所示,辣椒疫霉菌pcmpk12定位于本氏烟叶片细胞的细胞质膜;ev亚细胞(对照)定位于细胞质与核质。
实施例5植物过表达菌株中pcmpk12的westernblot检测与病原菌侵染检测
1、选取生长4-6周的长势较好的本氏烟,利用农杆菌瞬时表达技术(将实施例3获得的重组表达载体pbin-pcmpk12,提质粒,转化农杆菌gv3101表达菌株)获得植物过表达菌株,使pcmpk12基因于烟草叶片中瞬时表达。
2、为了验证pcmpk12能够在烟草中正常表达,48h后在黑暗条件下用长波紫外灯照射,并选取荧光程度高的叶片,液氮磨样,提取蛋白进行westernblot检测,检测结果如图2-b所示。结果显示,目的条带约为82kda,gfp对照为28kda,下方为对应内参actin丽春红染色结果。表明辣椒疫霉菌pcmpk12和gfp蛋白均能在本氏烟中正常表达。
westernblot检测方法如下:
(1)将农杆菌瞬时表达2天后的本氏烟叶片摘下,用液氮研磨至粉末状,将100mg左右的叶片粉末收集到到2ml离心管中,加650μl的2×加样缓冲液,上下颠倒混匀,冰上放置。
(2)将样品置于沸水中煮沸5min,振荡混匀,再次煮沸5min。
(3)室温下12000rpm离心5min,吸取上清液至新的离心管中,再次离心5min,彻底去除沉淀。
(4)吸取上清至新的离心管中,准备上样,剩下的-20℃保存。
(5)准备sds-page电泳,每个泳道加20-40μl样品,5-8μlmarker,电压调至150v,时间约为2h。
(6)电泳后,将泡过的蛋白胶与pvdf膜放到转膜仪中,进行230a恒流转膜,时间约为1.5h。
(7)转膜结束后,取下pvdf膜于方盒中,加入tbst洗涤3-5次(水平摇床),每次5min左右。
(8)然后向方盒中加入25ml5%的脱脂奶粉封闭液,室温下封闭1.5-2h(水平摇床)。
(9)加入25mlinvitrogen的单克隆抗体鼠抗一抗anti-gfp(3000:1),孵育90min(水平摇床)。
(10)孵育结束后用tbst洗涤4次,每次5min;加入25mlinvitrogen的兔抗鼠二抗(10000:1),室温下反应1h(水平摇床)。
(11)反应结束后用tbst洗涤3次,每次5min。
(12)加入诺唯赞显色液(1:1配比),ecl显影拍照。
3、病原菌侵染检测
为了验证pcmpk12能够在辣椒疫霉菌侵染过程中扮演角色,选取生长4-6周的长势较好的本氏烟,利用实例3中农杆菌瞬时表达技术,将pcmpk12与gfp对照分别接种于烟草叶片两侧,24h接种辣椒疫霉lt1534菌块,25℃培养箱黑暗处理2d左右,测量侵染直径,在紫外灯下拍照,辣椒疫霉侵染紫外照相结果如图3a;面积统计结果如图3b,t检验显示,在p<0.05水平上差异极显著。因此结果显示pcmpk12促进病原菌侵染,在致病进程中扮演正调控角色。
实施例6辣椒疫霉菌pcmpk12沉默转化子的构建与生物学分析
1、构建重组沉默载体ptor-pcmpk12
根据pcmpk12基因的cdna序列设计特异性片段引物,ptor-pcmpk12--f(seqidno:5所示)和ptor-pcmpk12--r(seqidno:6所示),分别在上、下游引物添加了ecori和ecorv酶切位点。以pbin-pcmpk12质粒为模板,ptor-pcmpk12--f和ptor-pcmpk12--r为引物,进行pcr扩增。将pcr产物反向插入和ptoregfp沉默载体,双酶切,回收纯化,连接转化大肠杆菌dh5α,获得重组沉默载体ptor-pcmpk12。
2、沉默转化子的制备
提取所述重组沉默载体ptor-pcmpk12的质粒,转化辣椒疫霉原生质体,筛选沉默转化子,具体地:peg介导的原生质体转化:包括制备原生质体、原生质体转化和原生质体重生三部分。
a、原生质体的制备:
(1)选取在npb固体培养基上长势较好的辣椒疫霉菌lt1534,用直径为5mm的打孔器沿着平板外沿打一圈小孔,选取10-15块菌饼移植到无菌培养皿中,加入35ml液体npb培养基,于25℃培养箱黑暗培养2天后取出备用,不可培养时间过长,菌体过老会影响后续质壁分离。
(2)将每个培养皿中的液体npb培养倒入废液缸,可以不去掉琼脂培养基,用25-30ml的无菌去离子水漂洗一次。
(3)用25-30ml的0.8m甘露醇再漂洗一次。
(4)将菌丝转移至深培养皿中,加入30ml0.8m甘露醇,室温下浸泡10min,使其质壁分离,为了使质壁分离的效率提高,可用灭菌手术刀将菌丝充分散开。
(5)在浸泡10min期间,配制酶解液和peg4000,酶解液室温下备用,peg4000用0.45μm的细菌过滤器过滤除菌,4℃保存备用。
(6)浸泡完毕后,弃滤液,收集菌丝,加入20ml左右的酶解液,将菌丝充分分散开,使酶解的效果达到最佳。
(7)用锡箔纸将培养皿封闭,室温下50rpm轻轻震荡40-60min(水平摇床),酶解效果可以通过在光镜下观察释放出原生质体的数量来确定。
(8)用70μmbdfalconcellstrainer细胞滤网过滤酶解产物,弃培养基残渣和菌丝碎片,收集原生质体滤液于50mlbd管中。
(9)将50mlbd置于水平离心机中,室温下1200×g离心2min。
(10)弃滤液,加入30mlw5solution(5mmkcl0.093g、125mmcacl2·2h2o4.6g、154mmnacl2.25g、177mmglucose7.8g加水定容至250ml)洗涤原生质体,为了方便重悬,可以先加入15mlw5液重悬原生质体,然后再加15ml补足至30ml。
(11)室温下1200×g离心2min,将w5液去除干净。
(12)根据载体质粒样品数量,加入适量的10mlmmgsolution(0.4mmmannitol18.22g、15mmmgcl2·6h2o0.76g,4mmmes2ml加水定容至250ml)重悬原生质体,,室温静置10min,原生质体制备完成。
b、原生质体转化试验方法:
(1)向50mlbd管中加入20μl重组沉默载体ptor-pcmpk12与1ml所述原生质体,轻轻摇晃使其混匀,不可剧烈摇晃,然后冰浴10-20min。
(2)将储存在4℃的peg4000取出,吸取1.74mlpeg4000分三次(每次0.58ml)缓慢加入到50mlbd管中,并轻轻摇晃使其混匀,动作要轻柔。
(3)冰浴15min后加入25ml含有amp(50μg/μl)抗性的液体pm培养基(提前放于4℃预冷)。
(4)冰浴10min后,25℃恒温培养箱中黑暗培养12-18h(倾斜放置)。
c、原生质体重生试验方法:
(1)取出培养箱中的原生质体,室温下2000×g离心2min。
(2)弃上清,剩余约10ml溶液重悬原生质体。
(3)向每个50mlbd管中加入25ml含有(g418、rif50μg/μl)抗生素的固体pm培养基,轻轻颠倒混匀。
(4)将每个bd管中的pm培养基平均倒入两个灭菌的培养皿中,25℃恒温培养箱中黑暗培养。
c、沉默疑似转化子的验证:
重生后的平板上会长出菌落,每个单克隆菌落为一个疑似转化子,挑取单克隆菌落至含有g418(50μg/μl)抗生素的固体npb培养基中,25℃黑暗培养5天。选取在npb固体培养基上长势较好的疑似转化子移菌备份,剩余的部分切成小块,加入35ml液体npb培养基黑暗培养5天,取出后收集菌丝提取总rna,然后设计引物,通过qrt-pcr检验沉默效率,以lt1534为对照,重复三次实验,即通过sybr实时定量rt-pcr测定pcmpk12在野生型菌株、空对照转化子和沉默转化子(t2和t19)中的相对表达量以评估沉默效率,沉默效率达到80%左右,即为沉默成功。最终筛选获得了两个沉默效率80%以上的沉默转化子和一个空载转化子(图4-b)。
3、辣椒疫霉菌pcmpk12沉默转化子生物学分析
(1)pcmpk12沉默转化子生长速率分析
将辣椒疫霉lt1534菌株、空载体转化子、pcmpk12沉默转化子于同一时间转移至新的无抗生素固体npb培养基中,每个菌株做15个重复,于25℃恒温培养箱中黑暗倒置培养5天后,观察菌落的生长情况,对各个平板的菌落直径进行测量并拍照记录,并对菌落直径的数据进行处理。实验结果如图4a、图4c所示。结果表明,与辣椒疫霉lt1534及空载体转化子相比,沉默转化子菌落的生长速率显著降低。
(2)pcmpk12沉默转化子菌丝形态与孢子囊形态
将培养好的辣椒疫霉lt1534及其转化子的插片平板取出,用镊子将玻片从培养基中取出,制作临时玻片,也可以制作永久玻片以备后续观察,在olympusbx-53荧光显微镜40×下观察并拍摄dic照片。然后将平板打孔并用去离子水冲洗数小时,放至低温下6-8h诱导产生孢子囊,用牙签挑取菌丝于载玻片上,制作临时玻片于显微镜下40×观察孢子囊的形态并拍摄dic照片,拍摄时要迅速,挑取菌丝后将平板继续放回低温培养箱中,防止孢子囊在室温下破裂释放游动孢子,影响对孢子囊的观察效果。实验结果如图5所示。结果显示,与lt1534菌株和空载体转化子相比,两个沉默转化子的菌丝侧枝增多,孢子囊成熟更晚,且孢子活性降低,无法从孢子囊中完全释放,说明pcmpk12对辣椒疫霉菌的生长发育十分重要。
(3)辣椒疫霉pcmpk12沉默转化子对辣椒的致病性
选取长势一致的辣椒疫霉lt1534菌株、空载体转化子和沉默转化子,用5mm打孔器打取菌饼,以备接种。选取生长5周左右的辣椒苗,选择长势相同的叶片用注射器针头扎小孔,接种菌块进行侵染。用辣椒疫霉lt1534菌株作为对照,每个大培养皿放8片叶片,做3次重复实验。2天后观察症状并拍照记录,再进行紫外观察和台盼蓝染色观察。所述野生菌株、空对照转化子和沉默转化子(t2和t19)菌块非创伤(上排)及创伤(下排)接种黑暗培养的辣椒叶片经台盼蓝染色、脱色的拍照结果如图6所示。
由图6可知,与菌株lt1534和空载体转化子相比,沉默转化子无法侵染未创伤辣椒叶片,在创伤辣椒叶片上留下水渍状病斑,说明pcmpk12沉默转化子侵染辣椒的能力下降了,降低了辣椒疫霉的致病性。
实施例7辣椒疫霉菌pcmpk12沉默转化子胁迫测定
为了确定pcmpk12是否为与压力相关,在氧化、渗透压和盐胁迫下研究其表达。将辣椒疫霉lt1534菌株、空载体转化子、pcmpk12沉默转化子于同一时间转移至新的胁迫固体npb培养基中,分别添加h2o2(2.0、4.0和6.0mm),山梨糖醇(0.5m,1.0m,1.5m)和nacl(0.2m,0.4m,0.6m)进行处理。每个菌株做15个重复,每个实验有三个重复,误差条表示标准偏差,于25℃恒温培养箱中黑暗倒置培养5天后,观察菌落的生长情况如图7a所示;在生长5天后对各个平板的菌落直径进行测量并拍照记录,并对菌落直径的数据进行处理如图7b所示,分为9个独立的实验,所述9个独立实验在横坐标上从左到右依次为h2o2(2.0、4.0和6.0mm),山梨糖醇(0.5m,1.0m,1.5m)和nacl(0.2m,0.4m,0.6m)处理,每个独立实验均包括wt组、ck组、t2组、t19组。
由图7可知,在各处理下,沉默转化子生长速率显著降低,说明辣椒疫霉菌pcmpk12与渗透压及各类压力胁迫相关。
所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包括在本发明的保护范围之内。
序列表
<110>长江大学
<120>辣椒疫霉菌pcmpk12基因及其载体与应用
<160>6
<170>siposequencelisting1.0
<210>1
<211>1476
<212>dna
<213>辣椒疫霉菌(phytophthoracapsici)
<400>1
atgcctcctacgcctgcgtttgtcaaccgcaacggcttcagccatacgcccgacggcttc60
tcgtccacgcccagcgacggcttcccgtccaacagcggagtggcgcaacaagcctccact120
cccgcggacgacaaccagacggccggtgctacgtccaatggtcactcttcgcacgcaccc180
acgccttctcctgttccccgcgcggcgccgctgaacctccgcaactttgccaactgggac240
gttggcagtcgctatacgctcgtgagattgctcggcaaaggatcatacggacaggtcgct300
gaggcattcgataacgaacgccagaagaaagtggctattaagaagatcatcaacgtcttt360
gaccaggagatcgactgcaagcgattgtatcgcgagatctacatcctgcggcgtctgagc420
cacccacaagtaatcaatctgatcgatgtggtcccgcccgagaactacgacaccttcaca480
gacttgtacctcgtgtttgacttcgtggacacagacttgcacaaactcatcatgagcccg540
cagtacttgaccattcgtcacattcaagtcttcctgtaccagcttctgtgtggtctgaag600
tacattcactcagccaacgtgattcaccgagatatgaaacccgccaacatcctgctgaac660
gaagactgcactctcatgatttgcgactttggtctctctcgtgtcatggagagcgatatg720
tcgatggaggagctgagcaagcacttgtactcaccgaaagactccaagtcgcccaccacg780
tctgacggaggtaccacttcggctccgtcaccgggaagtgcctcctcgacaccttcatca840
tccggagagtttcctaagatgcggcggcaattgacgaagcacgttgtgacacgatggtac900
cgtgcaccggagctgattctccttcaggattacgatttctcggtcgatatgtggagcatt960
ggatgtatttttgccgagctgttgagcatgcaagtcgagagttgcccgcgataccaggaa1020
cgtgttccccttttcccgggccgctcgtgtttcccgctaagtgcagaccgtccaacgacc1080
tactcggacaaactggaccagctcaatgtgatcttcaatgtgattggcacgcccggcgaa1140
gatgacattggtagcttgggcgaagtcaagcagtacttgagaaagttgcctaagaaggac1200
ccaagagacctccgcgagatgtacccaggtgcgcctgctgattcgctcgacttgctgaag1260
caaatgctgtcttttaaccccgagagccgaatttcggtcgacaaagcccttgcgcaccct1320
ttcttggagtcagtacgaaggacccagtctgagactgtagaaggcaatccttttggcatg1380
gagttcgaaaacgtccccctgaacaaggaggccctgaaaggtttgttaaactgcattttt1440
tgtattgatggtatctatgatattaacatcaactga1476
<210>2
<211>491
<212>prt
<213>辣椒疫霉菌(phytophthoracapsici)
<400>2
metproprothrproalaphevalasnargasnglypheserhisthr
151015
proaspglypheserserthrproseraspglypheproserasnser
202530
glyvalalaglnglnalaserthrproalaaspaspasnglnthrala
354045
glyalathrserasnglyhisserserhisalaprothrproserpro
505560
valproargalaalaproleuasnleuargasnphealaasntrpasp
65707580
valglyserargtyrthrleuvalargleuleuglylysglysertyr
859095
glyglnvalalaglualapheaspasngluargglnlyslysvalala
100105110
ilelyslysileileasnvalpheaspglngluileaspcyslysarg
115120125
leutyrarggluiletyrileleuargargleuserhisproglnval
130135140
ileasnleuileaspvalvalproprogluasntyraspthrphethr
145150155160
aspleutyrleuvalpheaspphevalaspthraspleuhislysleu
165170175
ilemetserproglntyrleuthrilearghisileglnvalpheleu
180185190
tyrglnleuleucysglyleulystyrilehisseralaasnvalile
195200205
hisargaspmetlysproalaasnileleuleuasngluaspcysthr
210215220
leumetilecysasppheglyleuserargvalmetgluseraspmet
225230235240
sermetglugluleuserlyshisleutyrserprolysaspserlys
245250255
serprothrthrseraspglyglythrthrseralaproserprogly
260265270
seralaserserthrproserserserglyglupheprolysmetarg
275280285
argglnleuthrlyshisvalvalthrargtrptyrargalaproglu
290295300
leuileleuleuglnasptyrasppheservalaspmettrpserile
305310315320
glycysilephealagluleuleusermetglnvalglusercyspro
325330335
argtyrglngluargvalproleupheproglyargsercysphepro
340345350
leuseralaaspargprothrthrtyrserasplysleuaspglnleu
355360365
asnvalilepheasnvalileglythrproglygluaspaspilegly
370375380
serleuglygluvallysglntyrleuarglysleuprolyslysasp
385390395400
proargaspleuargglumettyrproglyalaproalaaspserleu
405410415
aspleuleulysglnmetleuserpheasnprogluserargileser
420425430
valasplysalaleualahispropheleugluservalargargthr
435440445
glnsergluthrvalgluglyasnpropheglymetgluphegluasn
450455460
valproleuasnlysglualaleulysglyleuleuasncysilephe
465470475480
cysileaspglyiletyraspileasnileasn
485490
<210>3
<211>29
<212>dna
<213>人工序列(artificialsequence)
<400>3
cgggatccatgcctcctacgcctgcgttt29
<210>4
<211>31
<212>dna
<213>人工序列(artificialsequence)
<400>4
cccaagctttcagttgatgttaatatcatag31
<210>5
<211>27
<212>dna
<213>人工序列(artificialsequence)
<400>5
cggaattccaggtgcgcctgctgattc27
<210>6
<211>30
<212>dna
<213>人工序列(artificialsequence)
<400>6
gcgatatctcagttgatgttaatatcatag30
- 还没有人留言评论。精彩留言会获得点赞!
- 一种促使辣椒疫霉菌产生游动孢子囊的培养基的制作方法
- 四氟苯氧基烟碱胺类化合物、其制备方法及用作杀菌的用途的制作方法
- 一种芹菜为原料制作适宜恶疫霉菌产生孢子囊的液体培养基的制作方法
- 一种三七为原料制作适宜恶疫霉菌产生游动孢子的液体培养基的制作方法
- 来自辣椒疫霉菌的阿魏酸酯酶pcfae1及其编码基因与应用的制作方法
- 来自辣椒疫霉菌的阿魏酸酯酶pcfae2及其编码基因与应用的制作方法
- 来自辣椒疫霉菌的果胶裂解酶pcpel16及其编码基因与应用的制作方法
- 来自辣椒疫霉菌的果胶裂解酶pcpel20及其编码基因与应用的制作方法
- 来自辣椒疫霉菌的果胶裂解酶pcpel15及其编码基因与应用的制作方法
- 来自辣椒疫霉菌的果胶裂解酶pcpel18及其编码基因与应用的制作方法