灌注生物反应器、灌注器件、人造肝脏系统及相关方法与流程
相关申请的引证
本申请要求享有2018年5月22日提交的美国临时专利申请号62/674,696的优先权,该临时专利申请的全部内容通过引用结合于本文中。
本申请总体上涉及器官置换疗法,并且更具体而言,涉及用于执行器官置换疗法的反应器、器件和系统。
背景技术:
急性肝衰竭(alf)的特征在于,在没有预先存在的肝病的患者中,严重的肝脏损伤后的肝功能突降。急性肝衰竭的标准治疗方法是肝移植,肝移植应在症状发作后的几天内进行,以避免进展为多器官衰竭。肝移植困难,危险且不能广泛获得。肝脏的再生能力在文献中有充分记载。由于alf患者通常在受伤前没有任何基础疾病,因此,如果能够在肝脏再生所需的时间内如用体外(extracorporeal)系统替代肝功能,则有可能避免约80%的移植。
一些治疗肝衰竭的体外系统是无细胞肝支持系统,其基于用于纯化血液的分子吸附和白蛋白透析。该系统通常与血液透析结合使用,以去除水溶性溶质。然而,临床试验表明标准疗法与某些批准的体外系统在患者生存率方面并无显著差异。
一些基于细胞的透析系统正在研究中。人类肝细胞的使用受到了青睐,因为它规避了异种肝细胞使用相关的不良影响。然而,人类肝细胞的可用性有限,难以培养,并且某些肝细胞的肝特异性功能已经证实会随时间迅速下降。某些器件的另一个局限性是患者血液与体外肝细胞之间的物质交换有限。
技术实现要素:
本公开提供了一种灌注生物反应器,其包括:壳体,具有在壳体入口和壳体出口之间限定的长度,该壳体具有界定设置于壳体入口和壳体出口之间并与其流体连通的壳体内腔的内表面;和灌注器件,设置于该壳体的内腔中,每个灌注器件包括:网状结构,由该壳体的内表面支撑,该网状结构具有与第二壁间隔开以限定内部网状空腔的第一壁,该网状结构的第一和第二壁每个均具有在其中以允许流体连通通过该网状结构的开口;和封装器官组织,设置于该网状结构的第一壁和第二壁之间的内部网状空腔中,该封装器官组织具有至少一个至少部分被生物相容性的交联聚合物覆盖的类器官,该封装器官组织具有厚度由与所述网状结构的第一壁相邻的该主体第一表面和与所述网状结构的第二壁相邻的该主体第二表面之间限定的主体,该主体具有至少一个从第一表面和第二表面之一延伸进入该主体中以在其中接收流体的通道,所述至少一个通道具有经选择以将溶质从流体中扩散出来并进入该主体内的直径;该灌注器件布置于该壳体的内腔中,彼此相邻,并沿着该壳体的长度彼此间隔开,以接收从壳体入口传送到壳体出口的流体,并将该流体灌注到每个灌注器件的封装器官组织和其中的所述至少一个通道中。
本公开提供了一种灌注器件,其包括:网状结构,具有与第二壁间隔开以限定内部网状空腔的第一壁,所述网状结构的第一和第二壁每个均具有在其中以允许流体连通通过所述网状结构的开口;和封装器官组织,设置于所述网状结构的第一壁和第二壁之间的内部网状空腔中,该封装器官组织具有至少一个至少部分被生物相容性的交联聚合物覆盖的类器官,该封装器官组织具有厚度由与所述网状结构的第一壁相邻的该主体第一表面和与所述网状结构的第二壁相邻的该主体第二表面之间限定的主体,该主体具有至少一个从第一表面和第二表面之一延伸进入该主体中以在其中接收流体的通道,所述至少一个通道具有经选择以将溶质从流体中扩散出来并进入该主体内的直径。
本公开提供了一种人造肝脏系统,其包括:流体网络和使血浆循环通过该流体网络的泵;和与所述流体网络流体连通以接收来自其的血浆的灌注生物反应器,该灌注生物反应器包括:壳体,具有在所述壳体入口和壳体出口之间限定的长度,该壳体具有在所述壳体入口和壳体出口之间界定所述壳体内腔并与其流体连通的内表面,所述壳体入口接收血浆;和多个灌注器件,布置于所述壳体的内腔中,每个所述灌注器件包括:网状结构,由该壳体的所述内表面支撑,该网状结构具有与第二壁间隔开以限定内部网状空腔的第一壁,该网状结构的第一和第二壁每个均具有在其中以允许流体连通通过该网状结构的开口;和封装肝脏组织,设置于该网状结构的第一壁和第二壁之间的内部网状空腔中,该封装肝脏组织具有至少一个至少部分被生物相容性的交联聚合物覆盖的肝脏类器官,该封装肝脏组织具有厚度由与所述网状结构的第一壁相邻的该主体第一表面和与所述网状结构的第二壁相邻的该主体第二表面之间限定的主体,该主体具有至少一个从第一表面和第二表面之一延伸进入该主体中以在其中接收血浆的通道,所述至少一个通道具有经选择以将不希望的溶质从血浆中扩散出来并进入该主体内的直径;该灌注器件布置于该壳体的内腔中,彼此相邻,并沿着该壳体的长度彼此间隔开,以接收从壳体入口传送到壳体出口的血浆,并将血浆灌注到每个灌注器件的封装肝脏组织和其中的所述至少一个通道中。
本公开提供了一种处理血浆的方法,包括:将血浆输送到形成于封装肝组织中的至少一个通道中,所述封装肝组织具有至少一个至少部分被生物相容性的交联聚合物覆盖的肝脏类器官,所述至少一个通道具有经过选择以将不希望的溶质从所述血浆中扩散出来并且进入所述封装肝脏组织中的直径。
本公开提供一种制造灌注器件的方法,包括:提供至少一个至少部分被生物相容性的交联聚合物覆盖的肝脏类器官,所述至少一个至少部分被生物相容性的交联聚合物覆盖的肝脏类器官具有主体,至少一个通道延伸进入所述主体内,所述至少一个通道具有经选择以将溶质从流体中扩散出来并且进入所述主体内的直径;和将主体定位于网状结构的空腔内,以允许流体进入所述空腔和所述主体的至少一个通道中,并容许该流体离开所述空腔。
附图说明
现在参考附图,其中:
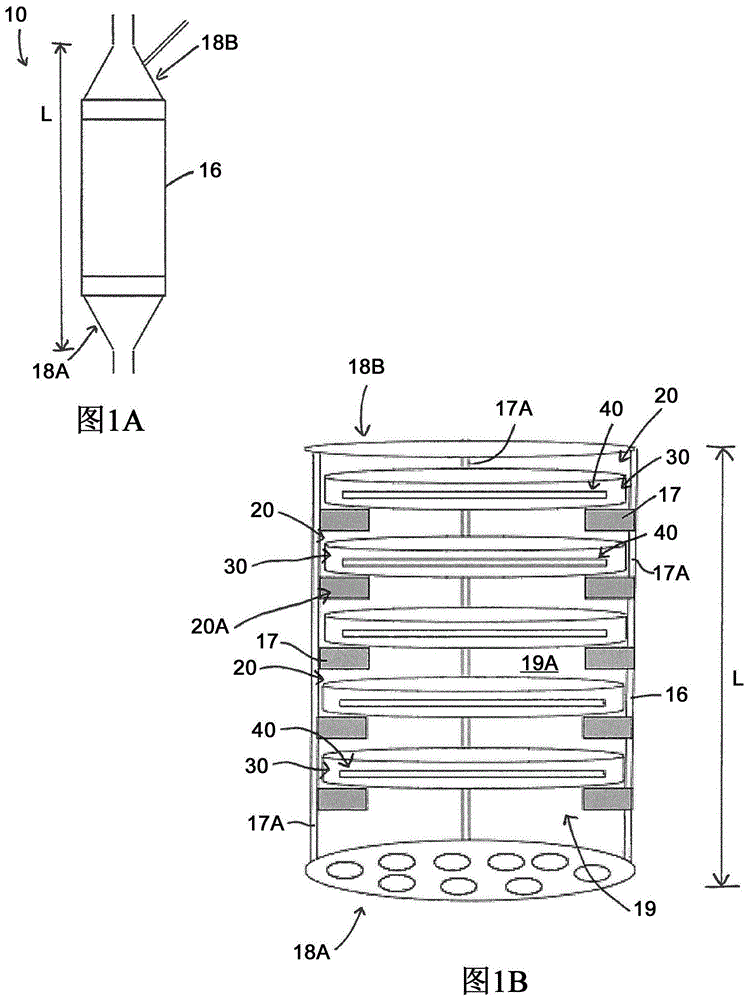
图1a是灌注生物反应器的示意图;
图1b是图1a的灌注生物反应器的壳体和灌注器件的示意图;
图2a是图1b的灌注器件的网状结构的一部分的立体图;
图2b是图2a的网状结构的另一部分的立体图;
图3是用于图1b的灌注器件中的另一网状结构的立体图;
图4显示了封装肝脏类器官并制造封装肝组织以用于图1b的灌注器件的过程;
图5a是图1b的灌注器件之一的立体图;
图5b是图5a所示的灌注器件的封装器官组织的侧视图(sideelevationalview);
图5c是图5a所示的灌注器件的封装器官组织的端视图(endview);
图5d是彼此相邻布置的图1b的两个灌注器件的封装器官组织的侧视图;
图6是用于图1b的灌注器件中的另一封装器官组织的侧视图;
图7是用于图1b的灌注器件中的另一封装器官组织的侧视图;
图8是具有图1a的灌注生物反应器的人造肝脏系统的示意图;
图9是具有图1a的灌注生物反应器的另一人造肝脏系统的示意图;
图10是具有图1a的灌注生物反应器的另一人造肝脏系统的示意图;
图11a是另一种灌注生物反应器的示意图;
图11b是图11a的灌注生物反应器的内部支撑件的立体图;和
图11c是带有灌注器件的图11b的内部支撑件的立体图。
具体实施方式
图1a图示说明了灌注生物反应器10。灌注生物反应器10是其中进行灌注操作的设备。具体而言,灌注生物反应器10(在本文中有时简称为“生物反应器10”)允许在液体与嵌入多孔生物材料内的细胞和组织之间交换颗粒。生物反应器10是具有受控环境的容器,该受控环境允许细胞存活并进行代谢活动。在所描绘的实施方式中,并且如下面更详细的解释,生物反应器10具有完成人体器官的至少一部分代谢功能的器官细胞的聚集体。为了实现该功能,生物反应器10可以由任何合适的生物相容性塑料、金属或其复合物例如聚碳酸酯制成。
在运行时,生物反应器10接收流体,并将流体输送出生物反应器10。因此,生物反应器10具有连接至合适导管的合适入口和合适出口。在所描绘的实施方式中,生物反应器10具有壳体16,该壳体16是在壳体入口18a和壳体出口18b之间延伸长度l的细长主体。壳体入口18a构造成允许将血浆、营养物或其他流体材料输注入壳体16中。在所示的实施方式中,壳体16是沿着纵轴延伸的圆柱体,以至于其长度大于宽度。壳体16的其他形状是可能的,并且都处于本公开的范围内。壳体入口18a和出口18b是壳体16的锥形端部,并且用作漏斗以将流体输入和输出壳体16的主体部分。壳体16是中空的,并因此具有内腔19,流体被输入该内腔19以与器官细胞相互作用。内腔19由壳体的壁界定,该壳体的壁在所示实施方式中是圆柱形的,并且限定了内表面19a。流体首先进入壳体入口18a,然后穿过内腔19,并随后通过壳体出口18b排出,从而穿过壳体16。
参照图1b,生物反应器10还包括灌注器件20。每个灌注器件20通过辅助液体与嵌入每个灌注器件20的多孔生物材料中的细胞和组织之间的颗粒交换而执行生物反应器10的工作。灌注器件20包含器官细胞的聚集体,该聚集体执行人体器官的至少部分代谢功能,正如下文更详细的解释。灌注器件20设置于壳体16的内腔19中。正如图1b所示,灌注器件20设置于内腔19中,彼此相邻并且沿着壳体16的长度l彼此间隔开。灌注器件20构成灌注器件20a的堆叠。在所描绘的实施方式中,灌注器件20a的堆叠具有竖直或垂直取向。灌注器件20在灌注器件20a的堆叠中相互上叠。在替代实施方式中,灌注器件20a的堆叠具有水平或倾斜取向。不管它们的取向如何,灌注器件20及其组件与从壳体入口18a至壳体出口18b行进通过壳体16的内腔19的流体进行相互作用。
仍然参考图1b,每个灌注器件20包括网状结构30和一个或多个封装器官组织40。网状结构30构成灌注器件20的主体并为其提供结构。网格结构30是多孔的,并由壳体16的内表面19a支撑以将每个灌注器件20安装于壳体16。每个灌注器件的封装器官组织40位于网状结构30内。因此,网状结构30是用于保持封装器官组织40并且允许壳体16内的流体与封装器官组织40接合(engage)的任何合适器件。
生物反应器600的另一实施方式如图11a-图11c所示。在所示的实施方式中,生物反应器600具有壳体616,该壳体616是在壳体入口618a和壳体出口618b之间延伸一定长度的细长主体。在所示的实施方式中,壳体616是沿着纵轴延伸而使其长度大于宽度的圆柱形主体。壳体616是透明的并且准许光通过。壳体入口618a和出口618b是壳体616的圆锥形端部,并充当漏斗以将流体输入和输出壳体616的主体部分。壳体616是中空的,因此具有内腔619,流体被输入该内腔619以与器官细胞相互作用。内腔619由壳体616的透明壁界定,该壳体616在所描绘的实施方式中呈圆柱形。流体通过首先进入壳体入口618a,然后通过内腔619,并经由壳体出口618b排出而流过壳体616。
仍参考图11a-图11c,生物反应器600具有用于支撑灌注器件20的内部支撑件617。内部支撑件617位于内腔619内。内部支撑件617包括端板617a,该端板617a经过钻孔以允许流体从中通过。端板617a通过在端板617a之间延伸的齿条(rack,架)617b彼此链接。齿条617b彼此隔开。齿条617b可以附连至壳体616的内表面。每个齿条617b包括沿着齿条617b的长度间隔开的凹口或凹槽617c。每个灌注器件20的网状结构30通过放置于凹槽617c中而可拆除地安装于齿条617b上。
生物反应器10,400提供了受控的环境。在所描绘的实施方式中,生物反应器10,400的内部温度通过热交换器控制,以使其保持恒定于37℃。生物反应器10,400的内部ph通过调节碳酸氢盐进行控制以使其恒定于约7.4。由于所描绘的生物反应器10,400用于处理血浆,因此血浆中不存在红细胞(即,红血细胞)。因此,控制了生物反应器10,400中血浆的氧含量。生物反应器10,400可以与其他类型的身体(corporeal)流体一起使用,并可以控制更少或其他参数。
现在将更详细地描述网状结构30和封装器官组织40。
参照图2a和图2b,网状结构30具有与第二壁34间隔开以限定内部网状空腔36的第一壁32。封装器官组织40(图2a和图2b中未显示)设置于第一32和第二壁34之间的内部网状空腔36中。第一壁32和第二壁34是多孔的,以允许流体进入内部网状空腔36中而与封装器官组织40相互作用。网状结构30的多孔性质由第一和第二壁32、34中每个的开口38提供,该开口38允许流体连通穿过网状结构30。在图2a和图2b中,网状结构30包括基部30a和可安装于基部30a上以封闭网状结构30并限定内部网状空腔36的盖30b。基部30a包括网状结构30的第一壁32,而盖30b包括第二壁34。盖30b压配于基部30a上。
网格结构30的其他实施方式是可能的。例如,图3显示了一件式(one-piece,一体式)网状结构130。网状结构130是圆柱形的,并且成形为盘状。第一壁132和第二壁134显示为间隔开以限定内部网状空腔136。第一壁132和第二壁134在其中也具有开口138。在图3中,网状结构130具有在其中具有孔口133的侧壁131。孔口133与内部网状空腔136流体连通。孔口133允许将构成封装器官组织40的组件引入内部网状空腔136中,如下文更详细的解释。不论其构造如何,网状结构30、130可以具有可以约1mm-约8mm的厚度,并可以具有约10mm-约80mm的直径。网孔尺寸(即,开口38、138的尺寸)可以为约500μm-约5mm。虽然在图2a-图3中显示为其形状基本上呈圆形,应当理解的是,网状结构30、130可以具有其他形状,包括但不限于矩形、正方形、三角形等。
参照图4,封装器官组织40(有时在本文中简称为“eot40”)具有至少部分被生物相容性的交联聚合物44覆盖的一个或多个类器官42。每个类器官42是类似于器官的细胞或组织的生长或培养团块。在图4中,每个类器官42是类似于肝脏的肝脏类器官,从而使eot40是封装肝组织(elt)。进入生物反应器10,400的流体与eot40中类器官42的组织或细胞交换化合物,从而使有毒化合物被类器官42的细胞代谢并以无毒形式消除,而同时有用蛋白质则通过类器官42的细胞制造并释放到流体中。因此,需要由肝脏处理的白蛋白、氨和其他血浆组分可以被肝脏类器官42代谢,这类似于人的肝功能。类器官42也可以由另一器官的细胞或组织进行培养。功能能够被类器官42模拟的其他器官的非限制性列表包括肾脏、内分泌组织和任何其它能够被血液灌注并且能够聚集成类器官42的组织。因此,应当理解的是,在本公开中所指的肝脏、肝脏类器官或封装肝组织并不限于仅由肝细胞或组织形成的类器官42或eot40。
图4显示了生物相容性且交联的聚合物44中提供多个单分散的肝脏类器官42的过程。如所示,由分化单个ipsc而获得了成肝细胞、内皮祖细胞和间充质祖细胞。这些细胞进行混合并在悬浮液中共培养以形成肝脏类器官42。在图4所示的肝脏类器官42的实施方式中,成肝细胞已分化为肝细胞,其(在将肝脏类器官42引入封装肝组织40中之前)基本上覆盖了由间充质和内皮祖细胞形成的细胞核心。图4中所示的肝脏类器官42的实施方式在形状上基本呈球形,并且具有约150μm的相对直径。然后,使用交联剂将肝脏类器官42封装于第一相容性的且可交联的基质中,该交联剂在图4中显示为uv光。封装肝组织40能够用作再生医学中的可移植肝组织(例如,具有5mm-10cm的尺寸)。可替代地,肝脏类器官42能够设计为多孔板,并用于药物开发以确定所筛选化合物的代谢或肝毒性。
能够用于封装肝组织40中的聚合物44(也称为聚合物基质)在肝脏类器官42周围形成水凝胶。水凝胶是指亲水性的聚合物链,其中水是分散介质。水凝胶能够从天然或合成聚合物网络获得。在本公开的上下文中,水凝胶内的封装会防止嵌入的肝脏类器官42泄漏出聚合物44。在一个实施方式中,每个肝脏类器官42被单独封装,并且在另一个实施方式中,封装的肝脏类器官42能够进一步包括于聚合物基质44中。在还有的另一实施方式中,肝脏类器官44包括于聚合物基质44中,以便将其封装。如图4所示,封装于水凝胶材料内的肝脏类器官42形成盘状或其他圆柱形结构。封装于水凝胶材料内的类器官42的其他形状是可能的,并且都处于本公开的范围内。水凝胶能够是任何生物相容性材料。水凝胶的一些非限制性实例包括peg,以及任何基于聚乙二醇(peg)的材料,如peg-乙烯基砜(peg-vs)。
图4显示了用于制造封装器官组织40的工艺,该工艺描述于2017年11月23日提交的标题为“封装的肝脏组织(encapsulatedlivertissue)”的pct专利申请pct/ca2017/051404(公开为wo2018/094522)中,该专利申请的全部内容通过引用结合于本文中。类器官42能够从超低附着性烧瓶中收获,并以低速进行离心(400g,5分钟)以形成团粒(pellet)。团粒(约3000个类器官)可以再悬浮于无钙和镁并补充0.1%n-乙烯基-2-吡咯烷酮和0.4mg/mlirgacure2959的无菌pbs中的5%4-臂peg-乙烯基砜(20kda)溶液中。可以产生50μl此类溶液液滴(包含约100个类器官42),并将其放置于96孔板的孔中,并且随后在uv光下(5分钟,1090μw/cm2,距离4cm)进行交联。生成的封装肝组织40可以保持于补充20ng/mlosm和10μm地塞米松的完全williame培养基/完全emb2(1:1)培养基中5天。封装后五天,osm补充剂可能发生悬浮,而完全williame培养基/完全ebm2培养基的比率可能从1:1变为4:1。该组织可以在37℃环境o2/5%co2中进行培养,并且该培养基可以每隔一天更换一次。白蛋白分泌可以每周在整理培养基中进行评价。封装类器官42有可能在超过7周的培养中保留其通过水凝胶分泌白蛋白的能力,从而证明了它们在聚合物44中的存活和其分化状态的维持,而同时确证了所分泌的蛋白向其外部的扩散。封装肝组织40可以足够坚固,能够用器械进行操作而不会损伤其形状和完整性。
图5a-图5c显示了灌注器件20和eot40中的之一。eot40具有向eot40提供物理结构的主体46。主体46限定了厚度t。厚度t限定于邻近网格结构30的第一壁32的主体46第一表面48a和邻近第二壁34的主体46第二表面48b之间。因此,eot40被网状结构30“夹心”。在所描述的实施方式中,主体46采取网状结构30的形式,并且因此成形为圆柱形或盘状。就像网状结构30一样,主体46可以具有其他形状,这是本公开的部分。在一个实施发生中,主体46的厚度t为约1mm-约3mm。主体46的厚度t的其他值也是可能的,并且都处于本公开的范围内。
参考图5b和图5c,eot40是三维多孔体。eot40嵌入有具有空间组织化通道,这些通道灌注有供给于壳体16的流体(例如,血浆)。如图5b和图5c所示,主体46具有一个或多个延伸进入主体46中的通道41。每个通道41从第一表面48a和第二表面48b中的一个或两个延伸进入主体46中,以便将流体接收到通道41中。每个通道41具有直径d。每个通道41的直径d选择成使流体内的不希望的溶质能够从流体中扩散出并进入主体46的周围组织中而被代谢。控制通道41的直径d可以允许改进从流体中移除一定尺寸的分子,而同时允许具有不同尺寸的所关注的分子保留于流体中。主体46中的每个通道41的直径d可以相同,或可以不同。在一个实施方式中,一个或多个通道41的直径d为约150μm-约750μm。通道41的直径d的其他值是可能的,并且处于本公开的范围内。
因此,能够理解的是,每个eot40具有类似血管的结构(即,通道41),这种结构可以辅助流体及其溶质在eot40内渗透,并辅助溶质从流体中扩散出并进入主体46的周围聚合物44水凝胶中。这与一些没有通道的常规聚合的器官组织形成对比,而使溶质的扩散仅限于所聚合的器官组织的表面。
通道41可以使用任何适当的技术形成。一些可能的技术包括光刻法、牺牲模制法或任何其他合适的微制作技术。例如,当使用光刻法时,形成通道41包括利用uv光源固化生物相容性的交联聚合物44的部分,而同时主体46保留于网状结构30的内部网状空腔36中。这可以包括用具有一个或多个对应于通道41的最终位置的不透明部分的光掩模覆盖主体46。然后用施加到光掩模上的uv光源固化生物相容性的交联聚合物44。主体46被光掩模的不透明部分覆盖的部分将保持未固化,从而在主体46中形成通道41。eot40因此可以在网状结构30内光聚合。如果在聚合物44处于网状结构30中时生成通道41,则用于光刻法的光掩模可能需要使不透明部分与网状结构30的开口38配合,以允许uv光穿透至水凝胶以进行固化。
在网状结构30内采用光刻法的另一实施方式中,形成通道41包括将至少一个肝脏类器官42和生物相容性的交联聚合物44注入网状结构的内部网状空腔36中,并随后用uv光源固化生物相容性的交联聚合物44的部分以使该团块固化。聚合物44中未固化的部分形成通道41。实现该结果的一种技术涉及经由第一壁32和第二壁34中的开口38,或经由孔口133(见图2a-图3),将水凝胶聚合物44和类器官42吸移到内部网状空腔36中。在注入水凝胶聚合物44和类器官42之前,第一和第二壁32、34二者及其开口38能够,如采用类似载玻片的光透明密封件进行密封。然后该混合物固化并在网状结构30中进行光聚合。
用于形成通道41的其他技术也是可能的,并都处于本公开的范围内。在替代实施方式中,在光聚合之后,eot40添加到网状结构30的内部网状空腔36中。在还有的另一个实施方式中,主体46是生物打印的,或使用包含通道41的制作模具,或通过使用聚合物或糖的牺牲模制而形成。在还有的另一个实施方式中,肝脏类器官42的内皮祖细胞以毛细或类毛细构型进行组织化。
通道41的形状、取向和路径可以变化,并且其中的至少一些现在会更详细地进行描述。
参照图5b和图5c,主体46包括多个通道41。通道41a在第一和第二表面48a、48b之间延伸穿过主体46。因此,通道41a连通穿过主体46的流体。通道41a的长度la基本上等于主体46的厚度t。通道41b也延伸穿过主体46,并且还连通穿过主体46的流体。通道41b的长度lb大于主体46的厚度t,因为通道41b相对于第一和第二表面48a、48b是偏斜或倾斜的。
参考图5c和图5d,贯通通道41a、14b允许流体穿过一个灌注器件20的主体46进行连通,并流到另一个紧邻的灌注器件20的主体46a。主体46的通道41a、41b与相邻的主体46a的通道41c、41d偏置。在灌注器件20a的堆叠具有竖直取向的实施方式中,主体46、46a的偏置通道41a、41b、41c、41d未垂直对准。主体46、46a的通道41a、41b、41c、41d不重叠。因此,防止流体在主体46、46a之间以笔直或无偏移的路径直接流动。因此,偏置的通道41a、41b、41c、41d限定了流体的曲折流动路径p,而使流体偏离主体46、46a之间的直线路径。在图5d中,一个曲折流动路径p允许流体进入通道41a并流过主体46,然后沿着主体46a的第一表面48a流动,直到到达通道41c,而此时流体进入通道41c并流过主体46a。流体从一个灌注器件20到另一灌注器件的这种偏离通过延迟扩散并给予流体更多时间与eot40的类器官42相互作用,可以有助于增加溶质从流体扩散出来的机会。
图6显示了eot40的通道141的另一种构型。通道141包括第一或主通道141a和一个或多个其他通道141,称为次通道141b。主通道141a是贯通通道,在第一和第二表面48a、48b之间延伸穿过主体46。次通道141b从第一表面48a和第二表面48b中之一处的第一端149a延伸进入主体46中,到达主通道141a处主体46内的第二端149b。次通道141b的第二端149b通向主通道141a,而使次通道141b与主通道141a流体连通。因此,流体可以从主体46的第一或第二表面48a、48b进行输送,穿过次通道141b,并进入主通道141a。主通道141a的长度la基本上等于或大于主体46的厚度t。次通道141b的长度lb小于主体46的厚度t,或大于主体46的厚度t。次通道141b的长度lb'小于主体46的厚度t。次通道141b的长度lb”大于主体46的厚度t,而使这种次通道141b沿着穿过主体46的曲折、弯曲或蜿蜒路径行进。次通道141b'″是“死端”通道,并且从第一和第二表面48a、48b之一延伸到主体46内,至不与任何其他通道141a、141b流体连通的主体46内第二端149b。死端次通道141b'″可以使溶剂从流体中扩散出来并进入主体46中。
图7显示了eot40的通道241的另一种构型。主体46包括两个主通道241a。每个主通道241a从第一表面48a和第二表面48b之一延伸进入主体46中。每个主通道241a是“死端”通道,并未延伸穿过主体46。一个或多个次通道241b在两个主通道241a之间延伸以将它们流体连接。因此,流体通过流入主通道241a中的一个,穿过一个或多个次通道241b,并流出另一主通道241a,能够从每个第一和第二表面48a、48b穿过主体46。
参照图1a和图1b,将更详细地举例说明生物反应器10的运行。在壳体16的壳体入口18a处接收的流体被输送到内部空腔19中,以将流体灌注到每个灌注器件20的eot40。因此,流体通过每个网状结构30的第一壁32和第二壁34中的开口38传送到类器官42和每个eot40的通道41。在所示实施方式中,流体抵抗重力从下部壳体入口18a输送到上部壳体出口18b。如图1b所示,壳体16具有多个支撑件17,这些支撑件17附连至内表面19a并且沿着壳体16的长度l间隔开。每个灌注器件20的网状结构30可拆卸地安装至支撑件17之一上。在所示的实施方式中,支撑件17是附连于内表面19a并沿着壳体16的长度l延伸的平行柱17a中的凹口或凹槽。柱17a由筛网支撑以防止类器官42在组织破裂的情况下从eot40逃逸到经过处理的流体中,并离开流体出口18b。支撑件17的其他构型是可能的,并且都处于本公开的范围内。例如,在任何替代实施方式中,每个网状结构30具有一个或多个用于附连至壳体16的内表面19a的支撑件17。
仍参考图1b,灌注器件20a的堆叠可以冷冻保存。所有使用的材料都可以承受极低的温度,而不会疲劳或疲劳最小。在开始血浆疗法之前,灌注器件20可以从冷冻保存中取出并插入生物反应器10中。温暖的流体(例如,温暖的血浆)的循环能够融化生物反应器10中的类器官42,并进一步维持类器官42的温度于体温,为组织创造最佳环境。在一个实施方式中,约0.1%-约1%的人类肝脏团块存在于壳体16的灌注器件20中。这相当于大约几百万至几十亿个肝细胞,并也可以相当于每个灌注器件20约500-约10,000个类器官。
图8显示了具有本文所述的生物反应器10,400的人造肝脏系统300的实施方式。人造肝脏系统300有助于模拟人类肝脏功能,因此可以被称为“生物人工肝器件(bald)”。人造肝系统300(有时在本文中简称为“系统300”)包括流体网络302,这是一系列管道、连接器和其他组件,以在系统300的特征之间连通血浆。系统300具有蠕动泵304以使血浆循环通过流体网络302。在所描绘的实施方式中,泵304以约50ml/min-约300ml/min的流速推动血浆通过流体网络302。在泵304之后可以立即放置输液泵以插入盐水和/或抗凝剂(肝素)。流体网络302可以具有压力传感器,以确定系统300内的压力,并确保血浆以与提取血浆时相似的压力重新进入患者体内。
系统300可以可选地具有吸附卡座(cartridge),正如在图8中显示为分子吸附系统306或mas。mas306是任何合适的灌注器件或炭吸附系统。mas306与流体网络302流体连通,以从血浆中去除一些不希望的溶质。不希望的溶质可能包括毒素和高水平的胆红素。利用在活性碳或疏水性树脂上的吸附,在mas306中从血浆中除去不希望的溶质。系统300还可以具有与流体网络302流体连通的氧合器(oxygenator,产氧器)308,如图8所示。氧合器308运行以将氧溶解于血浆中以产生氧合血浆(oxygenatedplasma)。生物反应器10,400显示为与氧合器308流体连通,并从其接收氧合血浆。氧合血浆进入生物反应器10,400,并与灌注器件20的elt40相互作用,该操作将尚未被mas306去除的其他剩余的不希望的溶质扩散出氧合血浆并进入eot40的主体46。在一个替代实施方式中,氧合器308是生物反应器10,400的组件,并且氧合是在生物反应器10,400本身中进行。在一个实施方式中,系统300没有氧合器。在一个实施方式中,在生物反应器10,400下游的血浆上进行氧合。离开生物反应器10,400的壳体出口18b的经处理的血浆可以提供于附连到商业上可获得的体外过滤系统310。因此,图8中的系统300可以是与现有的体外过滤系统310一起使用的附加器件。在可替代的实施方式中,在生物反应器10,400之后将透析器416(参见图9)放置于系统300中以进行血浆透析。
图9显示了具有本文所述的生物反应器10,400的人工肝系统400的另一实施方式。系统400是独立的体外单元,其包括血液回路401a和血浆回路401b。血液回路401a包括用于将血液泵送到系统400中的泵402。输液泵402a放置于泵402之后,以插入盐水和抗凝剂(肝素)。在图9中,mas406位于血浆分离模块408之前的血液回路401a中,血浆分离模块408将血浆与血液分离,并将血浆提供给血浆回路401b。在血浆回路401b中,系统400具有蠕动泵410,以使血浆循环通过流体网络412。在血浆回路401b的透析器416之前存在血液泄漏检测器414,透析器416使用透析液从血浆中去除了一些不希望的溶质。血浆回路401b还具有氧合器418,以将氧溶解于血浆中以产生氧合血浆。生物反应器10,400与氧合器418流体连通,并从其接收氧合血浆。氧合血浆进入生物反应器10,400,并与灌注器件20的elt40相互作用,其运行以将尚未被mas406或透析仪416去除的其他剩余的不希望的溶质扩散出氧合血浆并进入eot40的主体46内。离开生物反应器10,400的壳体出口18b的经处理的血浆被提供回血液回路401a,在此处与分离的血液产物重新组合并返回患者的血液中,或可以进行进一步的流体处理。血液回路401a具有气泡检测器420,以防止空气引入血液。系统400还可以包括温度传感器、流量计、细胞过滤器、维持恒定温度的热交换器、夹具、滴注室和任何其他合适器件。
图10显示了具有本文所述的生物反应器10,400的人造肝脏系统500的另一实施方式。系统500是独立的体外单元,其包括血液回路501a和血浆回路501b。血液回路501a包括用于将血液泵入系统500的泵502。输液泵502a紧接泵502之后,以插入盐水和抗凝剂(肝素)。血浆分离模块508将血浆与血液分离,并将血浆提供给血浆回路501b。在血浆回路501b中,系统500具有蠕动泵510以使血浆循环通过流体网络512。在泵510的上游存在血液泄漏检测器514。血浆回路501b还具有氧合器518以将氧溶解于血浆中而产生氧合血浆。生物反应器10,400与氧合器518流体连通,并从其接收氧合血浆。氧合血浆进入生物反应器10,400,并与灌注器件20的elt40相互作用,其运行以将剩余的不希望的溶质扩散出氧合血浆,并扩散到eot40的主体46中。离开生物反应器10,400的壳体出口18b的经处理的血浆提供回血液回路501a,然后提供给透析器516,透析器516使用透析液从血浆中除去一些不希望的溶质。经处理的血浆与分离出的血液产物重新组合并返回患者血液中,或可以进行进一步的流体处理。血液回路501a具有气泡检测器520,以防止空气引入血液。系统500还可以包括温度传感器、流量计、细胞过滤器、维持恒定温度的热交换器、夹具、滴注室和任何其他合适器件。系统500可以包括如图10所示的血液灌注(hp)卡座,其可以位于生物反应器10,400的上游。
本文公开的实施方式包括:
a.一种灌注生物反应器,其包括:壳体,具有在壳体入口和壳体出口之间限定的长度,该壳体具有界定设置于壳体入口和壳体出口之间并与其流体连通的壳体内腔的内表面;和灌注器件,设置于该壳体的内腔中,每个灌注器件包括:网状结构,由该壳体的内表面支撑,该网状结构具有与第二壁间隔开以限定内部网状空腔的第一壁,该网状结构的第一和第二壁每个均具有在其中以允许流体连通通过该网状结构的开口;和封装器官组织,设置于该网状结构的第一壁和第二壁之间的内部网状空腔中,该封装器官组织具有至少一个至少部分被生物相容性的交联聚合物覆盖的类器官,该封装器官组织具有厚度由与所述网状结构的第一壁相邻的该主体第一表面和与所述网状结构的第二壁相邻的该主体第二表面之间限定的主体,该主体具有至少一个从第一表面和第二表面之一延伸进入该主体中以接收其中流体的通道,所述至少一个通道具有经选择以将溶质从流体中扩散出来并进入该主体内的直径;该灌注器件布置于该壳体的内腔中,彼此相邻,并沿着该壳体的长度彼此间隔开,以接收从壳体入口传送到壳体出口的流体,并将该流体灌注到每个灌注器件的封装器官组织和其中的所述至少一个通道中。
b.一种灌注器件,其包括:网状结构,具有与第二壁间隔开以限定内部网状空腔的第一壁,所述网状结构的第一和第二壁每个均具有在其中的开口以允许通过所述网状结构流体连通;和封装器官组织,设置于所述网状结构的第一壁和第二壁之间的内部网状空腔中,该封装器官组织具有至少一个至少部分被生物相容性的交联聚合物覆盖的类器官,该封装器官组织具有厚度由与所述网状结构的第一壁相邻的该主体第一表面和与所述网状结构的第二壁相邻的该主体第二表面之间限定的主体,该主体具有至少一个从第一表面和第二表面之一延伸进入该主体中以接收其中流体的通道,所述至少一个通道具有经选择以将溶质从流体中扩散出来并进入该主体内的直径。
c.一种人造肝脏系统,其包括:流体网络和使血浆循环通过该流体网络的泵;和与所述流体网络流体连通以接收来自其的血浆的灌注生物反应器,该灌注生物反应器包括:壳体,具有在所述壳体入口和壳体出口之间限定的长度,该壳体具有在所述壳体入口和壳体出口之间界定所述壳体内腔并与其流体连通的内表面,所述壳体入口接收血浆;和多个灌注器件,布置于所述壳体的内腔中,每个所述灌注器件包括:网状结构,由该壳体的所述内表面支撑,该网状结构具有与第二壁间隔开以限定内部网状空腔的第一壁,该网状结构的第一和第二壁每个均具有在其中的开口以允许通过该网状结构流体连通;和封装肝脏组织,设置于该网状结构的第一壁和第二壁之间的内部网状空腔中,该封装肝脏组织具有至少一个至少部分被生物相容性的交联聚合物覆盖的肝脏类器官,该封装肝脏组织具有厚度由与所述网状结构的第一壁相邻的该主体第一表面和与所述网状结构的第二壁相邻的该主体第二表面之间限定的主体,该主体具有至少一个从第一表面和第二表面之一延伸进入该主体中以接收其中血浆的通道,所述至少一个通道具有经选择以将不希望的溶质从血浆中扩散出来并进入该主体内的直径;该灌注器件布置于该壳体的内腔中,彼此相邻,并沿着该壳体的长度彼此间隔开,以接收从壳体入口传送到壳体出口的血浆,并将血浆灌注到每个灌注器件的封装肝脏组织和其中的所述至少一个通道中。
d.一种处理血浆的方法,其包括:将血浆输送到形成于封装肝组织中的至少一个通道中,所述封装肝组织具有至少一个至少部分被生物相容性的交联聚合物覆盖的肝脏类器官,所述至少一个通道具有经过选择以将不希望的溶质从所述血浆中扩散出来并进入所述封装肝脏组织中的直径。
e.一种制造灌注器件的方法,其包括:提供至少一个至少部分被生物相容性的交联聚合物覆盖的肝脏类器官,所述至少一个至少部分被生物相容性的交联聚合物覆盖的肝脏类器官具有至少一个通道延伸进入所述主体内的主体,所述至少一个通道具有经选择以将溶质从流体中扩散出来并进入所述主体内的直径;和将该主体定位于网状结构的空腔内,以允许流体进入所述空腔和所述主体的至少一个通道中,并容许该流体离开所述空腔。
实施方式a、b、c、d和e中每一个可以具有任意组合的一个或多个以下附加要素。
要素1:每个灌注器件的主体的至少一个通道延伸穿过第一和第二表面之间的主体。
要素2:该至少一个通道的长度基本上等于或大于该主体的厚度。
要素3:灌注器件之一的所述至少一个通道与紧邻灌注器件的所述至少一个通道偏置,流体沿着相邻灌注器件的通道之间的弯曲流动路径行进。
要素4:主体的所述至少一个通道包括第一通道和至少另一个通道,第一通道延伸穿过第一和第二表面之间的主体,所述至少另一个通道延伸进入主体内从第一表面和第二表面中之一处的第一端至第一通道处该主体内的第二端,所述至少另一个通道与第一通道流体连通。
要素5:第一通道的长度基本等于或大于主体的厚度,并且所述至少另一个通道的长度小于或大于主体的厚度。
要素6:所述至少另一个通道的长度大于主体的厚度。
要素7:沿着壳体的长度方向间隔开的多个支撑件,每个灌注器件的网状结构可拆卸地安装于该支撑件之一上。
要素8:壳体具有直立的取向,灌注器件以一个在另一个顶部(相互上叠)的堆叠形式被壳体支撑。
要素9:该至少一个通道的直径为150μm-750μm。
要素10:封装器官组织的所述至少一个类器官包括多个肝脏类器官。
要素11:输送氧合血浆包括将氧合血浆从所述至少一个通道输送至另一个封装肝组织中的第二通道,该另一个封装肝组织具有至少一个至少部分被生物相容性的交联聚合物覆盖的肝脏类器官。
要素12:输送氧合血浆包括将氧合血浆从所述至少一个通道输送至另一个封装肝组织中的第二通道,该另一个封装肝组织具有至少一个至少部分被生物相容性的交联聚合物覆盖的肝脏类器官,该第二通道与所述至少一个通道未对准(misalign)。
要素13:将氧合血浆从至少一个通道输送到第二通道包括将氧合血浆输送到第二通道,该第二通道与所述至少一个通道垂直间隔开。
要素14:在将血浆输送通过流体网络之前,冷冻保存该封装肝组织。
要素15:用氧合血浆温热冷冻保存的封装肝组织。
要素16:提供至少一个至少部分被生物相容性的交联聚合物覆盖的肝脏类器官包括使用光刻法在该主体内形成所述至少一个通道。
要素17:形成所述至少一个通道包括在该主体保持于网状结构的空腔中时用uv光源固化生物相容性的交联聚合物的部分。
要素18:形成所述至少一个通道包括将至少一个肝脏类器官和生物相容性的交联聚合物注入网状结构的空腔中并用uv光源固化所述生物相容性的交联聚合物的部分。
要素19:形成所述至少一个通道包括用具有至少一个不透明部分的光掩模覆盖该主体;和用施加到该光掩模上的uv光源固化该生物相容性的交联聚合物,该主体被光掩模的所述至少一个不透明部分覆盖的部分保持未固化而形成所述至少一个通道。
要素20:对血浆氧合以产生氧合血浆。
要素21:对血浆氧合包括在将血浆输送到所述至少一个通道之前对血浆氧合。
要素22:对血浆氧合包括在灌注生物反应器中对血浆氧合。
要素23:与流体网络流体连通的氧合器将氧扩散到血浆中以产生氧合血浆。
以上描述仅是示例性的,并且本领域的技术人员将会认识到,在不脱离所公开的本发明的范围的情况下可以对所描述的实施方式进行变化。根据对本公开的回顾,落入本发明范围内的其他修改对于本领域技术人员将是显而易见的,并且这些修改旨在落入所附权利要求书之内。
- 还没有人留言评论。精彩留言会获得点赞!