模拟肠道环境的制作方法
本发明提供了一种模拟肠道环境,其允许在体外测定受关注细胞的代谢特性。本发明还涉及采用此类环境的系统和其中利用了此类环境和系统的方法。
虽然认为人体肠道在子宫内为无菌的,但是其在出生后立即暴露于多种母体和环境微生物中。此后,发生微生物定殖和演替的动态时期,这受诸如分娩方式、环境、饮食和宿主基因型等因素的影响,所有这些因素都会影响肠道微生物群的组成,尤其是在生命早期。随后,微生物群稳定化并且变得成人化(adult-like)人肠道微生物群含有多于500至1000种不同的种系型(phylotype),所述种系型基本上属于两个主要的细菌分支,即拟杆菌门(bacteroidetes)和厚壁菌门(firmicutes)。
人肠道细菌定殖所产生的成功共生关系产生了多种代谢、结构、保护和其他有益功能。所定殖的肠道的代谢活动增强确保了原本难以消化的膳食组分被降解,同时释放出副产物,从而为宿主提供重要的营养物质来源。同样,肠道微生物群的免疫重要性也得到了公认。
鉴于这些共生关系对保持健康的重要性,鉴定特定细胞(例如细菌或真菌细胞)对微生物组操作的影响受到极大关注,无论那些细胞被认为是对健康有益或是致病性的。验证在简单体外测定中观察到的受关注细胞的特性仍将在明显更复杂的肠道环境中被赋予也很重要。
体内研究可用于研究受关注细胞的作用。动物模型是一种能够评估特定细胞的作用的方便方式。在此类研究中使用的动物可为健康的,或可对其进行操纵或激发以表现出特定疾病的症状,并且可对由受关注细胞赋予的行为或疾病状态的变化进行观察。另外,还可通过其他方式确定受关注细胞的作用,例如通过粪便分析(以查看施用所研究细胞是否对微生物组的组成造成任何变化或干扰)和/或代谢组学分析(以查看施用细胞是否导致胃肠道或远端组织中代谢物谱的任何变化)。
然而,动物研究的一个问题是,因为它们是在受无数且复杂的生物反应影响的活生物中进行的,所以不可能总是得出结论,确定在施用受关注细胞后观察到的生理变化必然是由于所述施用或其他某些原因引起的。
会影响此类研究的结果和结果可靠性的其他因素包括所用动物之间的遗传差异和不一致的环境条件。虽然可以将这些差异的影响降至最低(例如,通过控制繁殖条件和对动物进行基因筛选和/或通过确保动物的存储和喂养的一致性),但是这些步骤增加了研究的成本和复杂性,特别是在多个场所进行的情况下。
动物研究的另一个问题是,从研究设计开始到生成有意义的数据,必须采取许多步骤,意味着这可能需要数周甚至数月的时间。
作为动物模型的替代方法,已尝试开发模拟胃肠道环境。例如,theimpactoffoodbioactivesonhealth(2015)的第305页至第317页讨论的人肠道微生物生态系统模拟器(simulatorofthehumanintestinalmicrobialecosystem,
为了模仿肠道,
正如theimpactoffoodbioactivesonhealth的上述章中所阐述的那样,关于
该章中还报告,为了在
由venema(2015,theimpactoffoodbioactivesonhealth,第293页至第304页)称为tim-2的肠道微生物组的另一个体外模型具有较短的设置时间,但仍使用了志愿者的粪便接种物,这一样由于此类样品的来源、供体间的可变性和由于此种接种物内病原体的安全性问题而产生问题。
已知人类微生物群含有至少1000种不同的细菌菌种(lozupone等人(2012)nature489(7415)220-230)。微生物组在个体之间具有高度差异性,并且可随年龄、饮食、疾病和环境的变化而变化。随着时间的推移从一个受试者获得的样品比从另一个受试者获得的样品更相似,这表明每个人都有相对不同的微生物组。tim-2和shime系统用人类粪便样品接种。因此,用于接种这些系统的细菌种群是高度可变的种群,这可例如导致系统之间代谢物产生的重大差异。
因此,本领域中需要更可控的模拟胃肠环境,所述模拟胃肠环境解决上述现有技术的一个或多个缺点。
因此,根据本发明的第一方面,提供了一种模拟肠道环境,所述模拟肠道环境包含液体培养基、营养能源和基本上由5至200种细菌菌种组成的细菌种群,其中所述细菌种群能够从所述营养能源产生丁酸盐、丙酸盐、琥珀酸盐、乙醇、乙酸盐、乳酸盐和甲酸盐中的至少三种。
有利地,与现有技术的系统相比,模拟肠道环境允许以更简单、更可控且更可重复的方式确定细胞的代谢相互作用。出乎意料的是,发明人发现可在模拟肠道环境中对体内代谢活性进行准确预测,所述模拟肠道环境中包含的生物种类远少于常规认为进行此类评估所需的生物种类。本领域技术人员将认识到,与从将含有成千上万种不同细菌菌种的粪便样品获得的材料相比,包含200种或更少的不同菌种的细菌种群显著地复杂性更低且更可控。
实际上,正如以下实施例所示,发明人已证明,包含基本上由少于200种细菌菌种组成的细菌种群的模拟肠道环境可用于提供对受关注细胞的代谢活性有价值的见解。具体地说,基本上由少于200种细菌菌种组成的细菌种群适用于提供对受关注细胞的代谢活性有价值的见解。在本发明的优选的实施方案中,细菌种群基本上由6种或更多种、7种或更多种、8种或更多种、9种或更多种、10种或更多种、11种或更多种、12种或更多种、13种或更多种、14种或更多种、15种或更多种或16种或更多种细菌菌种组成。另外或替代地,细菌种群可基本上由150种或更少、120种或更少、100种或更少、90种或更少、80种或更少、70种或更少、60种或更少、50种或更少、40种或更少、30种或更少、25种或更少或20种或更少的细菌菌种组成。在一个优选的实施方案中,细菌种群基本上由5至50种细菌菌种组成。在一个更优选的实施方案中,细菌种群基本上由10至30种细菌菌种组成。在进一步优选的实施方案中,细菌种群基本上由10至20种细菌菌种组成。
在本发明的一些实施方案中,细菌种群含有不超过200种细菌菌种。在优选的实施方案中,模拟肠道环境不是shime或tim-2系统。在优选的实施方案中,细菌种群不接种粪便样品,诸如人粪便样品。
应当理解,模拟肠道环境一般将是体外模拟肠道环境。
在本发明的一些实施方案中,细菌种群基本上由5至200个不同的细菌菌株组成。在一些实施方案中,细菌种群基本上由6个或更多个、7个或更多个、8个或更多个、9个或更多个、10个或更多个、11个或更多个、12个或更多个、13个或更多个、14个或更多个、15个或更多个或16个或更多个细菌菌株组成。另外或替代地,细菌种群可基本上由150个或更少、120个或更少、100个或更少、90个或更少、80个或更少、70个或更少、60个或更少、50个或更少、40个或更少、30个或更少或25个或更少的细菌菌株组成。在一个优选的实施方案中,细菌种群基本上由5至50个细菌菌株组成。在一个更优选的实施方案中,细菌种群基本上由10至30个细菌菌株组成。在进一步优选的实施方案中,细菌种群基本上由10至20个细菌菌株组成。细菌种群可基本上由5至50个细菌菌株组成。在一个更优选的实施方案中,细菌种群基本上由10至30个细菌菌株组成。在进一步优选的实施方案中,细菌种群基本上由10至20个细菌菌株组成。
细菌种群可包括选自由以下组成的组的科的一种或多种细菌菌种:拟杆菌科(bacteroidaceae)、普雷沃氏菌科(prevotellaceae)、理研菌科(rikenellaceae)、瘤胃菌科(ruminococcaceae)、韦荣氏菌科(veillonellaceae)和/或疣微菌科(verrucomicrobiaceae)。细菌种群可包括来自以下属的菌种:别样杆菌属(alistipes)、阿克曼氏菌属(akkermansia)、厌氧棒状菌属(anaerostipes)、拟杆菌属(bacteroides)、拟杆菌门(bacteroidetes)、拜瑞曲科斯菌属(bariatricus)、双歧杆菌属(bifidobacterium)、布劳特氏菌属(blautia)、丁酸弧菌属(butyrivibrio)、丁酸球菌属(butyricicoccus)、粪球菌属(coprococcus)、梭菌属(clostridium)、柯林斯氏菌属(collinsella)、戴阿利斯特杆菌属(dialister)、脱硫弧菌属(desulfovibrio)、多尔氏菌属(dorea)、埃希氏菌属(escherichia)、真杆菌属(eubacterium)、厚壁菌门(firmicutes)、粪杆菌属(faecalibacterium)、乳杆菌属(lactobacillus)、巨型球菌属(megasphaera)、甲烷短杆菌属(methanobrevibacter)、考拉杆菌属(phascolarctobacterium)、普雷沃菌属(prevotella)、瘤胃球菌属(ruminococcus)、罗斯氏菌属(roseburia)、月形单胞菌属(selenomonas)和/或疣微菌门(verrucomicrobia)。
本发明的细菌种群可包括由选自以下组成的组的一种或多种细菌菌种:腐烂别样杆菌(alistipesputredinis)、嗜粘蛋白阿克曼氏菌(akkermansiamuniciphilla)、粪厌氧棒状菌(anaerostipescaccae)、大肠厌氧棒状菌(anaerostipescoli)、哈氏厌氧棒状菌(anaerostipeshadrus)、食鼠李糖厌氧棒状菌(anaerostipesrhamnosivorans)、球形拟杆菌(bacteroidescoccoides)、多雷拟杆菌(bacteroidesdorei)、马赛拟杆菌(bacteroidesmassiliensis)、多形拟杆菌(bacteroidesthetaiotamicron)、单形拟杆菌(bacteroidesuniformis)、普通拟杆菌(bacteroidesvulgatus)、马赛拜瑞曲科斯菌(bariatricusmassiliensis)、青春双歧杆菌(bifidobacteriumadolescentis)、长双歧杆菌(bifidobacteriumlongum)、延长布劳特氏菌(blautiaproducta)、球形布劳特氏菌(blautiacoccoides)、卵形布劳特氏菌(blautiaobeum)、产丁酸菌(butyricicoccuspullicaecorum)、溶纤维丁酸弧菌(butyrivibriofibrisolvens)、丁酸梭菌(clostridiumbutyricum)、吲哚梭菌(clostridiumindolis)、无害梭菌(clostridiuminnocuum)、丙酸梭菌(clostridiumpropionicum)、灵巧粪球菌(coprococcuscatus)、陪伴粪球菌(coprococcuscomes)、规则粪球菌(coprococcuseutactus)、难见戴阿利斯特杆菌(dialisterinvisus)、惰性脱硫弧菌(desulfovibriopiger)、长链多尔氏菌(dorealongicatena)、大肠埃希氏菌(escherichiacoli)、柱状真杆菌(eubacteriumcylindroides)、霍氏真杆菌(eubacteriumhallii)、粘液真杆菌(eubacteriumlimosum)、细枝真杆菌(eubacteriumramulus)、直肠真杆菌(eubacteriumrectale)、普氏粪杆菌(faecalibacteriumprausnitzii)、唾液乳杆菌(lactobacillussalivarius)、埃氏巨型球菌(megasphaeraelsdenii)、史氏甲烷短杆菌(methanobrevibactersmithii)、琥珀酸考拉杆菌(phascolarctobacteriumsuccinatutens)、普雷沃菌(prevotellacopri)、白色瘤胃球菌(ruminococcusalbus)、粪便罗斯氏菌(roseburiafaecis)、人罗斯氏菌(roseburiahominis)、肠罗斯氏菌(roseburiaintestinalis)、食葡糖罗斯氏菌(roseburiainulinivorans)、反刍月形单胞菌(selenomonasruminantium)和/或小韦荣球菌(veillonellaparvula)。
在更优选的实施方案中,细菌种群由以下菌种组成:多雷拟杆菌、单形拟杆菌、多形拟杆菌、普通拟杆菌、长双歧杆菌、延长布劳特氏菌、布劳特氏菌某种、马赛拜瑞曲科斯菌、无害梭菌、长链多尔氏菌、霍氏真杆菌、大肠埃希氏菌、直肠真杆菌、唾液乳杆菌、普雷沃菌某种和粪便罗斯氏菌。含有这些菌种的细菌种群涵盖了短链脂肪酸的所有主要代谢途径,发明人已将其鉴定为对评估受关注细胞的代谢活性具有重要意义。
如本文所用,为了描述包含在本发明的模拟肠道环境内的细菌种群,术语“基本上由…组成”和“由…组成”用于将模拟肠道环境表征为排除其他细菌菌株或菌种,或仅包含极少量或生物学上不相关的其他细菌菌株或菌种。
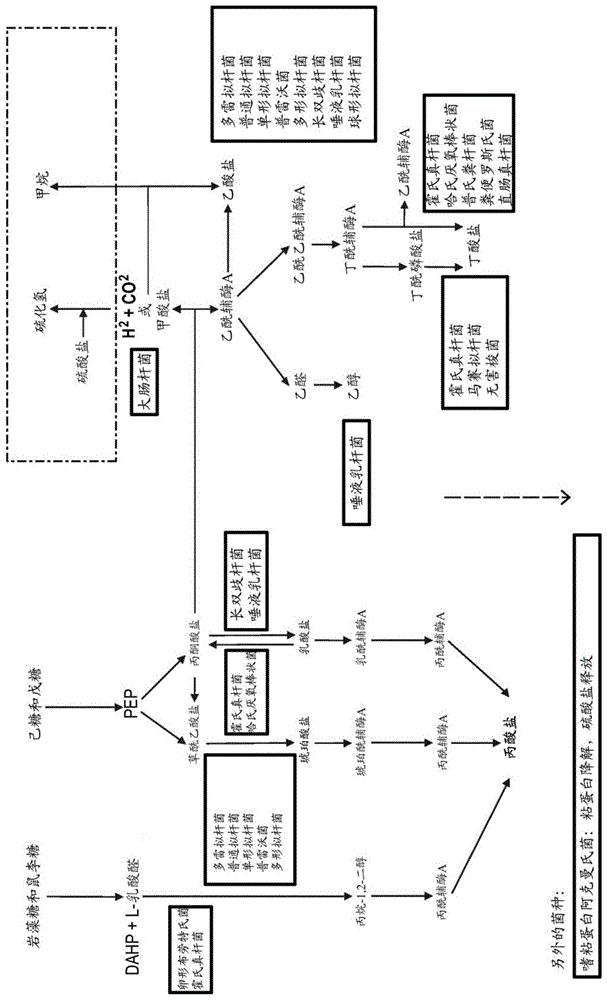
肠道微生物群中的主要短链脂肪酸产物包括甲酸盐、乙酸盐、丙酸盐、乳酸盐和丁酸盐(douglas和preston(2016)gutmicrobes,7,(3),189-200)。如上所述,细菌种群能够从营养能源中产生丁酸盐、丙酸盐、琥珀酸盐、乙醇、乙酸盐、乳酸盐和甲酸盐中的至少三种。在优选的实施方案中,细菌种群能够产生丁酸盐、丙酸盐、琥珀酸盐、乙醇、乙酸盐、乳酸盐和甲酸盐中的至少四种、至少五种、至少六种或全部。能够产生丁酸盐、丙酸盐、琥珀酸盐、乙醇、乙酸盐、乳酸盐和甲酸盐中的至少四种、至少五种、至少六种或全部的细菌种群涵盖了短链脂肪酸的主要代谢途径。这允许细菌种群准确地模仿肠道环境,发明人已将其鉴定为对评估受关注细胞的代谢活性具有重要意义。
为免存疑,这不一定意味着丁酸盐、丙酸盐、琥珀酸盐、乙醇、乙酸盐、乳酸盐和/或甲酸盐必须由细菌种群成员直接产生;这些化合物可间接产生。例如,第一细菌菌株可从营养能源产生第一代谢物(例如乳酸盐或琥珀酸盐),并且存在于细菌种群中的第二细菌菌株可从该第一代谢物产生短链脂肪酸(例如丙酸盐、丁酸盐、乙酸盐和/或甲酸盐)。
另外,不是必需在模拟肠道环境中产生丁酸盐、丙酸盐、琥珀酸盐、乙醇、乙酸盐、乳酸盐和/或甲酸盐中的每种作为终产物,使得一旦达到稳定化,可测量水平的那些化合物中的每种都将存在于模拟肠道环境中。例如,那些化合物中的一种或多种(例如琥珀酸盐和/或乙酸盐)可作为第一代谢物由细菌种群中的一个或多个菌株产生,然后所述第一代谢物可由细菌种群的其他成员转化为短链脂肪酸(例如丙酸盐、丁酸盐、乙酸盐和/或甲酸盐)。
在本发明的实施方案中,模拟肠道环境包含一种或多种短链脂肪酸。在优选的实施方案中,模拟肠道环境包含丁酸盐、丙酸盐、乙酸盐、乳酸盐和甲酸盐中的至少三种、至少四种或全部五种。
这些成分中的一些或全部(如果存在的话)可由细菌种群产生。另外或替代地,这些成分中的一些或全部可直接添加到液体培养基中。
例如,在一些实施方案中,丁酸盐、乳酸盐和/或甲酸盐可由细菌种群产生。另外或替代地,丙酸盐和/或乙酸盐可直接添加到液体培养基中。在一些实施方案中,乙酸盐和丙酸盐(如果存在的话)均可直接添加到液体培养基中并由细菌种群产生。
在优选的实施方案中,丁酸盐、丙酸盐、琥珀酸盐、乙醇、乙酸盐、乳酸盐和甲酸盐中的至少1种、至少2种、至少3种、至少4种、至少5种、至少6种或至少7种由细菌种群产生。发明人已发现,由细菌种群产生短链脂肪酸是有利的,因为这模仿了肠道环境。
在模拟肠道环境包含丁酸盐的实施方案中,丁酸盐以至少约0.5mm、约1.0mm、约1.5mm、约2.0mm、约3.0mm、约4.0mm或约5.0mm的浓度存在。另外或替代地,丁酸盐可以约10.0mm或更低、约8.0mm或更低、约6.0mm或更低或约5.0mm或更低的浓度存在。在模拟肠道环境包含丁酸盐的一个优选的实施方案中,丁酸盐以约1.0mm至约5.0mm的浓度存在。
在模拟肠道环境包含丙酸盐的实施方案中,丙酸盐以至少约0.5mm、约1.0mm、约1.5mm、约2.0mm、约3.0mm、约4.0mm或约5.0mm的浓度存在。另外或替代地,丙酸盐可以约10.0mm或更低、约8.0mm或更低、约6.0mm或更低或约5.0mm或更低的浓度存在。在模拟肠道环境包含丙酸盐的一个优选的实施方案中,丙酸盐以约2.0mm至约7.0mm的浓度存在。
在模拟肠道环境包含乙酸盐的实施方案中,乙酸盐以至少约0.1mm、约0.2mm、约0.5mm、约1.0mm、约1.5mm或约2.0mm的浓度存在。另外或替代地,乙酸盐可以约5.0mm或更低、约4.0mm或更低、约3.0mm或更低或约2.0mm或更低的浓度存在。在模拟肠道环境包含乙酸盐的一个优选的实施方案中,乙酸盐以约0.2mm至约2.0mm的浓度存在。
在模拟肠道环境包含乳酸盐的实施方案中,乳酸盐以至少约0.1mm、约0.2mm、约0.5mm、约1.0mm、约1.5mm或约2.0mm的浓度存在。另外或替代地,乳酸盐可以约5.0mm或更低、约4.0mm或更低、约3.0mm或更低或约2.0mm或更低的浓度存在。在模拟肠道环境包含乳酸盐的一个优选的实施方案中,乳酸盐以约0.2mm至约2.0mm的浓度存在。
在模拟肠道环境包含甲酸盐的实施方案中,甲酸盐以至少约0.01mm、约0.02mm、约0.05mm、约0.1m、约0.2mm或约0.5mm的浓度存在。另外或替代地,甲酸盐可以约2.0mm或更低、约1.5mm或更低或约1.0mm或更低的浓度存在。在模拟肠道环境包含甲酸盐的一个优选的实施方案中,甲酸盐以约0.01mm至约0.5mm的浓度存在。
在本文中对模拟肠道环境中成分的浓度进行定量的情况下,除非另有说明,否则以液体培养基中所讨论成分的摩尔量提供这些成分。测量这些化合物的手段在本领域中是众所周知的,并且包括液相色谱法、hp-lc、lc-ms和气相色谱法。如实施例中所示,可使用气相色谱法对模拟肠道环境的成分进行定量。
在模拟肠道环境包含丁酸盐、丙酸盐、乙酸盐、乳酸盐和甲酸盐中的至少三种、至少四种或全部五种的实施方案中,丙酸盐或丁酸盐可以最高浓度存在。另外或替代地,在此类实施方案中,乙酸盐、甲酸盐或乳酸盐可以最低浓度存在。
关于细菌种群的组成,本领域技术人员将熟悉能够产生丁酸盐、丙酸盐、琥珀酸盐、乙醇、乙酸盐、乳酸盐和/或甲酸盐的细菌。任何此种细菌都可包含在细菌种群内。
在实施方案中,当丁酸盐产生菌包括在细菌种群中时,这些丁酸盐产生菌可通过以下中间代谢物中的一种或多种产生丁酸盐:磷酸烯醇丙酮酸盐、丙酮酸盐、乙酰辅酶a、乙酰乙酰辅酶a、丁酰辅酶a、丁酰磷酸盐。
已知人肠道细菌通过三种不同的途径产生丙酸盐:1)琥珀酸盐途径;2)丙烯酸盐途径;和3)丙二醇途径(reichardt等人(2014)ismej.8(6):1323–1335)。在本发明的某些实施方案中,包括在细菌种群中的细菌可通过一种、两种或全部三种途径产生丙酸盐。在实施方案中,当丙酸盐产生菌包括在细菌种群中时,这些丙酸盐产生菌可通过以下中间代谢物中的一种或多种产生丙酸盐:磷酸二羟丙酮、l-乳酸醛、丙烷-1,2-二醇、丙酰辅酶a、pep、草酰乙酸盐、琥珀酸盐、琥珀酰辅酶a、丙酰辅酶a、丙酮酸盐、乳酸盐或乳酰辅酶a。
在某些实施方案中,通过琥珀酸盐途径产生的丙酸盐可由来自以下属的细菌产生:拟杆菌属和/或普雷沃菌属。在优选的实施方案中,通过琥珀酸盐途径产生的丙酸盐可由以下菌种中的任一种产生:多雷拟杆菌、普通拟杆菌、单形拟杆菌、多形拟杆菌和/或普雷沃菌。
在某些实施方案中,通过丙烯酸盐途径产生的丙酸盐可由来自以下属的细菌产生:真杆菌属、厌氧棒状菌属、双歧杆菌属和/或乳杆菌属。在优选的实施方案中,通过丙烯酸盐途径产生的丙酸盐可由以下菌种中的任一种产生:霍氏真杆菌、哈氏厌氧棒状菌、长双歧杆菌和/或唾液乳杆菌。
在实施方案中,当琥珀酸盐产生菌包括在细菌种群中时,这些琥珀酸盐产生菌可通过以下中间代谢物中的一种或多种产生琥珀酸盐:磷酸烯醇丙酮酸盐、草酰乙酸盐。
在某些实施方案中,通过丙二醇途径产生的丙酸盐可由来自以下属的细菌产生:布劳特氏菌属和/或真杆菌属。在优选的实施方案中,通过丙二醇途径产生的丙酸盐可由卵形布劳特氏菌和/或霍氏真杆菌产生。
在实施方案中,当乙醇产生菌包括在细菌种群中时,这些乙醇产生菌可通过以下中间代谢物中的一种或多种产生乙醇:磷酸烯醇丙酮酸盐、丙酮酸盐、乙酰辅酶a、乙醛。在优选的实施方案中,细菌种群中的乙醇产生菌为唾液乳杆菌。
在实施方案中,当乙酸盐产生菌包括在细菌种群中时,这些乙酸盐产生菌可通过以下中间代谢物中的一种或多种产生乙酸盐:磷酸烯醇丙酮酸盐、丙酮酸盐、甲酸盐、乙酰辅酶a。
在实施方案中,当乳酸盐产生菌包括在细菌种群中时,这些乳酸盐产生菌可通过以下中间代谢物中的一种或多种产生乳酸盐:磷酸烯醇丙酮酸盐、丙酮酸盐。
在实施方案中,当甲酸盐产生菌包括在细菌种群中时,这些甲酸盐产生菌可通过以下中间代谢物中的一种或多种产生甲酸盐:磷酸烯醇丙酮酸盐、丙酮酸盐。
在一些实施方案中,细菌种群可包含来自以下科中的一种或多种的丁酸盐产生菌:毛螺菌科(lachnospiraceae)和/或瘤胃菌科。在一些实施方案中,细菌种群可包含来自以下属中的一种或多种的丁酸盐产生菌:丁酸球菌属、真杆菌属、厌氧棒状菌属、粪球菌属、丁酸弧菌属、罗斯氏菌属、粪杆菌属、拜瑞曲科斯菌属、巨型球菌属和/或梭菌属。在优选的实施方案中,细菌种群可包含来自以下菌种中的一种或多种的丁酸盐产生菌:产丁酸菌、溶纤维丁酸弧菌、直肠真杆菌、细枝真杆菌、丁酸梭菌、粘液真杆菌、灵巧粪球菌、规则粪球菌、陪伴粪球菌、长链多尔氏菌、柱状真杆菌、霍氏真杆菌、普氏粪杆菌、哈氏厌氧棒状菌、食鼠李糖厌氧棒状菌、粪厌氧棒状菌、无害梭菌、人罗斯氏菌、粪便罗斯氏菌、食葡糖罗斯氏菌、埃氏巨型球菌、粪便罗斯氏菌、肠罗斯氏菌和/或马赛拜瑞曲科斯菌。丁酸盐是存在于人肠道环境中的主要短链脂肪酸,并且发明人已发现,丁酸盐产生菌种的存在对于准确地模拟肠道环境是重要的。已知这些优选的细菌菌种产生丁酸盐,并且因此可用于肠道环境的模拟。
在更优选的实施方案中,细菌种群可包含来自以下菌种中的一种或多种的丁酸盐产生菌:马赛拟杆菌、无害梭菌、马赛拜瑞曲科斯菌、霍氏真杆菌、长链多尔氏菌、哈氏厌氧棒状菌、普氏粪杆菌、粪便罗斯氏菌和/或直肠真杆菌。如实施例中所示,包含马赛拜瑞曲科斯菌、无害梭菌、霍氏真杆菌、长链多尔氏菌、粪便罗斯氏菌和直肠真杆菌的细菌种群可在本发明的模拟肠道环境中产生丁酸盐。
在一些实施方案中,细菌种群可包含来自以下科中的一种或多种的丙酸盐产生菌:拟杆菌科、普雷沃氏菌科、理研菌科、瘤胃菌科、韦荣氏菌科和/或疣微菌科。
在一些实施方案中,细菌种群可包含来自以下属中的一种或多种的丙酸盐产生菌:厚壁菌门、疣微菌门、拟杆菌门、拟杆菌属、布劳特氏菌属、普雷沃菌属和/或真杆菌属。
在一些实施方案中,细菌种群可包含来自以下菌种中的一种或多种的丙酸盐产生菌:嗜粘蛋白阿克曼氏菌、单形拟杆菌、普通拟杆菌、多雷拟杆菌、多形拟杆菌、普雷沃菌、长链多尔氏菌、腐烂别样杆菌、食葡糖罗斯氏菌、霍氏真杆菌、卵形布劳特氏菌、布劳特氏菌某种、灵巧粪球菌、难见戴阿利斯特杆菌、琥珀酸考拉杆菌、嗜粘蛋白阿克曼氏菌、反刍月形单胞菌、丙酸梭菌和/或小韦荣球菌。
在更优选的实施方案中,细菌种群可包含来自以下菌种中的一种或多种的丙酸盐产生细菌:长链多尔氏菌、多形拟杆菌、单形拟杆菌、普通拟杆菌、多雷拟杆菌、长双歧杆菌、布劳特氏菌某种、霍氏真杆菌、普雷沃菌、普雷沃菌某种和/或唾液乳杆菌。
普雷沃菌、卵形布劳特氏菌、多雷拟杆菌、单形拟杆菌、多形拟杆菌和/或普通拟杆菌是可在本发明的模拟肠道环境中使用的生物实例。
在一些实施方案中,细菌种群可包含来自拟杆菌门的乙酸盐产生菌。在某些实施方案中,细菌种群可包含来自以下属中的一种或多种的乙酸盐产生菌:拟杆菌属、双歧杆菌属、普雷沃菌属、布劳特氏菌属、月形单胞菌属和/或梭菌属。在某些实施方案中,细菌种群可包含来自以下菌种中的一种或多种的乙酸盐产生菌:长双歧杆菌、普雷沃菌、普雷沃菌某种、球形布劳特氏菌、球形拟杆菌、多雷拟杆菌、延长布劳特氏菌、普通拟杆菌、多形拟杆菌、单形拟杆菌、多形拟杆菌、反刍月形单胞菌、唾液乳杆菌和/或多雷拟杆菌。
在更优选的实施方案中,细菌种群可包含来自以下菌种中的一种或多种的乙酸盐产生菌:长双歧杆菌、普雷沃菌、多雷拟杆菌、延长布劳特氏菌、普通拟杆菌、多形拟杆菌、单形拟杆菌、多形拟杆菌和/或唾液乳杆菌。
多形拟杆菌、单形拟杆菌、普通拟杆菌、球形拟杆菌、多雷拟杆菌、长双歧杆菌、唾液乳杆菌和/普雷沃菌是可在本发明的模拟肠道环境中使用的生物实例。
另外或替代地,细菌种群可包含来自以下属中的一种或多种的乳酸盐产生菌:双歧杆菌属、拟杆菌属、厌氧棒状菌属、粪球菌属、梭菌属、柯林斯氏菌属、月形单胞菌属、罗斯氏菌属和/或乳杆菌属。
在一些实施方案中,细菌种群可包含来自以下菌种中的一种或多种的乳酸盐产生菌:反刍月形单胞菌、青春双歧杆菌、直肠真杆菌、普氏粪杆菌、粪厌氧棒状菌、大肠厌氧棒状菌、长双歧杆菌、哈氏厌氧棒状菌、长链多尔氏菌、唾液乳杆菌、灵巧粪球菌、马赛拜瑞曲科斯菌和/或吲哚梭菌。
在更优选的实施方案中,细菌种群可包含来自以下菌种中的一种或多种的乳酸盐产生菌:直肠真杆菌、长双歧杆菌、唾液乳杆菌和/或马赛拜瑞曲科斯菌。
长双歧杆菌和/或唾液乳杆菌是可在本发明的模拟肠道环境中使用的生物实例。
在实施方案中,细菌种群可包含来自以下属的甲酸盐产生菌:埃希氏菌属、瘤胃球菌属和/或双歧杆菌属。
在一些实施方案中,细菌种群可包含来自以下菌种中的一种或多种的甲酸盐产生菌:白色瘤胃球菌、长双歧杆菌和/或大肠埃希氏菌。大肠埃希氏菌和长双歧杆菌是可在本发明的模拟肠道环境中使用的生物实例。
除了短链脂肪酸产生菌外,具有另外功能的生物也可包括在细菌种群中。因此,在本发明的实施方案中,细菌种群可包含:
i)硫酸盐释放菌,诸如来自阿克曼氏菌属的硫酸盐释放菌。嗜粘蛋白阿克曼氏菌是可在本发明的模拟肠道环境中使用的生物实例。
ii)粘蛋白降解菌,诸如来自阿克曼氏菌属的粘蛋白降解菌。嗜粘蛋白阿克曼氏菌是可在本发明的模拟肠道环境中使用的生物实例。
iii)硫酸盐还原菌,诸如来自脱硫弧菌属的硫酸盐还原菌。惰性脱硫弧菌是可在本发明的模拟肠道环境中使用的生物实例。
iv)产甲烷菌,诸如来自甲烷短杆菌属的产甲烷菌。史氏甲烷短杆菌是可在本发明的模拟肠道环境中使用的生物实例。
v)乙醇产生菌,诸如来自埃希氏菌属的细菌。大肠埃希氏菌是可在本发明的模拟肠道环境中使用的生物实例。
在本发明的实施方案中,存在于本发明的模拟肠道环境中的细菌种群主要或仅包含从健康供体的人肠道分离的共生生物的生物。在此类实施方案中,存在于细菌种群中的至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%或至少99.5%的细菌菌种是从健康供体的人肠道分离的共生生物。在模拟肠道环境中使用从健康供体的人肠道分离的共生生物作为细菌种群的优势在于,这些生物可提供更准确的人肠道微生物组模型。用于分离共生细菌菌种的方法在本领域中是众所周知的。
微生物群组成的巨大变化已被记录在许多疾病中,诸如胃肠道病症,例如炎症性肠病(ibd)(frank等人(2007)pnas104(34):13780-5)。在本发明的其他实施方案中,细菌种群包含从不健康和/或患病供体(诸如患有肠易激综合征的供体)的人肠道分离的共生生物的生物。使用从不健康和/或患病供体分离的细菌种群可为有利的,因为这允许模拟肠道环境模拟患病状态。这允许在模拟不健康的人中肠道微生物组的肠道环境中准确预测受关注生物的体内代谢活性。
在本发明的某些实施方案中,可从单个受关注的健康供体或多个受关注的健康供体的人肠道分离细菌生物。在其他实施方案中,可从受关注的单个不健康和/或患病供体或多个不健康和/或患病供体的人肠道分离细菌生物。在一些实施方案中,可从至少2个或更多个、3个或更多个、4个或更多个、5个或更多个、6个或更多个、7个或更多个、8个或更多个、9个或更多个、10个或更多个、11个或更多个、12个或更多个、13个或更多个、14个或更多个、15个或更多个单独的受关注的供体分离细菌菌种。
从健康供体的人肠道分离的共生生物可作为单个细菌菌种或作为细菌菌种的组合而分离。从健康供体的人肠道分离的共生生物可作为单个细菌菌株或作为细菌菌株的组合而分离。可使用本领域众所周知的方法,例如使用nmr、液相色谱法、气相色谱法、液相色谱质谱法或气相色谱质谱法,根据代谢功能或生长曲线分离细菌的单个菌种或菌株。
一旦从健康或不健康的受关注供体的人肠道分离出单个细菌菌种或菌株或细菌菌种或菌株的组合,就可将它们用于接种模拟肠道环境,或者可使用本领域众所周知的方法存储细菌,例如,可制备细菌的甘油原液并将其存储在-80℃下,或可将细菌冷冻干燥。模拟肠道环境可用从健康供体的人肠道新鲜分离出的细菌生物来启动,或者模拟肠道环境可用分离后冷冻干燥的细菌生物来启动。
模拟肠道环境可用单独的单个细菌菌种或细菌菌种的组合接种。在其他实施方案中,模拟肠道环境可用单独的单个细菌菌株或细菌菌株的组合接种。细菌菌株的组合可包括来自相同菌种的细菌菌株,或可包括来自不同菌种的细菌菌株。本领域技术人员可选择用于接种模拟肠道环境的特定细菌菌种。这允许更好地控制模拟肠道环境。
本发明的模拟肠道环境可用于模拟人胃肠系统的不同隔室,诸如小肠、升结肠、横结肠或降结肠。本发明的模拟肠道环境可用于模拟在这些隔室的每个中发现的微生物群。这种模拟不同胃肠道隔室中的人肠道微生物群的能力是有用的,因为它可提供对人肠道的不同隔室中受关注细胞的代谢活性的有价值的见解。
在本发明的某些实施方案中,存在于本发明的模拟肠道环境中的细菌种群主要或仅包含不是遗传修饰的生物的生物。在此类实施方案中,存在于细菌种群中的至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%或至少99.5%的细菌不是遗传修饰的生物。
在本发明的一些实施方案中,存在于本发明的模拟肠道环境中的细菌种群主要或仅包含不是致病性的生物。在此类实施方案中,存在于细菌种群中的至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%或至少99.5%的细菌不是致病性的。
本发明的模拟肠道环境的一个优点是其允许可靠地控制拟杆菌属:厚壁菌门的比率。因此,在本发明的实施方案中,模拟肠道环境包含细菌种群,其中拟杆菌门:厚壁菌门的比率为5至50:50至95、10至45:55至90、15至40:60至85或20至35:65至80。在优选的实施方案中,拟杆菌门:厚壁菌门的比率为30-35:65-70,诸如30:65、30:70、35:65或35:70。
在一些实施方案中,存在于模拟肠道环境中的细菌种群含有革兰氏阴性菌和革兰氏阳性菌。在某些实施方案中,革兰氏阴性菌与革兰氏阳性菌的比率为20%:80%、30%:70%、40%:60%、50%:50%、60%:40%、70%:30%或80%:20%。在优选的实施方案中,革兰氏阴性菌与革兰氏阳性菌的比率为40%:60%、50%:50%或60%:40%。在替代的实施方案中,细菌种群仅含有革兰氏阴性菌。在其他实施方案中,细菌种群仅含有革兰氏阳性菌。
就液体培养基的组成而言,其可包含常规用于制备液体生长培养基的材料。培养基的确切组成并不关键。相反,可使用允许细菌种群稳定化的任何培养基。
可使用的液体培养基的实例包括:yfca、postgate培养基、庖肉肉汤(例如罗伯逊氏庖肉培养基(robertson’scookedmeatmedium))、蛋白胨酵母提取物葡萄糖肉汤、巯基乙酸盐肉汤、溶菌肉汤(lysogenybroth)(lb)培养基、最小盐(m9)培养基、极品肉汤(terrificbroth)、sob培养基、soc培养基、2xyt培养基、nzcym肉汤、nzym肉汤、nzm肉汤、胰蛋白酶大豆肉汤和siem培养基。在优选的实施方案中,培养基为yfca、postgate培养基、庖肉肉汤(例如罗伯逊氏庖肉培养基)、蛋白胨酵母提取葡萄糖肉汤、巯基乙酸盐肉汤和siem培养基。最优选地,培养基为ycfa。
在某些实施方案中,yfca培养基每升含有酪蛋白水解物10.0g、酵母提取物2.5g、碳酸氢钠4.0g、葡萄糖2.0g、纤维二糖2.0g、可溶性淀粉2.0g、磷酸氢二钾0.45g、磷酸二氢钾0.45g、刃天青0.001g、l-半胱氨酸hcl1.0g、硫酸铵0.9g、氯化钠0.9g、硫酸镁0.09g、氯化钙0.09g、血红素0.01g、scfa3.1ml(乙酸2.026ml/l、丙酸0.715ml/l、正戊酸0.119ml/l、异戊酸0.119ml/l、异丁酸0.119ml/l)、维生素混合物1:1ml(生物素1mg/100ml、氰钴胺1mg/100ml、对氨基苯甲酸3mg/100ml、吡哆醇15mg/100ml)、维生素混合物2:1ml(硫胺素5mg/100ml、核黄素5mg/100ml)、维生素混合物3:1ml(叶酸5mg/100ml)。
液体培养基中可包含另外的成分。这些成分的目的可能是为了模仿胃肠道状况。在一些实施方案中,粘蛋白可例如以按液体培养基的重量计约0.001%、约0.002%或约0.005%至约0.05%、约0.1%、约0.2%、约0.5%或约1%的水平被包含。
为了维持细菌种群的存活和操作的最佳条件,本发明的模拟肠道环境优选具有4或更高、4.5或更高、5或更高、5.5或更高、或6或更高的ph。另外或替代地,本发明的模拟肠道环境优选具有8或更低、7.5或更低、7.0或更低、或6.5或更低的ph。
另外或替代地,本发明的模拟肠道环境优选地存储在厌氧条件下,例如在包含小于约500ppm、小于约200ppm、小于100ppm、小于50ppm或小于约20ppm氧气的气氛中。
本发明的模拟肠道环境中所包含的营养能源可包含能被细菌种群代谢(直接或间接)以产生丁酸盐、丙酸盐、乙酸盐、乳酸盐和甲酸盐中的至少三种的任何化合物。
例如,营养能源可包含糖,包括单糖、二糖和/或寡糖。可包含在本发明的营养能源中的此类糖的优选实例包括岩藻糖、鼠李糖、己糖、戊糖。可在本发明中使用的戊糖糖的具体实例为阿拉伯糖、来苏糖、核糖、木糖、核酮糖、木酮糖和脱氧核糖。可在本发明中使用的己糖糖的具体实例为阿洛糖、阿卓糖、葡萄糖、甘露糖、古洛糖、艾杜糖、半乳糖、塔洛糖、阿洛酮糖、果糖、山梨糖和塔格糖。在本发明的实施方案中,营养能源可以按液体培养基的重量计小于约2%、小于约1%、小于约0.5%、小于约0.2%或小于0.1%的量存在。另外或替代地,营养能源可以按液体培养基的重量计大于约0.001%、约0.002%、约0.005%、约0.01%、0.02%或0.05%的量存在。
如上所述,本发明的模拟肠道环境有利地允许以受控和直接的方式评估受关注细胞的代谢活性。
实施例表明,当将马赛巨型球菌(megasphaeramassiliensis)添加到本发明的模拟肠道环境中时,此菌株的代谢物和特定的hdac抑制作用被转移到细菌核心群落。这表明受关注细胞的代谢活性可成功地转移到本发明的模拟肠道环境中,这允许在受控环境中分析受关注细胞的代谢特性。
根据本发明的另一方面,提供了一种用于制造根据本发明且如上所述的稳定化的模拟肠道环境的方法。所述方法包括将基本上由5至200种细菌菌种组成的细菌种群接种于液体培养基,其中所述细菌种群能够从所述营养能源产生丁酸盐、丙酸盐、琥珀酸盐、乙醇、乙酸盐、乳酸盐和甲酸盐中的至少三种。在优选的实施方案中,用于制备稳定化的模拟肠道环境的方法包括将基本上由5至20种细菌菌种组成的细菌种群接种于液体培养基。在优选的实施方案中,细菌菌株选自以下菌种:腐烂别样杆菌、嗜粘蛋白阿克曼氏菌、粪厌氧棒状菌、大肠厌氧棒状菌、哈氏厌氧棒状菌、食鼠李糖厌氧棒状菌、球形拟杆菌、多雷拟杆菌、马赛拟杆菌、多形拟杆菌、单形拟杆菌、普通拟杆菌、马赛拜瑞曲科斯菌、青春双歧杆菌、长双歧杆菌、延长布劳特氏菌、球形布劳特氏菌、卵形布劳特氏菌、产丁酸菌、溶纤维丁酸弧菌、丁酸梭菌、吲哚梭菌、无害梭菌、丙酸梭菌、灵巧粪球菌、陪伴粪球菌、规则粪球菌、难见戴阿利斯特杆菌、惰性脱硫弧菌、长链多尔氏菌、大肠埃希氏菌、柱状真杆菌、霍氏真杆菌、粘液真杆菌、细枝真杆菌、直肠真杆菌、普氏粪杆菌、唾液乳杆菌、埃氏巨型球菌、史氏甲烷短杆菌、琥珀酸考拉杆菌、普雷沃菌、白色瘤胃球菌、粪便罗斯氏菌、人罗斯氏菌、肠罗斯氏菌、食葡糖罗斯氏菌、反刍月形单胞菌和/或小韦荣球菌。
应当理解,此过程通常将是体外过程。
如实施例所示,发明人已证实,将细菌菌种添加到模拟肠道环境中的顺序可为重要的。根据细菌菌种的敏感性和生长曲线来选择接种细菌菌种的顺序。例如,稍后接种在任何条件下都生长良好且非常快的细菌(诸如大肠杆菌(e.coli)),以确保更敏感或更严格的厌氧菌(诸如直肠真杆菌、粪便罗斯氏菌、长链多尔氏菌、霍氏真杆菌和/或马赛拜瑞曲科斯菌)在添加更具竞争性的细菌菌种之前在模拟的肠道环境中建立。此方法是有利的,因为它防止模拟肠道环境被单个或少数细菌菌种所控制,并允许简化本发明的肠道环境以更准确地模拟含有多种细菌菌种的人类微生物组。
细菌菌种的比生长速率的计算在本领域中是众所周知的。例如,可使用分光光度计来测量细菌悬浮液的浊度或光密度,其中浊度的增加指示细菌生物量的增加。
因此,在某些实施方案中,将本发明的细菌菌种如上所述顺序地接种于模拟肠道环境。具体地说,一种用于制备本发明的模拟肠道环境的方法可包括接种5至200种细菌菌种的步骤,其中细菌菌种根据其生长特征顺序地添加,其中优先添加显示出较慢生长特征的细菌菌种,然后再添加具有较快生长特征的细菌菌种。技术人员将理解,在稳定化的模拟肠道环境中发现的生长条件下评估各个菌种的生长特征。通过在对照实验中评估不同细菌在稳定化的模拟肠道环境中的生长特征,可容易地确定这一点。在此上下文中,“优先”也并不意味着必须严格按照细菌的生长特征添加细菌。相反,这意味着大多数具有较慢生长特征的细菌(例如,至少90%、至少95%或至少99%)在具有较快生长特征的细菌之前添加。
在某些实施方案中,将单独的细菌菌种接种于模拟肠道环境。在其他实施方案中,模拟肠道环境接种有至少2组或更多组、3组或更多组、4组或更多组、5组或更多组、6组或更多组、7组或更多组、8组或更多组、9组或更多组、10组或更多组、11组或更多组、12组或更多组、13组或更多组、14组或更多组或15组或更多组的细菌。在某些实施方案中,各细菌组具有相似的生长曲线,例如,一组中的细菌菌种都将是严格厌氧的。在优选的实施方案中,模拟肠道环境接种有至少7组或更多组细菌。
因此,根据本发明的另一方面,提供了一种用于评估受关注细胞的代谢活性的方法,所述方法包括以下步骤:
在某些实施方案中,方法可包括另一步骤:将模拟肠道环境保持在稳定化条件下直到达到肠道环境的稳定化。
在本发明的其他方面,受关注细胞生物可在达到肠道环境的稳定化之前添加到模拟肠道环境中。如上所述,可以多个组顺序地添加细菌种群中的细菌菌种。受关注细胞可添加到这些组中的任一组中。在优选的实施方案中,如实施例中所示,将受关注细胞作为最后一组添加到模拟肠道环境中。如果细菌菌种严格厌氧或不能很好地生长,则将受关注细胞更早(例如第2、3或4组)添加到模拟肠道环境可为有利的。
可评估模拟肠道环境的组成,以观察添加受关注细胞后发生的变化。这些变化可包括由模拟肠道环境产生的代谢物水平的增加或减少,所述代谢物诸如丁酸盐、丙酸盐、琥珀酸盐、乙醇、乙酸盐、乳酸盐和甲酸盐。用于测量代谢物的方法在本领域中是众所周知的,例如使用nmr、液相色谱法、气相色谱法、液相色谱质谱法或气相色谱质谱法。如实施例中所示,受关注细胞的添加可导致模拟肠道环境产生另外的代谢物。本发明的方法允许在简化的模拟肠道环境中阐明受关注生物的代谢活性。
因此,在某些实施方案中,本发明提供了一种用于评估受关注细胞的代谢活性的方法,所述方法包括以下步骤:
在某些实施方案中,方法可包括另一步骤:将模拟肠道环境保持在稳定化条件下直到达到肠道环境的稳定化。
本发明的方法可用于研究包括原核细胞或真核细胞在内的任何类型细胞的代谢活性以及潜在地阐明其作用机理。在本发明的实施方案中,受关注细胞可为细菌细胞、真菌细胞、古细菌细胞或病毒。受关注细胞可为致病性的。替代地,受关注细胞可能对健康有益;在此类实施方案中,本发明有利地发现作为药物发现过程的一部分的效用。
本发明的方法允许在简化的模拟肠道环境中阐明受关注生物的代谢活性。单独研究时,受关注的分离生物将具有一定的代谢特征。然而,人肠道微生物组由数千种彼此相互作用(例如竞争营养或共生工作)的不同细菌菌种组成。然而,发明人已确定,当在模拟肠道环境中研究微生物组时,代谢物丁酸盐、丙酸盐、琥珀酸盐、乙醇、乙酸盐、乳酸盐和/或甲酸盐尤其重要。
本发明的方法允许在模拟了肠道环境的受控环境中阐明生物的代谢活性。本发明的方法允许可靠地预测肠道微生物群落中受关注生物的体内代谢特性。
在本发明的实施方案中,例如在用户希望研究具有特定底物或受关注的第二细胞的细胞的代谢活性的情况下,本发明的方法可包括向模拟肠道环境添加底物和/或受关注的第二细胞的步骤。可在达到模拟肠道环境的稳定化之后,将受关注的第二细胞添加到模拟肠道环境中。
在本发明的实施方案中,本发明的方法可用于筛选受关注的生物在模拟肠道环境中的特定代谢物活性。以此方式筛选特定代谢物活性允许可靠地预测肠道微生物群落中受关注生物的体内代谢特性。在其他实施方案中,模拟肠道环境与受关注的代谢物的共孵育可例如与次生植物代谢物一起进行。本发明的方法允许可靠地预测受关注的代谢物可对人肠道微生物组具有的体内作用。
可在达到模拟肠道环境的稳定化之前或之后,将底物添加到模拟肠道环境中。当底物为糖时,其优选不是被细菌种群代谢的糖和/或不是包含在营养能源中的糖。
如本领域技术人员将理解的,期望模拟肠道环境尽可能快地达到稳定化,以便使设置时间最少并且可尽可能迅速地开始对受关注细胞的代谢特性的分析。如以下实施例所示,与现有技术的布置相比,可显著更快地实现本发明的模拟肠道环境的稳定化。因此,在本发明的实施方案中,在2周或更短、10天或更短、1周或更短或5天或更短、或4天或更短、或3天或更短、或2天或更短、或1天或更短时间内实现稳定化。
可采用任何稳定化条件,只要达到模拟肠道环境的稳定化即可。在本发明的实施方案中,稳定化条件可包括以下中的一项或多项:
如上所述,将模拟肠道环境维持在稳定化条件,直到达到模拟肠道环境的稳定化。为了本发明的目的,一旦模拟肠道环境中存在丁酸盐、丙酸盐、乙酸盐、乳酸盐和甲酸盐中的至少三种,并且这些化合物中的每种的浓度在24小时内不发生20%的变化,就认为已达到稳定化。
在一些实施方案中,模拟肠道环境包含丁酸盐、丙酸盐、乙酸盐、乳酸盐和甲酸盐中的至少三种,其可由细菌种群产生和/或直接添加到液体培养基中。在稳定化之前,由模拟肠道环境中的细菌种群产生的代谢物(诸如丁酸盐、丙酸盐、乙酸盐、乳酸盐和甲酸盐)的总水平会发生变化。达到稳定化时,由组合物中的细菌产生丁酸盐、丙酸盐、乙酸盐、乳酸盐和甲酸盐中的至少三种,并且这些化合物中的每种的浓度在24小时、18小时、12小时或6小时内不发生20%的变化。
在达到稳定化后的模拟肠道环境包含丁酸盐的实施方案中,丁酸盐可以至少约0.5mm、约1.0mm、约1.5mm、约2.0mm、约3.0mm、约4.0mm或约5.0mm的浓度存在。另外或替代地,丁酸盐可以约10.0mm或更低、约8.0mm或更低、约6.0mm或更低或约5.0mm或更低的浓度存在。在达到稳定化后的模拟肠道环境包含丁酸盐的一个优选的实施方案中,丁酸盐以约1.0mm至约5.0mm的浓度存在。
在达到稳定化后的模拟肠道环境包含丙酸盐的实施方案中,丙酸盐以至少约0.5mm、约1.0mm、约1.5mm、约2.0mm、约3.0mm、约4.0mm或约5.0mm的浓度存在。另外或替代地,丙酸盐可以约10.0mm或更低、约8.0mm或更低、约6.0mm或更低或约5.0mm或更低的浓度存在。在达到稳定化后的模拟肠道环境包含丙酸盐的一个优选的实施方案中,丙酸盐以约2.0mm至约7.0mm的浓度存在。
在达到稳定化后的模拟肠道环境包含乙酸盐的实施方案中,乙酸盐以至少约0.1mm、约0.2mm、约0.5mm、约1.0mm、约1.5mm或约2.0mm的浓度存在。另外或替代地,乙酸盐可以约5.0mm或更低、约4.0mm或更低、约3.0mm或更低或约2.0mm或更低的浓度存在。在达到稳定化后的模拟肠道环境包含乙酸盐的一个优选的实施方案中,乙酸盐以约0.2mm至约2.0mm的浓度存在。
在达到稳定化后的模拟肠道环境包含乳酸盐的实施方案中,乳酸盐以至少约0.1mm、约0.2mm、约0.5mm、约1.0mm、约1.5mm或约2.0mm的浓度存在。另外或替代地,乳酸盐可以约5.0mm或更低、约4.0mm或更低、约3.0mm或更低或约2.0mm或更低的浓度存在。在达到稳定化后的模拟肠道环境包含乳酸盐的一个优选的实施方案中,乳酸盐以约0.2mm至约2.0mm的浓度存在。
在达到稳定化后的模拟肠道环境包含甲酸盐的实施方案中,甲酸盐以至少约0.01mm、约0.02mm、约0.05mm、约0.1m、约0.2mm或约0.5mm的浓度存在。另外或替代地,甲酸盐可以约2.0mm或更低、约1.5mm或更低或约1.0mm或更低的浓度存在。在达到稳定化后的模拟肠道环境包含甲酸盐的一个优选的实施方案中,甲酸盐以约0.01mm至约0.5mm的浓度存在。
可使用本领域技术人员已知的技术来评估添加受关注细胞后的模拟肠道环境的组成。在本发明的实施方案中,可进行代谢组学分析,以例如测定短链脂肪酸和中链脂肪酸的浓度,所述脂肪酸包括甲酸盐、乙酸盐、丙酸盐、丁酸盐、异丁酸盐、戊酸盐、异戊酸盐、己酸盐、辛酸盐、癸酸盐、十二酸盐。代谢组学分析可使用本领域技术人员已知的任何技术进行,例如hplc。
另外或替代地,对模拟肠道环境的组成的评估可包括量化受关注细胞的数量,以便用户可评估该细胞的生长速率和最佳生长条件。
细菌种群的变化也可作为模拟肠道环境评估的一部分进行评估。例如,可评估种群中不同成员的比例,以预测将共生细菌暴露于受关注细胞的效果。此种评估可例如使用16s宏基因组测序来进行,所述宏基因组测序是本领域技术人员将熟悉的技术。技术人员还将熟悉可用于进行此种测序的设备,例如illuminamiseq。
对组成的评估可在达到模拟肠道环境的稳定化后的任何时间进行。然而,本领域技术人员将认识到,优选将评估推迟到受关注细胞具有足够时间来影响组成的时间点。例如,可在将受关注细胞添加到模拟肠道环境后1小时、2小时、3小时、4小时、5小时、6小时、8小时、10小时、12小时、18小时或24小时对组成进行评估。
此后,可任选地定期(例如1小时、2小时、3小时、4小时、5小时、6小时、8小时、10小时、12小时、18小时或24小时)进行后续评估。
可在模拟肠道环境本身中直接进行对模拟肠道环境的评估(例如,通过在发酵罐中时分析模拟肠道环境),或者本发明的方法可包括提取模拟肠道环境的样品并对该样品进行评估的步骤。
在本发明的实施方案中,方法还包括对照研究的步骤,其中提供与模拟肠道环境相对应的第二模拟肠道环境并将其保持在与用于达到模拟肠道环境的稳定化的那些条件相对应的稳定化条件下,以便达到第二模拟肠道环境的稳定化,其中以与模拟肠道环境相同的方式评估第二模拟肠道环境的组成,其中不将受关注细胞添加到第二模拟肠道环境中,并且其中将模拟肠道环境的评估结果与第二模拟肠道环境的评估结果进行比较。
在此类实施方案中,模拟肠道环境和第二模拟肠道环境可取自模拟肠道环境的共同原液。替代地,可分别制备模拟肠道环境和第二模拟肠道环境。
本发明的方法可在允许将细菌种群保持在受控条件下的任何合适的设备中进行。在本发明的实施方案中,方法在发酵罐(例如不锈钢、塑料或玻璃发酵罐)中进行,所述发酵罐包括加热装置(例如磁性加热器)、ph传感器和/或温度传感器。发酵罐可设置有一个或多个入口,从而允许添加液体培养基、细菌种群、受关注细胞、底物、添加剂、惰性气体诸如氮气和/或ph调节剂(包括酸和碱)中的一种或多种。另外或替代地,发酵罐可设置有一个或多个出口,用于提取用于测试的模拟肠道环境的样品、液体流出物和/或废气。
在本发明的实施方案中,方法有利地在连续的基础上进行。例如,可将液体培养基连续或间断地送入细菌种群保持在受控条件下的设备中。将液体培养基送入细菌种群保持在受控条件下的设备中的速率可为约0.1ml/分钟、0.2ml/分钟、0.3ml/分钟、约0.4ml/分钟或约0.5ml/分钟至约1ml/分钟、2ml/分钟、3ml/分钟、4ml/分钟或约5ml/分钟。
另外或替代地,可连续或间断地从细菌种群保持在受控条件下的设备中提取样品。从细菌种群保持在受控条件下的设备中提取样品的速率可为约0.1ml/分钟、0.2ml/分钟、0.3ml/分钟、约0.4ml/分钟或约0.5ml/分钟至约1ml/分钟、2ml/分钟、3ml/分钟、4ml/分钟或约5ml/分钟。
在本发明的另一方面,提供了一种试剂盒,所述试剂盒包含如本文所述的细菌种群和制备如本文所述的模拟肠道模型的说明书。在某些实施方案中,细菌种群可以冻干组合物的形式提供。另外或替代地,试剂盒可包含如本文所述的营养能源和/或如本文所述的液体培养基。
实施例
实施例1–细菌种群的合理设计
设计细菌种群的目的是简化(与现有技术模拟胃肠环境中使用的细菌种群相比)以及使得能够快速达到稳定化。如图1所示,细菌种群被设计成涵盖短链脂肪酸的所有主要代谢途径,发明人已将其鉴定为对评估受关注细胞的代谢活性是重要的。此外,选择构成种群的细菌以避免特定生物的过度生长以及较快生长的菌株与较慢生长的菌株的竞争。
实施例2–模拟肠道环境的稳定化
设置了图2中示意性示出的设备。所示设备包括玻璃发酵罐(1),其中已提供了模拟肠道环境(3)。模拟肠道环境(3)包括实施例1中设计的细菌种群、液体培养基和包含岩藻糖、鼠李糖、己糖和戊糖的营养能源。
将发酵罐(1)密封并在厌氧条件(氮气覆盖)下操作。设备被有利地设计成连续操作,并且因此发酵罐(1)设置有培养基入口(5),所述培养基入口允许模拟肠道环境保持在恒定体积,并且还设置有控制入口(7),所述控制入口允许添加酸和碱来控制ph值以及添加氮气来保持厌氧环境。传感器入口(9)允许将ph和温度传感器插入发酵罐(1)的内部。发酵罐(1)还设置有磁性加热器(11)。
出口(13)允许提取模拟肠道环境的样品进行评估以及去除流出物。
在将液体培养基、细菌种群和营养能源添加到发酵罐(1)中后,将模拟肠道环境(3)在稳定化条件(ph6至6.5,温度为37℃)下保持五天。在将细菌种群添加到模拟肠道环境中后,评估丁酸盐、丙酸盐、乙酸盐和甲酸盐的水平,然后每隔24小时评估一次,并且这些评估的结果在图3中示出。可以看出,模拟肠道环境在4至5天后达到稳定化,这比现有技术的布置快得多。
实施例3–评估mrx0029在简化的人肠道微生物群模型(simmi)中的功效
马赛巨型球菌菌株mrx0029是丁酸盐产生菌菌株,其也可产生戊酸和中链脂肪酸(mcfa)己酸(参见图4)。
在本发明的模拟肠道环境(本文中称为simmi)中测试了mrx0029在已建立的细菌群落中保持其短链脂肪酸scfa和mcfa产生以及hdac活性的能力。此系统用于预测mrx0029的体内代谢特性。
方法
如实施例1和2所述,在连续培养中发展出先前从健康供体的人粪便样品中分离出的16个细菌菌株的稳定群落,以模仿人肠道微生物群的核心代谢功能。
simmi环境中的细菌菌株为多雷拟杆菌、单形拟杆菌、多形拟杆菌、普通拟杆菌、长双歧杆菌、延长布劳特氏菌、布劳特氏菌某种、马赛拜瑞曲科斯菌、无害梭菌、长链多尔氏菌、霍氏真杆菌、大肠埃希氏菌、直肠真杆菌、唾液乳杆菌、普雷沃菌某种和粪便罗斯氏菌。
simmi环境中的细菌菌种涵盖了广泛的代谢途径,主要集中于scfa的产生,但也考虑了互养(cross-feeding)、细菌丰度和多样性。
将细菌群落接种于七个组中。
在接种马赛巨型球菌菌株mrx0029之前,对模拟肠道环境进行接种并允许建立1小时。最后一次接种后,将模拟细菌环境放置2小时,然后以0.5ml/分钟的流速用干净培养基泵入反应容器。
使含有和不含mrx0029的simmi培养物生长13天。
细菌上清液的scfa和mcfa定量
在13天内对两个联合体的代谢进行了分析。由丹麦的msomicsaps对细菌上清液中的短链脂肪酸(scfa)和中链脂肪酸(mcfa)进行分析和定量。使用盐酸将样品酸化,并添加氘标记的内标物。所有样品按随机顺序进行分析。使用安装在与四极杆检测器(59977b,agilent)结合的气相色谱仪(7890b,agilent)中的高极性柱(zebrontmzb-ffap,gccap.column30mx0.25mmx0.25μm)进行分析。系统由chemstation(agilent)控制。使用chemstation(agilent)将原始数据转换为netcdf格式,之后导入数据并在matlabr2014b(mathworks,inc.)中使用描述于以下中的paradise软件处理:johnsen,l.g等人(2017).jchromatogra,1503:第57-64页。
hdac活性测定
分析了来自培养两个联合体的两种simmi培养物(含有和不含mrx0029)的样品在第12天的hdac活性。
分离含有和不含mrx0029的simmi培养物中的无细胞上清液(cfs),以进行hdac活性分析。将两种simmi培养物(含有或不含mrx0029)的等分试样以5000xg离心5分钟,并使用0.2μm过滤器(millipore,uk)过滤无细胞上清液(cfs),之后将cfs的1ml等分试样存储在-80℃直至使用。
细胞培养:ht-29人结肠直肠腺癌细胞获自欧洲细胞培养物保藏中心(ecacc)(第162-173代)。使细胞生长在含有10%fbs、4mml-谷氨酰胺、1%非必需氨基酸和抗真菌素和抗生素的杜尔贝科氏最低必需培养基(dulbecco’sminimumessentialmedia)(dmem)培养基(sigma,uk)中。汇合后三天,将细胞用汉克平衡盐溶液(hank’sbalancedsaltsolution)(hbss)洗涤两次,并使其逐步进入(steppeddown)含有4mml-谷氨酰胺、1%非必需氨基酸、5μgml-1载脂蛋白转铁蛋白和0.2μgml-1亚硒酸钠的1mldmem(sigmaaldrich,uk)中。在实验开始前24h使细胞逐步进入。
hdac测定
将ht-29细胞与100μl来自含有和不含mrx0029的simmi培养物的cfs在co2孵育箱中一起孵育48h。
核蛋白提取
处理后,将细胞用pbs洗涤两次,然后通过从孔中刮下细胞来收获。将细胞以450xg离心5min。然后根据制造商的说明使用nxtractnuclear试剂盒(sigmaaldrich,uk)进行核提取。一旦提取,就将核蛋白速冻并存储在-80℃下,以进行hdac活性分析。
总hdac活性分析
使用组蛋白脱乙酰基酶测定试剂盒(sigmaaldrich,uk)分析hdac活性。根据制造商的说明使用15μl提取的ht-29核蛋白进行测定。
另外,提取未处理细胞的ht-29核蛋白,并将其标准化为nxtractnuclear试剂盒(sigmaaldrich,uk)提供的hela细胞裂解物的蛋白浓度。使用piercebicinchoninicproteinassay(bca)试剂盒a(thermofisher,uk)测定蛋白浓度。孵育10%cfs后,将15ul此提取物用于hdac活性分析,以确认全细胞中的hdac抑制作用。
结果
将mrx0029添加到simmi培养物中向培养物中引入了另外的途径。戊酸和己酸在simmi的原始核心联合体中未产生,而在整个运行期间(13天)内在添加了mrx0029的simmi中产生(图5至图7)。
以ycfa作为对照,测试了来自12个simmi和simmi+mrx0029培养物的等分试样的总hdac抑制作用。结果表明,simmi+mrx0029培养物关于全ht-29细胞(p<0.001)和ht-29细胞裂解物(p<0.05)的总hdac抑制作用比标准联合体更有效(图8)。这表明了mrx0029作为丁酸盐和戊酸产生菌在已建立的细菌群落中刺激hdac抑制作用的生理相关潜力在simmi培养物中得以保持。
将马赛巨型球菌mrx0029添加到体外简化的人肠道微生物群联合体中显示,该菌株的代谢物和特定的hdac抑制作用被转移到了细菌核心群落。
这些结果表明了群落对受关注细胞的功效的影响,反之亦然。这使得无需进行体内研究就可以评估受关注细胞对体内的药理特性有什么影响。
- 还没有人留言评论。精彩留言会获得点赞!