高效分离和培养神经干细胞的方法与流程
本发明涉及高效分离和培养神经干细胞的方法,该方法能够通过简化分离和培养神经干细胞的方法来缩短分离和培养时间,并提高神经干细胞的获取量。
背景技术:
21世纪的生物技术提出了以人类福祉为最终目标的食品、环境和健康问题新解决方案的可能性,最近,使用干细胞的技术正在成为治疗不可治愈疾病的新篇章。以前,曾建议用器官移植或基因疗法来治疗人类不治之症,但由于免疫排斥,器官供应不足,载体开发不足或缺乏对疾病相关基因的了解而未能有效地投入实际应用。
因此,随着对干细胞研究的兴趣的增长,已经认识到能够通过增殖和分化形成所有器官的多能干细胞可以从根本上解决器官损伤以及治疗大多数疾病。干细胞是指可以自我更新而分化为两种以上细胞的细胞,分为全能干细胞,多能干细胞和专能干细胞。许多科学家建议干细胞以各种方式适用,包括治疗帕金森氏病,各种类型的癌症,糖尿病和脊髓损伤,以及几乎所有人体器官的再生等不可治愈的疾病。
神经干细胞是可以分化为神经元、星形胶质细胞和少突胶质细胞的干细胞,最早是在啮齿动物的小鼠中发现的。此后,人们知道神经干细胞存在于人脑中,并参与整个人一生的脑细胞再生。因此,近年来,在退行性神经系统疾病的治疗中,使用神经干细胞的治疗剂的开发受到关注。
在人类衍生的神经干细胞研究开始之初,从胎儿大脑中分离出神经干细胞并进行培养。基于该研究,最近,进行了治疗中风或脊髓损伤的临床试验。另外,已经进行了从胚胎干细胞分离和培养神经干细胞的研究。已知胚胎干细胞可自然分化为外胚层,并且已经鉴定出分化为神经干细胞的方法。近来,已经研究了从诱导多能干(ips)细胞分化为神经干细胞的方法,并且对能够进行自体移植的神经干细胞的培养的期望越来越高。
然而,源自胎儿的神经干细胞或胚胎干细胞存在伦理问题,并涉及致瘤安全性。另外,由于源自ips细胞的神经干细胞也具有致瘤安全性问题,因此对于这些干细胞的临床应用,需要验证生物学安全性和基本解决方案。
在先前的研究中,为了分离和培养神经干细胞,已经广泛使用了从脑组织分离和培养单细胞的方法。
然而,分离和培养神经干细胞的方法,包括使用percoll分离液进行单细胞分离,花费了很长时间,并且存在神经干细胞获得量的问题。
技术实现要素:
[技术问题]
本发明提供了一种高效分离和培养神经干细胞的方法,该方法能够通过简化分离和培养神经干细胞的方法来缩短分离和培养时间,并提高神经干细胞的获取量。
然而,本发明中要解决的技术问题不限于上述问题,并且本领域普通技术人员将从以下描述中充分理解本文中未描述的其他问题。
[技术解决方案]
一方面,本发明提供了一种高效分离和培养神经干细胞的方法,包括:将脑组织置于酶溶液中进行酶处理;从酶处理过的脑组织中物理解离细胞团;按大小分离细胞团并去除杂质;然后通过将细胞团接种到培养皿中进行传代培养。
另外,酶溶液可以包括木瓜蛋白酶;可以是木瓜蛋白酶、脱氧核糖核酸酶i(dnasei)和d,l-半胱氨酸。
另外,细胞团的尺寸可以为40至70μm,或大于70μm且小于或等于100μm。
另外,脑组织可以是成体脑组织,并且分离和培养神经干细胞的方法可以不包括使用percoll分离液的单细胞分离。
[有益效果]
根据本发明的高效分离和培养神经干细胞的方法可以通过简化分离和培养神经干细胞的方法来缩短分离和培养时间,并提高神经干细胞的获得量。另外,可以通过缩短分离和培养时间来提高细胞生存力,并且可以在短时间内获得大量细胞,从而具有增加培养神经干细胞的成功率的优点。
附图简要说明
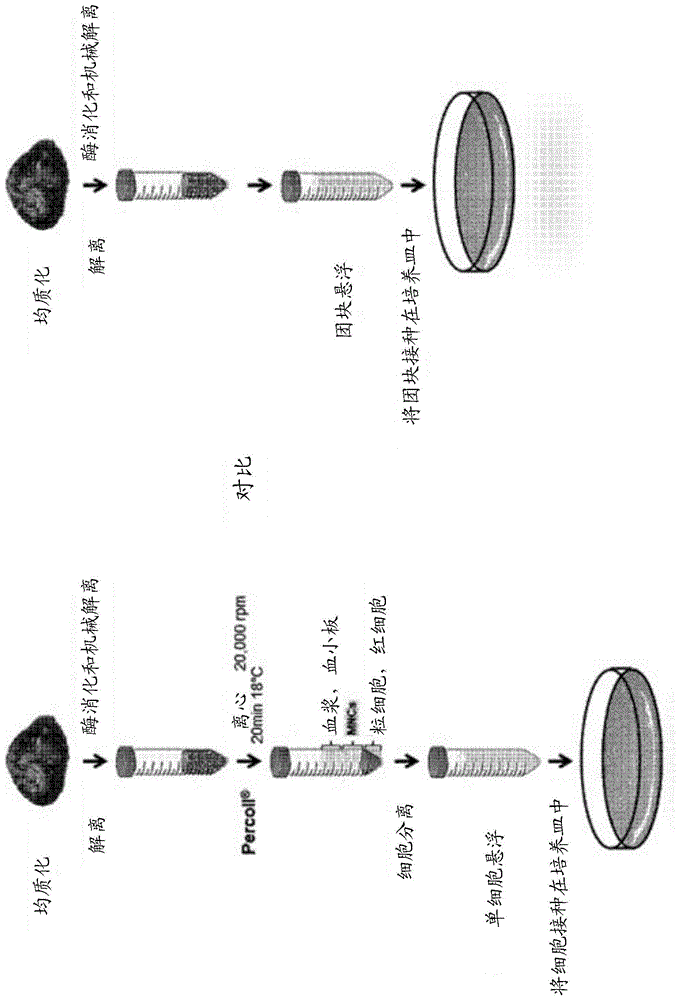
图1显示了使用percoll分离液分离和培养神经干细胞的常规方法,以及根据本发明的使用成团培养物分离和培养神经干细胞的分离和培养方法的示意图。
图2a是比较常规分离和培养方法(percoll)与根据本发明一方面的分离和培养方法(团块培养)之间的每脑组织重量(g)的细胞产量的图。
图2b是显示根据神经干细胞的传代培养来确认细胞生长的结果的图,神经干细胞根据常规分离和培养方法(percoll)和根据本发明一方面的分离和培养方法(团块培养)获得。
图3a显示了根据常规分离和培养方法(percoll)的神经干细胞的形态以及根据本发明一方面的分离和培养方法(团块培养)的神经干细胞的形态。
图3b显示了根据常规分离和培养方法(percoll)和根据本发明一方面的分离和培养方法(团块培养)分离和孵育的神经干细胞在分化条件下的分化模式。
图4a仅显示了根据团块培养方法分离团块以找到团块的最佳尺寸条件的方法。
图4b显示了使用显微镜观察到的四种类型的团块(团块i至iv)的形态。
图5a和图5b显示了在孵育来源于两个患者组(ns18-007tl,ns18-008tl)的类型i至iv团块后三天和六天在培养皿底部观察到的集落(colonies)的数量。
图5c显示了在类型i至iv团块孵育三天和六天后确认在培养皿中观察到的集落形态的结果。
图6a是比较使用类型ii团块培养的细胞的生长曲线和使用常规percoll的单细胞的生长曲线的图。
图6b显示了用类型ii团块传代培养的细胞形态。
图6c显示分化后的免疫荧光染色的结果,以证实使用团块类型ii培养的神经干细胞保持神经分化能力。
图7a显示了关于类型ii团块神经干细胞的血管生成能力的实验结果。
图7b显示了对α-sma和cd31进行免疫荧光染色以确认移植的神经干细胞的位置的结果。
具体实施方式
本发明旨在提供一种高效分离和培养神经干细胞的方法,其能够通过简化分离和培养神经干细胞的方法来缩短分离和培养时间,并提高神经干细胞的获得率。
在本发明的一实施方案中,作为根据本发明的方法(团块培养)培养神经干细胞的结果,与使用常规的percoll方法相比,已证实每相同的脑组织重量可以获得更多的神经干细胞(参见实施例1)。
在本发明的另一实施方案中,证实了根据本发明的方法(团块培养)的神经干细胞保持神经分化能力(参见实施例3)。
在本发明的又一实施方案中,通过按尺寸分离和培养团块,结果证实了类型ii团块(70至100μm)表现出最佳效率(参见实施例4和5)。
在本发明的又一实施方案中,当根据本发明的方法(团块培养)培养类型ii团块时,已证实第一次传代的时间缩短了,细胞形态正常,神经分化能力为正常情况下,干细胞的特性也得到了很好的维持(参见实施例6)。
在本发明的又一实施方案中,证实了源自类型ii团块的神经干细胞具有诱导血管生成能力(参见实施例7)。
在下文中,将详细描述本发明。
本发明提供了一种高效分离和培养神经干细胞的方法,该方法包括:将脑组织置于酶溶液中进行酶处理;从酶处理过的脑组织中物理解离细胞团;按大小分离细胞团并去除杂质;然后通过将细胞团接种到培养皿中进行传代培养。
分离和培养神经干细胞的方法,包括使用常规的percoll分离单个细胞,需要花费很长时间,并且在神经干细胞的采集产量方面存在问题。因此,发明人通过实验证实,在引入通过团块分离细胞的方法而不包括使用percoll分离单细胞的方法的情况下,缩短了分离和培养时间,并且神经干细胞获得率能够增加,因此完成了本发明。
根据本发明的一方面,本发明提供了一种高效分离和培养神经干细胞的方法,包括:将脑组织置于酶溶液中进行酶处理;从酶处理过的脑组织中物理解离细胞团;按大小分离细胞团并去除杂质;通过将细胞团接种在培养皿中进行传代培养。
酶溶液没有特别限制,可以包括木瓜蛋白酶、dnasei和d,l-半胱氨酸。
另外,从脑组织解离后,可以使用筛网进一步将细胞团按大小分开。细胞团块的尺寸可以为40至70μm,或大于70μm且小于或等于100μm。
此外,脑组织优选是成体脑组织。
同时,如上所述,根据本发明的高效分离和培养神经干细胞的方法不包括使用percoll分离单细胞。根据本发明的分离和培养神经干细胞的方法具有以下优点:通过排除使用percoll分离单细胞,简化了分离和培养神经干细胞的方法,从而缩短了分离和培养时间,提高了神经干细胞的获取率,并且由于缩短了分离和培养时间而提高了细胞活力,并在短时间内获得了大量细胞,从而提高了培养神经干细胞的成功率。
在下文中,为了帮助理解本发明,将提出示例性实施例。然而,提供以下实施例仅是为了更容易理解本发明,而不是限制本发明。
[实施例]
实施例1.神经干细胞的原代培养
在测量人脑组织的重量之后,使用pbs进行洗涤2-3次。将组织匀浆至适当大小后,将组织添加至酶溶液(10单位/ml木瓜蛋白酶,0.1mg/mldnasei,4mg/mld,l-半胱氨酸)中,并使用刀片和手术剪刀将其物理切割成较小的碎片。在37℃处理30分钟后,使用一次性移液器打碎所得碎片,使用70μm滤网过滤,然后使用磷酸盐缓冲生理盐水(pbs)进行洗涤。
当使用percoll时,将10倍浓度的pbs和percoll以1:9的比例混合以制备percoll溶液,将20ml细胞悬液和10mlpercoll混合并在20,000rpm和18℃下离心分离,以从细胞层分离细胞,然后再次用pbs洗涤两次,并在涂有聚l-鸟氨酸(plo)的培养皿中培养。
当达到70%至80%的汇合度时,使用accutase细胞消化液分离细胞,然后传代培养。使用台盼蓝染色液(tryphanbluesolution)计算细胞数和生存力,并测量群体倍增长度(pdl),从而绘制细胞生长曲线,并在显微镜下观察分离和培养的神经干细胞的形态。
结果,如图2a所示,证实了与使用percoll的方法相比,根据分离和培养方法(团块培养),每相同重量的脑组织可获得更大量的神经干细胞,以及如图2b所示,证实了根据分离和培养方法(团块培养),细胞生长效果总体上优于根据使用percoll的常规方法的细胞生长效果。
另外,如图3a所示,作为观察培养细胞的结果,还证实了根据本发明的分离培养方法(团块培养),细胞形态与使用percoll的常规方法的细胞形态相似。
实施例2.在神经分化条件下的分化诱导
将神经干细胞培养至大约70%至80%的汇合度,并用pbs洗涤两次。在神经分化条件下如dmem/f12、0.5%fbs\b27、0.5mmibmx和p/s处理后48小时,将细胞固定,然后进行免疫染色。
实施例3.免疫染色
将神经干细胞在涂有plo的8孔室玻片(thermo)上培养,并在4%多聚甲醛中固定5分钟。用0.1%triton-x100-稀释的pbs(0.1%pbst)冲洗细胞,用封闭溶液(5%正常山羊血清,5%正常驴血清)处理大约1小时,与一抗反应过夜,第二天用pbs洗涤两次,并用alexa488或alexa594-缀合的二抗处理1小时。用dapi复染并固定后,在荧光显微镜下观察细胞。
结果,如图3b所示,在神经干细胞分化后,证实巢蛋白表达降低并且神经细胞(tuj1,map2)和星形胶质细胞(gfap)的表达增加。
实施例4.团块的尺寸依赖性分离和形态观察
为了找到用于团块培养方法的最佳条件,用酶溶液处理人脑组织,进行物理分割,然后通过各种尺寸的网过滤,从而获得按尺寸的团块(参见图4a)。如下所述,将团块按尺寸分类为i至iv型,然后在显微镜下观察。
类型i团块>100μm
70μm<类型ii团块<100μm
40μm<类型iii团块<70μm
类型iv团块<40μm
结果,如图4b所示,能够证实根据每种类型分成均匀大小的团块。
实施例5.类型i至iv团块的分离和培养的效果比较
为了比较根据团块大小分离和培养的效果,根据实施例1的方法,对来源于两名患者的类型i至iv团块进行培养,以确认集落数并使用显微镜观察集落形态。
结果,如图5a和5b所示,在分离和培养的第3天和第6天,在类型ii团块中观察到最多数量的集落,证实了类型ii团块具有最佳的培养效率。
实施例6.类型ii团块的传代培养和神经分化能力的确认
为了比较在通过根据本发明的方法培养类型ii团块的情况和使用percoll的培养单细胞的情况下的效果,根据实施例1的方法培养细胞,然后绘制生长曲线,然后使用显微镜观察根据类型ii团块的传代培养的细胞形态。
另外,为了确认用类型ii团块方法培养的神经干细胞是否维持神经分化能力,在神经分化之后,根据实施例3的方法使用免疫荧光染色。
结果,如图6a所示,已经证实,在类型ii团块培养的情况下,第一次传代培养的时间缩短了,达到109个细胞的时间也缩短了,以及如图6b所示,在类型ii团块的传代培养中细胞形态得到很好的维持。
另外,作为免疫荧光染色的结果,如图6c所示,未分化标记物巢蛋白在分化为神经之前强烈表达,但在分化后几乎未观察到,并且在分化前未观察到神经元标志物tuj1和map2的表达,但在分化后观察到。分化前几乎未观察到星形胶质细胞标记物gfap,但分化后却观察到。
该结果意味着使用类型ii团块培养的神经干细胞保持良好的干细胞特性。
实施例7.证实来源于类型ii团块的神经干细胞的血管生成
脐静脉内皮细胞购自promocell,并使用制造商的专有培养基。将1×106血管内皮细胞和1×106神经干细胞混合在200μl无酚红matrigel基质胶(bd)中,然后皮下移植到4至6周龄的balbc-nu小鼠中。在3至4天后,将matrigel移出,然后用4%pfa固定24小时,从而产生团块。为了进行组织学分析,进行了苏木精和曙红(h&e)染色,并且为了对matrigel基质胶中产生的新血管进行染色,对血管内皮细胞和神经干细胞分别用cd31和α-平滑肌肌动蛋白(α-sma)进行免疫荧光染色。
结果,如图7a所示,仅神经干细胞几乎不形成血管,但是当将血管内皮细胞和神经干细胞混合并移植时,能够确认血管形成。另外,如图7b所示,已证实神经干细胞位于血管周围,有助于血管形成。
本领域普通技术人员应该理解,本发明的上述描述是示例性的,并且在不脱离本发明的技术精神或基本特征的情况下,本文中公开的示例性实施方案可以容易地修改为其他特定形式。因此,上述示例性实施方案应被解释为说明性的,并且在任何方面均不受限制。
[工业实用性]
根据本发明的高效分离和培养神经干细胞的方法可以通过简化分离和培养神经干细胞的方法来缩短分离和培养时间,并提高神经干细胞的获得产量。另外,本发明的优点在于由于缩短了分离和培养时间而增加了细胞存活力,并且通过在短时间内获得大量细胞而提高了神经干细胞培养的成功率,因此可预期使用神经干细胞有助于中枢神经系统疾病的治疗,以实现直接或间接的神经再生作用。另外,预期本发明也可用于与通过从神经干细胞释放的蛋白质或酶的直接或间接神经再生有关的领域(条件培养基的纯化,外泌体的发育等)。
- 还没有人留言评论。精彩留言会获得点赞!