光调控BK通道的融合蛋白及其制备方法和应用与流程
本发明属于生物技术领域,具体涉及光调控bk通道的融合蛋白及其制备方法和应用。
背景技术:
离子通道是生命活动的基础之一,无论真核还是原核生物的细胞膜及各类细胞器膜上都存在着大量的离子通道。离子通道在维持膜内外离子环境的稳定,调控细胞的兴奋性,信号通路的激活等多种重要生理活动中都起到重要的作用。离子通道最重要的功能之一是调控细胞的电活动,进而影响神经递质释放、腺体分泌、肌肉收缩等生理活动。
大电导钙激活钾离子通道,简称为bk通道(bigpotassium),得名于其非常大的单通道电导(100~300ps),以及其收到胞内钙离子浓度和膜电位改变的双重调控。对上述两种信号的整合,及其较大的单通道电导,使得bk通道起到了偶联胞内钙离子浓度与超极化钾电流的重要负反馈作用。bk通道的主体为α亚基的四聚体,分为s0-s6七个跨膜结构域和rck1、rck2两个胞内结构域。(a.pantazis,r.olcese,biophysicsofbkchannelgating,internationalreviewofneurobiology,128,1-49,2016)
光遗传学是现代神经科学广泛运用的一门科学,它使用基因工程技术,构建可以在活体动物细胞中表达的光敏蛋白,使用光刺激改变光敏蛋白的构象,引起不同生物学效应。在神经科学中,常用光遗传学工具激活或是抑制神经元的活动。
现有的光遗传工具可有效的调控神经元的兴奋性,神经元的激活可以使用chr2为代表的光敏阳离子通道(boyden,zhang,bamberg,nagelanddeisseroth,millisecond-timescale,geneticallytargetedopticalcontrolofneuralactivity,natureneuroscience,8,1263-1268,2005),神经元的抑制可以使用以enphr为代表的光敏氯离子通道,但这类激活抑制工具使用的是外源表达的离子通道等蛋白,难以实现对细胞本身的内源性离子通道的调控,另一类现有的离子通道调控策略是利用化学合成小分子化合物,实现对内源性离子通道的有效调控,但是时间分辨率和空间分辨率较差,难以实现精准调控,如经典的药理学工具河豚毒素(tetrodotoxin,ttx)可以阻断内源钠离子通道,尼莫地平等二氢近年来,有研究合成了能够用光调控离子通道的小分子化合物,举例而言,如acosta-ruiz等人开发的portl工具(acosta-ruiz,gutzeit,skelly,meadows,lee,parekh,orr,liston,pleil,broichhagenandlevitz,branchedphotoswitchabletetheredligandsenableultra-efficientopticalcontrolanddetectionofgprotein-coupledreceptorsinvivo,neuron,2019),能够与外源表达的融合有snap标签蛋白的代谢性谷氨酸受体结合,并用光调控该受体的活动。虽然该工具能够实现对离子通道的精确调控,但仍存在以下缺点,一,调控对象是外源谷氨酸受体而非内源受体,二,该工具依赖于化学合成,在制备方法上难度大于基因编码的蛋白工具。吡啶类药物可以阻断钙离子通道。
现有的遗传编码的调控离子通道功能的光遗传工具,以2014年tillberg等人开发的lumitoxin(直译:光毒素)为例(schmidt,tillberg,chenandboyden,afullygeneticallyencodedproteinarchitectureforopticalcontrolofpeptideligandconcentration,naturecommunications,5,3019,2014),将光敏蛋白lov2结构域与特异性结合离子通道的多肽毒素结合起来,实现对离子通道的阻断,并在蓝光作用下恢复离子通道的开放,但该工具在使用时,在无光照状态下离子通道处于被阻断状态,对细胞的正常生理状态具有一定的影响。
以下为本发明中各组件涉及的背景。
光敏蛋白lov结构域是在拟南芥中发现的一种蛋白激酶nph1中所含有的光敏感结构域(e.huala,p.w.oeller,e.liscum,i.s.han,e.larsen,w.r.briggs,arabidopsisnph1:aproteinkinasewithaputativeredox-sensingdomain,science,278,pp.2120-2123,1997),分为lov1和lov2两部分。在nph1蛋白中,光敏结构域lov吸收光的能量并发生构象变化,并通过连接接头将构象变化传递到nph1的催化结构域,从而导致催化结构域的结构改变和活化。在光遗传学应用中,将光敏蛋白lov2结构域与其他效应蛋白结合,通过蓝光光照使得效应蛋白的可接近性或者活性改变。
liu等报道了crbn基因编码的蛋白cereblon的81-186号氨基酸具有结合bk通道胞内结构域rck1和rck2的能力(liu,j.,ye,j.,zou,x.etal.crl4acrbne3ubiquitinligaserestrictsbkchannelactivityandpreventsepileptogenesis.natcommun5,3924(2014))。
前人研究中,lck(酪氨酸蛋白激酶)的n末端结构域被用于将重组蛋白锚定在细胞膜内侧(shigetomi,e.,kracun,s.,sofroniew,m.etal.ageneticallytargetedopticalsensortomonitorcalciumsignalsinastrocyteprocesses.natneurosci13,759–766(2010)),其原理在于lck的n末端结构域含有串联的棕榈酰化和豆蔻酰化结构域,因此具有锚定在细胞膜脂质双分子层的能力。
技术实现要素:
本发明的目的是针对以上要解决的技术问题,提供一种灵敏度高、能够有效调控bk通道的bk通道光控调节元件。
为了实现以上发明目的,本发明提供了一种光调控bk通道的融合蛋白,其包括从n末端到c末端依次连接的细胞膜锚定序列、荧光蛋白、光敏蛋白lov2结构域、以及bk钾离子通道特异性结合蛋白,所述细胞膜锚定序列、所述荧光蛋白、所述光敏蛋白lov2结构域和所述bk钾离子通道特异性结合蛋白的连接方式为直接相连或通过连接肽相连。
优选地,所述细胞膜锚定序列为lck酪氨酸蛋白激酶n末端结构域。
所述荧光蛋白作用仅为指示工具蛋白的表达和蛋白在亚细胞的定位,优选地,可选用的荧光蛋白包括但不限于红色荧光蛋白、红外荧光蛋白,黄色荧光蛋白等,最优选为mcherry红色荧光蛋白。
优选地,所述蛋白为cereblon蛋白第81-186位氨基酸。
优选地,所述融合蛋白的氨基酸序列如seqidno.1所示。
优选地,所述细胞膜锚定序列的氨基酸序列如seqidno.2所示。
优选地,所述荧光蛋白的氨基酸序列如seqidno.3所示。
优选地,所述光敏蛋白lov2结构域的氨基酸序列如seqidno.4所示。
优选地,所述bk钾离子通道特异性结合蛋白的氨基酸序列如seqidno.5所示。
优选地,所述连接肽为1至15个氨基酸。更优选地,所述连接肽包括柔性氨基酸;更优选地,所述柔性氨基酸包括甘氨酸、丝氨酸、丙氨酸;更优选地,所述连接肽由甘氨酸、丝氨酸、丙氨酸的组合构成。
本发明还提供了所述光调控bk通道的融合蛋白的制备方法,该方法包括以下步骤:将分别编码细胞膜锚定序列、荧光蛋白、光敏蛋白lov2结构域、以及bk钾离子通道特异性结合蛋白的核苷酸序列,通过序列互补实现同源片段重组连接,将上述四个核苷酸序列连接并插入质粒真核表达载体,得到重组质粒,通过该重组质粒表达所述融合蛋白。
本发明还提供了所述光调控bk通道的融合蛋白在光调控bk通道方面的应用,特别是在使用蓝光调控组织中bk钾离子通道活动方面的应用。
本发明利用向光素(phototropin)这一蛋白的n末端感光结构域(lov2结构域)能够感受蓝光并发生构想变化的特点,将lov2结构域与细胞膜锚定序列及特异性结合离子通道的多肽相偶联,使融合蛋白能够锚定在细胞膜内侧,并能够在蓝光的刺激下发生构象变化,进而通过特异性结合bk钾离子通道的多肽影响离子通道的构象,达到调控bk钾离子通道功能的目的。结合高精度的光刺激,本发明可以在较高的时间分辨率与空间分辨率上对bk钾离子通道进行调控。
本发明使用完全基因编码的方式,可实现在动物细胞中表达一个光敏感的融合蛋白工具,该工具可在蓝光刺激的条件下,实现对内源性bk通道的功能调控。具体表现为,光照前,bk通道电流无变化,光照后bk通道电流增大。
bk通道在细胞中起到对钙离子的内流,可兴奋细胞的动作电位时程、半宽度非常重要的负反馈作用,通过调控bk通道的功能,便可实现对细胞钙离子内流、动作电位的调控。
该发明所涉及的核酸序列,可用于构建aav(腺相关病毒)重组表达载体,用于在实验动物体细胞进行蛋白质表达,从而实现在非侵入的条件下,通过蓝光刺激,调控表达该蛋白质的组织中bk钾离子通道的功能,举例而言,可用于小鼠大脑皮层的某一脑区表达该蛋白质,使用蓝光刺激调控该脑区bk钾离子通道的活动。
附图说明
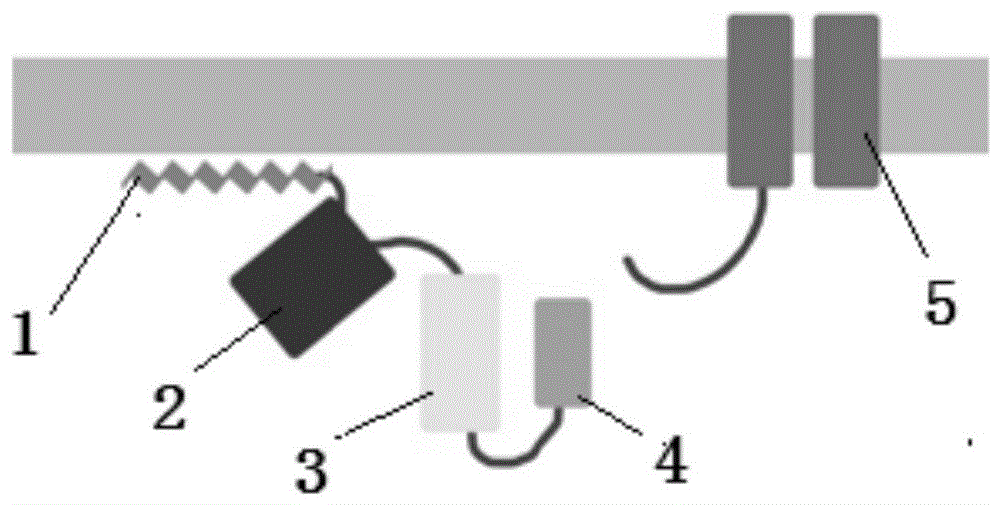
图1是本发明的光调控bk通道的融合蛋白的结构示意图。
图2是本发明的光调控bk通道的融合蛋白在hek293t细胞中的表达结果。
图3是使用本发明的光调控bk通道的融合蛋白的膜片钳电生理实验结果。
图4是对照组的不含bk特异性结合蛋白结构域的重组质粒的膜片钳电生理实验结果。
具体实施方式
以下结合具体实施例,对本发明作进一步说明。应理解,以下实施例仅用于说明本发明,而非用于限制本发明的范围。
如未特别指出,以下所涉及的试剂均可通过商业途径购得。为简便起见,部分操作未详述操作的参数、步骤及所使用的仪器,应当理解,这些都是本领域技术人员所熟知并可重复再现的。
如图1所示,本发明的光调控bk通道的融合蛋白包括从n末端到c末端通过连接肽(linker)依次连接的细胞膜锚定序列1(如lck酪氨酸蛋白激酶n末端结构域的26个氨基酸,序列来源于addgene质粒保藏中心#52924)、荧光蛋白2(如mcherry红色荧光蛋白,亦可选用红色荧光蛋白、红外荧光蛋白,黄色荧光蛋白等)、光敏蛋白lov2结构域3(来源于addgene质粒保藏中心#51691)、以及bk钾离子通道特异性结合蛋白4(如cereblon蛋白(优选为人源蛋白)第81-186位氨基酸)。
优选地,各个蛋白/多肽组件之间直接相连,或通过1至15个、2至15个、3至14个、4至14个氨基酸的连接肽连接。例如,光敏蛋白lov2结构域3与bk钾离子通道特异性结合蛋白4直接相连,而其他组件则通过连接肽相连接。更优选地,所述连接肽包括柔性氨基酸;更优选地,所述柔性氨基酸包括甘氨酸、丝氨酸、丙氨酸;更优选地,所述连接肽由甘氨酸、丝氨酸、丙氨酸的组合构成。
各个组件蛋白/多肽的氨基酸序列如下:
lck酪氨酸蛋白激酶n末端结构域:
mgcgcssnpeddwmenidvcenchyp(seqidno.2)
mcherry红色荧光蛋白:
mvskgeednmaiikefmrfkvhmegsvnghefeiegegegrpyegtqtaklkvtkggplpfawdilspqfmygskayvkhpadipdylklsfpegfkwervmnfedggvvtvtqdsslqdgefiykvklrgtnfpsdgpvmqkktmgweassermypedgalkgeikqrlklkdgghydaevkttykakkpvqlpgaynvniklditshnedytiveqyeraegrhstggmdelyk(seqidno.3)
光敏蛋白lov2结构域:
lattlerieknfvitdprlpdnpiifasdsflqlteysreeilgrncrflqgpetdratvrkirdaidnqtevtvqlinytksgkkfwnlfhlqpmrdqkgdvqyfigvqldgtehvrdaaeregvmlikktaenideaakel(seqidno.4)
bk钾离子通道特异性结合肽cereblon第81-186位氨基酸
ipvlpqvmmilipgqtlplqlfhpqevsmvrnliqkdrtfavlaysnvqereaqfgttaeiyayreeqdfgieivkvkaigrqrfkvlelrtqsdgiqqakvqilp(seqidno.5)
各个蛋白/多肽组件之间通过0至15个氨基酸的连接肽连接。
在一个优选的实施方案中,该融合蛋白的全部氨基酸序列如seqidno.1所示:
其中下划线部分分别为lck酪氨酸蛋白激酶n末端结构域、mcherry红色荧光蛋白、光敏蛋白lov2结构域的氨基酸序列组件一到三,黑体部分为bk钾离子通道特异性结合肽cereblon第81-186位氨基酸。
本发明提供的由基因编码的光调控大电导钙激活钾离子通道工具的构建方法如下:将各组件多肽序列通过聚合酶链式反应(pcr)克隆得到序列,通过gibsonassembly原理,即通过序列互补实现同源片段重组连接,将四个序列连接并插入质粒真核表达载体得到重组质粒即得。
本发明提供的由基因编码的光调控大电导钙激活钾离子通道工具的应用方法如下:将重组质粒转染进动物细胞后12-48h,荧光显微镜可观察到红色荧光说明该工具表达正常,此时使用450-500nm之间波长的蓝光照射表达该工具蛋白的细胞,在膜片钳记录中可记录到电流增大。
该基因编码的光调控大电导钙激活钾离子通道工具的原理如下:
组件一lck酪氨酸蛋白激酶n末端结构域的部分氨基酸可发生棕榈酰化和豆蔻酰化修饰,具有锚定在细胞膜胞质侧的能力;
组件二mcherry红色荧光蛋白用于指示该工具蛋白在细胞中是否表达,以及该工具蛋白在细胞中的亚细胞位置分布;
组件三光敏蛋白lov2结构域,在无光照时保持折叠状态,在蓝光照射时构象改变,lov2结构域的c末端展开,带动lov2结构域c末端所连接多肽位置的变化;
组件四bk钾离子通道特异性结合蛋白cereblon蛋白第81-186号氨基酸,具有结合bk钾离子通道胞内段的能力。在未光照时,该融合蛋白聚集在细胞膜胞质侧,见图2,该融合蛋白在hek293t细胞中的表达,荧光显微镜下可见该融合蛋白工具亚细胞定位集中在细胞膜附近。
组件四可能与bk通道胞质段有一定程度结合,
光照后,组件三构象改变,改变组件四的空间位置,通过组件四拉动bk通道的胞质段,bk通道电流增大。
实施例
1.光调控大电导钙激活钾离子通道工具的分子克隆
分子克隆采用gibsonassembly无缝克隆原理,即利用序列互补实现同源片段的重组连接。在扩增引物中采用20-30个碱基的同源互补序列实现序列之间的有效拼接。正确重组的克隆经过生工生物工程(上海)股份有限公司进行sanger测序验证序列准确性。
克隆中所用质粒pcdna3.1-dtxk-lumitoxin(#51691)、pzac2.1-gfaabc1d-lck-gcamp6f(#52924)来源于美国addgene质粒保藏中心,另外,cereblon蛋白81-186号氨基酸序列对应核酸序列由生工生物工程(上海)股份有限公司合成。
由于lck片段长度很短,无缝克隆难以连接,因此分子克隆采用两步法(包括步骤一和步骤二)。
步骤一:
将mcherry、lov2结构域、cereblon蛋白81-186号氨基酸分别pcr扩增,克隆到lckn端结构域所在的pzac2.1载体上。
pcr扩增所用引物及模板如下:
载体:pzac2.1-lck
模板:pzac2.1-gfaabc1d-lck-gcamp6f(#52924)
引物:
caaattcttccctgatctagagtcgacccgggc;
tacgaatcctcatggtggctggatccattcgaag;
片段一:mcherry
模板:pcdna3.1-dtxk-lumitoxin(#51691)
引物:
gatccagccaccatgaggattcgtatggtgagcaagggc;
tagccaagctgccgctgcccttgtacagctcgtccatgccgc
片段二:lov2结构域
模板:pcdna3.1-dtxk-lumitoxin(#51691)
引物:
tacaagggcagcggcagcttggctactacacttgaacgtattgagaag;
gaagaactggaataagttcttttgccgcctcatcaatat;
片段三:cereblon蛋白81-186号氨基酸
模板:基因合成序列
引物:
gcaaaagaacttattccagttcttccacaagtgatgatgatc;
cgactctagatcagggaagaatttgcactttagcttg。
所有pcr反应使用toyobokodneoplus(#kod-401)高保真dna聚合酶扩增。
扩增后片段使用neb公司的
步骤二:
将包括lck在内的所有四个组件,克隆到真核通用表达载体pcdna3.1上。
克隆所用真核表达载体采用pcdna3.1,使用限制性核酸内切酶nhei及xbai双酶切消化pcdna3.1-dtxk-lumitoxin质粒,以得到pcdna3.1线性化载体。
插入片段扩增引物:
ctcactatagggagacccaagctggctagcatgggctgtggctgcagctcaaacc;
tgatcagcgggtttaaacgggccctctagatcagggaagaatttgcactttagcttgc
所有pcr反应使用toyobokodneoplus(#kod-401)高保真dna聚合酶扩增。
扩增后片段使用neb公司的
2.细胞培养及转染
hek293t细胞培养于37℃,5%二氧化碳培养箱(thermofisher)中,完全培养基为10%fbs(gibco),dmem(gibco),根据细胞的生长状况及密度,采取每两天进行一次细胞传代,每次传代保留四分之一。转染前一天,细胞消化分散后均匀铺在放有圆形盖玻片的24孔培养板中。转染当天,培养基换成无血清dmem,采用lipo3000(thermofisher)进行双质粒共转染,转染方法参见thermofisher官网,转染质粒为本发明所构建的重组质粒及表达人源bk通道α亚基的质粒,转染后2h换液为完全培养基。转染后24h进行膜片钳电生理实验。
3.细胞的荧光成像及膜片钳电生理实验
细胞的荧光成像采用奥林巴斯的荧光显微镜,通过荧光鉴定有双质粒表达的状态良好的细胞进行电生理实验。
玻璃电极拉制至尖端直径1-2μm,在电极前端涂硅酮树脂,以降低电极与灌流液之间的电容。向电极内灌注电极液:先将电极尖端浸入内液5s左右,然后用聚丙烯注射管从电极后端插至尖端附近,将溶液充至1/4长度,并弹除尖端的气泡。
将电极接触细胞膜,先轻轻吸吮,使微电极与细胞膜之间形成高阻封接,电阻达到1gω以上,再继续用力吸吮打破细胞膜,使电极内液与细胞内液沟通,可记录全细胞电位。
当形成高阻封接时轻轻回撤电极,可以撕下一小片细胞膜,记录这一片膜上的跨膜离子电流,此时该膜上有数个离子通道,通过数据分析可获得单一通道电流数据。
实验结果
电生理采用全细胞记录模式,记录45sbk通道电流基线之后,通过荧光显微镜蓝光照射60s。记录得归一化bk电流增大幅度平均超过300%,并在撤光后持续增大。如图3所示。
对照组所用重组质粒不含bk特异性结合蛋白结构域(cereblon蛋白81-186号氨基酸),相同实验条件,归一化bk电流增大幅度较低,如图4所示。
序列表
<110>中山大学
<120>光调控bk通道的融合蛋白及其制备方法和应用
<160>15
<170>siposequencelisting1.0
<210>1
<211>529
<212>prt
<213>人工序列(artificialsequence)
<400>1
metglycysglycysserserasnprogluaspasptrpmetgluasn
151015
ileaspvalcysgluasncyshistyrproproprolysleuargmet
202530
aspproalathrmetargileargmetvalserlysglyglugluasp
354045
asnmetalaileilelysgluphemetargphelysvalhismetglu
505560
glyservalasnglyhisgluphegluilegluglygluglyglugly
65707580
argprotyrgluglythrglnthralalysleulysvalthrlysgly
859095
glyproleuprophealatrpaspileleuserproglnphemettyr
100105110
glyserlysalatyrvallyshisproalaaspileproasptyrleu
115120125
lysleuserpheprogluglyphelystrpgluargvalmetasnphe
130135140
gluaspglyglyvalvalthrvalthrglnaspserserleuglnasp
145150155160
glyglupheiletyrlysvallysleuargglythrasnpheproser
165170175
aspglyprovalmetglnlyslysthrmetglytrpglualaserser
180185190
gluargmettyrprogluaspglyalaleulysglygluilelysgln
195200205
argleulysleulysaspglyglyhistyraspalagluvallysthr
210215220
thrtyrlysalalyslysprovalglnleuproglyalatyrasnval
225230235240
asnilelysleuaspilethrserhisasngluasptyrthrileval
245250255
gluglntyrgluargalagluglyarghisserthrglyglymetasp
260265270
gluleutyrlysglyserglyserleualathrthrleugluargile
275280285
glulysasnphevalilethraspproargleuproaspasnproile
290295300
ilephealaseraspserpheleuglnleuthrglutyrserargglu
305310315320
gluileleuglyargasncysargpheleuglnglyprogluthrasp
325330335
argalathrvalarglysileargaspalaileaspasnglnthrglu
340345350
valthrvalglnleuileasntyrthrlysserglylyslysphetrp
355360365
asnleuphehisleuglnprometargaspglnlysglyaspvalgln
370375380
tyrpheileglyvalglnleuaspglythrgluhisvalargaspala
385390395400
alagluarggluglyvalmetleuilelyslysthralagluasnile
405410415
aspglualaalalysgluleuileprovalleuproglnvalmetmet
420425430
ileleuileproglyglnthrleuproleuglnleuphehisprogln
435440445
gluvalsermetvalargasnleuileglnlysaspargthrpheala
450455460
valleualatyrserasnvalglngluargglualaglnpheglythr
465470475480
thralagluiletyralatyrargglugluglnasppheglyileglu
485490495
ilevallysvallysalaileglyargglnargphelysvalleuglu
500505510
leuargthrglnseraspglyileglnglnalalysvalglnileleu
515520525
pro
<210>2
<211>26
<212>prt
<213>人工序列(artificialsequence)
<400>2
metglycysglycysserserasnprogluaspasptrpmetgluasn
151015
ileaspvalcysgluasncyshistyrpro
2025
<210>3
<211>236
<212>prt
<213>人工序列(artificialsequence)
<400>3
metvalserlysglyglugluaspasnmetalaileilelysgluphe
151015
metargphelysvalhismetgluglyservalasnglyhisgluphe
202530
gluilegluglygluglygluglyargprotyrgluglythrglnthr
354045
alalysleulysvalthrlysglyglyproleuprophealatrpasp
505560
ileleuserproglnphemettyrglyserlysalatyrvallyshis
65707580
proalaaspileproasptyrleulysleuserpheprogluglyphe
859095
lystrpgluargvalmetasnphegluaspglyglyvalvalthrval
100105110
thrglnaspserserleuglnaspglyglupheiletyrlysvallys
115120125
leuargglythrasnpheproseraspglyprovalmetglnlyslys
130135140
thrmetglytrpglualasersergluargmettyrprogluaspgly
145150155160
alaleulysglygluilelysglnargleulysleulysaspglygly
165170175
histyraspalagluvallysthrthrtyrlysalalyslysproval
180185190
glnleuproglyalatyrasnvalasnilelysleuaspilethrser
195200205
hisasngluasptyrthrilevalgluglntyrgluargalaglugly
210215220
arghisserthrglyglymetaspgluleutyrlys
225230235
<210>4
<211>143
<212>prt
<213>人工序列(artificialsequence)
<400>4
leualathrthrleugluargileglulysasnphevalilethrasp
151015
proargleuproaspasnproileilephealaseraspserpheleu
202530
glnleuthrglutyrserargglugluileleuglyargasncysarg
354045
pheleuglnglyprogluthraspargalathrvalarglysilearg
505560
aspalaileaspasnglnthrgluvalthrvalglnleuileasntyr
65707580
thrlysserglylyslysphetrpasnleuphehisleuglnpromet
859095
argaspglnlysglyaspvalglntyrpheileglyvalglnleuasp
100105110
glythrgluhisvalargaspalaalagluarggluglyvalmetleu
115120125
ilelyslysthralagluasnileaspglualaalalysgluleu
130135140
<210>5
<211>106
<212>prt
<213>人工序列(artificialsequence)
<400>5
ileprovalleuproglnvalmetmetileleuileproglyglnthr
151015
leuproleuglnleuphehisproglngluvalsermetvalargasn
202530
leuileglnlysaspargthrphealavalleualatyrserasnval
354045
glngluargglualaglnpheglythrthralagluiletyralatyr
505560
argglugluglnasppheglyilegluilevallysvallysalaile
65707580
glyargglnargphelysvalleugluleuargthrglnseraspgly
859095
ileglnglnalalysvalglnileleupro
100105
<210>6
<211>33
<212>dna
<213>人工序列(artificialsequence)
<400>6
caaattcttccctgatctagagtcgacccgggc33
<210>7
<211>34
<212>dna
<213>人工序列(artificialsequence)
<400>7
tacgaatcctcatggtggctggatccattcgaag34
<210>8
<211>39
<212>dna
<213>人工序列(artificialsequence)
<400>8
gatccagccaccatgaggattcgtatggtgagcaagggc39
<210>9
<211>42
<212>dna
<213>人工序列(artificialsequence)
<400>9
tagccaagctgccgctgcccttgtacagctcgtccatgccgc42
<210>10
<211>48
<212>dna
<213>人工序列(artificialsequence)
<400>10
tacaagggcagcggcagcttggctactacacttgaacgtattgagaag48
<210>11
<211>39
<212>dna
<213>人工序列(artificialsequence)
<400>11
gaagaactggaataagttcttttgccgcctcatcaatat39
<210>12
<211>42
<212>dna
<213>人工序列(artificialsequence)
<400>12
gcaaaagaacttattccagttcttccacaagtgatgatgatc42
<210>13
<211>37
<212>dna
<213>人工序列(artificialsequence)
<400>13
cgactctagatcagggaagaatttgcactttagcttg37
<210>14
<211>55
<212>dna
<213>人工序列(artificialsequence)
<400>14
ctcactatagggagacccaagctggctagcatgggctgtggctgcagctcaaacc55
<210>15
<211>58
<212>dna
<213>人工序列(artificialsequence)
<400>15
tgatcagcgggtttaaacgggccctctagatcagggaagaatttgcactttagcttgc58
- 还没有人留言评论。精彩留言会获得点赞!