一种CXCR4基因的shRNA及其应用的制作方法
本发明属于基因工程
技术领域:
,涉及一种cxcr4基因的shrna及其应用。
背景技术:
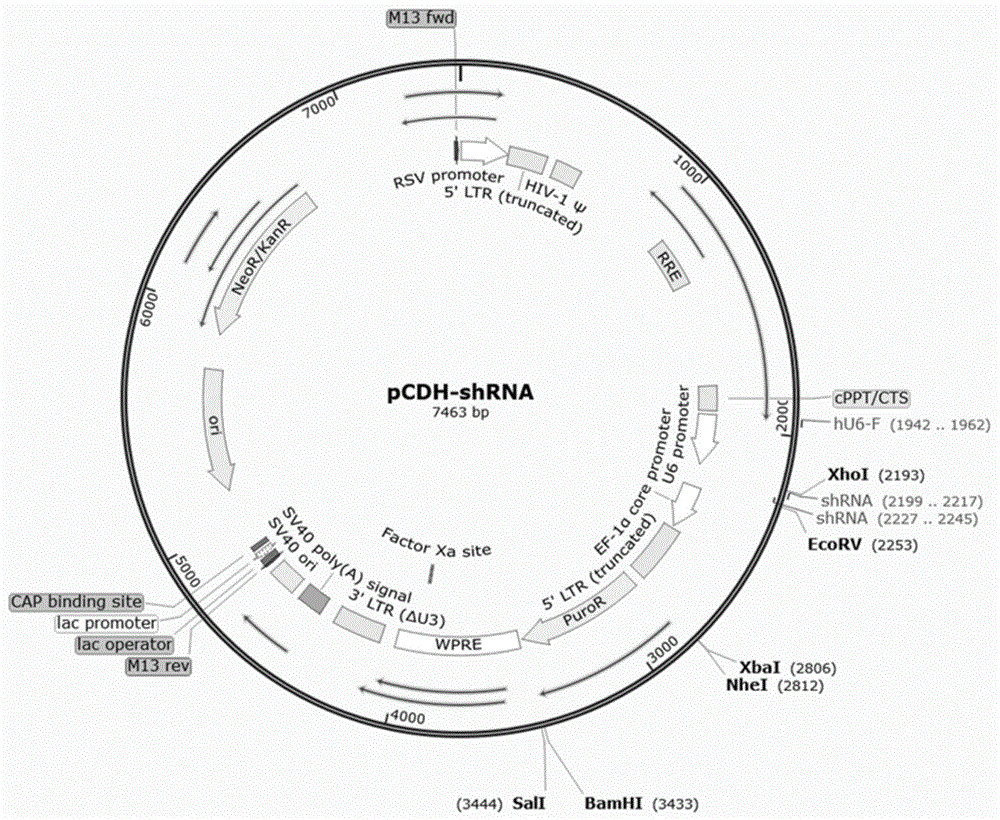
:t细胞作为人体的主要免疫细胞,对免疫系统具有重要的调节作用。t细胞是人类免疫缺陷病毒(hiv)的主要靶点,病毒通过介导细胞凋亡并诱导自身免疫反应,造成t细胞数量减少,引发细胞免疫丧失、体液免疫应答和后天免疫机能丧失综合症。hiv通过病毒包膜蛋白与cd4+t细胞的ccr5或c-x-c基序趋化因子受体4(cxcr4)结合进入宿主细胞。在大多数情况下,hiv通过ccr5进入宿主细胞,引发原发感染;在感染的后期,包膜蛋白的突变使得病毒对cxcr4具有趋向性。使用基因编辑技术治疗hiv具有可行性。在自体未感染的cd4+t细胞或cd34+造血干细胞中敲除ccr5基因,在体外和免疫缺陷小鼠中展现出良好的t细胞增殖和抗hiv效应。与输注未修饰的t细胞相比,输注基因修饰的cd4+t细胞显著降低了hiv感染的外周血中的病毒载量,增加了cd4+t细胞的数量。研究表明,输注敲除了ccr5的cd4+t细胞可以重建患者的免疫系统,从而产生持久有效的抗hiv效应。c-x-c基序趋化因子受体4(cxcr4)是hiv感染后期的另一重要辅助受体,敲除t细胞中的cxcr4基因有利于获得对hiv感染的抗性,敲除cxcr4后的cd4+t细胞具有正常的增殖功能,并显示出对利用cxcr4受体的病毒的有效抗性。现有技术表明,对t细胞进行基因编辑,为治疗癌症、艾滋病、自身免疫病提供了新手段。目前,基因编辑技术已经应用于多种类型的细胞基因组编辑,但是对人源t细胞尚有一定难度。技术实现要素:针对现有技术的不足和实际需求,本发明提供了一种cxcr4基因的shrna及其应用,所述shrna及其构建的慢病毒载体实现了对t细胞中cxcr4基因的沉默,经过编辑后的t细胞中cxcr4的表达水平显著降低,为肿瘤、免疫疾病的治疗提供了新的方法和思路。为达此目的,本发明采用以下技术方案:第一方面,本发明提供了一种cxcr4基因的sirna,所述sirna包括如seqidno:1~6所示的核酸序列;seqidno:1:gcaaggcagtccatgtcatct;seqidno:2:ggatcagcatcgactccttca;seqidno:3:gcacatcatggttggccttat;seqidno:4:agataactacaccgaggaaat;seqidno:5:cctgttcttaagacgtgattt;seqidno:6:tcctgtcctgctattgcatta。本发明中,对cxcr4基因的全长mrna进行分析,经blast比对获得特异性的mrna,由此设计得到如seqidno:1~6所示的6条cxcr4基因的sirna,其中,如seqidno:1所示的sirna的靶点mrna的位置为421~441,如seqidno:2所示的sirna的靶点mrna的位置为868~888,如seqidno:3所示的sirna的靶点mrna的位置为701~721,如seqidno:4所示的sirna的靶点mrna的位置为122~142,如seqidno:5所示的sirna的靶点mrna的位置为1512~1532,如seqidno:6所示的sirna的靶点mrna的位置为739~759。第二方面,本发明提供了一种shrna,所述shrna包括茎环连接的反向重复序列;所述反向重复序列包括cxcr4基因的sirna和所述sirna的反向重复序列。本发明中,设计的shrna序列包含如第一方面所述的cxcr4基因的sirna,有利于整合入基因组,从而使对cxcr4基因的沉默可被遗传。优选地,所述shrna包括正义链和反义链。优选地,所述shrna的茎环包括如seqidno:7~8所示的核酸序列;seqidno:7:ttcaagaga;seqidno:8:tctcttgaa。本发明中,如seqidno:7所示的核酸序列为shrna正义链的茎环,如seqidno:8所示的核酸序列为shrna反义链的茎环。优选地,所述shrna包括如seqidno:9~20所示的核酸序列;seqidno:9:tcgaggcaaggcagtccatgtcatctttcaagagaagatgacatggactgccttgcttttttgatat;seqidno:10:actaaaaaagcaaggcagtccatgtcatcttctcttgaaagatgacatggactgccttgcc;seqidno:11:tcgagggatcagcatcgactccttcattcaagagatgaaggagtcgatgctgatccttttttgatat;seqidno:12:actaaaaaaggatcagcatcgactccttcatctcttgaatgaaggagtcgatgctgatccc;seqidno:13:tcgaggcacatcatggttggccttatttcaagagaataaggccaaccatgatgtgcttttttgat;seqidno:14:actaaaaaagcacatcatggttggccttattctcttgaaataaggccaaccatgatgtgcc;seqidno:15:tcgagagataactacaccgaggaaatttcaagagaatttcctcggtgtagttatctttttttgat;seqidno:16:actaaaaaaagataactacaccgaggaaattctcttgaaatttcctcggtgtagttatctc;seqidno:17:tcgagcctgttcttaagacgtgatttttcaagagaaaatcacgtcttaagaacaggttttttgat;seqidno:18:actaaaaaacctgttcttaagacgtgattttctcttgaaaaatcacgtcttaagaacaggc;seqidno:19:tcgagtcctgtcctgctattgcattattcaagagataatgcaatagcaggacaggattttttgat;seqidno:20:actaaaaaatcctgtcctgctattgcattatctcttgaataatgcaatagcaggacaggac。本发明中,seqidno:9~10互为正反义链,seqidno:11~12互为正反义链,seqidno:13~14互为正反义链,seqidno:15~16互为正反义链,seqidno:17~18互为正反义链,seqidno:19~20互为正反义链,各正义链中的小写字母代表cxcr4基因的sirna及其反向重复序列。第三方面,本发明提供了一种shrna表达载体,所述shrna表达载体包括如第二方面所述的shrna。优选地,所述表达载体包括病毒载体。优选地,所述病毒载体包括慢病毒载体、逆转录病毒载体或腺相关病毒载体中的任意一种,优选为慢病毒载体。第四方面,本发明提供了一种如第三方面所述的shrna表达载体的制备方法,所述制备方法包括以下步骤:(1)根据cxcr4基因的sirna设计shrna;(2)将shrna插入表达载体中,得到所述shrna表达载体。优选地,所述shrna插入表达载体的xhoi和ecorv酶切位点。第五方面,本发明提供了一种重组慢病毒,所述重组慢病毒采用如第三方面所述的表达载体与包装辅助质粒共转染哺乳细胞制备得到。优选地,所述哺乳细胞包括293细胞、293t细胞或293f细胞中的任意一种或至少两种的组合,优选为293t细胞。第六方面,本发明提供了一种宿主细胞,所述宿主细胞转染有如第一方面所述的sirna、如第二方面所述的shrna、如第三方面所述的sgrna表达载体或如第五方面所述的重组慢病毒中的任意一种或至少两种的组合。优选地,所述宿主细胞包括免疫细胞。优选地,所述免疫细胞包括t细胞。第七方面,本发明提供了一种沉默cxcr4基因的方法,所述方法包括:将如第一方面所述的sirna、如第二方面所述的shrna、如第三方面所述的shrna表达载体或如第五方面所述的重组慢病毒转染宿主细胞,进行cxcr4基因的沉默。第八方面,本发明提供了一种cxcr4抑制剂,所述cxcr4抑制剂包括如第一方面所述的sirna、如第二方面所述的shrna、如第三方面所述的shrna表达载体或如第五方面所述的重组慢病毒中的任意一种或至少两种的组合。第九方面,本发明提供了一种药物组合物,所述药物组合物包括如第一方面所述的sirna、如第二方面所述的shrna、如第三方面所述的shrna表达载体、如第五方面所述的重组慢病毒、如第六方面所述的宿主细胞或如第八方面所述的cxcr4抑制剂中的任意一种或至少两种的组合。优选地,所述药物组合物还包括药学上可接受的载体、赋形剂或稀释剂中的任意一种或至少两种的组合。第十方面,本发明提供了一种如第一方面所述的sirna、如第二方面所述的shrna、如第三方面所述的shrna表达载体、如第五方面所述的重组慢病毒、如第六方面所述的宿主细胞、如第八方面所述的cxcr4抑制剂或如第九方面所述的药物组合物在制备疾病治疗药物中的应用。优选地,所述疾病包括恶性肿瘤和/或免疫缺陷病。与现有技术相比,本发明具有如下有益效果:(1)本发明筛选的shrna序列含有cxcr4基因的sirna,包装构建慢病毒载体后,有利于整合入t细胞基因组中,从而使对cxcr4基因的沉默可被遗传;(2)本发明的shrna慢病毒实现了对t细胞中cxcr4基因的编辑作用,经过编辑的t细胞中cxcr4表达显著降低,为肿瘤、免疫疾病的治疗提供了新的方法和思路。附图说明图1为pcdh-shrna载体图谱及多克隆限制性酶切位点;图2(a)为pcdh-shcxcr4-1的测序结果,图2(b)为pcdh-shcxcr4-2的测序结果,图2(c)为pcdh-shcxcr4-3的测序结果,图2(d)为pcdh-shcxcr4-4的测序结果,图2(e)为pcdh-shcxcr4-5的测序结果,图2(f)为pcdh-shcxcr4-6的测序结果;图3为转染有pcdh-shcxcr4的t细胞中cxcr4的表达水平;图4为t细胞表面cxcr4的表达情况。具体实施方式为进一步阐述本发明所采取的技术手段及其效果,以下结合实施例和附图对本发明作进一步地说明。可以理解的是,此处所描述的具体实施方式仅仅用于解释本发明,而非对本发明的限定。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购获得的常规产品。实施例1cxcr4基因的sirna和shrna序列设计对genbank公开的cxcr4基因的全长mrna序列(nm_003467.2)进行分析,经blast比对获得特异性的mrna,设计cxcr4mrna的sirna,各sirna的靶点位置如图1所示,具体的序列信息如表1所示。表1cxcr4基因的6条特异性sirna序号靶核苷酸序列靶点位置seqidno:1gcaaggcagtccatgtcatct421~441seqidno:2ggatcagcatcgactccttca868~888seqidno:3gcacatcatggttggccttat701~721seqidno:4agataactacaccgaggaaat122~142seqidno:5cctgttcttaagacgtgattt1512~1532seqidno:6tcctgtcctgctattgcatta739~759根据sirna序列,设计对应的shrna,所述shrna包括正义链(s)和反义链(a),shrna序列由sense(下划线)+茎环(loop)+antisense+终止序列组成,具体序列如表2所示。表2cxcr4基因的shrna实施例2cxcr4基因的shrna慢病毒表达载体的构建将pchd载体采用xhoi/ecorv进行双酶切,并切胶回收;根据shrna设计特异性引物完成引物退火;将shrna和酶切回收的载体重组形成环状片段,转入制备好的细菌感受态细胞,挑选单克隆菌落进行测序鉴定,比对正确的克隆即为构建成功的shrna沉默载体。具体步骤如下:(1)载体的双酶切①将含有pcdh空载体的克隆菌株过夜培养,取5ml新鲜菌液采用qiagen质粒小抽试剂盒提取质粒;②取2μg提取的pcdh,用相应的限制性内切酶在37℃下酶切约1h,酶切体系如表3所示;表3pcdh2μg缓冲液buffer5μlxhoi1μlecorv1μlddh2o补齐至50μl③将酶切产物进行琼脂糖凝胶电泳,电泳结束后进行胶回收,步骤如下:在紫外灯照射下,切下包含目的片段的胶条,用天平称量总重量并减去空管的重量算出凝胶的重量,按100mg=100μl来计算凝胶的体积,并加入1倍凝胶体积的结合液(bindingsolution),置于65℃水浴锅内将凝胶彻底融化,期间适当摇晃ep管,加快凝胶的溶解;④将上述液体全部转移到滤柱内,13000rpm离心30s(可重复一次),然后弃掉管内液体,向柱内加入500μl的wasolution,13000rpm离心30s;弃掉管内液体,再向柱内加入500μl的washsolution,13000rpm离心30s(可重复一次),然后空离3min;将滤柱放置在一个新的1.5mlep管中,室温晾干,最后在柱子内加入35μl的ddh2o,静置5min,13000rpm离心1.5min,为了提高回收率,可将溶解的dna再次加入柱子内离心一分钟,弃掉柱子,即为回收的载体片段,并测定浓度。(2)shrna的退火①将合成的引物稀释成终浓度为100nmol/l的储藏液,按照如表4所示的体系进行退火;表4primer-f2μlprimer-r2μlnacl2μlddh2o补齐至20μl②将体系混匀、瞬时离心后放入pcr仪中,进行退火和延伸,条件为90℃4min,70℃10min,55℃10min,37℃5min,25℃10min,4℃保存。(3)t4连接反应因退火产物与载体粘性末端相匹配,使用t4连接酶将回收片段与线性化pcdh载体进行连接,完成回收目的基因与载体的重组过程,构建得到如图1所示的pcdh-shrna慢病毒载体。(4)转化①将感受态细胞置于冰上(4℃)待其自然解冻后,取10μl连接产物加入感受态细胞中,于冰上(4℃)放置30min;②于42℃水浴中热击90s,迅速置于冰上(4℃)放置2~3min;③加入600μl不含抗生素的soc培养基于37℃、200rpm振荡培养45min;④4000rpm离心3min,弃掉600μl的上清液,将管底的菌液吹打散开,加入到含有抗性的培养平板中,用灭菌的涂布器涂匀,倒置于37℃恒温培养箱内过夜培养。(5)克隆鉴定挑选平板中的多个克隆转化子进行测序鉴定,保存菌种。如图2(a)、图2(b)、图2(c)、图2(d)、图2(e)和图2(f)所示分别为pcdh-shcxcr4-1、pcdh-shcxcr4-2、pcdh-shcxcr4-3、pcdh-shcxcr4-4、pcdh-shcxcr4-5和pcdh-shcxcr4-6的测序结果,可以看出,载体中的碱基序列与预计序列一致,确认慢病毒载体构建成功。实施例3慢病毒包装将实施例2构建的慢病毒载体进行慢病毒包装,采用四质粒系统,具体步骤如下:(1)四质粒系统包括包装慢病毒载体所需的gag/pol、rev、vsv-g及慢病毒载体pcdh-shcxcr4-1~6或阴性对照质粒,将上述质粒加入到一定体积的无血清dmem培养基中,混匀后放置15min;(2)将上述混合液加入到铺有293t细胞的t75培养瓶中,轻轻混匀,瞬时转染293t细胞,于37℃、5%co2细胞培养箱培养6h;(3)6h后更换新鲜培养基,继续培养,并且加入10mm丁酸钠溶液,72h后收集培养上清进行慢病毒纯化检测。实施例4慢病毒转导人原代t细胞将采集的外周血与生理盐水按1:1的比例混合,在离心管中加入ficoll,缓慢加入稀释后的外周血,1500rpm离心30min,轻轻吸取pbmc层加入另一离心管中;用生理盐水洗涤pbmc,转入x-vivo培养基(含50ng/ml的okt3,300iu/ml的il-2)中进行培养;pbmc分离后,用x-vivo培养基(含50ng/ml的okt3,300iu/ml的il-2)进行激活,2天后进行慢病毒感染;将t细胞和慢病毒溶液加入预包被retronectin的6孔板内,2000g离心2h,于37℃、5%co2和一定湿度的细胞培养箱内培养,4天后收集细胞,检测cxcr4的敲减效率。实施例5荧光定量pcr检测cxcr4基因的表达量(1)rna提取向含有trizol的1.5mlep管中加入200μl氯仿,震荡混匀后,静置5min,12000rpm、4℃离心10min;从离心机中取出1.5mlep管,再将上层无色透明的水相层吸入到另一干净的1.5mlep管中(样品分为三层:下层为有机相层,中间层和上层为水相层,rna位于上层水相中),加入等体积的异丙醇,上下轻轻颠倒混匀后,静置10min,12000rpm、4℃离心10min;小心弃上清,用1ml75%乙醇洗涤rna沉淀,7000rpm、4℃离心5min,将上清尽量去除干净;室温静置干燥5~10min,加入25μldepc水,用枪头吹打几次,使rna充分溶解,-80℃保存;使用核酸蛋白检测仪检测提取的rna浓度。结果如表5所示,提取的rna纯度高,未被污染。表5样品名称纯度浓度(ng/μl)control组1.80682.25shnc组1.81788.39shcxcr4-1组1.73620.08shcxcr4-2组1.77443.38shcxcr4-3组1.83623.08shcxcr4-4组1.76544.57shcxcr4-5组1.79630.99shcxcr4-6组1.79430.89(2)反转录①按照表6配制反应液,72℃孵育5min,置于冰上急冷;表6总rna5μgoligodt(5μm)2.5μldepch2o补齐至12.5μl②向上述反应液中加入反转录试剂,配制如表7所示的反转录体系,42℃孵育60min,72℃孵育10min,进行反转录,得到cdna;表7(3)cxcr4的qpcr设计cxcr4和gapdh的引物seqidno:21~24,按照表8配制qpcr体系,反应条件如表9所示,熔解过程如表10所示;hcxcr4-188-f(seqidno:21):ccgtggcaaactggtactt;hcxcr4-188-r(seqidno:22):gacgccaacatagaccacct;hgapdh-127f(seqidno:23):ccaggtggtctcctctga;hgapdh-127r(seqidno:24):gctgtagccaaatcgttgt;表8成分体积sybrgreenimix(2×)5μlf(10μm)0.3μlr(10μm)0.3μlcdna0.2μl灭菌蒸馏水补齐至10μl表9表10数据采用iq5荧光定量pcr分析系统进行分析,采用2-△△ct法进行相对基因表达分析,以gapdh为内参将正常培养的人t细胞表达量设为1,计算各转染组的相对表达量。结果如图3所示,靶向cxcr4的shrna-1~6的沉默效率分别达到59.41%、86.5%、69.5%、28.3%、49.7%和55.5%,其中shrna-2的沉默效率最高。实施例6流式检测cxcr4蛋白的表达采用流式细胞仪检测t细胞表面cxcr4的表达情况,pe标记的抗cxcr4抗体(biolegend;货号306506)与t细胞共孵育30min后,pbs洗涤3遍进行流式检测。结果如图4所示,shcxcr4-2组cxcr4的表达最低,为3.2%。综上所述,本发明通过筛选靶向cxcr4的shrna,包装慢病毒载体,转入到t细胞中对cxcr4基因进行沉默,成功地完成了对t细胞中的hiv病毒的共同受体cxcr4蛋白的基因靶点的编辑,经过编辑后的t细胞中cxcr4表达显著降低,为肿瘤、免疫疾病的治疗提供了新的方法和思路。申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属
技术领域:
的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。sequencelisting<110>广州百暨基因科技有限公司<120>一种cxcr4基因的shrna及其应用<130>20200312<160>24<170>patentinversion3.3<210>1<211>21<212>dna<213>人工合成<400>1gcaaggcagtccatgtcatct21<210>2<211>21<212>dna<213>人工合成<400>2ggatcagcatcgactccttca21<210>3<211>21<212>dna<213>人工合成<400>3gcacatcatggttggccttat21<210>4<211>21<212>dna<213>人工合成<400>4agataactacaccgaggaaat21<210>5<211>21<212>dna<213>人工合成<400>5cctgttcttaagacgtgattt21<210>6<211>21<212>dna<213>人工合成<400>6tcctgtcctgctattgcatta21<210>7<211>9<212>dna<213>人工合成<400>7ttcaagaga9<210>8<211>9<212>dna<213>人工合成<400>8tctcttgaa9<210>9<211>67<212>dna<213>人工合成<400>9tcgaggcaaggcagtccatgtcatctttcaagagaagatgacatggactgccttgctttt60ttgatat67<210>10<211>61<212>dna<213>人工合成<400>10actaaaaaagcaaggcagtccatgtcatcttctcttgaaagatgacatggactgccttgc60c61<210>11<211>67<212>dna<213>人工合成<400>11tcgagggatcagcatcgactccttcattcaagagatgaaggagtcgatgctgatcctttt60ttgatat67<210>12<211>61<212>dna<213>人工合成<400>12actaaaaaaggatcagcatcgactccttcatctcttgaatgaaggagtcgatgctgatcc60c61<210>13<211>65<212>dna<213>人工合成<400>13tcgaggcacatcatggttggccttatttcaagagaataaggccaaccatgatgtgctttt60ttgat65<210>14<211>61<212>dna<213>人工合成<400>14actaaaaaagcacatcatggttggccttattctcttgaaataaggccaaccatgatgtgc60c61<210>15<211>65<212>dna<213>人工合成<400>15tcgagagataactacaccgaggaaatttcaagagaatttcctcggtgtagttatcttttt60ttgat65<210>16<211>61<212>dna<213>人工合成<400>16actaaaaaaagataactacaccgaggaaattctcttgaaatttcctcggtgtagttatct60c61<210>17<211>65<212>dna<213>人工合成<400>17tcgagcctgttcttaagacgtgatttttcaagagaaaatcacgtcttaagaacaggtttt60ttgat65<210>18<211>61<212>dna<213>人工合成<400>18actaaaaaacctgttcttaagacgtgattttctcttgaaaaatcacgtcttaagaacagg60c61<210>19<211>65<212>dna<213>人工合成<400>19tcgagtcctgtcctgctattgcattattcaagagataatgcaatagcaggacaggatttt60ttgat65<210>20<211>61<212>dna<213>人工合成<400>20actaaaaaatcctgtcctgctattgcattatctcttgaataatgcaatagcaggacagga60c61<210>21<211>19<212>dna<213>人工合成<400>21ccgtggcaaactggtactt19<210>22<211>20<212>dna<213>人工合成<400>22gacgccaacatagaccacct20<210>23<211>18<212>dna<213>人工合成<400>23ccaggtggtctcctctga18<210>24<211>19<212>dna<213>人工合成<400>24gctgtagccaaatcgttgt19当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1