一种3-烷氧基-4-喹啉酮衍生物制备方法与流程
本发明涉及医药合成及抗癌药物技术领域,更具体地,涉及一种3-烷氧基-4-喹啉酮衍生物的制备方法。
技术背景
3-烷氧基-4-喹啉酮骨架结构广泛存在于天然产物和一些常见的药物中,其具有很好的生物活性作用,例如,具有很好的抗肿瘤、治疗hiv感染、抗真菌感染等作用(j.nat.prod.2014,77,183-187;j.nat.prod.2016,79,300-307等)。其中,3-烷氧基-4-喹啉酮是非常普遍的药效团,例如天然产物waltherionec,waltherioned和leiokininea等。经典的合成方法具有通用性和简单性,但这些合成具有相当大的缺点,例如苛刻的反应条件和高酸性介质,合成步骤长(例如:org.lett.2018,20,5058-5061),这使得将产物与粗混合物分离变得繁琐。此外,这些反应通常产生区域异构体的混合物,也存在难以分离的问题。
因此,对该类型结构化合物高效合成方法的开发具有重要的应用价值;同时,该制备方法反应步骤少,操作简单安全,成本低,具有高原子经济性,高选择性,产物结构多样的优势。
技术实现要素:
本发明的目的在于克服现有技术中喹啉酮类化合物制备时合成步骤长、反应条件和分离过程复杂等问题,提供一种3-烷氧基-4-喹啉酮类化合物高效合成新方法。
本发明提供的3-烷氧基-4-喹啉酮类化合物中含有3-烷氧基喹啉药效团,具有很好的生物活性(如抗癌、抗hiv和抗真菌),可以作为重要的化工或医药的中间体。该3-烷氧基-4-喹啉酮类化合物是强效抗癌药物和抗癌药物的关键骨架结构,在制备抗癌药物的领域中具有很广阔的应用前景。
在研究前期中,利用类似的成环策略,高效合成了一类含3-卤代-4-烷氧基喹啉衍生物(专利201811353314.4)并在抗癌活性分子合成研究中得到应用。该发明在进一步优化的条件下,利用类似的关环策略,通过与醇类化合物新的终止反应,提供上述3-烷氧基-4-喹啉酮类化合物的制备方法。
本发明的另一目的在于,提供上述3-烷氧基-4-喹啉酮类化合物在抗肿瘤、抗hiv感染、抗真菌感染的药物中的应用。
为解决上述技术问题,本发明采用的技术方案是:
一种3-烷氧基-4-喹啉酮衍生物的制备方法,将
所述衍生物的结构如式(ⅰ)所示:
其中,所述r1为烷基、苯、取代苯基、萘基;
r2为c1~8烷基;
ar为苯、取代苯基。取代苯基中取代基为氢、卤基或烷氧基。
反应式如下所示:
本发明所述化合物利用简单易得的炔烃为原料,以稳定高效的金属为催化剂,利用廉价的醇为底物和反应溶剂,经过一步反应即可制备得到目标产物。
优选地,醇类化合物为c1~8烷基醇。
优选地,其中
优选地,反应的时间为3~20h;温度为0~80摄氏度。
优选地,所述催化剂为对甲苯磺酸、氯化金、三氯化金、六氟锑酸银、烯丙基二氯化钯、三氟甲磺酸铜、三氟甲磺酸亚铜或六氟膦铜中的一种或多种。
更优选地,所述金属催化剂为氯化金、三氯化金、六氟锑酸银中的一种或多种。
本发明同时提供一种3-烷氧基-4-喹啉酮衍生物,所述衍生物的结构如式(ⅰ)所示:
所述r1为甲基、丙基、苯基、4-三氟甲基苯基或1-萘基;
r2为甲基、异戊基或(s)-(-)-β-香茅醇基;
ar为苯、8-甲氧基-苯基、8-甲基-苯基、7-氟-苯基、7-氯-苯基或7-溴-苯基。
优选地,所述衍生物的结构如下之一所示:
本发明同时还提供上述3-烷氧基-4-喹啉酮衍生物在制备抗肿瘤、抗hiv感染、抗真菌感染的药物中的应用。
与现有技术相比,本发明具有如下优点:
本发明提供的制备方法反应步骤少,操作简单安全,成本低,产生废物少,具有高原子经济性,高选择性,高收率、产物结构多样的优势,对具有很好的生物活性(如抗癌、抗hiv和抗真菌)的3-烷氧基-4-喹啉酮类化合物提供了一种高效合成方法,具有重要的应用价值。
附图说明
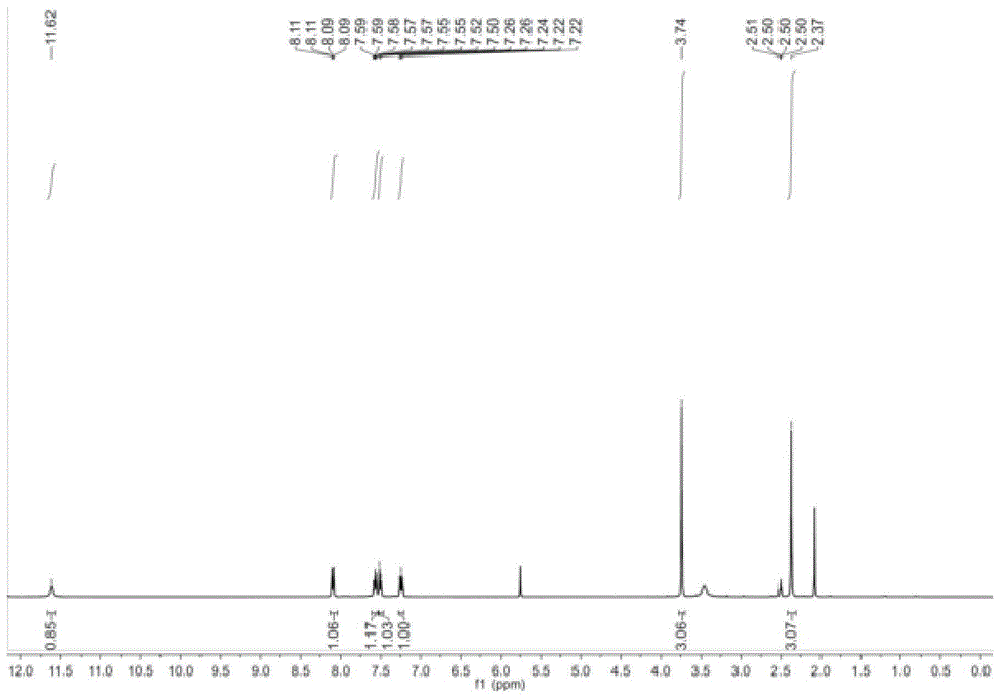
图1是化合物1的1hnmr图谱。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面结合具体实施例对本发明的技术方案进行详细的描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它实施方式,都属于本发明所保护的范围。
除特殊说明,本实施例、实验例中所用的设备均为常规实验设备,所用的材料、试剂无特殊说明均为市售得到,无特殊说明的实验方法也为常规实验方法。
化合物i-1至i-12的制备:
实施例1
反应式如下:
将金属催化剂aucl(0.01mmol),1a(0.2mmol)和甲醇2a(1.0ml)依次加入到反应瓶中,室温反应8小时,减压浓缩除去溶剂,用体积比为1∶(15~40)的甲醇和二氯甲烷的混合溶液进行柱层析。得到纯的3-烷氧基-4-喹啉酮类化合物i-1,黄色固体,产率为90%。
化合物i-1的谱图数据:1hnmr(400mhz,dmso-d6)(δ,ppm)11.62(s,1h),8.11–8.09(m,1h),7.59–7.55(m,1h),7.51(d,j=8.3hz,1h),7.28–7.21(m,1h),3.74(s,3h),2.37(s,3h);13cnmr(100mhz,dmso-d6)δ171.0,141.9,139.6,138.3,130.9,125.5,124.8,122.1,117.7,58.9,14.4。
实施例2
反应式如下:
将金属催化剂aucl3(0.02mmol),1b(0.2mmol)和甲醇2a(1.0ml)依次加入到反应瓶中,室温反应10小时,减压浓缩除去溶剂,用体积比为1∶(15~40)的乙酸乙酯和石油醚的混合溶液进行柱层析。得到纯的3-烷氧基-4-喹啉酮类化合物i-2,黄色固体,产率为85%。
化合物i-2的谱图数据:1hnmr(400mhz,dmso-d6)(δ,ppm)10.97(s,1h),7.65(d,j=3.0hz,1h),7.18(d,j=6.6hz,2h),3.98(s,3h),3.72(s,3h),2.41(s,3h);13cnmr(100mhz,dmso-d6)δ170.7,148.2,141.9,140.1,129.2,126.5,122.1,116.1,110.2,58.8,56.1,14.1。
实施例3
反应式如下:
将金属催化剂agsbf6(0.01mmol),1c(0.2mmol)和甲醇2a(1.0ml)依次加入到反应瓶中,室温反应20小时,减压浓缩除去溶剂,用体积比为1∶(15~40)的甲醇和二氯甲烷的混合溶液进行柱层析。得到纯的3-烷氧基-4-喹啉酮类化合物i-3,黄色固体,产率为45%。
化合物i-3的谱图数据:1hnmr(400mhz,dmso-d6)(δ,ppm)10.29(s,1h),8.05–7.89(m,1h),7.47–7.40(m,1h),7.17–7.13(m,1h),3.73(s,3h),2.52(s,3h),2.45(s,3h);13cnmr(100mhz,dmso-d6)δ171.2,142.2,139.6,137.1,131.8,125.8,125.7,122.9,121.9,58.8,17.6,14.2。
实施例4
反应式如下:
将催化剂tsoh(0.02mmol),1d(0.2mmol)和甲醇2a(1.0ml)依次加入到反应瓶中,60℃反应18小时,减压浓缩除去溶剂,用体积比为1∶(15~40)的甲醇和二氯甲烷的混合溶液进行柱层析。得到纯的3-烷氧基-4-喹啉酮类化合物i-4,黄色固体,产率为66%。
化合物i-4的谱图数据:1hnmr(400mhz,dmso-d6)(δ,ppm)11.61(s,1h),8.14–8.10(m,1h),7.30–6.99(m,2h),3.72(s,3h),2.34(s,3h);13cnmr(100mhz,dmso-d6)δ170.8,163.5(d,j=246.9hz),142.3,139.7,139.4(d,j=12.6hz),128.2(d,j=10.6hz),122.5,111.2(d,j=23.6hz),102.6(d,j=25.0hz),59.0,14.4;19fnmr(376mhz,dmso-d6)δ-109.1。
实施例5
反应式如下:
将金属催化剂cu(otf)2(0.01mmol),1e(0.2mmol)和甲醇2a(1.0ml)依次加入到反应瓶中,80℃反应20小时,减压浓缩除去溶剂,用体积比为1∶(15~40)的甲醇和二氯甲烷的混合溶液进行柱层析。得到纯的3-烷氧基-4-喹啉酮类化合物i-5,黄色固体,产率为62%。
化合物i-5的谱图数据:1hnmr(400mhz,dmso-d6)(δ,ppm)11.64(s,1h),8.07(d,j=8.7hz,1h),7.50(d,j=2.0hz,1h),7.26–7.24(m,1h),3.73(s,3h),2.35(s,3h);13cnmr(100mhz,dmso-d6)δ170.7,142.4,140.0,138.9,135.5,127.2,124.1,122.6,116.7,59.0,14.4。
实施例6
反应式如下:
将金属催化剂aucl3(0.01mmol),1f(0.2mmol)和甲醇2a(1.0ml)依次加入到反应瓶中,40℃反应10小时,减压浓缩除去溶剂,用体积比为1∶(15~40)的甲醇和二氯甲烷的混合溶液进行柱层析。得到纯的3-烷氧基-4-喹啉酮类化合物i-6,黄色固体,产率为80%。
化合物i-6的谱图数据:1hnmr(400mhz,dmso-d6)(δ,ppm)11.64(s,1h),8.01–7.99(d,j=8.5hz,1h),7.67(d,j=1.7hz,1h),7.38–7.35(m,1h),3.73(s,3h),2.35(s,3h);13cnmr(100mhz,dmso-d6)δ170.6,142.3,139.9,139.1,127.2,125.2,124.3,124.2,119.8,58.9,14.4。
实施例7
反应式如下:
将金属催化剂aucl3(0.005mmol),1g(0.2mmol)和甲醇2a(1.0ml)依次加入到反应瓶中,室温反应10小时,减压浓缩除去溶剂,用体积比为1∶(15~40)的甲醇和二氯甲烷的混合溶液进行柱层析。得到纯的3-烷氧基-4-喹啉酮类化合物i-7,黄色固体,产率为83%。
化合物i-7的谱图数据:1hnmr(400mhz,dmso-d6)(δ,ppm)11.55(s,1h),8.18–8.09(m,1h),7.64–7.55(m,2h),7.25–7.25(m,1h),3.80(s,3h),2.76–2.67(m,2h),1.77–1.65(m,2h),0.97(t,j=7.4hz,3h);13cnmr(100mhz,dmso-d6)δ171.2,145.3,139.4,138.3,130.9,125.4,124.8,122.1,117.8,59.2,30.2,21.9,13.7。
实施例8
反应式如下:
将金属催化剂aucl3(0.01mmol),1h(0.2mmol)和甲醇2a(1.0ml)依次加入到反应瓶中,室温反应10小时,减压浓缩除去溶剂,用体积比为1∶(15~40)的甲醇和二氯甲烷的混合溶液进行柱层析。得到纯的3-烷氧基-4-喹啉酮类化合物i-8,黄色固体,产率为88%。
化合物i-8的谱图数据:1hnmr(400mhz,dmso-d6)(δ,ppm)11.69(s,1h),8.18–8.15(m,1h),7.72–7.60(m,4h),7.60–7.53(m,3h),7.32–7.28(m,1h),3.67(s,3h);13cnmr(100mhz,dmso-d6)δ172.1,142.4,138.9,138.6,132.2,131.1,129.5,129.0,128.2,125.4,124.6,122.4,118.3,59.2。
实施例9
反应式如下:
将金属催化剂aucl3(0.01mmol),1i(0.2mmol)和甲醇2a(5.0ml)依次加入到反应瓶中,室温反应10小时,减压浓缩除去溶剂,用体积比为1∶(15~40)的甲醇和二氯甲烷的混合溶液进行柱层析。得到纯的3-烷氧基-4-喹啉酮类化合物i-9,黄色固体,产率为35%。
化合物i-9的谱图数据:1hnmr(400mhz,dmso-d6)(δ,ppm)11.79(s,1h),8.19–8.17(m,1h),7.97–7.89(comp,4h),7.71–7.61(m,2h),7.34–7.30(m,1h),3.71(s,3h);13cnmr(100mhz,dmso-d6)δ172.4,141.1,139.3,138.8,136.3,131.6,130.3,130.0(q,j=32.1hz),128.0(q,j=237.1hz),125.7,125.31(q,j=3.6hz),124.9,122.8,118.5,59.5;19fnmr(376mhz,dmso-d6)δ-61.3。
实施例10
反应式如下:
将金属催化剂aucl3(0.01mmol),1j(0.2mmol)和甲醇2a(10.0ml)依次加入到反应瓶中,室温反应15小时,减压浓缩除去溶剂,用体积比为1∶(15~40)的甲醇和二氯甲烷的混合溶液进行柱层析。得到纯的3-烷氧基-4-喹啉酮类化合物i-10,黄色固体,产率为68%。
化合物i-10的谱图数据:1hnmr(400mhz,dmso-d6)(δ,ppm)11.90(s,1h),8.27–8.22(m,1h),8.15–8.12(m,1h),8.08–8.06(m,1h),7.71–7.67(m,2h),7.66–7.57(comp,4h),7.57–7.52(m,1h),7.37–7.33(m,1h),3.55(s,3h);13cnmr(100mhz,dmso-d6)δ172.0,141.5,140.1,138.7,133.0,131.6,130.8,130.3,129.6,128.3,127.4,127.0,126.4,125.9,125.3,125.1,124.9,122.5,118.3,59.2。
实施例11
反应式如下:
将金属催化剂aucl3(0.01mmol),1a(0.2mmol)和甲醇2b(1.5ml)依次加入到反应瓶中,室温反应10小时,减压浓缩除去溶剂,用体积比为1∶(15~40)的甲醇和二氯甲烷的混合溶液进行柱层析。得到纯的3-烷氧基-4-喹啉酮类化合物i-11,黄色固体,产率为55%。
化合物i-11的谱图数据:1hnmr(400mhz,dmso-d6)(δ,ppm)11.52(s,1h),8.09–8.07(m,1h),7.59–7.55(m,1h),7.50–7.48(m,1h),7.22(d,j=7.4hz,1h),3.99(t,j=6.7hz,2h),2.37(s,3h),1.82–1.73(m,1h),1.55(q,j=6.8hz,2h),0.92(d,j=6.7hz,6h);13cnmr(100mhz,dmso-d6)δ171.2,141.7,138.6,138.2,130.8,125.4,124.8,122.0,117.6,69.2,38.6,24.5,22.6,14.4。
实施例12
反应式如下:
将金属催化剂aucl3(0.01mmol),1a(0.2mmol)和甲醇2c(0.5ml)依次加入到反应瓶中,室温反应10小时,减压浓缩除去溶剂,用体积比为1∶(15~40)的甲醇和二氯甲烷的混合溶液进行柱层析。得到纯的3-烷氧基-4-喹啉酮类化合物i-12,黄色固体,产率为45%。
化合物i-12的谱图数据:1hnmr(400mhz,dmso-d6)(δ,ppm)11.53(s,1h),8.09–8.07(m,1h),7.59–7.55(m,1h),7.50–7.47(m,1h),7.25–7.21(m,1h),5.13–5.04(m,1h),4.02–3.98(m,2h),2.36(s,3h),2.02–2.19(m,2h),1.74–1.64(m,2h),1.63(d,j=1.4hz,3h),1.56(d,j=1.4hz,3h),1.50–1.28(comp,3h),1.24–1.11(m,2h),0.91(d,j=6.5hz,3h);13cnmr100mhz,dmso-d6)δ171.2,141.7,138.6,138.2,130.8,130.5,125.4,124.9,124.7,122.0,117.6,69.0,36.8,36.7,28.8,25.5,25.0,19.4,17.5,14.4。
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,对于本领域的普通技术人员来说,在上述说明及思路的基础上还可以做出其它不同形式的变化或变动,这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!