一种生物可降解的血管支架材料的制备方法与流程
本发明属于医用材料
技术领域:
,具体涉及一种生物可降解的血管支架材料的制备方法。
背景技术:
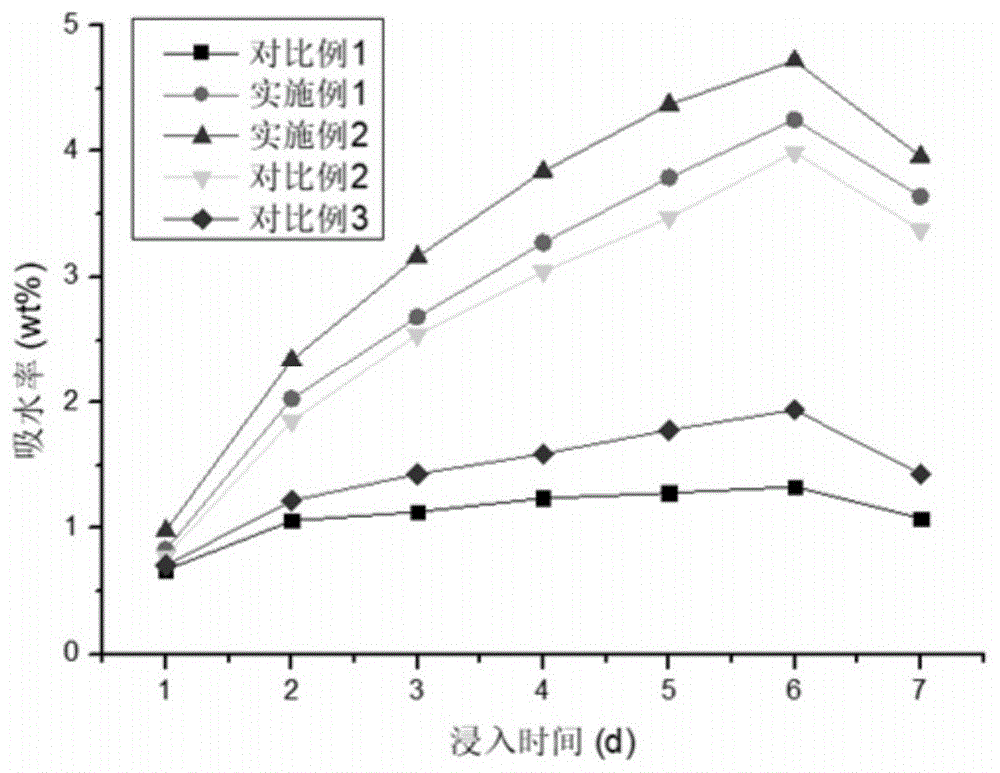
:心血管病的死亡率高于肿瘤和其他疾病,占居民疾病死亡构成的40%以上,且心血管病患病率及死亡率呈不断上升趋势,在我国心血管疾病已被列为重大公共卫生问题。药物治疗和手术治疗是治疗心脑血管疾病的传统方法。药物治疗是指通过药物降低血液粘度,从而提高血液流动性来治疗心脑血管疾病,但药物治疗周期长、见效慢,且对重症患者治疗效果较差;手术治疗主要指冠脉搭桥手术,该方法给患者带来的创伤较大,术后恢复期长,价格昂贵,同时手术难度大,且部分患者因自身体质较差不能承受该手术。20年前,美国食品和药物管理局(fda)批准了用于主动脉瘤的人工血管内支架,从此腔内介入治疗的飞速发展改变了血管外科的手术方式。血管支架以恢复血管血流正常流动为目标,在血管病变位置处置入内支架以支撑血管、减少血管弹性回缩及血管再塑,在治疗血管狭窄类疾病的过程中,血管支架力学性能的好坏对治疗效果起到了决定性的作用。血管支架作为异物,会引起血管壁长期炎症反应,导致支架术后远期血栓形成和支架内再狭窄,治疗完成后,便不再需要血管支撑物,可降解的材料引起人们关注。聚乳酸在体内能水解为乳酸,参与人体代谢,不存在生理排异反应,最终降解产物为二氧化碳和水,并且具有好的生物相容性和力学性能,是目前可降解支架中主流的材料。但聚乳酸在医疗中应用的同时遇到如下问题:(1)聚乳酸中有大量的酯键,亲水性弱,在作为组织工程材料以及亲水性药物如蛋白质,多肽的载体材料时,严重影响了它与细胞和药物的相容性;(2)聚乳酸的降解源于高分子链上酯键的水解,酯键的断裂产生了大量的羧酸,羧酸的大量积累使得生物体局部酸度过大而出现炎症,局部严重积水等问题,同时大量的羧酸会产生自催化降解效应,使降解速率难以控制,;(3)聚乳酸为线型共聚物,其相对分子量分布过宽,热变形温度低,抗冲击性差,脆性高,难以达到要求的强度。技术实现要素:本发明的目的在于提供一种亲水性好,自降解减弱,具有较好的柔性的生聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物。本发明为实现上述目的所采取的技术方案为:本发明的一个目的在于提供一种聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物材料,其具有下式(1)所具有的结构式:n为160-1500,m为150-1500。本发明聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物中,聚葡萄糖酸-羟基乙酸的引入可降低聚乳酸的结晶度,葡萄糖酸中含有未反应的羟基,羟基具有亲水性,而共聚物中含有大量葡萄糖酸片段,提高了亲水性;在聚乳酸中引入了葡萄糖酸的长链,聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物的柔性得到提高,脆性减弱;此外,共聚物端羧基是引起共聚物酯键降解的重要原因,通过聚葡萄糖酸-羟基乙酸的引入,减少了共聚物中酯键数量,同样降低了酸根与酯键的碰撞概率,葡萄糖酸中的羟基与端羧基可以形成分子间氢键,减弱羧基的反应性。总之,本发明聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物的亲水性好,自降解减弱,具有较好的柔性。作为优选,上述聚葡萄糖酸-羟基乙酸的重均分子量在40-375kda。作为优选,上述聚乳酸的重均分子量在10-120kda。作为优选,上述聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物的重均分子量在50-390kda。本发明的另一个目的在于提供一种聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物材料在制备医用材料中的用途。优选的,该医用材料为生物可降解的血管支架材料。本发明的另一个目的在于提供一种生物可降解的血管支架材料的制备方法,通过聚葡萄糖酸-羟基乙酸对聚乳酸的共聚,改进了聚乳酸的亲水性弱、自降解高、脆性高的问题,该制备方法具体包括:利用葡萄糖酸、羟基乙酸聚合获得聚葡萄糖酸-羟基乙酸;利用乳酸聚合获得聚乳酸;利用聚葡萄糖酸-羟基乙酸与聚乳酸聚合得到聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物。本发明通过在聚乳酸中引入聚葡萄糖酸-羟基乙酸,提高了聚乳酸的亲水性,降低了聚乳酸的脆性,减弱了聚乳酸的自降解性。对本发明而言,聚葡萄糖酸-羟基乙酸的制备条件为:将葡萄糖酸与羟基乙酸加入到溶剂中,加入脱水剂,加入催化剂,在100-160℃的温度下,搅拌回流反应9-24h,冷却后,缓慢加入甲醇溶液中搅拌沉淀,抽滤后20-50℃下真空干燥12-48小时,获得聚葡萄糖酸-羟基乙酸;上述溶剂为二甲基亚砜,上述脱水剂为n,n-二环己基碳二亚胺,上述催化剂为4-二甲氨基吡啶。葡萄糖酸上有羧基和羟基,羟基乙酸中有羟基和羧基,葡萄糖酸与羟基乙酸中的羟基和羧基可以综合反应形成酯键,酯综合反应为吸热反应,高温提供缩合的能量,催化剂4-二甲氨基吡啶降低葡萄糖酸与羟基乙酸的反应活化能,回流除去综合反应中生成的水分子,使反应向聚合方向移动,生成聚葡萄糖酸-羟基乙酸。作为优选,上述葡萄糖酸与羟基乙酸的添加比例为质量比1:0.5-3。对本发明而言,上述聚乳酸的制备条件为:称取乳酸加入烧瓶中,升高温度至100-150℃,压力为20-80kpa下除水30-150min,在氮气保护下,加入催化剂,1-5kpa下升温至170-180℃,反应6-15h。反应结束后,加入丙酮溶解产物,再将其倒入大量去离子水中,析出聚乳酸,洗涤3-5次,30-50℃下真空干燥24-48h;上述催化剂为氯化亚锡。乳酸分子中含有羟基和羧基,羟基和羧基综合反应生成乳酸二聚体,并且乳酸二聚体上同时仍存在未反应的羟基和羧基,可以继续进行综合瓜,乳酸缩聚反应为吸热反应,乳酸在高温下脱水生成低聚物,催化剂氯化亚锡降低反应活化能,提高了反应速率,由乳酸分子逐渐反应聚合生成长链聚乳酸。乳酸缩聚时有沸点较低的小分子水生成,聚合反应为可逆反应,通过减压除去缩聚产生的水分,使反应向生成聚乳酸的方向转移,最终得到聚乳酸。通过控制乳酸聚合反应的时间,可以得到小分子量的聚乳酸。对本发明而言,上述的聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物的制备条件为:将聚葡萄糖酸-羟基乙酸与聚乳酸加入到溶剂中,加入催化剂,加胶水剂,加入引发剂,在120-160℃的温度下,搅拌反应6-18h,冷却后,加入蒸馏水沉淀,沉淀用丙酮冲洗2-3次,随后蒸馏水冲洗2-3次得到聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物;上述溶剂为二甲基亚砜,上述脱水剂为n,n-二环己基碳二亚胺,上述催化剂为4-二甲氨基吡啶,上述引发剂为乙醇钾。乙醇钾为引发剂,聚合后形成含醇端基的乙醇酸-聚葡萄糖酸-羟基乙酸共聚物,该共聚物作为大分子引发剂,与聚乳酸共聚,形成聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物。聚葡萄糖酸-羟基乙酸的引入可降低聚乳酸的结晶度,葡萄糖酸中含有未反应的羟基,羟基具有亲水性,而共聚物中含有大量葡萄糖酸片段,提高了亲水性;聚葡萄糖酸-羟基乙酸与聚乳酸共聚后,在聚乳酸中引入了葡萄糖酸的长链,聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物的柔性得到提高,脆性减弱;共聚物端羧基是引起共聚物酯键降解的重要原因,通过聚葡萄糖酸-羟基乙酸的引入,减少了共聚物中酯键数量,同样降低了酸根与酯键的碰撞概率,葡萄糖酸中的羟基与端羧基可以形成分子间氢键,减弱羧基的反应性。作为优选,上述聚乳酸与聚葡萄糖酸-羟基乙酸的添加比例为质量比1:0.1-1。本发明的有益效果为:1)本发明聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物的亲水性好,自降解减弱,具有较好的柔性;2)本发明制备方法通过聚葡萄糖酸-羟基乙酸对聚乳酸共聚获得聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物,在聚乳酸中引入聚葡萄糖酸-羟基乙酸,提高了聚乳酸的亲水性,降低了聚乳酸的脆性,减弱了聚乳酸的自降解性,且原材料无毒无害,步骤少,操作流程简单。本发明采用了上述技术方案提供一种生物可降解的血管支架材料的制备方法,弥补了现有技术的不足,设计合理,操作方便。附图说明图1为本发明的所得材料的吸水率示意图;图2为本发明的所得材料的失重率示意图;图3为本发明的所得材料生物相容性示意图。具体实施方式体现发明特征与优点的典型实施例将在以下的说明中详细叙述。应理解的是本发明能够在不同的实施例上具有各种的变化,其皆不脱离本发明的范围,且其中的描述在本质上是当作说明之用,而非用以限制本发明。本发明一实施方式提供了葡萄糖酸和羟基乙酸制备的聚葡萄糖酸-羟基乙酸,葡萄糖酸与羟基乙酸的添加比例为质量比1:0.5-2,例如1:0.8、1:1、1:1.3、1:1.5、1:1.8,添加比例可以为质量比1:0.8-1.8。本发明的一实施例中获得了聚葡萄糖酸-羟基乙酸的分子量在40-375kda,可以为55、90、130、235、350kda。本发明的一实施例中获得了聚乳酸的分子量在10-120kda,例如20、50、80、100、110kda。本发明的一实施例中获得聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物的分子量在50-390kda,例如70、90、130、180、230、280、350、380kda。本发明的一实施例中,聚乳酸与聚葡萄糖酸-羟基乙酸的添加比例为质量比1:0.1-1,例如1:0.2、1:0.5、1:0.7、1:0.9,添加比例可以为1:0.2-0.9。本发明的一实施例中提供了明胶处理,添加量为为1-10wt%,例如2、3、5、7、9wt%等,明胶使用量可以为2-9wt%。下面,结合具体实施例对本发明一实施方式的一种生物可降解的血管支架材料的制备方法做进一步说明。实施例1:一种生物可降解的血管支架材料的制备方法,包括:(1)聚葡萄糖酸-羟基乙酸的制备:将葡萄糖酸与羟基乙酸加入到溶剂中,加入脱水剂,加入催化剂,在140℃的温度下,搅拌回流反应12h后获得聚葡萄糖酸-羟基乙酸;上述溶剂为二甲基亚砜,上述脱水剂为n,n-二环己基碳二亚胺,上述催化剂为4-二甲氨基吡啶;(2)聚乳酸的制备:称取乳酸加入烧瓶中,升高温度至120℃,压力为60kpa下除水60min,在氮气保护下,加入催化剂,3kpa下升温至170℃,反应8h。反应结束后,加入丙酮溶解产物,再将其倒入大量去离子水中,析出聚乳酸,洗涤3次,40℃下真空干燥24h;上述催化剂为氯化亚锡;(3)聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物的制备:将聚葡萄糖酸-羟基乙酸与聚乳酸加入到溶剂中,加入催化剂,加胶水剂,加入引发剂,在150℃的温度下,搅拌反应12h,冷却后,加入蒸馏水沉淀,沉淀用丙酮冲洗2次,随后蒸馏水冲洗2次得到聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物;上述溶剂为二甲基亚砜,上述脱水剂为n,n-二环己基碳二亚胺,上述催化剂为4-二甲氨基吡啶,上述引发剂为乙醇钾。实施例2:一种生物可降解的血管支架材料的制备方法,包括:(1)聚葡萄糖酸-羟基乙酸的制备:将葡萄糖酸与羟基乙酸加入到溶剂中,加入脱水剂,加入催化剂,在140℃的温度下,搅拌回流反应12h后获得聚葡萄糖酸-羟基乙酸;所述溶剂为二甲基亚砜,所述脱水剂为n,n-二环己基碳二亚胺,所述催化剂为4-二甲氨基吡啶。(2)聚乳酸的制备:称取乳酸加入烧瓶中,升高温度至120℃,压力为60kpa下除水60min,在氮气保护下,加入催化剂,3kpa下升温至170℃,反应8h。反应结束后,加入丙酮溶解产物,再将其倒入大量去离子水中,析出聚乳酸,洗涤3次,40℃下真空干燥24h;上述催化剂为氯化亚锡。(3)聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物的制备:将聚葡萄糖酸-羟基乙酸与聚乳酸加入到溶剂中,加入催化剂,加胶水剂,加入引发剂,在150℃的温度下,搅拌反应12h,冷却后,加入蒸馏水沉淀,沉淀用丙酮冲洗2次,随后蒸馏水冲洗2次得到聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物;上述溶剂为二甲基亚砜,上述脱水剂为n,n-二环己基碳二亚胺,上述催化剂为4-二甲氨基吡啶,上述引发剂为乙醇钾。(4)明胶修饰聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物的制备条件为:明胶溶于50-90℃的热水中,加入聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物,搅拌10-60min后,冷冻干燥得到明胶修饰聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物。明胶中含有羟基、羧基和醛基,明胶羧基与聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物中的羟基形成分子间氢键,吸附在共聚物上,多重分子以氢键结合,明胶成分中含有氨基酸形成的肽键,与生物体相溶,提高聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物的生物相容性。明胶和聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物的重量比为1:1-10,该重量比范围内明胶与聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物混合得到的血管支架材料的生物相容性较佳;于本实施例中,明胶和聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物的重量比为1:5,具体条件为:明胶溶于60℃的热水中,加入聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物,搅拌30min后,冷冻干燥得到明胶修饰聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物。对比例1:本对比例与实施例1相比,仅有步骤(2),聚乳酸的制备条件为:称取乳酸加入烧瓶中,升高温度至120℃,压力为60kpa下除水60min,在氮气保护下,加入催化剂,3kpa下升温至170℃,反应36h。反应结束后,加入丙酮溶解产物,再将其倒入大量去离子水中,析出聚乳酸,洗涤3次,40℃下真空干燥24h;上述催化剂为氯化亚锡。通过长时间的聚合反应,获得大分子量的聚乳酸。对比例2:本对比例与实施例1相比,步骤(3)中葡萄糖酸与聚乳酸生成聚葡萄糖酸-聚乳酸共聚物。对比例3:本对比例与实施例1相比,步骤(3)中羟基乙酸与聚乳酸生成聚羟基乙酸-聚乳酸共聚物。试验例11.血管支架材料的吸水率测定精密称取一定量的已干燥至恒重的聚乳酸和实施例、对比例产物的样品,记为w0,随后将其置于小瓶中,并标号,各称取8ml的pbs(ph=7.4,0.1m)到小瓶中,密封后,将其放在恒温箱(37.0±1℃)中,测试时间为一周,每天取一次样,取样时,用滤纸将材料表面的水分吸干后称重,记为wi。吸水率(waterabsorbed)的计算公式为:吸水率(wt%)=wi-w0/w0×100%。血管支架材料的吸水率测定结果如图1所示,可以看出:实施例1与对比例1相比,实施例1所得产物的吸水率大于聚乳酸,表明葡萄糖酸具有亲水性,与水分子形成氢键,增大了实施例1制得的血管支架材料的吸水性能;对比例1与对比例2相比,葡萄糖酸提高了聚乳酸的吸水性;对比例1与对比例3相比,羟基乙酸对聚乳酸的吸水性也有提高;此外,实施例2制得的血管支架材料的吸水性能优于实施例1,这说明明胶和聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物的混合,能够提高血管支架材料的吸水性能。2.血管支架材料的降解性能测试材料失重率的测定:取一定量的实施例与对比例产物,精密称重,记为w0,将其置于小瓶中,称取8ml的pbs(ph=7.4,0.1m)到小瓶中,密封后,将其放在37.0±1℃的恒温箱中,每隔一周取一次样,取出样品,将其放于干燥箱中,干燥至恒重,记为wj,考察材料的失重率随降解时间的变化规律。失重率(weightloss)的计算公式为:失重率(wt%)=w0-wj/w0×100%。血管支架材料的降解性能测试结果如图2所示,可以看出:实施例1与对比例1相比,实施例1所得血管支架材料的失重大于对比例1所得聚乳酸,这表明实施例1中葡萄糖酸的羟基与共聚物端羧基结合,降低了共聚物的降解;对比例1与对比例2相比,对比例2所得血管支架材料的失重率小于对比例1,表明葡萄糖酸起到减弱共聚物降解的作用;对比例1与对比例3相比,对比例2所得血管支架材料的失重率小于对比例1,羟基乙酸减弱了聚乳酸的降解性;此外,实施例2制得的血管支架材料的失重大于实施例1,这说明明胶和聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物的混合,能够影响血管支架材料的降解性。3.血管支架材料的力学性能表征由万能材料试验机(h5k-s,英国housefield)进行测定,根据astmd638-03,随机选取5条以上试样,规格8cm×1cm×0.01cm进行测试,夹具为5cm,拉伸速度为10mm/min。血管支架材料的力学性能表征如表1所示,可以看出:实施例1与对比例1相比,对比例1所得聚乳酸为脆性断裂,断裂延伸率仅有7.69%,实施例1的断裂延伸率达到了189.47%,这说明聚葡萄糖酸-羟基乙酸与聚乳酸共聚后,在聚乳酸中引入了葡萄糖酸的长链,聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物的柔性得到提高,脆性减弱,得到的血管支架材料具有较高的韧性。对比例3与对比例1相比,表明羟基乙酸的共聚对聚乳酸的韧性影响不大。而实施例2得到的血管支架材料的断裂延伸率和实施例1相差不明显,这说明明胶和聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物的混合,对得到的血管支架材料的断裂延伸率影响不大。表1血管支架材料的力学性能4.血管支架材料的生物相容性测试切割经不同方法处理过的实施例和对比例产物材料成片状(1×1cm2),将其放入24孔板中,每种类型材料放四片,分别加入一定数量的人冠状动脉内皮细胞(5×104个)以及1ml培养基,随后将24孔板放入细胞培养箱中进行培养,每2天换液一次并观察细胞生长情况,第5天的时候将支架材料取出,并用pbs清洗以除去未贴壁的细胞,然后一片置于倒置显微镜下观察细胞在支架材料表面生长情况,同时另三片用胰蛋白酶消化加培养基终止后制成细胞悬液,计算细胞数量并进行比对。血管支架材料的生物相容性测试结果如图3所示,可以看出:实施例2的细胞数最多,表明经过明胶处理后的聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物,生物相容性最好;实施例1与对比例1相比,实施例1所得材料上细数量大,表明聚葡萄糖酸-羟基乙酸提高聚乳酸的生物相容性;对比例2与对比例1的对比,表明葡萄糖酸提高生物相容性;对比例3与对比例1相比,表明羟基乙酸没有提高聚乳酸的生物相容性。试验例2:1.血管支架材料的重均分子量测定通过美国沃特斯515+2410的凝胶渗透色谱(gpc)测得的,溶剂为四氢呋喃。结果如表2所示,不同实施例和对比例所得到不同的重均分子量的材料。表2重均分子量实施例1实施例2对比例1对比例2对比例3重均分子量最小值/kda5070505050重均分子量最大值/kda3904302603502302.血管支架材料的核磁检测采用核磁共振波谱仪,以zgpr脉冲序列采集1hqnmr。测定参数:温度26.9℃;射频中心频率2820.99hz;弛豫时间20s;采集时间2s;扫描次数32次。精密量取供试品溶液0.05ml,内标溶液0.45ml,置于5mm核磁管中,混合均匀,同一份供试样品重复测试5次。聚乳酸的氢吸收峰:化学位移1.26ppm为甲基上氢的信号峰,化学位移2.23ppm为与羰基相连的碳氢的信号峰。聚葡萄糖酸-羟基乙酸的氢吸收峰:化学位移1.36ppm为聚合物中亚甲基的碳氢吸收峰,化学位移3.76ppm、3.62ppm为与羟基相连的碳氢的吸收峰,化学位移在4.26ppm、4.12ppm为羟基氢的吸收峰。聚(葡萄糖酸-羟基乙酸)-聚乳酸共聚物的氢吸收峰:化学位移1.2-1.5ppm为共聚物中甲基、亚甲基氢的吸收峰,化学位移2.35ppm为与羰基相连的碳氢的吸收峰,化学位移在3.5-3.8ppm为羟基相连碳上氢的吸收峰,化学位移在4.1-4.3ppm为羟基氢的吸收峰。上述实施例中的常规技术为本领域技术人员所知晓的现有技术,故在此不再详细赘述。以上实施方式仅用于说明本发明,而并非对本发明的限制,本领域的普通技术人员,在不脱离本发明的精神和范围的情况下,还可以做出各种变化和变型。因此,所有等同的技术方案也属于本发明的范畴,本发明的专利保护范围应由权利要求限定。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1