一种遗传编码的甲醛反应性非天然氨基酸、制备方法及其应用与流程
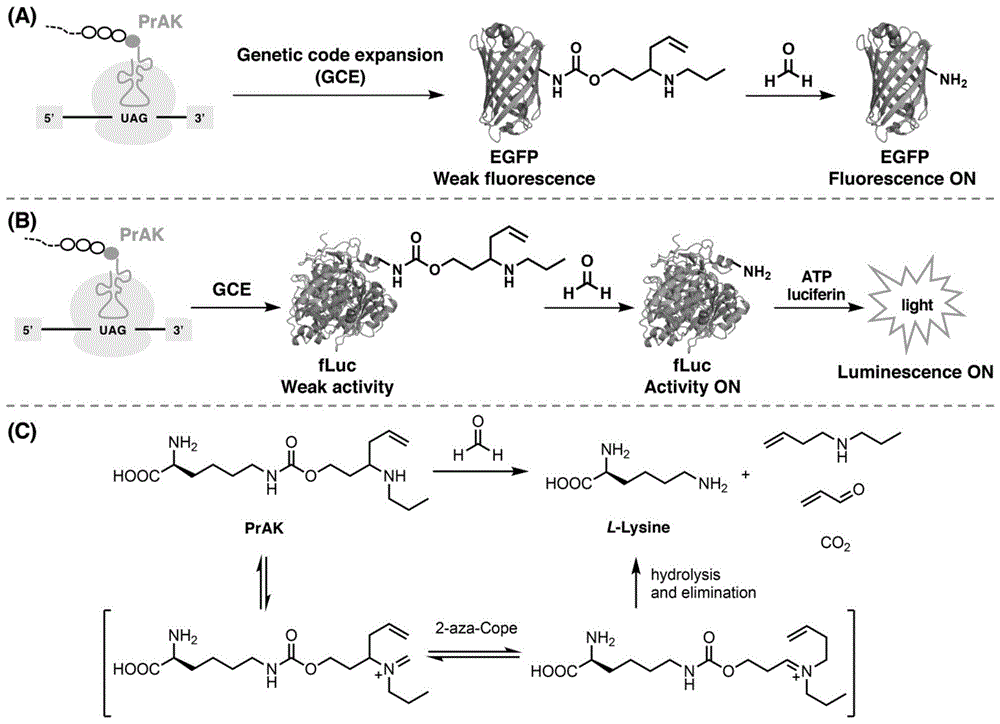
本发明涉及生物样品检测领域,具体涉及生物样品中甲醛的检测领域。技术背景甲醛是一种最简单的活性羰基化合物(reactivecarbonylspecies,rcs),是众所周知的广泛用于工业和生物医学的基本化学原料,也是一种常见的环境危害物和致癌物。但少为人知的是,在生物系统的一系列生物过程中,包括表观遗传调控、一碳单位代谢能和酒精解毒等,都能产生甲醛。例如,赖氨酸脱甲基化酶(lysine-specificdemethylase,lsd)或组蛋白脱甲基化酶(jmjcdomain-containinghistonedemethylases,jhdm)能通过催化组蛋白的去甲基化产生甲醛副产物;在一碳单位代谢中,对氨基脲敏感的胺氧化酶(semicarbazide-sensitiveamineoxidase,ssao)通过催化甲胺的去氨基化而生成甲醛;此外,在细胞内甲醇可以被醇脱氢酶1(alcoholdehydrogenase1,adh1)氧化生成甲醛。除了多种内源性甲醛来源外,生物体内也存在相应的分子机制来分解甲醛,例如通过醛脱氢酶(aldehydedehydrogenase2,aldh2)或醇脱氢酶3(alcoholdehydrogenase3,adh3,又名adh5)的作用将其氧化成甲酸。因此,在生理条件下,生物体内甲醛的浓度会维持在一个稳定的水平,如在血液或尿液中甲醛的浓度大概是0.1mm。而在大脑和细胞内大约是0.2-0.4mm。生理水平的内源性甲醛是重要的一碳来源,可用于制造重要的细胞结构单元并作为信号分子介导正常的生理过程。但是,已有报道表明机体内源性甲醛浓度的异常增高与一系列疾病的发生过程相关,包括癌症、阿尔茨海默症、中风和糖尿病。事实上,中度和重度痴呆患者的尿液中甲醛浓度水平是健康对照组的三倍多,达到0.3-0.4mm;而据估计,癌症组织中甲醛浓度可高达0.8mm。然而目前对甲醛在生理和病理过程中的确切作用仍知之甚少,这促使人们不断努力开发新的检测生物样品中甲醛的工具。虽然传统的检测方法包括比色分析、色谱法和放射检验法都可以用来测量血浆和匀浆组织中的甲醛水平,然而这些方法都需要复杂的样品处理过程,会破坏样本的完整性,限制了在活体生物样品中无创和原位检测甲醛的应用。光学探针,尤其是荧光探针和生物发光探针,具有非侵入性、实时性和时空成像能力等优点,已经成为甲醛检测的有力替代选择。因此,开发甲醛光学探针(包括甲醛荧光探针和生物发光探针)对于检测和成像生物样品中甲醛的含量,并揭示甲醛在生理和病理条件下的作用至关重要。在过去的几年里,一系列针对甲醛的小分子荧光探针和生物发光探针已经被开发出来。然而,基于蛋白质的遗传编码甲醛荧光探针和生物发光探针目前还鲜有报道。相比于小分子光学探针,基于蛋白质的遗传编码甲醛荧光探针和生物发光探针能以dna的形式引入活细胞或生物体内,具有独特的优势,如优越的细胞滞留性,细胞特异和亚细胞器特异靶向性,以及稳定持久的标记等。有鉴于此,本发明公开了一种遗传编码的甲醛反应性非天然氨基酸prak,将其位点特异地引入蛋白质,如增强绿色荧光蛋白(egfp)和萤火虫荧光素酶(fluc)中,分别用于构建基于蛋白质的遗传编码甲醛荧光探针和生物发光探针,选择性检测和成像生物样品中的甲醛。利用甲醛反应性非天然氨基酸prak构建遗传编码的甲醛荧光探针和生物发光探针的关键在于将其位点特异地插入蛋白质中。蛋白质通常由20种天然氨基酸组成。作为蛋白质合成的模板,mrna上的核苷酸(a,u,c,g)序列决定着蛋白质的氨基酸排列顺序。mrna上三个核苷酸组成一个三联体密码(tripletcode),决定一个氨基酸。而4种核苷酸a,u,c,g编码的三联体密码共有64个,其中61个用来编码20种标准氨基酸,另外3个:uaa,uag,uga通常为终止密码子,指导蛋白质翻译的终止。本领域已开发了一套“正交翻译系统”,能在原核和真核生物中将各种非天然氨基酸位点特异性地插入蛋白质。这一系统依赖于外源的、在体内多肽翻译期间识别合适的选择者密码子(如终止密码子uag,即对应dna上的tag),而将所需非天然氨基酸插入规定位置的正交蛋白质翻译组分。这一系统利用识别选择者密码子(如终止密码子uag,即对应dna上的tag)的正交trna(o-trna),进而相应的特异性正交氨酰基-trna合成酶(o-rs)用非天然氨基酸加载该o-trna。这些组分不与宿主生物中任何内源性trna、氨酰基-trna合成酶(rs)、天然氨基酸或编码天然氨基酸的密码子交叉反应(即它必须是正交的)。利用这种外源的、正交trna-rs配对能遗传编码大量结构各异的非天然氨基酸。本领域技术人员熟知如何利用适于制备含非天然氨基酸的蛋白质的“正交翻译系统”,以及产生正交翻译系统的通用方法。例如,参见国际公开号wo2002/086075,名为“产生正交trna-氨酰基-trna合成酶配对的方法和组合物”(methodsandcompositionfortheproductionoforthogonaltrna-aminoacyl-trnasynthetasepairs);wo2002/085923,名为“非天然氨基酸的体内掺入”(invivoincorporationofunnaturalaminoacids);wo2004/094593,名为“扩展真核生物遗传密码”(expandingtheeukaryoticgeneticcode);wo2005/019415,名为“用于体内掺入非天然氨基酸的正交翻译组分”(orthogonaltranslationcomponentsfortheinvivoincorporationofunnaturalaminoacids)。掺入非天然氨基酸的正交翻译系统及其产生和使用方法的其它讨论还可参见如下论文:wang和schultz,“扩展遗传密码”(expandingthegeneticcode),chem.commun.(camb.)1:1-11(2002);wang和schultz,“扩展遗传密码”(expandingthegeneticcode),angewandtechemieint.ed.44(1):34-66(2005);xie和schultz,“扩展遗传密码”(anexpandinggeneticcode),methods36(3):227-238(2005);xie和schultz,“将氨基酸加入遗传库”(addingaminoacidstothegeneticrepertoire),curr.opinioninchemicalbiology9(6):548-554(2005);wang等,“扩展遗传密码子”(expandingthegeneticcode),annu.rev.biophys.biomol.struct.35:225-249(2006);xie和schultz,“蛋白质的化学工具盒-扩展的遗传密码”(achemicaltoolkitforproteins-anexpandedgeneticcode),nat.rev.mol.cellbiol.7(10):775-782(2006)。技术实现要素:本发明的目的在于提供一种能与甲醛反应的非天然氨基酸(一种赖氨酸类似物),以及利用其构建基于蛋白质的遗传编码甲醛荧光探针或生物发光探针的方法。本发明设想合成一个具有甲醛反应性的非天然氨基酸(unnaturalaminoacid),特异性地插入到生物大分子荧光或生物发光蛋白,分别用来控制它们的荧光和生物发光(图1a、1b)。当不存在甲醛时,非天然氨基酸修饰的egfp和fluc突变体分别没有荧光和生物发光;当甲醛存在时,非天然氨基酸与甲醛反应恢复成关键的赖氨酸残基,导致其荧光和生物发光恢复(图1a、1b),从而实现甲醛检测。为实现上述目的,本发明提供如下技术方案:本发明提供一类能与甲醛反应的非天然氨基酸赖氨酸类似物,其结构通式如下所示:其中r为烷基;优选地,r为甲基、乙基、丙基或苄基。具体而言,此类非天然氨基酸是一种赖氨酸类似物,包含l-赖氨酸、一个与甲醛反应的高烯丙胺基团、以及一个氮取代烷基。其与甲醛发生加成反应并脱水生成亚胺正离子,接着发生2-氮杂柯普重排反应生成一种新的亚胺正离子,然后通过进一步水解和β-消除最终得到l-赖氨酸。本发明提供一种能与甲醛反应的非天然氨基酸赖氨酸类似物prak,其特征在于,所述非天然氨基酸prak结构式如下所示:具体而言,非天然氨基酸prak是一种赖氨酸类似物,包含l-赖氨酸、一个与甲醛反应的高烯丙胺基团、以及一个氮取代丙基。prak与甲醛发生加成反应并脱水生成亚胺正离子,接着发生2-氮杂柯普重排反应生成一种新的亚胺正离子,然后通过进一步水解和β-消除最终得到l-赖氨酸(如图1c所示)。本发明还提供了一种非天然氨基酸prak的化学合成方法,包括如下步骤:步骤1)羟基保护的3-羟基丙醛与丙胺和烯丙基硼酸频哪醇酯加成反应制备高烯丙基胺;步骤2)高烯丙基胺进行胺基保护,并脱除羟基保护基生成醇化合物;步骤3)醇化合物进行醇羟基活化,并与胺基保护的l-赖氨酸连接生成氨基甲酸酯化合物;步骤4)氨基甲酸酯化合物脱除胺基保护基生成非天然氨基酸prak。在一些实施方式中,步骤1)所述羟基保护基为对甲氧基苄基;在一些实施方式中,步骤2)所述胺基保护基为叔丁氧羰基(boc);在一些实施方式中,步骤3)所述活化是采用对硝基苯基氯甲酸酯活化醇羟基,所述胺基保护基为叔丁氧羰基(boc)或芴甲氧羰基(fmoc)。具体而言,对甲氧基苄基保护的3-羟基丙醛与丙胺和烯丙基硼酸频哪醇酯的加成反应生成高烯丙基胺,之后胺基用叔丁氧羰基(boc)保护,并脱除对甲氧基苄基保护基生成醇。紧接着,醇羟基用对硝基苯基氯甲酸酯活化,并与boc保护的l-赖氨酸反应连接生成氨基甲酸酯化合物。最后,boc保护基在酸性条件下被脱除生成非天然氨基酸prak,具体途径见图2。芴甲氧羰基(fmoc)保护的prak(fmoc-prak)可由同样的合成路线制备,如图3所示,即对硝基苯基氯甲酸酯活化的醇与fmoc保护的l-赖氨酸反应连接生成氨基甲酸酯化合物,并脱除boc保护基即制备获得fmoc-prak。类似地,r为甲基、乙基或苄基时的非天然氨基酸赖氨酸类似物也可由相似的合成方法制备。本发明还提供一种连接上述非天然氨基酸赖氨酸类似物prak的化合物。本发明还提供一种包含上述非天然氨基酸赖氨酸类似物prak的组合物。本发明还提供一种包含上述非天然氨基酸赖氨酸类似物prak的表达系统、翻译系统或细胞。本发明还提供一种生物大分子探针,其特征在于,生物大分子探针是在生物大分子特定位点引入上述非天然氨基酸赖氨酸类似物prak。在一些实施方式中,所述生物大分子探针为遗传编码的甲醛荧光探针和生物发光探针,其特征在于,包括在特定位点引入了上述的非天然氨基酸赖氨酸类似物prak的荧光蛋白和荧光素酶等生物大分子;优选的,所述荧光蛋白和荧光素酶等生物大分子为增强绿色荧光蛋白(egfp)和萤火虫荧光素酶(fluc);在一些实施方式中,所述增强绿色荧光蛋白(egfp)或萤火虫荧光素酶(fluc)的关键赖氨酸位点之一被特异引入非天然氨基酸prak;优选的,所述增强绿色荧光蛋白(egfp)的关键赖氨酸位点为k85;所述萤火虫荧光素酶(fluc)的关键赖氨酸位点为k529;更优选的,所述遗传编码的甲醛荧光探针或生物发光探针为egfp-k85prak和fluc-k529prak。本发明还提供一种包含上述生物大分子探针的组合物。本发明还提供一种包含上述生物大分子探针的表达系统、翻译系统或细胞。本发明还提供一种上述生物大分子或遗传编码的甲醛荧光探针或生物发光探针在样本成像或检测甲醛中的应用;在一些实施方式中,所述样本是生物样本;优选的,所述生物样本是活体实验动物,如小鼠、斑马鱼、线虫和果蝇;或者所述生物样本是哺乳动物细胞,例如人源hek293t细胞;在一些实施方式中,所述样本是体外或细胞外样本。本发明还提供一种上述非天然氨基酸赖氨酸类似物prak制备生物大分子探针的方法,其特征在于:将上述非天然氨基酸赖氨酸类似物prak向生物大分子定点引入,制备生物大分子探针。在一些实施方式中,所述生物大分子为遗传编码的甲醛荧光探针或生物发光探针,其特征在于:将前述非天然氨基酸赖氨酸类似物prak向荧光蛋白和荧光素酶等生物大分子定点引入,制备遗传编码的甲醛荧光探针或生物发光探针。具体而言,所述方法包括在宿主细胞中,在存在非天然氨基酸prak的条件下,共表达吡咯赖氨酰-trna合成酶基因、同源关联trna以及需引入非天然氨基酸prak的位点突变为琥珀终止密码子tag的荧光蛋白或荧光素酶基因;在一些实施方式中,进一步包括纯化步骤,通过纯化获得遗传编码的甲醛荧光探针或生物发光探针;优选的,通过亲和纯化制备在特定位点引入prak的荧光蛋白或荧光素酶蛋白;更优选的,通过本领域内熟知的ni2+柱或柱对标签蛋白进行亲和纯化。在一些实施方式中,所述宿主细胞为大肠杆菌细胞,同时向大肠杆菌中转化第一和第二表达载体;所述第一表达载体同时含有吡咯赖氨酰-trna合成酶基因及其同源关联trna,所述第二表达载体含有欲引入非天然氨基酸prak的、特定位点突变为琥珀终止密码子tag的荧光蛋白或荧光素酶基因。在宿主细胞内,特定位点突变为琥珀终止密码子tag的荧光蛋白或荧光素酶基因在翻译过程中,吡咯赖氨酰-trna合成酶基因及其同源关联trna能特异识别琥珀终止密码子tag,从而将非天然氨基酸prak位点特异地引入荧光蛋白或荧光素酶蛋白中。在宿主细胞内,新表达的吡咯赖氨酰-trna合成酶不以显著水平或者某些情况下不以可检测水平地用天然或非天然氨基酸加载内源性trna;另一方面,宿主细胞内源性氨酰基-trna合成酶不会用天然或非天然氨基酸加载新表达的与吡咯赖氨酰-trna合成酶的同源关联trna。在一个具体实施方式中,所述宿主细胞例如是大肠杆菌bl21(de3)。在一些实施方式中,优选地,所述非天然氨基酸prak的定点引入采用来自于马氏甲烷八叠球菌(methanosarcinamazei,简称为mm)的吡咯赖氨-trna合成酶(pylrs)活性突变体及其同源关联trna构成的正交翻译系统。更优选地,所述吡咯赖氨-trna合成酶活性突变体为在马氏甲烷八叠球菌(methanosarcinamazei)的野生型吡咯赖氨酰-trna合成酶(mmpylrs)基础上的y306a、l309a、y384f突变体,其命名为prakrs,其氨基酸序列如seqidno.1所示。在一些实施方式中,所述荧光蛋白为增强绿色荧光蛋白(egfp),通过前述“正交翻译系统”,其原第85位赖氨酸位点被特异地定点引入上述非天然氨基酸赖氨酸类似物prak。在一些实施方式中,所述荧光素酶为萤火虫荧光素酶(fluc),通过前述“正交翻译系统”,其原第529位赖氨酸位点被特异地定点引入上述非天然氨基酸赖氨酸类似物prak。本发明还提供一种上述非天然氨基酸赖氨酸类似物prak成像或检测生物样本中甲醛的方法,其特征在于:包括如下步骤:1)在生物样本中将所述非天然氨基酸赖氨酸类似物prak向荧光蛋白和荧光素酶等生物大分子定点引入,表达遗传编码的甲醛荧光探针或生物发光探针;2)利用遗传编码的甲醛荧光探针或生物发光探针检测生物样品中的甲醛。具体而言,所述方法包括在生物样本中、在存在非天然氨基酸prak的条件下,共表达吡咯赖氨酰-trna合成酶基因、同源关联trna以及需引入非天然氨基酸prak的位点突变为琥珀终止密码子tag的荧光蛋白或荧光素酶基因,从而在生物样本中表达在特定位点引入prak的荧光蛋白或荧光素酶蛋白,即遗传编码的甲醛荧光探针或生物发光探针。在一些实施方式中,所述生物样本同时转化进入了第一和第二表达载体;所述第一表达载体同时含有吡咯赖氨酰-trna合成酶基因及其同源关联trna,所述第二表达载体含有欲引入非天然氨基酸prak的、特定位点突变为琥珀终止密码子tag的荧光蛋白或荧光素酶基因。在生物样本内,特定位点突变为琥珀终止密码子tag的荧光蛋白或荧光素酶基因在翻译过程中,吡咯赖氨酰-trna合成酶基因及其同源关联trna能特异识别琥珀终止密码子tag,从而将非天然氨基酸prak位点特异地引入荧光蛋白或荧光素酶蛋白中。在生物样本内,新表达的吡咯赖氨酰-trna合成酶不以显著水平或者某些情况下不以可检测水平地用天然或非天然氨基酸加载内源性trna;另一方面,生物样本中内源性氨酰基-trna合成酶不会用天然或非天然氨基酸加载新表达的与吡咯赖氨酰-trna合成酶的同源关联trna。在一些实施方式中,所述生物样本是活体实验动物,如小鼠、斑马鱼、线虫和果蝇。在一些实施方式中,所述生物样本是哺乳动物细胞;在一个具体实施方式中,所述生物样本例如是人源hek293t细胞。在一些实施方式中,优选地,所述非天然氨基酸prak的定点引入采用来自于马氏甲烷八叠球菌(methanosarcinamazei)的吡咯赖氨-trna合成酶活性突变体及其同源关联trna构成的正交翻译系统。更优选地,所述吡咯赖氨-trna合成酶活性突变体为在马氏甲烷八叠球菌(methanosarcinamazei)的野生型吡咯赖氨酰-trna合成酶基础上的y306a、l309a、y384f突变体prakrs,其氨基酸序列如seqidno.1所示。在一些实施方式中,所述荧光蛋白为增强绿色荧光蛋白(egfp),通过前述“正交翻译系统”,其原第85位赖氨酸位点被特异地定点引入上述非天然氨基酸赖氨酸类似物prak。在一些实施方式中,所述荧光素酶为萤火虫荧光素酶(fluc),通过前述“正交翻译系统”,其原第529位赖氨酸位点被特异地定点引入上述非天然氨基酸赖氨酸类似物prak。本发明还提供一种上述吡咯赖氨酰trna合成酶prakrs及其编码基因,其氨基酸序列如seqidno.1所示。本发明还提供一种编码前述吡咯赖氨酰trna合成酶prakrs的基因。本发明还提供一种前述吡咯赖氨酰trna合成酶prakrs在向生物大分子中定点引入非天然氨基酸中的应用;优选的,所述非天然氨基酸为前述的非天然氨基酸prak;优选的,所述生物大分子为荧光蛋白或荧光素酶;更优选的,所述荧光蛋白或荧光素酶为增强绿色荧光蛋白(egfp)或萤火虫荧光素酶(fluc)。本发明还提供一种正交翻译系统,其特征在于,所述正交翻译系统是大肠杆菌细胞,包含前述的吡咯赖氨酰trna合成酶prakrs和相应的同源关联trna。本发明还提供一种在正交翻译系统中产生在所选位置含非天然氨基酸的蛋白质的方法,其特征在于,包括利用前述吡咯赖氨酰trna合成酶prakrs作为氨酰基-trna合成酶进行非天然氨基酸的引入,或利用前述正交翻译系统进行非天然氨基酸的引入。在一些实施方式中,所述方法引入前述非天然氨基酸prak,具体而言,所述方法包括在生物样本中、在存在非天然氨基酸prak的条件下,共表达上述吡咯赖氨酰-trna合成酶prakrs基因、同源关联trna以及需引入非天然氨基酸prak的位点突变为琥珀终止密码子tag的荧光蛋白或荧光素酶基因,从而在生物样本中表达在特定位点引入prak的荧光蛋白或荧光素酶蛋白,即遗传编码的甲醛荧光探针或生物发光探针。在一些实施方式中,所述生物样本同时转化进入了第一和第二表达载体;所述第一表达载体同时含有吡咯赖氨酰-trna合成酶基因及其同源关联trna,所述第二表达载体含有欲引入非天然氨基酸prak的、特定位点突变为琥珀终止密码子tag的荧光蛋白或荧光素酶基因。在生物样本内,特定位点突变为琥珀终止密码子tag的荧光蛋白或荧光素酶基因在翻译过程中,吡咯赖氨酰-trna合成酶prakrs基因及其同源关联trna能特异识别琥珀终止密码子tag,从而将非天然氨基酸prak位点特异地引入荧光蛋白或荧光素酶蛋白中。在生物样本内,新表达的吡咯赖氨酰-trna合成酶prakrs不以显著水平或者某些情况下不以可检测水平地用天然或非天然氨基酸加载内源性trna;另一方面,生物样本中内源性氨酰基-trna合成酶不会用天然或非天然氨基酸加载新表达的与吡咯赖氨酰-trna合成酶的同源关联trna。在一些实施方式中,所述生物样本是活体实验动物,如小鼠、斑马鱼、线虫和果蝇。在一些实施方式中,所述生物样本是哺乳动物细胞;在一个具体实施方式中,所述生物样本例如是人源hek293t细胞。在一些实施方式中,优选地,所述非天然氨基酸prak的定点引入采用来自于马氏甲烷八叠球菌(methanosarcinamazei)的吡咯赖氨-trna合成酶活性突变体及其同源关联trna构成的正交翻译系统。更优选地,所述吡咯赖氨-trna合成酶活性突变体为在马氏甲烷八叠球菌(methanosarcinamazei)的野生型吡咯赖氨酰-trna合成酶基础上的y306a、l309a、y384f突变体prakrs,其氨基酸序列如seqidno.1所示。在一些实施方式中,所述荧光蛋白为增强绿色荧光蛋白(egfp),通过前述正交翻译系统,其原第85位赖氨酸位点被特异地定点引入上述非天然氨基酸赖氨酸类似物prak。在一些实施方式中,所述荧光素酶为萤火虫荧光素酶(fluc),通过前述正交翻译系统,其原第529位赖氨酸位点被特异地定点引入上述非天然氨基酸赖氨酸类似物prak。相比于现有技术,本发明的有益效果在于:1)本发明制备的遗传编码的甲醛反应性非天然氨基酸prak能够特异性地插入到生物大分子荧光蛋白或生物发光蛋白,能够控制它们的荧光和生物发光。当不存在甲醛时,非天然氨基酸prak修饰的egfp和fluc突变体分别没有荧光和生物发光;当甲醛存在时,非天然氨基酸prak与甲醛反应恢复成关键的赖氨酸残基,致使其荧光和生物发光恢复,实现甲醛检测。2)本发明基于prak制备的探针能够将甲醛的2-氮杂柯普重排反应活性与位点特异性蛋白工程和调控结合起来,为生物相关浓度甲醛,而非其他潜在干扰分子,提供选择性荧光和生物发光增强响应;3)本发明制备的探针能够成像活细胞内的甲醛,由于这些探针具有可遗传编码的特点,为甲醛成像提供诸多优势,如稳定的标记、细胞内滞留的优势、易于细胞特异性或器官特异性靶向操作、以及易于引入活体组织等;4)本发明开发出吡咯赖氨酰trna合成酶突变体prakrs(y306a,l309a,y384f),能有效地将prak引入大分子荧光或生物发光蛋白中,制备反应型荧光探针和生物发光探针;5)本发明的赖氨酸类似物prak及其反应型荧光探针和生物发光探针对生物样本中甲醛的检测和成像,具有便捷性、无创性、实时性和可视化性等诸多优势。附图说明图1:基于prak定点引入的遗传编码甲醛(a)荧光探针和(b)生物发光探针原理以及(c)prak的结构及其与甲醛的2-氮杂柯普重排反应;图2:prak合成路线;图3:fmoc-prak合成路线;图4:lc-ms分析fmoc-prak与甲醛的反应:(a)fmoc-prak,(b)fmoc-prak和甲醛的反应混合物以及(c)fmoc-l-lys在254nm处的hplc图谱;(d)在(a)中显示的19.079分钟处hplc峰的质谱图;(e)在(b)中显示的18.365分钟处hplc峰的质谱图;(f)在(b)中显示的17.273分钟处hplc峰的质谱图;(g)在(c)中显示的17.225分钟处hplc峰的质谱图;图5:荧光光谱法筛选吡咯赖氨酰trna合成酶突变体在大肠杆菌中将prak插入到egfp-y39tag的结果图;图6:在大肠杆菌和哺乳动物细胞中prak位点特异性插入到egfp中结果图:(a)免疫印迹检测大肠杆菌egfp-y39tag中插入bock和prak,以考马斯亮蓝染色(cb)为上样量对照;bock为n(e)-boc-l-赖氨酸,是公认的野生型吡咯赖氨酰trna合成酶(mmpylrs)的优良底物;(b)免疫印迹检测大肠杆菌egfp-k85tag中插入prak,以考马斯亮蓝染色(cb)为上样量对照;(c)免疫印迹检测hek293t细胞egfp-y39tag和egfp-k85tag插入prak;图7:大肠杆菌中纯化的egfp-k85prak蛋白sds-page电泳图;图8:纯化的egfp-k85prak体外荧光检测甲醛:(a)egfp-k85prak(0.5μm)对不同浓度甲醛的荧光响应。(b)egfp-k85prak(0.5μm)对相关生物分子(2mm)的相对荧光响应(λem=510nm);egfp-k85prak与甲醛或相关生物分子在37℃共孵育1小时,在pbs(20mm,ph7.4)中检测荧光信号,激发波长为468nm;图9:纯化的egfp-k85prak进行甲醛的荧光体外检测图:(a)egfp-k85prak(0.5μm)对不同浓度甲醛的荧光响应;(b)egfp-k85prak(0.5μm)对甲醛荧光响应的线性关系;(c)egfp-k85prak(0.5μm)对低浓度甲醛的荧光响应。(d)egfp-k85prak(0.5μm)对100μm甲醛的荧光响应动力学;室温下在20mmpbs中468nm激发下,在510nm的最大发射强度下记录荧光强度;数据显示为平均荧光强度±标准偏差(n=3);使用graphpadprism中的单因素方差分析进行(c)中多个比较的统计分析,**p<0.01;图10:甲醛与egfp-k85prak反应的esi-ms验证图:(a)与甲醛反应后egfp-k85prak的分子量变化示意图;(b)在大肠杆菌中表达的egfp-k85prak蛋白的esi-ms谱。30,307.78da的分子量峰表明没有形成生色团的全长egfp-k85prak蛋白;(c)甲醛处理后egfp-k85prak蛋白的esi-ms谱;30,124.59da和29,993.23da的分子量峰表明甲醛反应可以生成天然赖氨酸残基;29,973.84da的分子量峰则表明egfp生色团的形成(-20da);图11:在表达egfp-k85prak的hek293t活细胞中检测甲醛的荧光共聚焦成像图:(a)用nahso3(1mm)预处理表达egfp-k85prak或egfp-k85bock的细胞,然后在成像前与甲醛(1mm)孵育1小时;(b)将表达egfp-k85prak的细胞与thfa(2mm)或5,10-me-thfa(1mm)孵育1小时,并进行荧光成像;细胞核用hoechst33342染色;图12:egfp-k85prak荧光检测活hek293t细胞中的甲醛:(a)在活细胞中egfp-k85prak对不同浓度的甲醛进行荧光成像,将表达egfp-k85prak的hek293t细胞在bss缓冲液中用不同浓度的甲醛处理1h,然后用共聚焦荧光显微镜成像;(b)相对于未经甲醛处理的hek293t细胞,经甲醛处理的平均荧光强度比较,数据显示为平均荧光强度±标准偏差(n=3);使用graphpadprism中的studentt检验对两个比较进行统计分析,****p<0.0001;图13:利用egfp-k85prak荧光检测活hek293t细胞中四氢叶酸(thfa)代谢产生的甲醛成像图:将表达egfp-k85prak的hek293t细胞在bss缓冲液中用不同浓度的thfa处理1h,然后用共聚焦荧光显微镜成像;图14:fluc-k529prak在大肠杆菌中的表达和纯化sds-page电泳图:(a)大肠杆菌中fluc-k529bock和fluc-k529prak表达的蛋白质免疫印迹分析:(b)纯化的fluc-k529bock和fluc-k529prak蛋白的sds-page凝胶分析;图15:在溶液和细胞中利用fluc-k529prak对甲醛进行生物发光分析检测:(a)纯化的fluc-k529prak(0.5μm)对不同浓度甲醛的生物发光响应;(b)(a)中所示数据的生物发光强度定量;(c)fluc-k529prak对活细胞中甲醛(0.5mm)的生物发光成像;(d)(c)中所示数据的生物发光强度定量;图16:利用fluc-k529prak对甲醛进行生物发光检测结果图:(a)fluc-k529prak(0.5μm)对不同浓度甲醛的生物发光响应;(b)fluc-k529prak(0.5μm)对低浓度甲醛的生物发光响应的线性关系;(c)fluc-k529prak(0.5μm)对250μm甲醛的生物发光响应的动力学;(d)fluc-k529prak(0.5μm)在500μm浓度下对相关生物物种的发光响应;在室温下20mmpbs中采集数据;数据显示为平均强度±标准偏差(n=3);使用graphpadprism中的单因素方差分析进行(b)中多个比较的统计分析,***p<0.001;图17:利用fluc-k529prak在活hek293t细胞中进行甲醛的生物发光检测结果图:(a)fluc-k529prak对活hek293t细胞中不同浓度甲醛的生物发光成像;(b)fluc-k529prak对活hek293t细胞中低浓度甲醛的生物发光响应;数据显示为平均生物发光强度±标准偏差(n=3);使用graphpadprism中的单因素方差分析进行统计比较,****p<0.0001。具体实施方式下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市场购买获得的常规产品。部分术语定义除非在下文中另有定义,本发明具体实施方式中所用的所有技术术语和科学术语的含义意图与本领域技术人员通常所理解的相同。虽然相信以下术语对于本领域技术人员很好理解,但仍然阐述以下定义以更好地解释本发明。如本发明中所使用,术语“包括”、“包含”、“具有”、“含有”或“涉及”为包含性的(inclusive)或开放式的,且不排除其它未列举的元素或方法步骤。术语“由…组成”被认为是术语“包含”的优选实施方案。如果在下文中某一组被定义为包含至少一定数目的实施方案,这也应被理解为揭示了一个优选地仅由这些实施方案组成的组。在提及单数形式名词时使用的不定冠词或定冠词例如“一个”或“一种”,“所述”,包括该名词的复数形式。本发明中的术语“大约”表示本领域技术人员能够理解的仍可保证论及特征的技术效果的准确度区间。该术语通常表示偏离指示数值的±10%,优选±5%。此外,说明书和权利要求书中的术语第一、第二、第三、(a)、(b)、(c)以及诸如此类,是用于区分相似的元素,不是描述顺序或时间次序必须的。应理解,如此应用的术语在适当的环境下可互换,并且本发明描述的实施方案能以不同于本发明描述或举例说明的其它顺序实施。以下术语或定义仅仅是为了帮助理解本发明而提供。这些定义不应被理解为具有小于本领域技术人员所理解的范围。本发明所用的术语“遗传编码”是指:活细胞将dna或mrna序列中编码的遗传物质信息翻译为蛋白质。在某些方面,术语“编码”用于描述dna半保守复制的过程,其中双链dna分子的一条链用作模板,由dna依赖性的dna聚合酶编码合成新互补姊妹链。在另一方面,术语“编码”是指一个分子内的信息用于指导化学性质与第一分子不同的第二分子的合成所依据的任何程序。例如,dna分子可编码rna分子,例如,通过有dna依赖性的rna聚合酶参与的转录过程。另外,rna分子可编码多肽,如翻译过程。当术语“编码”用于描述翻译过程时,该术语还指编码氨基酸的三联密码子。在某些方面,rna分子也可编码dna分子,例如,通过有rna依赖性的dna聚合酶参与的逆转录过程。在另一方面,dna分子可编码多肽,此时“编码”应当被理解为既包括转录过程又包括翻译过程的情况。本发明所用的术语“甲醛反应性”是指:具有与甲醛发生特异化学反应的性质。反应也是化学术语,表示两种或两种以上化学物质之间的相互作用而产生新的化学物质的过程,即化学反应(chemicalreaction)。因此,本发明所述的“遗传编码的甲醛反应性非天然氨基酸”是指:具有与甲醛发生化学反应的性质,同时能够参与遗传编码的非天然氨基酸。本发明所用的术语“关联”:术语“关联”指共同起作用的组分,例如正交trna和正交氨酰基-trna合成酶。这些组分也可互称为“互补的”。本发明所用的术语“同源”是指:在遗传学中,同源这一概念主要是指序列同源,表明两个或多个蛋白质或dna序列具有相同的祖先。同源的序列也很可能有相似的功能。两个序列或者同源,或者不同源,不存在“同源度”这样的概念。序列中同源的部分也被称为保守的(conserved)。本发明所用的术语“同源关联trna”是指:与感兴趣翻译系统同源且共同起作用的同源trna,应该知道,实际上优选利用本发明同源关联trna与翻译系统在翻译期间对选择者密码子起反应而基本上可将任何氨基酸(无论天然或非天然的)掺入延伸的多肽内。本发明所用的术语“吡咯赖氨酰-trna合成酶”是指:催化吡咯赖氨酸激活并共价结合在相应的trna分子3’端的酶。吡咯赖氨酸(pyl)在产甲烷菌的甲胺甲基转移酶中发现,是目前已知的第22种参与蛋白质生物合成的氨基酸。与标准氨基酸不同的是,吡咯赖氨酸(pyl)由终止密码子uag的有义编码形成。与之对应的,在产甲烷菌中也含有特异的吡咯赖氨酰-trna合成酶(pylrs)和吡咯赖氨酸trna(trnapyl),其具有不同于经典trna的特殊结构。产甲烷菌通过直接途径和间接途径生成吡咯赖氨酰-trnapyl(pyl-trnapyl),它可能通过mrna上的特殊结构以及其他还未发现的机制,控制uag编码成为终止密码子或者吡咯赖氨酸。野生型吡咯赖氨酰-trna合成酶(pylrs),例如可以从作为产甲烷古细菌的马氏甲烷八叠球菌(methanosarcinamazei)、巴氏甲烷八叠球菌(methanosarcinabarkeri)和噬乙酸甲烷八叠球菌(methanosarcinaacetivorans)等取得,但不限于这些。本发明所用的术语“突变型吡咯赖氨酰-trna合成酶”是指:以从野生型吡咯赖氨酰-trna合成酶(pylrs)为基础,通过各种方法导入突变来制作。野生型pylrs所能够活化的赖氨酸衍生物的种类有限,例如本发明中吡咯赖氨酰trna合成酶突变体prakrs即属于一种“突变型吡咯赖氨酰-trna合成酶”,通过本发明的突变体pylrs,即便是对于采用野生型pylrs时无活性的非天然氨基酸prak,也能高效地导入蛋白质。本发明所用的术语“琥珀终止密码子tag”是指:在蛋白质基因dna上转录形成mrna上终止密码子uag所对应的三联多核苷酸,即tag。在本发明中,“tag”和“uag”分别指对应dna和mrna上的琥珀终止密码子。本发明所用的术语“非天然氨基酸”是指:不在20种常见天然氨基酸之列的任何氨基酸,修饰的氨基酸和/或氨基酸类似物。例如,本发明可使用非天然氨基酸prak。本发明所用的术语“亲和纯化”是指:纯化蛋白质的一种方法,利用生物分子间的特异性结合作用的原理进行生物物质分离纯化。本发明所用的术语“翻译系统”是指:将氨基酸掺入延伸中的多肽链(蛋白质)的各组分。翻译系统的组分可包括,例如核糖体、trna、合成酶、mrna等。本发明的o-trna和/或o-rs可加入体外或体内翻译系统或是其一部分,例如存在于非真核细胞,如细菌(如大肠杆菌)中,或存在于真核细胞中,如酵母菌、哺乳动物细胞、植物细胞、藻类细胞、真菌细胞、昆虫细胞等。本发明所用的术语“pbs”是指:磷酸缓冲盐溶液,即phosphatebuffersaline,为本领域技术人员熟知并广泛使用。本发明通过附图和如下实施例进一步描述,所述的附图和实施例只是为了例证本发明的特定实施方案,不应理解为以任何方式限制本发明范围之意。实施例1非天然氨基酸赖氨酸类似物prak的设计和制备本发明的最初设想是合成一个具有甲醛反应性的非天然氨基酸,特异性地插入到生物大分子荧光和生物发光蛋白,分别用来控制它们的荧光和生物发光(图1a、1b)。当不存在甲醛时,非天然氨基酸修饰的egfp和fluc突变体并没有荧光和生物发光活性;当甲醛存在时,非天然氨基酸与甲醛反应恢复成关键的赖氨酸残基,导致其荧光和生物发光活性恢复(图1a、1b),从而实现甲醛检测。为实现上述目的,本发明自主设计一种甲醛反应性赖氨酸类似物prak,通过生物样本中甲醛的检测和成像证明该设想。本发明设计并合成了由赖氨酸衍生的甲醛反应性非天然氨基酸,命名为prak,具体结构见图1c,prak包含一个与甲醛反应的高烯丙胺基基团和一个能增加亲核性的n-丙基取代基。prak与甲醛发生加成反应并脱水生成亚胺正离子,接着发生2-氮杂柯普重排反应生成一种新的亚胺正离子,然后通过进一步水解和β-消除最终得到l-赖氨酸(图1c)。基于这一反应,即可实现利用上述荧光蛋白和生物发光蛋白对甲醛进行检测和成像。prak的具体制备方法步骤如下(见图2):化合物2的合成。根据文献(padhi,b.;reddy,d.s.;mohapatra,d.k.,2,6-反式-二取代四氢吡喃衍生物的金催化的非对映选择性合成:合成双链酰胺a和b的c1-c13片段的应用,rscadvances2015,5(117),96758-96768)合成化合物1。在0℃下,向化合物1(17.44g,89.8mmol)的100mlthf的溶液中加入8.9ml丙胺(107.7mmol)。将反应混合物在0℃下搅拌30分钟,然后添加烯丙基硼酸频哪醇酯(25.3ml,134.7mmol),并将反应混合物加热至环境温度并搅拌10h。将反应淬灭,然后用ea(3×100ml)萃取。合并的有机层用盐水(100ml)洗涤,经无水na2so4干燥,并在减压下浓缩。残余物通过硅胶柱色谱法纯化(乙酸乙酯/己烷=1∶10),得到化合物2(16.66g,67%收率)。1hnmr(400mhz,cdcl3)δ7.20(d,j=8.5hz,2h),6.81(d,j=8.6hz,2h),5.81–5.65(m,1h),5.03(d,j=3.7hz,1h),5.00(s,1h),4.37(s,2h),3.72(s,3h),3.54–3.44(m,2h),2.69–2.63(m,1h),2.55–2.41(m,2h),2.20–2.07(m,2h),1.71–1.59(m,2h),1.47–1.33(m,2h),0.85(t,j=7.4hz,3h)。13cnmr(101mhz,cdcl3)δ159.10,135.65,130.58,129.13,117.12,113.68,72.53,67.71,55.11,54.94,49.00,38.72,33.96,23.36,11.80。hrms:c17h28no2[m+h]+278.2120(计算值),278.2115(实测值)。化合物3的合成。向化合物2(16.66g,60mmol)的100mlthf的溶液中加入boc酸酐(20.7ml,90mmol),并将该反应在25℃下搅拌8h,随后tlc(10%etoac/己烷)表明化合物2已完全消耗。将反应混合物用饱和na2co3稀释,并用etoac萃取。合并的有机层经na2so4干燥,过滤,在减压下浓缩,得到呈无色油状的boc保护的粗产物,将其重新溶解于ch2cl2(100ml)中,并直接用于下一步。在0℃下,向该溶液分批加入水(10ml)和2,3-二氯-5,6-二氰基-1,4-苯醌(ddq;34g,150mmol)。将反应混合物在25℃搅拌2h,用饱和nahco3水溶液(200ml)淬灭,并用水(100ml)和ch2cl2(200ml)稀释。将所得混合物剧烈搅拌2小时。分离各层,水层用ch2cl2(3×150ml)萃取。合并的有机层用盐水(200ml)洗涤,用无水na2so4干燥并且在减压下浓缩。残余物通过硅胶柱色谱法纯化(乙酸乙酯/己烷=2∶3),得到无色油状的醇3(13g,两步收率84%)。1hnmr(300mhz,cdcl3)δ5.74(ddt,j=17.0,10.2,6.7hz,1h),5.17–4.95(m,2h),4.41–4.19(m,1h),3.57–3.39(m,3h),3.05–2.77(m,2h),2.48–2.27(m,1h),2.27–2.07(m,1h),1.61–1.50(m,2h),1.47(s,9h),0.86(t,j=7.4hz,3h)。13cnmr(101mhz,cdcl3)δ157.29,135.16,116.71,79.66,58.60,51.59,44.76,37.67,35.34,28.30,23.38,11.51。hrms:c14h27no3na[m+na]+280.1889(计算值),280.1883(实测值)。化合物4的合成。在0℃下,向化合物3(3.22g,12.5mmol)的ch2cl2(30ml)溶液中加入吡啶(1.35ml,16.8mmol)和氯甲酸4-硝基苯酯(3.4g,16.8mmol)。将反应混合物在25℃下搅拌10h,并用水淬灭。分离各层,水层用ch2cl2(50ml)萃取。合并的有机层用饱和nh4cl水溶液(3×30ml)和盐水(50ml)洗涤,用无水na2so4干燥,并在减压下浓缩。残余物通过硅胶柱色谱法纯化(乙酸乙酯/己烷=20∶1),得到无色油状的化合物4(3g,57%收率)。1hnmr(300mhz,cdcl3)δ8.25(d,j=9.0hz,2h),7.34(d,j=9.0hz,2h),5.73(ddt,j=17.1,10.1,7.0hz,1h),5.10–5.01(m,2h),4.30–3.95(m,3h),3.12–2.82(m,2h),2.52–2.32(m,1h),2.27–2.20(m,1h),2.03–1.87(m,2h),1.66–1.49(m,2h),1.43(s,9h),0.86(t,j=7.4hz,3h)。13cnmr(75mhz,cdcl3)δ155.67,152.51,145.44,135.07,135.03,125.36,122.01,121.87,117.42,100.12,79.47,66.84,53.10,38.00,31.83,31.39,28.53,23.55,11.71。hrms:c21h30n2o7na[m+na]+445.1951(计算值)445.1946(实测值)。化合物5的合成。在0℃下,向nα-boc-l-lys(348mg,1.41mmol)的dmf(5ml)溶液中加入dipea(0.47ml,0.61mmol)、dmap(23mg,0.19mmol)和化合物4(396mg,0.94mmol)的dmf(5ml)溶液。将反应混合物在25℃下搅拌10h,并用水淬灭。分离各层,水层用ch2cl2(50ml)萃取。合并的有机层用1nhcl(3×15ml)和盐水(20ml)洗涤,用无水na2so4干燥,并在减压下浓缩。残余物通过硅胶柱色谱法纯化(5%meoh/ch2cl2),得到白色固体化合物5(317mg,64%产率)。1hnmr(400mhz,cd3od)δ5.75(td,j=17.0,7.0hz,1h),5.13–4.98(m,2h),4.05–3.87(m,3h),3.36–3.33(m,1h),3.13–3.05(m,2h),3.05–2.93(m,2h),2.42–2.33(m,1h),2.31–2.13(m,1h),1.98–1.71(m,3h),1.71–1.60(m,1h),1.59–1.31(m,24h),0.88(t,j=7.4hz,3h)。13cnmr(75mhz,cd3od)δ174.97,162.45,157.70,156.84,156.29,135.41,118.28,116.32,79.90,79.41,79.17,78.26,61.68,53.54,40.16,38.01,37.46,31.21,29.24,27.58,22.89,10.71。hrms:c26h48n3o8[m+h]+530.3441(计算值),530.3467(实测值)。prak的合成。向化合物5(317mg,0.6mmol)的溶液中加入8mlhcl的1,4-二氧六环(4m)溶液。将反应混合物在25℃下搅拌2h。减压除去溶剂,得到prak的白色固体(185.3mg,94%产率)。1hnmr(400mhz,cd3od)δ5.84(td,j=16.9,7.1hz,1h),5.33–5.25(m,2h),4.29–4.05(m,2h),3.97(t,j=6.0hz,1h),3.41–3.38(m,1h),3.18–3.08(m,2h),3.02–2.96(m,2h),2.57–2.51(m,2h),2.04–2.01(m,2h),1.98–1.88(m,2h),1.77–1.71(m,2h),1.63–1.49(m,3h),1.50–1.47(m,1h),1.03(t,j=7.3hz,3h)。13cnmr(75mhz,cd3od)δ170.66,157.39,131.81,119.61,60.57,55.10,52.66,46.73,40.01,34.33,29.90,29.45,29.09,21.98,19.54,10.22。hrms:c16h32n3o4[m+h]+330.2393(计算值),330.2381(实测值)。实施例2体外fmoc-prak与甲醛的反应性实验1)制备fmoc-prak,具体方法步骤如下(见图3):化合物6的合成。向nα-fmoc-l-lys(190mg,0.474mmol)的dmf(5ml)溶液中添加dipea(100μl,0.61mmol)和化合物4(143mg,0.34mmol)的dmf(5ml)溶液,。将反应混合物在25℃下搅拌10h,并用水淬灭。分离各层,水层用ch2cl2(50ml)萃取。合并的有机层用1nhcl(3×15ml)和盐水(20ml)洗涤,用无水na2so4干燥,并在减压下浓缩。将残余物通过硅胶柱色谱法纯化(5%meoh/ch2cl2),得到白色固体化合物6(86mg,30%收率)。1hnmr(300mhz,d6-dmso)δ7.89(d,j=7.3hz,2h),7.73(d,j=7.1hz,2h),7.60(d,j=7.8hz,1h),7.40(dd,j=14.1,6.8hz,2h),7.33(dd,j=14.1,6.8hz,2h),7.09(s,1h),5.81–5.57(m,1h),5.05–5.00(m,2h),4.36–4.13(m,3h),3.94–3.80(m,4h),3.65–3.14(m,2h),3.01–2.86(m,4h),2.30–2.21(m,2h),1.94–1.51(m,4h),1.49–1.25(m,13h),0.79(t,j=6.7hz,3h)。13cnmr(75mhz,d6-dmso)δ174.61,156.73,155.43,144.43,144.38,141.30,136.28,128.21,127.64,125.87,120.69,117.32,79.00,78.71,66.17,61.63,54.42,47.25,38.19,37.61,32.82,32.31,31.05,29.59,28.62,23.49,22.50,11.99。hrms:c36h49n3o8na[m+na]+674.3417(计算值),674.3412(实测值)。fmoc-prak的合成。向化合物6(36mg,0.055mmol)的溶液中加入3mlhcl的1,4-二氧六环(4m)溶液。将反应混合物在25℃下搅拌2h。减压除去溶剂,得到白色固体fmoc-prak(25mg,83%收率)。1hnmr(500mhz,cd3od)δ7.78(d,j=7.5hz,2h),7.66(t,j=8.4hz,2h),7.38(t,j=7.4hz,2h),7.30(t,j=7.4hz,2h),5.92–5.63(m,1h),5.31–5.18(m,2h),4.45–4.28(m,2h),4.28–4.14(m,2h),4.12–4.04(m,2h),3.35–3.32(m,1h),3.18–3.11(m,2h),3.01–2.89(m,2h),2.59–2.43(m,2h),2.08–1.91(m,2h),1.85–1.84(m,1h),1.75–1.68(m,3h),1.59–1.46(m,2h),1.45–1.33(m,2h),0.99(t,j=7.4hz,3h)。13cnmr(126mhz,cd3od)δ178.68,178.61,158.68,158.08,145.46,145.27,142.59,132.95,128.75,128.14,126.21,120.90,120.74,67.76,61.51,57.23,56.12,56.06,49.85,48.53,47.49,41.50,35.49,35.40,33.51,31.17,30.52,30.45,23.71,20.82,11.30。hrms:c31h42n3o6[m+h]+552.3074(计算值),552.3066(实测值)。2)fmoc-prak与甲醛的反应向fmoc-prak(0.5mm)溶液(pbs和乙腈混合溶剂(v/v=1:1)中添加甲醛溶液(最终1mm)。将所得混合物在37℃下孵育1小时,然后使用shimadzulcms-2020系统通过lc-ms直接分析反应混合物。将uv检测器设置为254nm,以360nm处吸收为参比。从alltima反相c18色谱柱(4.6×250mm,5μm)上以水(含0.1%tfa)和乙腈(15分钟内70%乙腈)线性梯度洗脱样品,流速为0.8ml/分钟。esi和apci电离源用于ms分析。通过液质联用lc-ms分析fmoc-prak与甲醛的反应,结果证实了产物fmoc-lys和醛中间体的产生(图4),从而验证了prak对甲醛具有2-氮杂柯普重排反应活性,可能应用于甲醛检测。实施例3非天然氨基酸prak定点引入蛋白质1)prakrs序列优化和筛选本发明为获得能够插入prak的吡咯赖氨酰trna合成酶的活性位点突变体,将prak计算模拟建模到吡咯赖氨酰trna合成酶的吡咯赖氨酸结合口袋中,并注意到prak的侧链可能与口袋周围的许多残基发生空间冲突(例如y306、l309、c348、m350、i405和i413v)。因此,通过合理设计将这些残基突变为空间位阻较小的氨基酸,构建了一系列基于野生型吡咯赖氨酰trna合成酶的活性位点突变体,见下表。突变组突变位点组1l309a,y384f组2l309a,c348s,y384f组3y384f组4y306a,y384f组5y306g,l309g,y384f组6l309a,y348f,y384f组7y306g,l309a,y384f组8y306a,l309g,y384f组9y306a,l309a,y384f组10y306a,l309a,c348a,y384f组11y306a,l309a,y384f,i405r组12y306a,l309a,c348s,y384f组13y306a,l309a,c348s,y384f,i405r组14y306a,l309a,y384f,i413v组15y306a,l309a,m350a,y384f为了筛选prakrs,本发明将plx-egfp-y39tag质粒与pbx-pylrs活性位点突变质粒共转化到大肠杆菌菌株bl21中。转化的单克隆细菌在含有卡那霉素(40μg/ml)和氯霉素(34μg/ml)的lb培养基中于37℃过夜振荡培养,然后以1:100稀释接种到补充有卡那霉素(40μg/ml)和氯霉素(34μg/ml)的新鲜tb培养基(ph=8.0)中并在37℃下振荡培养。当od600达到0.6时,将2mmprak加入细菌培养物中。孵育1小时后,在37℃下通过1mm异丙基-1-硫代-β-d-半乳糖吡喃糖苷(iptg)诱导蛋白表达10小时。在酶标仪上测量单个细菌培养物的荧光强度,并与未添加prak的对照培养物进行比较。令人高兴的是,本发明发现了一个吡咯赖氨酰trna合成酶突变体(y306a,l309a,y384f,命名为prakrs),其序列如seqidno.1所示,它可以有效地将prak引入egfp-y39tag(图5)。seqidno.1序列如下:mdkkplntlisatglwmsrtgtihkikhhevsrskiyiemacgdhlvvnnsrssrtaralrhhkyrktckrcrvsdedlnkfltkanedqtsvkvkvvsaptrtkkampksvarapkplenteaaqaqpsgskfspaipvstqesvsvpasvstsissistgatasalvkgntnpitsmsapvqasapaltksqtdrlevllnpkdeislnsgkpfrelesellsrrkkdlqqiyaeerenylgklereitrffvdrgfleikspilipleyiermgidndtelskqifrvdknfclrpmlapnlanyarkldralpdpikifeigpcyrkesdgkehleeftmlnfcqmgsgctrenlesiitdflnhlgidfkivgdscmvfgdtldvmhgdlelssavvgpipldrewgidkpwigagfglerllkvkhdfknikraarsesyyngistnl。2)将prak掺入大肠杆菌的蛋白质中将含有琥珀终止密码子tag所需目的质粒与pbx-prakrs质粒共转化为大肠杆菌菌株bl21(de3)。转化的细菌在含卡那霉素(40μg/ml)和氯霉素(34μg/ml)的lb培养基中于37℃过夜生长,然后以1:100稀释接种到补充有卡那霉素(40μg/ml)和氯霉素(34μg/ml)的新鲜tb培养基(ph=8.0)中并在37℃下振荡培养。当od600达到0.6时,将2mmprak加入细菌培养物中。孵育1小时后,通过加入1mm异丙基-1-硫代-β-d-半乳糖吡喃糖苷(iptg)诱导蛋白表达10小时。之后离心收集细胞并在95℃下用4%sds裂解缓冲液(4%sds,150mmnacl,50mm三乙醇胺,ph7.4)裂解。将所得的细胞裂解物在室温下以16,000xg离心5分钟以去除细胞碎片。通过bca测定法测定蛋白质浓度。最后,将细胞裂解物在自制的sds-page凝胶上电泳分离,并通过免疫印迹和考马斯亮蓝染色进行分析。结果表明,只有当培养基中存在prak时,全长egfp蛋白才会表达。因此,prak成功整合到大肠杆菌egfp的y39和k85位点(图6a和6b)。并且,prak在大肠杆菌中表现出与bock相当的插入效率(图6a)。bock为n(e)-boc-l-赖氨酸,是公认的野生型mmpylrs的优良底物。3)将prak掺入哺乳动物细胞的蛋白质中将hek293t细胞接种在多聚赖氨酸包被的12孔板上,并在1ml生长培养基中培养过夜。第二天,在添加或不添加prak(1mm)的条件下,使用pei(每孔2.5μg)将含有琥珀密码子tag的目的质粒(每孔0.65μg)和pylrs质粒(每孔0.35μg)共转染进细胞。为了表达prak修饰的蛋白,使用了pef1α-flag-prakrs;另一方面则使用pef1α-flag-mmpylrs掺入bock作为对照。转染24小时后,通过超声处理和涡旋,用含有蛋白酶抑制剂和β-巯基乙醇的4%sds裂解缓冲液裂解细胞。将所得的细胞裂解物在室温下以16,000xg离心5分钟以去除细胞碎片。通过bca测定法测定蛋白质浓度。最后,将细胞裂解物在自制的sds-page凝胶上分离并通过免疫印迹进行分析。结果表明,在哺乳动物hek293t细胞中,只有当培养基中存在prak时,全长egfp蛋白才会表达,表明在哺乳动物hek293t细胞中成功实现了egfp的y39和k85位点prak的基因编码(图6c)。综上结果表明,在大肠杆菌和哺乳动物细胞中prak均能被prakrs突变体位点特异地编码到egfp中。实施例4egfp-k85prak的制备以及egfp-k85prak体外甲醛检测1)egfp-k85prak的制备为了纯化egfp-k85prak,将plx-egfp-k85tag-twin-strep-tag质粒与pbx-prakrs质粒共转化为大肠杆菌bl21(de3)。转化的细菌在含卡那霉素(40μg/ml)和氯霉素(34μg/ml)的lb培养基中于37℃过夜生长,然后以1:100稀释接种到补充有卡那霉素(40μg/ml)和氯霉素(34μg/ml)的新鲜tb培养基(ph=8.0)中,并在37℃下培养。当od600达到0.6时,将2mmprak加入细菌培养物中。孵育1小时后,在37℃下通过1mm异丙基-1-硫代-β-d-半乳糖吡喃糖苷(iptg)诱导蛋白表达10小时。收集细胞,在含有蛋白酶抑制剂混合物的缓冲液w(100mmtris-hcl,150mmnacl,1mmedta,ph8.0)中用声波干扰器裂解。离心后将沉淀物溶解在含有8m尿素的pbs缓冲液(ph=8.0)中。然后用strep-tactinxtsuperflow树脂纯化egfp-k85prak蛋白,并用bxt缓冲液(含50mm生物素的w缓冲液)洗脱。使用从6m到0m的线性尿素梯度,在柱上进行egfp-k85prak蛋白的逐步重折叠。经纯化的egfp-k85prak蛋白sds-page电泳图如图7所示。2)egfp-k85prak体外甲醛检测37℃下,在96孔光学底黑色平板中,将20mmpbs(ph7.4)中的egfp-k85bock或egfp-k85prak蛋白(0.5μm)用不同浓度甲醛的pbs缓冲液处理40分钟。然后加入5mmdtt和300mmtris-hcl(ph7.4),在37℃下孵育2h淬灭过量的甲醛。之后在酶标仪上测定每个孔在468nm激发下510nm处的荧光强度。结果表明,egfp-k85prak实际上是无荧光的(图8a),证实k85位对egfp荧光至关重要。相比之下,随着溶液甲醛浓度增加,最大发射峰510nm处有明显的荧光响应,呈现甲醛浓度依赖性(图8a和图9a)。在低浓度甲醛下,egfp-k85prak荧光强度与甲醛浓度之间存在线性关系(图9b)。甲醛的体外检测极限估计为25μm(图9c)。动力学分析表明,egfp-k85prak对甲醛的荧光响应在1h左右基本达到饱和(图9d)。为了进行选择性测定,用2mm甲醛或其他潜在干扰的反应性物种(2mm)在37℃处理0.5μm的egfp-k85prak蛋白40分钟。然后将5mmdtt和300mmtris-hcl(ph7.4)添加到每个样品中,在37℃下孵育2h淬灭过量的反应物种。之后在酶标仪上测量具有三个生物学重复的每个孔在468nm激发下510nm处的荧光强度。结果表明,相比于潜在干扰的生物活性羰基化合物以及细胞内常见的氧化、还原性分子(如h2o2和谷胱甘肽),egfp-k85prak对甲醛具有良好的选择性(图8b)。3)egfp-k85prak体外甲醛检测的lc-ms分析为了进一步验证,本发明分析了甲醛处理前后egfp-k85prak的蛋白分子量:甲醛处理前观察到的分子量(30176.584da)与未形成生色团的全长egfp-k85prak蛋白理论分子量相一致,而甲醛处理后观察到的分子量(29973.844da)与已形成生色团的野生型egfp分子量一致(图10),证实了prak与甲醛的反应可还原天然赖氨酸残基使得egfp生色团形成。实施例5egfp-k85prak活细胞内检测甲醛将hek293t细胞接种在多聚赖氨酸包被的12孔板上,并在1ml生长培养基中培养过夜。第二天,使用pei(每孔2.5μg)将质粒pef1α-flag-prakrs(每孔0.35μg)和pcmv-egfp-k85tag(每孔0.65μg)共转染细胞。在存在prak(1mm)的情况下完全培养细胞。温育24小时后,将细胞培养基更换为没有prak的新鲜opti-mem培养基。在37℃、5%co2下再培养3小时后,加入甲醛的bss缓冲液(136.9mmnacl,将5.37mmkcl,1.26mmcacl2、0.81mmmgso4、0.44mmkh2po4、0.335mmna2hpo4、10mmpipes,ph7.2)洗涤1小时,并在2小时内用opti-mem培养基洗涤4次以除去过量的甲醛。然后将细胞用nucblue活细胞染色剂染色,细胞换液至fluorobritedmem,并在nikona1r共聚焦荧光显微镜上成像。对于nucblue通道,使用405nm激光作为激发光,并在425nm至475nm之间收集荧光信号。对于egfp通道,使用488nm激光作为激发光,并在500nm至550nm之间收集荧光信号。在对照实验中,在bock(0.25mm)存在下,将hek293t细胞与质粒pef1α-flag-mm-pylrs和pcmv-egfp-k85tag共转染处理。对于nahso3处理,将细胞在bss缓冲液中用1mmnahso3处理,并与甲醛孵育1小时。每个荧光成像实验随机选择每孔至少三个视野。在imagej中量化每个图像的荧光强度,并分组以进行统计分析。使用graphpadprism中的单因素方差分析进行多次比较的统计分析。结果表明,egfp-k85prak能够对细胞内0.1mm到1mm的生物相关浓度的甲醛进行检测和成像(图11a和图12)。此外,用nahso3(甲醛清除剂)对细胞进行预处理,可以显著减弱细胞内甲醛诱导产生的egfp-k85prak荧光信号(图11a)。为了验证egfp-k85prak能够可视化成像内源性甲醛,本发明用四氢叶酸(thfa)或5,10-亚甲基四氢叶酸(5,10-me-thfa)处理表达egfp-k85prak的细胞,thfa和5,10-me-thfa在叶酸循环中能被转化为甲醛。事实上,在thfa或5,10-me-thfa处理组中确实观察到强烈的荧光信号(图11b和图13),表明探针能够检测内源性产生的甲醛。总之,这些结果表明,egfp-k85prak非常适合于活细胞中生理水平甲醛的荧光成像。实施例6fluc-k529prak制备及其体外检测甲醛性能验证1)fluc-k529prak的制备为了纯化fluc-k529prak,将plx-fluc-k529tag-twin-strep-tag质粒与pbx-prakrs质粒共转化为大肠杆菌bl21(de3)。转化的细菌细胞在含卡那霉素(40μg/ml)和氯霉素(34μg/ml)的lb培养基中于37℃过夜生长,然后以1:100稀释接种到补充有卡那霉素(40μg/ml)和氯霉素(34μg/ml)的新鲜tb培养基(ph=8.0)中并于37℃培养。当od600达到0.6时,将2mmprak加入细菌培养物中。孵育1小时后,在30℃下通过添加1mmiptg诱导蛋白表达10小时。在进行表达分析实验时,收集细胞将所得的细胞裂解物在室温下以16,000xg离心5分钟去除细胞碎片。通过bca测定法测定蛋白质浓度。最后,将细胞裂解物在自制的sds-page凝胶上分离,并通过免疫印迹和考马斯亮蓝染色进行分析。在制备纯化蛋白时,则收集细胞在含有蛋白酶抑制剂混合物的缓冲液w(100mmtris-hcl,150mmnacl,1mmedta,ph8.0)中用声波干扰器裂解细菌。离心后收集上清,然后按照说明书操作,用strep-tactinxtsuperflow树脂纯化蛋白,并用bxt缓冲液(含50mm生物素的w缓冲液)洗脱,透析将蛋白缓冲液置换为pbs缓冲液。fluc-k529prak蛋白在大肠杆菌中的表达如图14a所示。只有当培养基中存在prak时,全长fluc蛋白才会表达。因此,prak成功整合到大肠杆菌fluc的k529位点。经纯化的fluc-k529prak蛋白sds-page电泳图如图14b所示。同时,fluc-k529bock蛋白在bock存在下表达,并以相似的方式进行纯化(图14b)。2)fluc-k529prak体外检测甲醛在96孔光学底黑色平板中,在37℃下,用不同浓度的甲醛处理fluc-k529bock或fluc-k529prak蛋白(0.5μm)30分钟。然后将100mmtris-hcl(ph7.4)加入每个孔中以淬灭过量的甲醛。使用bright-lumi荧光素酶测定试剂盒在酶标仪上测量荧光素酶的活性,并进行三个生物学重复。使用化学发光检测模式在chemidoc成像系统上拍摄生物发光图像。结果显示,fluc-k529prak在含有atp和底物荧光素的水溶液中对甲醛显示出强烈的剂量依赖性生物发光响应(图15a、15b和图16),而fluc-k529bock则没有观察到生物发光变化(图15a和15b)。同时,fluc-k529prak能够在0.5小时内检测到生理浓度范围为0.1-2mm的甲醛(图15a、15b和图16)。为了进行选择性测定,在37℃下用0.5mm甲醛或其他可能干扰反应的物种在pbs缓冲液中(20mmpbs,ph7.4)处理0.5μmfluc-k529prak蛋白。然后将100mmtris-hcl(ph7.4)加入每个孔中以淬灭过量的活性反应物种。如上所述用三个生物学重复测量荧光素酶活性。结果表明,相比于潜在干扰的生物活性物种以及细胞内常见的氧化、还原性分子(如h2o2和谷胱甘肽),fluc-k529prak对甲醛具有良好的选择性(图16d)。实施例7fluc-k529prak活细胞内检测甲醛将hek293t细胞接种在多聚赖氨酸包被的96孔光学底黑色平板上,并在0.2ml生长培养基中培养过夜。第二天,在添加或不添加1mmprak下,在完全细胞生长培养基中使用pei(每孔250ng)将质粒pef1α-flag-prakrs(每孔35ng)和pcmv-fluc-k529tag(每孔65ng)共转染细胞。温育24小时后,将细胞培养基更换为没有prak的新鲜opti-mem培养基。对于甲醛的时间依赖性发光成像,将细胞在bss缓冲液中用0.5mm甲醛处理指定的时间。对于剂量依赖性发光成像,将细胞在bss缓冲液中用不同浓度的甲醛处理1小时。使用bright-lumi荧光素酶测定试剂盒在酶标仪上测量荧光素酶活性。使用化学发光检测模式在chemidoc成像系统上拍摄生物发光图像。结果表明,在表达fluc-k529prak的活hek293t细胞中,甲醛处理组发光信号明显增强,且呈现甲醛剂量依赖性(图15c、15d和图17)。同时,在表达fluc-k529bock的活hek293t细胞中,并未在甲醛处理组中观察到发光信号增强(图15c和15d)。总之,这些数据表明fluc-k529prak是一种基因编码的生物发光探针,能够在体外和活细胞上检测生理水平的甲醛。综上所述,本发明成功开发了一种甲醛反应性赖氨酸类似物prak,基于它制备的egfp-k85prak和luc-k529prak两种基因编码的荧光探针和生物发光探针,可用于检测和成像溶液和活细胞中的甲醛。以上对本发明具体实施方式的描述并不限制本发明,本领域技术人员可以根据本发明作出各种改变或变形,只要不脱离本发明的精神,均应属于本发明所附权利要求的范围。sequencelisting<110>北京大学深圳研究生院<120>一种遗传编码的甲醛反应性非天然氨基酸、制备方法及其应用<130>2020<160>1<170>patentinversion3.5<210>1<211>454<212>prt<213>人工序列<400>1metasplyslysproleuasnthrleuileseralathrglyleutrp151015metserargthrglythrilehislysilelyshishisgluvalser202530argserlysiletyrileglumetalacysglyasphisleuvalval354045asnasnserargserserargthralaargalaleuarghishislys505560tyrarglysthrcyslysargcysargvalseraspgluaspleuasn65707580lyspheleuthrlysalaasngluaspglnthrservallysvallys859095valvalseralaprothrargthrlyslysalametprolysserval100105110alaargalaprolysproleugluasnthrglualaalaglnalagln115120125proserglyserlyspheserproalaileprovalserthrglnglu130135140servalservalproalaservalserthrserileserserileser145150155160thrglyalathralaseralaleuvallysglyasnthrasnproile165170175thrsermetseralaprovalglnalaseralaproalaleuthrlys180185190serglnthraspargleugluvalleuleuasnprolysaspgluile195200205serleuasnserglylysprophearggluleuglusergluleuleu210215220serargarglyslysaspleuglnglniletyralaglugluargglu225230235240asntyrleuglylysleugluarggluilethrargphephevalasp245250255argglypheleugluilelysserproileleuileproleuglutyr260265270ilegluargmetglyileaspasnaspthrgluleuserlysglnile275280285pheargvalasplysasnphecysleuargprometleualaproasn290295300leualaasntyralaarglysleuaspargalaleuproaspproile305310315320lysilephegluileglyprocystyrarglysgluseraspglylys325330335gluhisleuglugluphethrmetleuasnphecysglnmetglyser340345350glycysthrarggluasnleugluserileilethrasppheleuasn355360365hisleuglyileaspphelysilevalglyaspsercysmetvalphe370375380glyaspthrleuaspvalmethisglyaspleugluleuserserala385390395400valvalglyproileproleuaspargglutrpglyileasplyspro405410415trpileglyalaglypheglyleugluargleuleulysvallyshis420425430aspphelysasnilelysargalaalaargserglusertyrtyrasn435440445glyileserthrasnleu450当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1